Le propriet delle soluzioni le propriet colligative Le






















- Slides: 26

Le proprietà delle soluzioni: le proprietà colligative

Le soluzioni ideali ü Il volume della soluzione è uguale alla somma dei volumi delle singole sostanze che la costituiscono ü Il processo di formazione di una soluzione, a partire dai componenti, è atermico (non c’è scambio calore) Conseguenza: Nelle soluzioni ideali non ci sono interazioni soluto-soluto Si avvicinano al comportamento ideale le soluzioni diluite con componenti di natura chimica simile

Proprietà delle soluzioni Le proprietà delle soluzioni che dipendono dalla concentrazione del soluto e non dalla natura del solvente e del soluto sono chiamate proprietà colligative. Con la concentrazione del soluto si intende il numero di particelle effettivamente presenti in soluzione. Data la dissociazione ionica: Na. NO 3(s) → Na+(aq) + NO 3–(aq) Il numero di ioni presenti in soluzione è doppio rispetto alle particelle di Na. NO 3.

Proprietà colligative delle soluzioni Per determinare il numero di particelle presenti in soluzione occorre moltiplicare il numero di moli di soluto per un fattore «i» chiamato coefficiente di Van’t Hoff : moli di particelle in soluzione i = ––––––––––––– moli di soluto disciolto i=1 i=2 i=3

Proprietà colligative ü Abbassamento della pressione parziale di vapore ü Innalzamento della temperatura di ebollizione ü Abbassamento della temperatura di congelamento ü Pressione osmotica

Osservazione • Il numero di particelle che dal liquido tendono a passare alla fase gassosa dipende anche dal numero delle particelle presenti nell’unità di volume • Pertanto, la tendenza del solvente a passare alla fase gassosa diminuisce al crescere della concentrazione del soluto (ci sono meno particelle di solvente per unità di volume!)

Abbassamento della pressione di vapore Tanto meno soluto è presente in una soluzione, tanto più facilmente il solvente liquido passa allo stato di vapore.

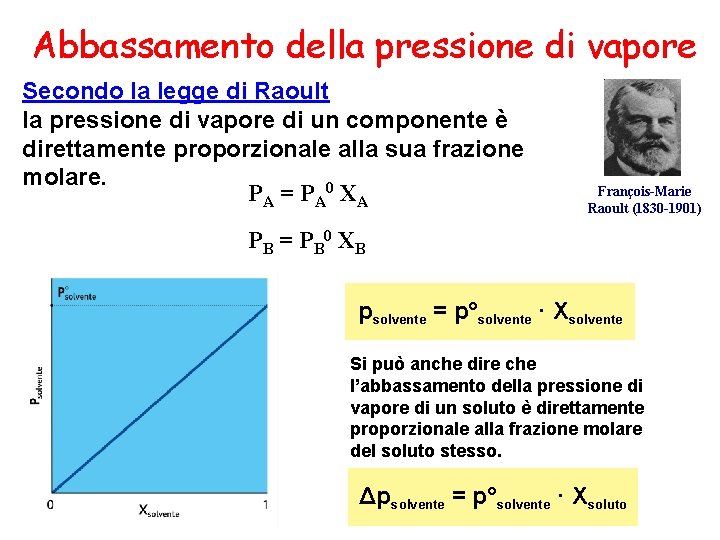
Abbassamento della pressione di vapore Secondo la legge di Raoult la pressione di vapore di un componente è direttamente proporzionale alla sua frazione molare. P A = P A 0 X A François-Marie Raoult (1830 -1901) P B = P B 0 XB psolvente = p°solvente · Xsolvente Si può anche dire che l’abbassamento della pressione di vapore di un soluto è direttamente proporzionale alla frazione molare del soluto stesso. Δpsolvente = p°solvente · Xsoluto

Miscele liquide binarie P A = P A 0 X A PA PB P B = P B 0 X B XA + XB = 1 Ptot P B 0 P A 0 PB PA 1 XA 0 0 XB 1

Esempio: Calcolare P dell’acqua a 25°C quando 5, 67 g di glucosio (C 6 H 12 O 6) sono sciolti in 25, 2 g di acqua. A tale temperatura la tensione di vapore dell’acqua pura è 23, 8 mm. Hg Dalla legge di Raoult: P= PA°xglucosio = 23, 8 mm. Hg 0, 0220 = 0, 524 mm. Hg PA= PA°x. H 2 O = 23, 8 mm. Hg (1 -0, 0220) = 23, 3 mm. Hg

Osservazione • Il numero di particelle che dal liquido tendono a passare alla fase gassosa dipende anche dal numero delle particelle presenti nell’unità di volume • Pertanto, la temperatura di ebollizione del solvente è maggiore del liquido puro • Le particelle di soluto interagiscono con le particelle di solvente che pertanto interagiranno tra di loro con maggiore difficoltà • Pertanto, la temperatura di solidificazione del solvente è più bassa di quella del liquido puro

Innalzamento della temperatura di ebollizione Una soluzione bolle a temperatura superiore a quella del solvente puro; l’innalzamento ebullioscopico è proporzionale alla concentrazione.

Innalzamento della temperatura di ebollizione Abbassamento della temperatura di congelamento Per soluzioni diluite si può dimostrare che Tb= Tb(soluzione) - Tb(solvente) = Kb m Tcr= Tcr(solvente) - Tcr(soluzione) = Kcr m Kb, nota come costante ebullioscopica, e Kcr, nota come costante crioscopica, sono costanti caratteristiche solo del solvente. Esse hanno unità °C/m. Per l’acqua Teb= 100°C Tcr= 0°C Keb= 0, 512 Kcr= 1, 86

Soluzioni a uguale concentrazione determinano lo stesso innalzamento ebullioscopico ∆teb e lo stesso abbassamento crioscopico ∆tcr ∆teb = m · keb · i ∆tcr = m · kcr · i keb e kcr sono rispettivamente dette costante ebullioscopica molare e costante crioscopica molare. Il loro valore cambia da sostanza Esempi di keb Esempi di kcr

Problema: Sapendo che per l’acqua Kb= 0, 512 °C/m e Kf=1, 86 °C/m calcolare il punto di ebollizione e di fusione di una soluzione acquosa di glucosio 0, 0222 m. Tb= Kb m = 0, 512 °C/m 0, 0222 m = 0, 0114 °C Tb= 100, 00 + 0, 0114 = 100, 011°C Tf= Kf m = 1, 86 °C/m 0, 0222 m = 0, 0413 °C Tf= 0, 000 + 0, 0413 = - 0, 041°C

Le proprietà colligative possono essere usate per determinare il peso molecolare di sostanze non note. Problema: La canfora è un solido che fonde a 179, 5°C ed ha K f= 40°C/m. Se 1, 07 mg di un composto sono sciolti in 78, 1 mg di canfora fusa la soluzione congela a 176, 0 °C. Determinare il peso molecolare del composto. L’abbassamento del punto di congelamento è: Tf= 179, 5 – 176, 0 = 3, 5 °C Da cui si ricava la molalità della soluzione:

Dalla definizione di molalità si può ottenere il numero di moli del composto: moli= m Kg solvente Quindi: Moli = m Kg solvente = 0, 088 mol/Kg 78, 1 10 -6 Kg = 6, 9 10 -6 mol La massa molare del composto è data da:

Diagramma di fase di una soluzione pressione Temperatura di congelamento della soluzione LIQUIDO 1, 00 atm SOLIDO Temperatura di ebollizione della soluzione GAS 0°C soluzione 100°C temperatura

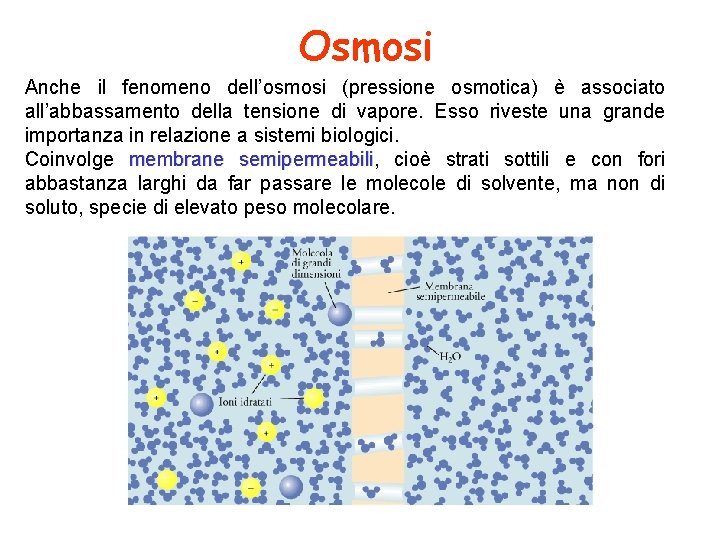
Osmosi Anche il fenomeno dell’osmosi (pressione osmotica) è associato all’abbassamento della tensione di vapore. Esso riveste una grande importanza in relazione a sistemi biologici. Coinvolge membrane semipermeabili, semipermeabili cioè strati sottili e con fori abbastanza larghi da far passare le molecole di solvente, ma non di soluto, specie di elevato peso molecolare.

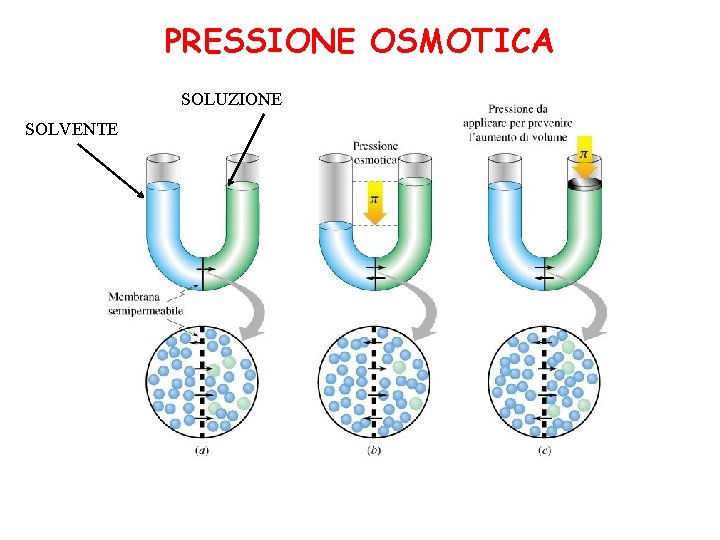
PRESSIONE OSMOTICA SOLUZIONE SOLVENTE

membrana semipermeabile (fa passare solo il solvente) solvente con soluto A B solvente puro flusso di solvente (osmosi) pressione che occorre Pressione osmotica = esercitare su A per bloccare il flusso osmotico

Legge di Van’t Hoff = pressione osmotica V = n RT da cui: Jacobus Henricus van 't Hoff Rotterdam (1852) - Steglitz (1911) Premio Nobel per la Chimica 1901 = RT c (c = molarità) c= concentrazione specie in soluzione

Esempio: Calcolare la pressione osmotica di una soluzione 0, 02 M di glucosio a 25°C? = MRT = 0, 02 mol/l 0, 0821 l atm/(K mol) 298 K= = 0, 5 atm Esempio: Calcolare la pressione osmotica di una soluzione 0, 020 M di Na. Cl a 25°C? = Mi. RT = 2 0, 020 mol/l 0, 0821 l atm/(K mol) 298 K= = 1, 0 atm

La pressione osmotica viene utilizzata per calcolare il peso molecolare di sostanze polimeriche o macromolecole. Problema: 50 ml di una soluzione acquosa contengono 1, 08 g di una proteina e presentano una pressione osmotica di 5, 85 mm. Hg a 298 K. Quale è il peso molecolare di tale proteina? La pressione in atmosfere è: La concentrazione molare della proteina è: Il numero di moli della proteina è: La massa molare della proteina è:

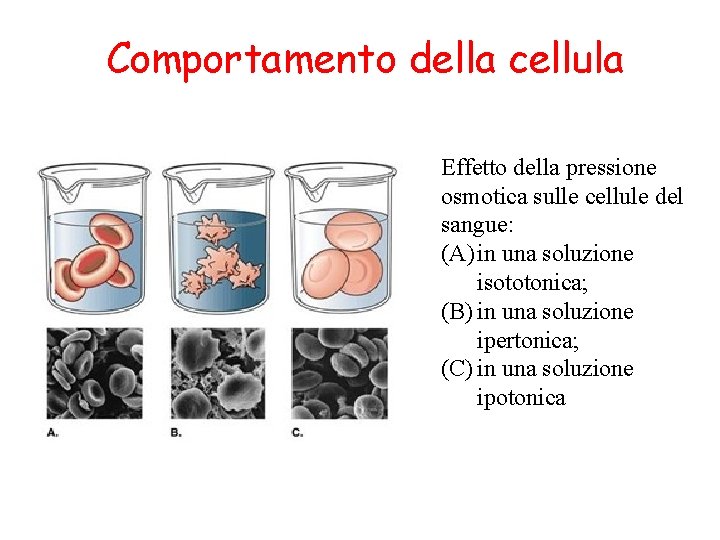
Comportamento della cellula Effetto della pressione osmotica sulle cellule del sangue: (A) in una soluzione isototonica; (B) in una soluzione ipertonica; (C) in una soluzione ipotonica

Riepilogo: proprietà colligative ü Abbassamento della pressione parziale di vapore P i = P i° X i ü Innalzamento della temperatura di ebollizione Teb = keb mi ü Abbassamento della temperatura di congelamento Tcr = - kcr mi ü Pressione osmotica = RT Mi
 Proprietà colligative
Proprietà colligative Dalle soluzioni all'elettrochimica soluzioni capitolo 16
Dalle soluzioni all'elettrochimica soluzioni capitolo 16 Equilibrio chimico zanichelli capitolo 19
Equilibrio chimico zanichelli capitolo 19 Soluzioni il racconto della chimica
Soluzioni il racconto della chimica Soluzioni il racconto delle scienze naturali
Soluzioni il racconto delle scienze naturali Formule inverse concentrazione percentuale
Formule inverse concentrazione percentuale Soluzioni il racconto delle scienze naturali
Soluzioni il racconto delle scienze naturali Elettrolisi
Elettrolisi Klein soluzioni
Klein soluzioni Capitolo 14 soluzioni
Capitolo 14 soluzioni Pressione oncotica
Pressione oncotica Soluzioni il racconto delle scienze naturali
Soluzioni il racconto delle scienze naturali Cose moderne
Cose moderne La nascita delle lingue e delle letterature romanze
La nascita delle lingue e delle letterature romanze L esperienza delle cose moderne e la lezione delle antique
L esperienza delle cose moderne e la lezione delle antique 4 colligative properties
4 colligative properties Pure solvent
Pure solvent Chimica proprietà colligative
Chimica proprietà colligative Application of colligative properties in pharmacy
Application of colligative properties in pharmacy Calculating molar mass using colligative properties
Calculating molar mass using colligative properties Colligative properties worksheet
Colligative properties worksheet Colligative properties definition
Colligative properties definition Propriété colligative
Propriété colligative Colligative properties depend on
Colligative properties depend on Applications of colligative properties in foods
Applications of colligative properties in foods Colligative properties of milk
Colligative properties of milk Chemical properties of seawater
Chemical properties of seawater