Le Le Soluzioni e propriet le propriet colligative















- Slides: 24

Le Le Soluzioni e proprietà le proprietà colligative

Le soluzioni ideali Soluzioni ideali: ü Il volume della soluzione è uguale alla somma dei volumi delle singole sostanze che la costituiscono ü Il processo di formazione di una soluzione, a partire dai componenti, è atermico (non c’è scambio calore) Conseguenza: Nelle soluzioni ideali non ci sono interazioni soluto-soluto Si avvicinano al comportamento ideale le soluzioni diluite con componenti di natura chimica simile

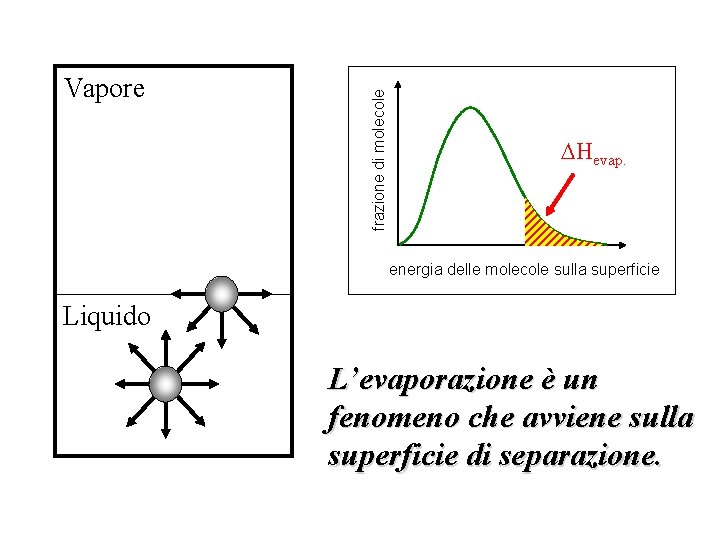
frazione di molecole Vapore Hevap. energia delle molecole sulla superficie Liquido L’evaporazione è un fenomeno che avviene sulla superficie di separazione.

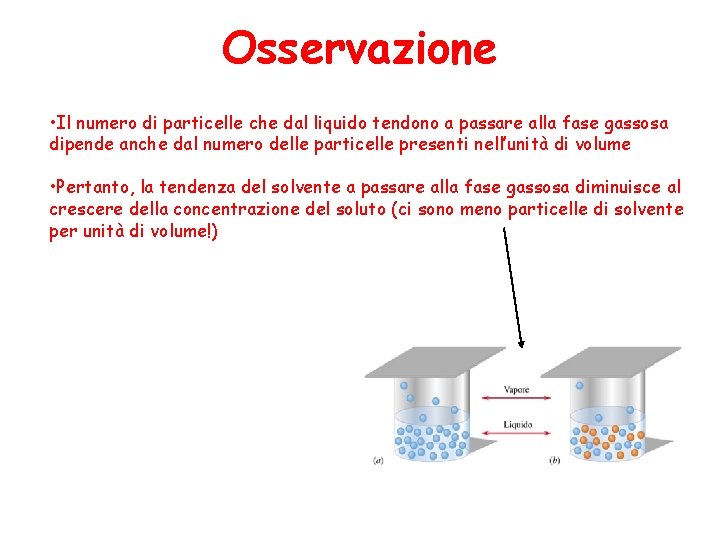
Osservazione • Il numero di particelle che dal liquido tendono a passare alla fase gassosa dipende anche dal numero delle particelle presenti nell’unità di volume • Pertanto, la tendenza del solvente a passare alla fase gassosa diminuisce al crescere della concentrazione del soluto (ci sono meno particelle di solvente per unità di volume!)

Legge di Raoult: La tensione di vapore di un componente è proporzionale alla frazione delle sue molecole p = p 0 x 1 + x 2=1 François-Marie Raoult (1830 -1901) p = p 0 (1 -x 2) p 0 - p = x 2 p Soluto 2 Solvente 1

Legge di Raoult La variazione della tensione di vapore di un componente di una soluzione rispetto al componente puro è proporzionale alla somma delle frazione molari dei componenti della soluzione P = P 0 X 2

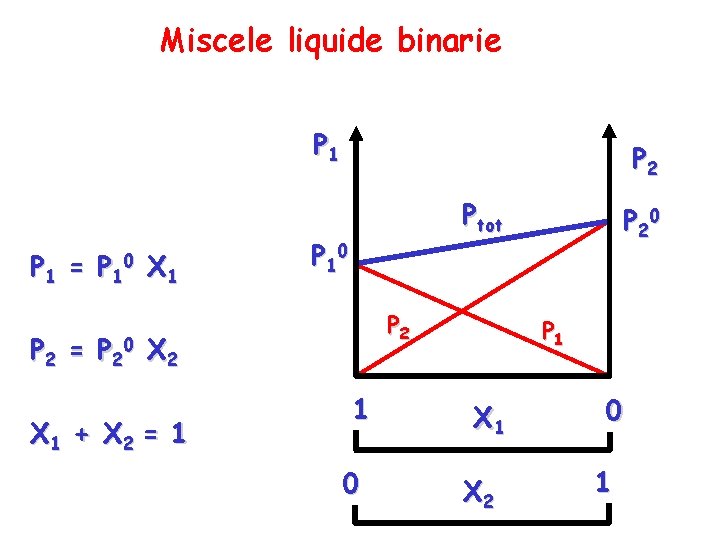
Miscele liquide binarie P 1 = P 2 = P 10 P 20 X 1 P 2 Ptot P 10 P 2 X 1 + X 2 = 1 1 0 P 20 P 1 X 2 0 1

Esempio: Calcolare P dell’acqua a 25°C quando 5, 67 g di glucosio (C 6 H 12 O 6) sono sciolti in 25, 2 g di acqua. A tale temperatura la tensione di vapore dell’acqua pura è 23, 8 mm. Hg Dalla legge di Raoult: P= PA°xglucosio = 23, 8 mm. Hg 0, 0220 = 0, 524 mm. Hg PA= PA°x. H 2 O = 23, 8 mm. Hg (1 -0, 0220) = 23, 3 mm. Hg

Osservazione • Il numero di particelle che dal liquido tendono a passare alla fase gassosa dipende anche dal numero delle particelle presenti nell’unità di volume • Pertanto, la temperatura di ebollizione del solvente è maggiore del liquido puro • Le particelle di soluto interagiscono con le particelle di solvente che pertanto interagiranno tra di loro con maggiore difficoltà • Pertanto, la temperatura di solidificazione del solvente è più bassa di quella del liquido puro

Proprietà colligative: abbassamento della pressione parziale di vapore P i = P i° X i innalzamento della temperatura di ebollizione Teb = keb mi abbassamento della temperatura di congelamento Tcr = - kcr mi pressione osmotica = RT Mi

Innalzamento della temperatura di ebollizione Abbassamento della temperatura di congelamento Per soluzioni diluite si può dimostrare che Teb= Teb(soluzione) - Teb(solvente) = Keb m Tcr= Tcr(solvente) - Tcr(soluzione) = Kcr m Keb, nota come costante ebullioscopica, e Kcr, nota come costante crioscopica, sono costanti caratteristiche solo del solvente. Esse hanno unità °C/m.

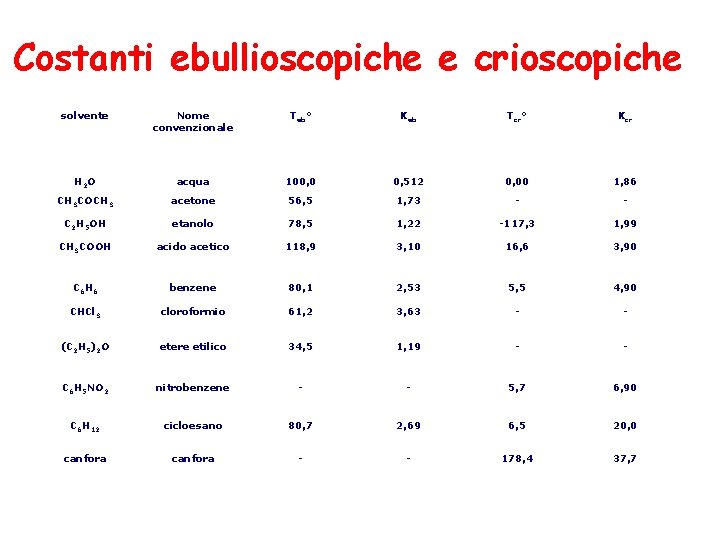
Costanti ebullioscopiche e crioscopiche solvente Nome convenzionale Teb° Keb Tcr° Kcr H 2 O acqua 100, 0 0, 512 0, 00 1, 86 CH 3 COCH 3 acetone 56, 5 1, 73 - - C 2 H 5 OH etanolo 78, 5 1, 22 -117, 3 1, 99 CH 3 COOH acido acetico 118, 9 3, 10 16, 6 3, 90 C 6 H 6 benzene 80, 1 2, 53 5, 5 4, 90 CHCl 3 cloroformio 61, 2 3, 63 - - (C 2 H 5)2 O etere etilico 34, 5 1, 19 - - C 6 H 5 NO 2 nitrobenzene - - 5, 7 6, 90 C 6 H 12 cicloesano 80, 7 2, 69 6, 5 20, 0 canfora - - 178, 4 37, 7

Problema: Sapendo che per l’acqua Keb= 0, 512 °C/m e Kcr=1, 86 °C/m calcolare il punto di ebollizione e di fusione di una soluzione acquosa di glucosio 0, 0222 m. Teb= Keb m Tcr= Kcr m Teb= Keb m = 0, 512 °C/m 0, 0222 m = 0, 0114 °C Teb= 100, 00 + 0, 0114 = 100, 011°C Tcr= Kcr m = 1, 86 °C/m 0, 0222 m = 0, 0413 °C Tcr= 0, 000 - 0, 0413 = - 0, 041°C

Le proprietà colligative possono essere usate per determinare il peso molecolare di sostanze non note. Problema: La canfora fonde a 179, 5°C ed ha Kcr= 40°C/m. Se 1, 07 mg di un composto sono sciolti in 78, 1 mg di canfora fusa la soluzione congela a 176, 0 °C. Determinare il peso molecolare del composto. L’abbassamento del punto di congelamento è: Tcr= 179, 5 – 176, 0 = 3, 5 °C Da cui si ricava la molalità della soluzione:

Dalla definizione di molalità si può ottenere il numero di moli del composto: moli= m Kg solvente Quindi: Moli = m Kg solvente = 0, 088 mol/Kg 78, 1 10 -6 Kg = 6, 9 10 -6 mol La massa molare del composto è data da:

Proprietà delle soluzioni ideali: abbassamento della pressione parziale di vapore P i = P i° X i innalzamento della temperatura di ebollizione Teb = keb mi abbassamento della temperatura di congelamento Tcr = - kcr mi

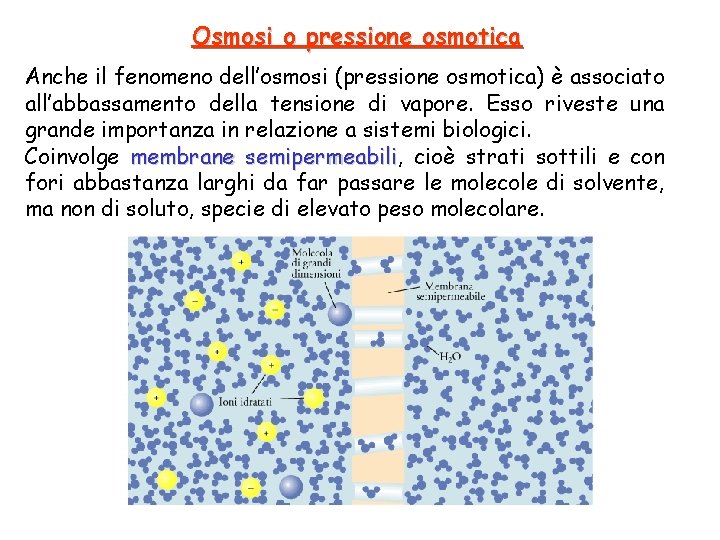
Osmosi o pressione osmotica Anche il fenomeno dell’osmosi (pressione osmotica) è associato all’abbassamento della tensione di vapore. Esso riveste una grande importanza in relazione a sistemi biologici. Coinvolge membrane semipermeabili, semipermeabili cioè strati sottili e con fori abbastanza larghi da far passare le molecole di solvente, ma non di soluto, specie di elevato peso molecolare.

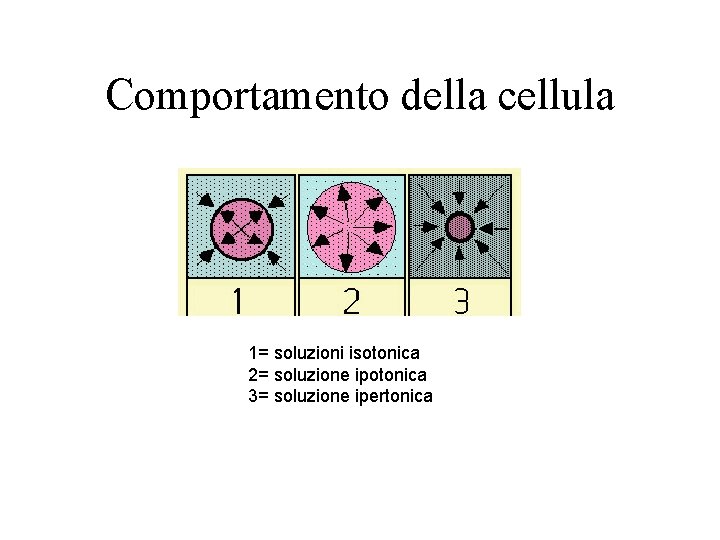
Comportamento della cellula 1= soluzioni isotonica 2= soluzione ipotonica 3= soluzione ipertonica

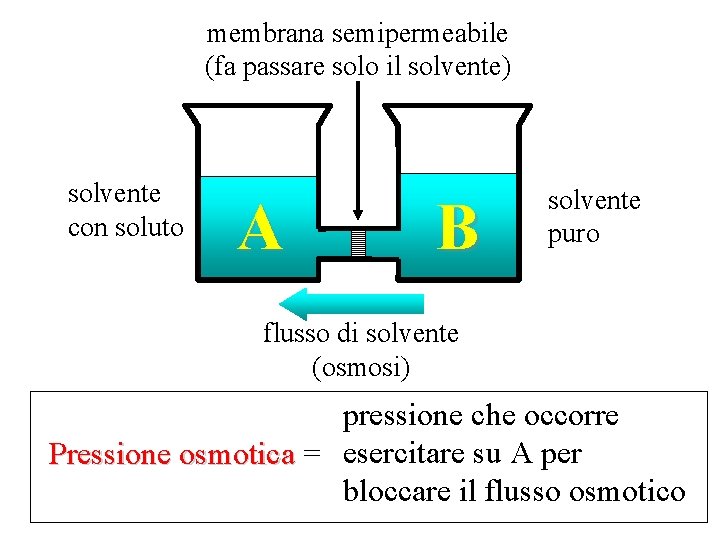
membrana semipermeabile (fa passare solo il solvente) solvente con soluto A B solvente puro flusso di solvente (osmosi) pressione che occorre Pressione osmotica = esercitare su A per bloccare il flusso osmotico

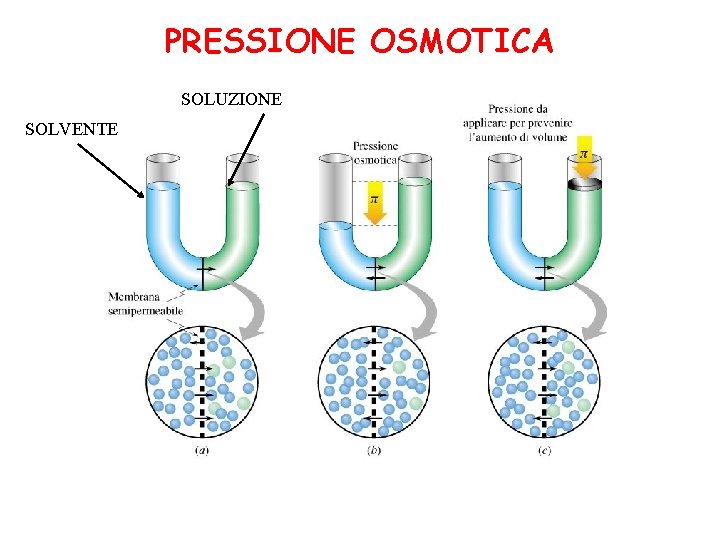
PRESSIONE OSMOTICA SOLUZIONE SOLVENTE

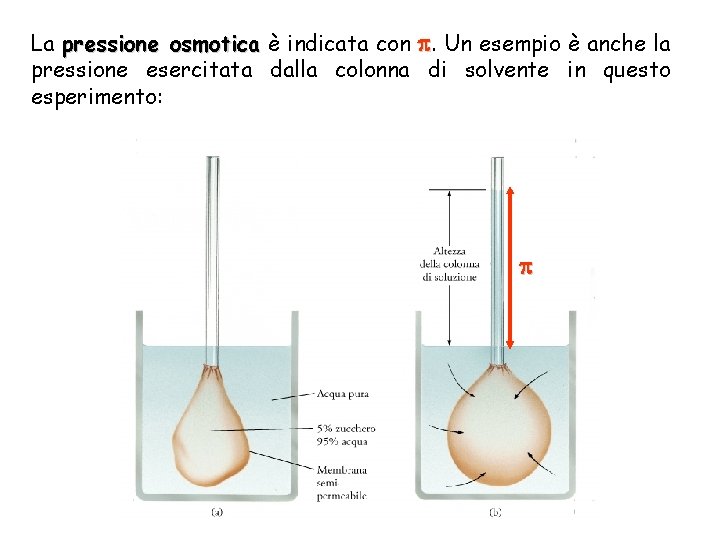
La pressione osmotica è indicata con . Un esempio è anche la pressione esercitata dalla colonna di solvente in questo esperimento:

Legge di van’t Hoff = pressione osmotica V = n RT da cui: Jacobus Henricus van 't Hoff Rotterdam (1852) - Steglitz (1911) Premio Nobel per la Chimica 1901 = RT c (c = molarità) c= concentrazione specie in soluzione

Esempio 1: Calcolare la pressione osmotica di una soluzione 0, 02 M di glucosio a 25°C? = MRT = 0, 02 mol/l 0, 0821 l atm/(K mol) 298 K= = 0, 5 atm Esempio 2: Calcolare la pressione osmotica di una soluzione 0, 02 M di Na. Cl a 25°C? = Mi. RT = 2 0, 02 mol/l 0, 0821 l atm/(K mol) 298 K= = 1, 0 atm

La pressione osmotica viene utilizzata per calcolare il peso molecolare di sostanze polimeriche o macromolecole. Problema: 50 ml di una soluzione acquosa contengono 1, 08 g di una proteina e presentano una pressione osmotica di 5, 85 mm. Hg a 298 K. Quale è il peso molecolare di tale proteina? La pressione in atmosfere è: La concentrazione molare della proteina è: Il numero di moli della proteina è: La massa molare della proteina è: