I sistemi a pi componenti In chimica si






















- Slides: 39

I sistemi a più componenti In chimica, si definisce soluzione una miscela omogenea in cui più sostanze sono contenute in una fase liquida o solida o gassosa. Contiene particelle diverse mescolate e distribuite in modo uniforme nello spazio disponibile in modo che ogni volume di soluzione abbia la medesima composizione degli altri e quindi le proprietà di ogni volume sono uniformi in ogni parte del campione. Es. 1. Due liquidi se miscibili in certi rapporti danno un sistema omogeneo e quindi soluzione, se immiscibili danno un sistema etereogeneo. 2. Se un solido è solubile in un liquido in certi rapporti si ha un sistema omogeneo, se insolubile si ha un sistema eterogeneo. 3. Gas sono miscibili in tutte le loro proporzioni e sono quindi sistemi sempre omogenei.

Le soluzioni possono esistere in ognuno dei tre stati della materia: gas, liquido o solido. Il solvente è il componente presente in quantità maggiore e determina lo stato della materia in cui la soluzione esiste. Il soluto è un componente presente in quantità minore.

Il caso più comune è quello di soluzioni liquide (soluzioni di gas, solidi o liquidi sciolti in un liquido). Soluzioni liquide: • Sistemi omogenei liquidi costituiti da più di una sostanza con composizione variabile continuità entro certi limiti più o meno ampi • Sono le più comuni e sono ottenute nella maggior parte dei casi sciogliendo un gas, un liquido o un solido in un liquido che è presente in maggior quantità, detto solvente. Se soluzione formata da due o più componenti liquidi, in genere il solvente è considerato quello in quantità maggiori. • Le soluzioni liquido-liquido possono non essere miscibili in tutte le proporzioni.

Si possono però avere: Soluzioni gassose: in genere i gas possono mescolarsi in tutte le proporzioni per dare soluzioni gassose. Soluzioni solide: sono principalmente leghe di due o più metalli. Le leghe di mercurio (l’unico metallo liquido) con altri metalli sono chiamate amalgame e possono essere sia liquide che solide.

La composizione delle soluzioni liquide Massa del soluto e del solvente. Se i componenti sono liquidi si può avere volume del soluto e solvente. Dividendo massa, o volume, del soluto per la massa, o volume, della soluzione e moltiplicando per 100 si ha la percentuale in massa, o volume, del soluto nella soluzione. Es. Na. Cl al 5% in peso, 5 g di Na. Cl per 100 g di soluzione CH 3 OH al 10% in volume, 10 dm 3 di alcol per ogni 100 dm 3 di soluzione Frazione molare: x 1 = n 1 + n 2 x 2 = n 2 n 1 + n 2

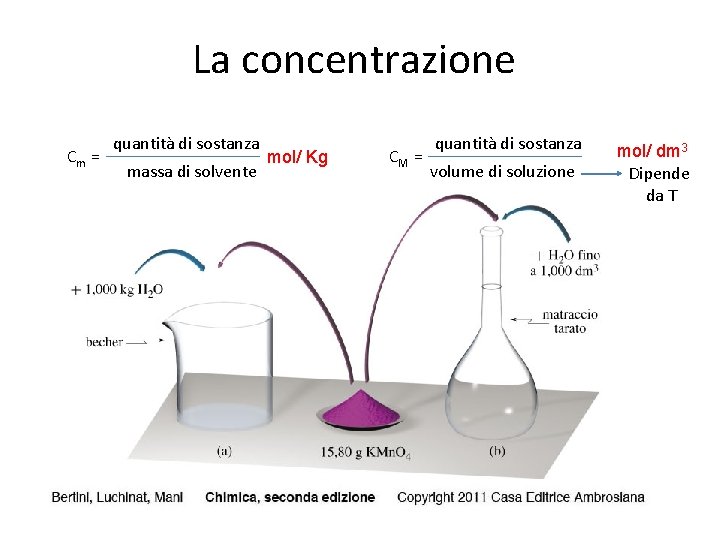
La concentrazione Cm = quantità di sostanza massa di solvente mol/ Kg CM = quantità di sostanza volume di soluzione mol/ dm 3 Dipende da T

Interconversione tra CM e Cm Per farlo è necessario conoscere la densità della soluzione, d = massa /volume: Cm = 1 d - M 1 CM 1000 CM = d 1 + M 1 Cm 1000 Solubilità = la massima quantità di soluto che si scioglie in una quantità definita di solvente puro o di soluzione. E’ costante a T costante; se soluto è gas, è costante a P e T costante Dipende dalla natura chimica del solvente e del soluto Soluzione satura = il soluto ha raggiunto il suo valore di solubilità massima.

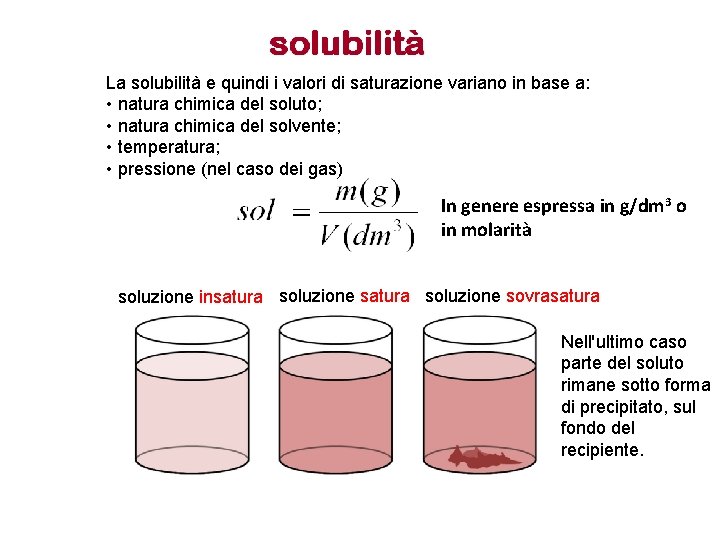
La solubilità e quindi i valori di saturazione variano in base a: • natura chimica del soluto; • natura chimica del solvente; • temperatura; • pressione (nel caso dei gas) In genere espressa in g/dm 3 o in molarità soluzione insatura soluzione sovrasatura Nell'ultimo caso parte del soluto rimane sotto forma di precipitato, sul fondo del recipiente.

Esistono criteri empirici per prevedere se un tipo di soluto si scioglie in un determinato solvente? Sì, e si basano sulla conoscenza della natura delle interazioni presenti nel soluto e nel solvente, che devono «essere simili»

La solubilità di una sostanza in un’altra può essere spiegata sulla base di due fattori: 1. Una naturale tendenza al disordine (fattore entropico). E’ praticamente l’unico fattore ad agire nel caso dei gas (ideali) che sono miscibili in tutte le proporzioni. 2. Forze intermolecolari di attrazione tra le molecole delle due sostanze (fattore entalpico). Chiamando A le molecole di una sostanze e B quelle dell’altra, se la media delle attrazioni A-A e B-B è superiore all’attrazione A-B le due sostanze non tendono a mescolarsi. La solubilità di un soluto in un solvente dipende da un bilancio fra questi due fattori.

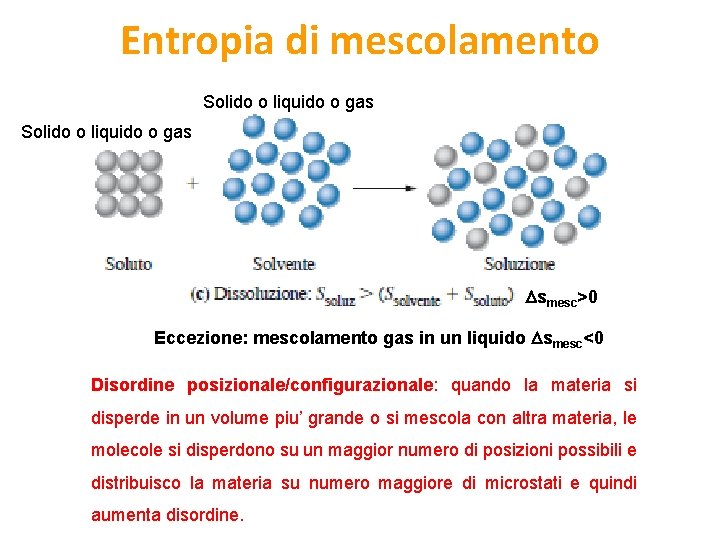
Entropia di mescolamento Solido o liquido o gas smesc>0 Eccezione: mescolamento gas in un liquido smesc<0 Disordine posizionale/configurazionale: quando la materia si disperde in un volume piu’ grande o si mescola con altra materia, le molecole si disperdono su un maggior numero di posizioni possibili e distribuisco la materia su numero maggiore di microstati e quindi aumenta disordine.

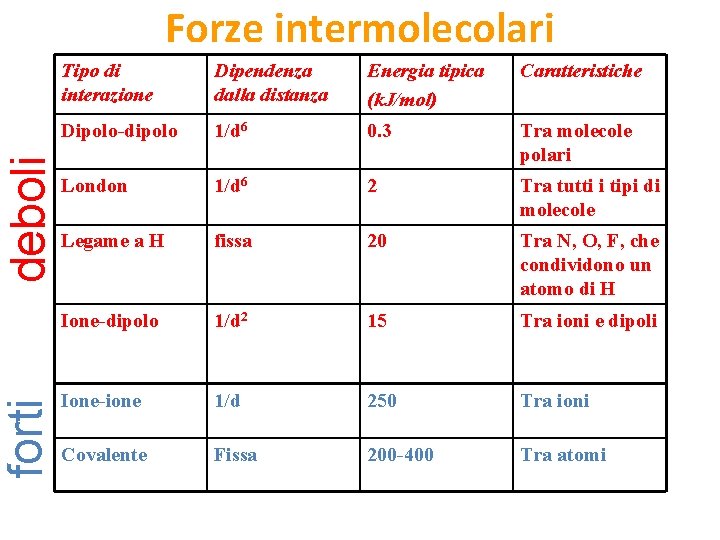
forti deboli Forze intermolecolari Tipo di interazione Dipendenza dalla distanza Energia tipica (k. J/mol) Caratteristiche Dipolo-dipolo 1/d 6 0. 3 Tra molecole polari London 1/d 6 2 Tra tutti i tipi di molecole Legame a H fissa 20 Tra N, O, F, che condividono un atomo di H Ione-dipolo 1/d 2 15 Tra ioni e dipoli Ione-ione 1/d 250 Tra ioni Covalente Fissa 200 -400 Tra atomi

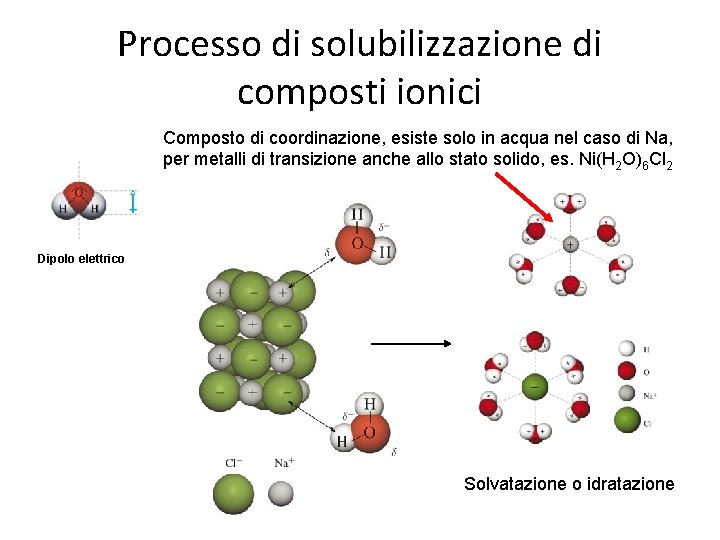
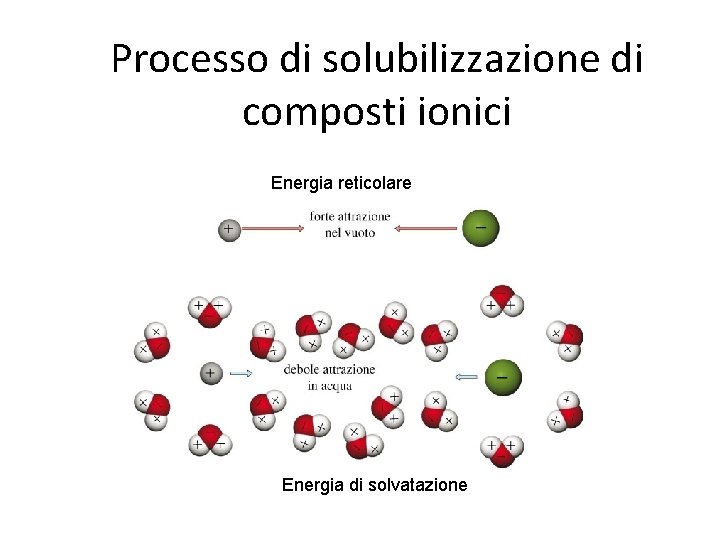
Processo di solubilizzazione di composti ionici Composto di coordinazione, esiste solo in acqua nel caso di Na, per metalli di transizione anche allo stato solido, es. Ni(H 2 O)6 Cl 2 Dipolo elettrico Solvatazione o idratazione

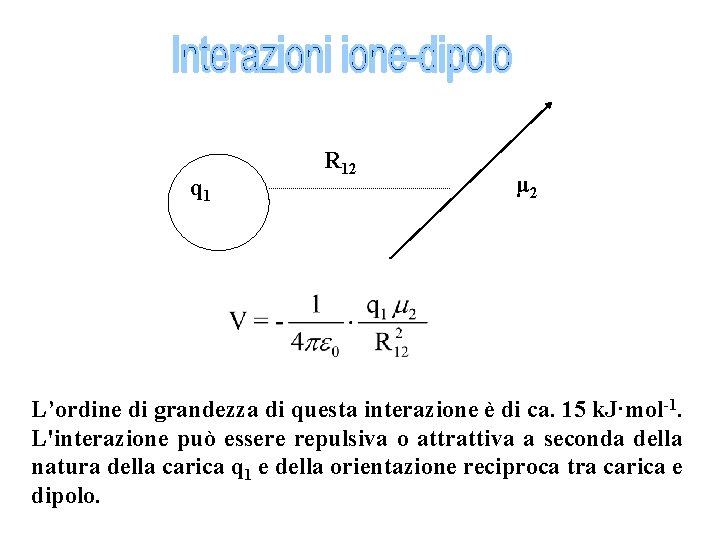
q 1 R 12 μ 2 L’ordine di grandezza di questa interazione è di ca. 15 k. J·mol-1. L'interazione può essere repulsiva o attrattiva a seconda della natura della carica q 1 e della orientazione reciproca tra carica e dipolo.

Processo di solubilizzazione di composti ionici Energia reticolare Energia di solvatazione

Termodinamica di dissoluzione di un composto ionico Entalpia di solubilizzazione DHsol = DHret + DHidr > 0 Termine positivo negativo In genere, il contributo entalpico alla solubilizzazione di composti ionici risulta contrario al processo di dissoluzione (anche se di poco), perché il contributo di entapia di idratazione non è abbastaza negativo da compensare il contributo positivo dell’entalpia reticolare (o anche detta di dissociazione).

Entalpia di sobulizzazione Per il processo di soluzione di un solido in un liquido è possibile definire un calore o entalpia di solubilizzazione, Hsol che è sostanzialmente uguale all’energia di solvatazione (negativa) più l’energia reticolare (positiva): Hsol = energia di solvatazione + energia reticolare Se prevale l’energia di solvatazione il processo di soluzione è esotermico Hsol<0 mentre se prevale l’energia reticolare il processo è endoternico, Hsol>0. Solidi con Hsol<0 sono molto solubili ma anche solidi con Hsol>0 sono spesso solubili (purchè il Hsol non sia troppo grande) per effetto della tendenza al disordine Di fatto, la maggior parte dei solidi ionici solubili ha Hsol piccolo e positivo.

Termodinamica di dissoluzione di un composto ionico All’inizio del processo di dissoluzione DS (Entropia di solubilizzazione) > 0 TDSsol > DHsol Man mano che il processo di solubilizzazione va avanti, la conc. della soluzione aumenta, DS diminuisce e puo’ diventare anche negativo. All’equilibrio DHsol – TDSsol = 0 e la soluzione è satura. Quando DHsol = TDSsol si ha l’equilibrio ed il numero di particelle che dal solido passano in soluzione è uguale al numero di particelle che nello stesso tempo dalla soluzione ritornano allo stato solido (equilibrio dinamico). Da questo punto di equilibrio in poi, la soluzione è satura, e pur aggiungendo sale la concentrazione del sale non aumenta più, ma il solido rimane come corpo di fondo. La solubilità è costante a T costante una volta stabilito il soluto e il solvente, perche’ dipende solo dalla loro natura chimica.

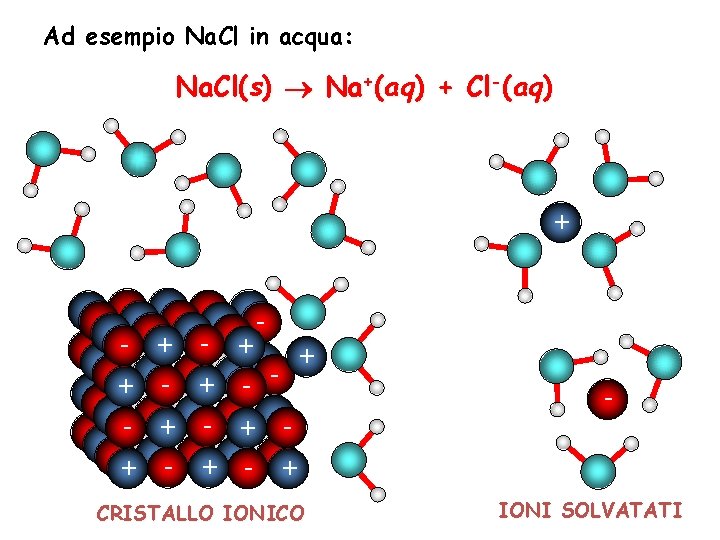
Ad esempio Na. Cl in acqua: Na. Cl(s) Na+(aq) + Cl-(aq) + - + + - - - + + + - - + + - + CRISTALLO IONICO - IONI SOLVATATI

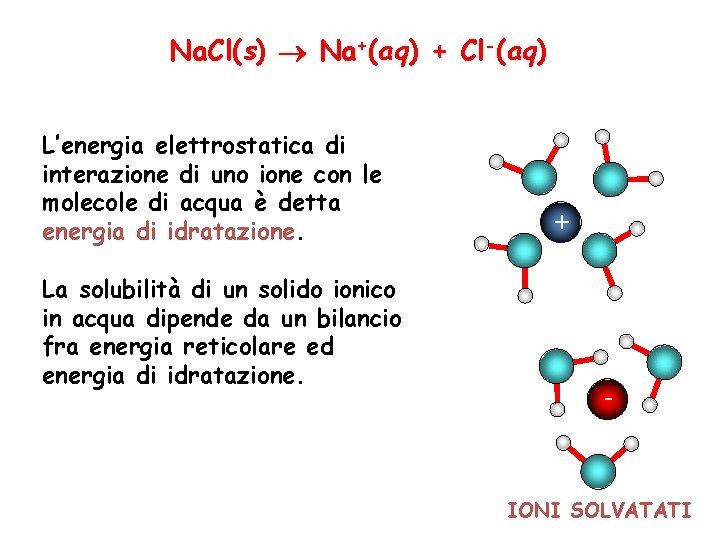
Na. Cl(s) Na+(aq) + Cl-(aq) L’energia elettrostatica di interazione di uno ione con le molecole di acqua è detta energia di idratazione. La solubilità di un solido ionico in acqua dipende da un bilancio fra energia reticolare ed energia di idratazione. + - IONI SOLVATATI

Soluzioniche In questo caso il soluto è un solido ionico tenuto assieme da forti legami ionici e può sciogliersi solo in solventi polari. I fattori che determinano la dissoluzione di un solido ionico in un solvente polare sono due: - l’energia reticolare del solido (somma delle energie di attrazione fra anioni e cationi): più è grande e minore è la tendenza del solido a sciogliersi - l’energia di attrazione-dipolo fra gli ioni e i dipoli elettrici costituiti dalle molecole di solvente opportunamente orientati: più è grande maggiore è la tendenza del solido a sciogliersi

Maggiore è l’energia reticolare di un composto ionico e minore è la sua solubilità e viceversa. L’energia reticolare dipende sia dalle cariche degli ioni che dalla loro distanza: - maggiore è la carica dello ione e maggiore è l’energia reticolare - maggiore è la distanza fra gli ioni (più grandi sono gli ioni) e minore è l’energia reticolare La situazione è complicata dal fatto che l’energia di idratazione è più grande per ioni di carica elevata e di dimensioni piccole. In genere l’energia reticolare prevale per cui è possibile quindi prevedere che: - solidi formati da ioni con una sola carica specie se di grandi dimensioni (K+, NH 4+) sono in genere solubili - solidi formati da ioni con due o tre cariche specie se di piccole dimensioni (S 2 - PO 43 -) sono in genere insolubili.

In conseguenza di questa tendenza si possono dare le seguenti regole di solubilità: Sono sempre solubili sali di: metalli alcalini e ione NH 4+ nitrati perclorati e acetati Sono per lo più solubili sali di: cloruri, bromuri e ioduri tranne quelli di Ag+ e Pb 2+ solfati tranne quelli di Ca 2+, Sr 2+, Ba 2+e Pb 2+ Sono per lo più insolubili sali di: solfuri e idrossidi tranne che dei gruppi I-II e NH 4+ carbonati e fosfati tranne che del gruppo I e NH 4+

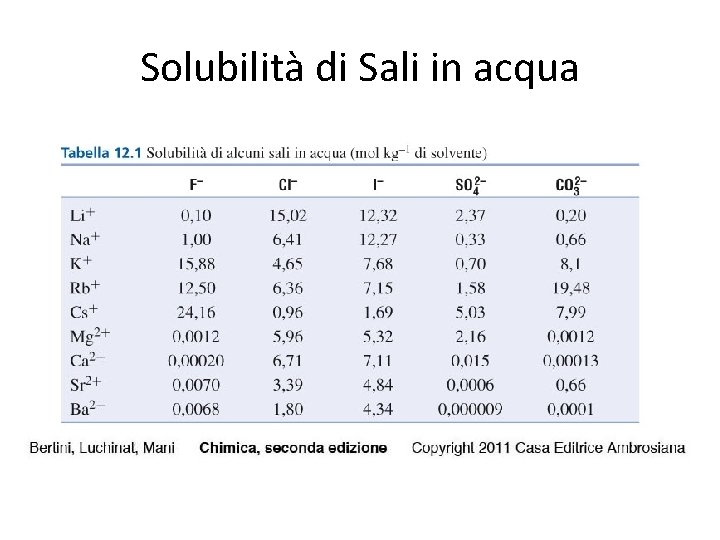
Solubilità di Sali in acqua

Solubilità di Sali in diversi solventi In genere, se il momento dipolare del solvente è alto, le interazioni di solvatazione sono forti, e quindi il composto ionico è solubile

Dissoluzione di composti molecolari liquidi e solidi Principio di Mitscherlich: similia similibus solvuntur (i simili sono sciolti da simili) L’interazione tra composto molecolare, soluto, e solvente è di tipo di Van der Waals DHsol piccolo in valore assoluto, se interazione soluto-solvente e solvente-solvente sono delle stesso ordine di grandezza e dello stesso tipo. Entropia di mescolamento determina completa solubilità in tutte le proporzioni. Es. Liquidi completamente miscibili in tutte le proporzioni sono

Dissoluzione di composti molecolari liquidi e solidi Principio di Mitscherlich: similia similibus solvuntur (i simili sono sciolti da simili) Se i due liquidi sono strutturalmente molto diversi, per es. acqua e benzene, sono praticamente immiscibili. Termine entalpico è infatti sfavorevole alla dissoluzione e predomina su quello entropico. Se il soluto è solido molecolare, vale lo stesso criterio del soluto liquido (Es. I 2 benzene e I 2 -H 2 O). Insolubilità di solidi covalenti polimeri e metalli per elevata entalpia reticolare, ad eccezione del solvente Mercurio che porta in soluzione i metalli per effetto entropico, amalgama Solubilità di composti con legame a idrogeno

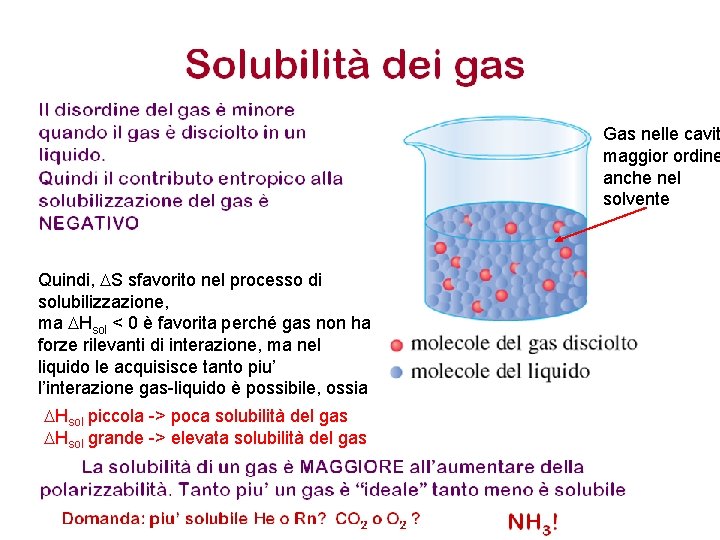
Gas nelle cavit maggior ordine anche nel solvente Quindi, DS sfavorito nel processo di solubilizzazione, ma DHsol < 0 è favorita perché gas non ha forze rilevanti di interazione, ma nel liquido le acquisisce tanto piu’ l’interazione gas-liquido è possibile, ossia DHsol piccola -> poca solubilità del gas DHsol grande -> elevata solubilità del gas

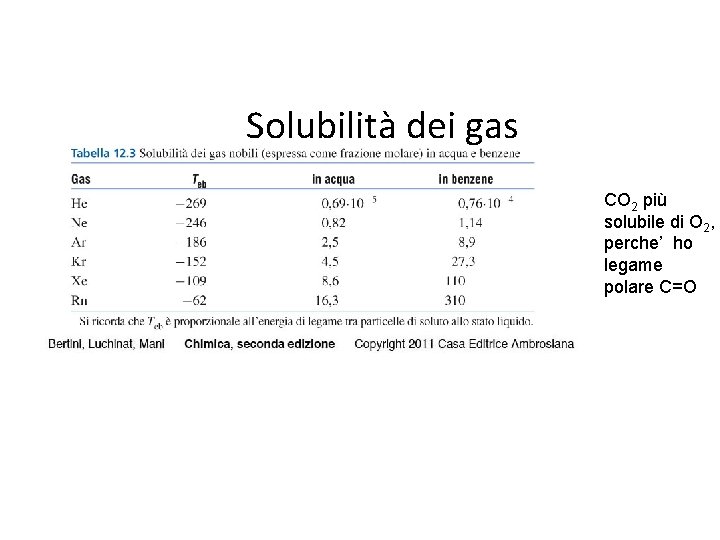
Solubilità dei gas CO 2 più solubile di O 2, perche’ ho legame polare C=O

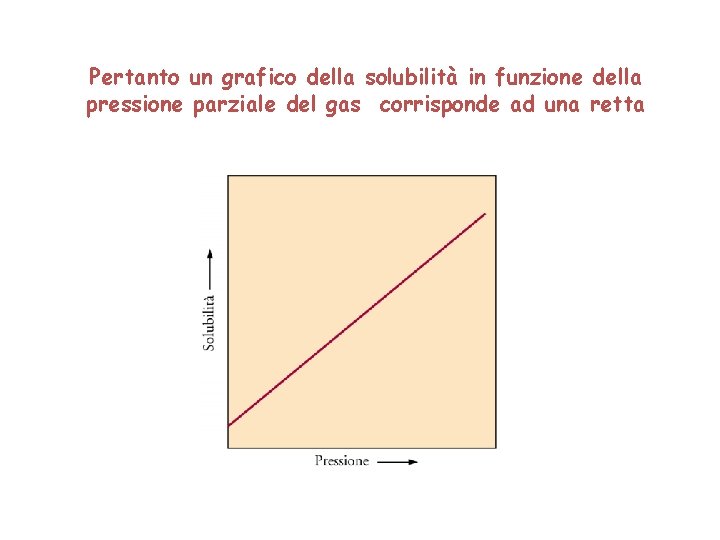
Solubilità in funzione della pressione La pressione ha poco effetto sulla solubilità di solidi e di liquidi. E’ invece importante per la solubilità dei gas. Solubilità dei gas La solubilità di un gas in un liquido dipende dalla pressione parziale del gas secondo la legge di Henry. La solubilità di un gas è direttamente proporzionale alla pressione parziale del gas, P, sopra la soluzione (per pressioni moderate): s=k. HP La solubilità s è generalmente espressa in grammi di soluto per litro di soluzione e k. H è una costante.

legge di Henry. La solubilità di un gas è direttamente proporzionale alla pressione parziale del gas, P, sopra la soluzione: s=k. HP

Pertanto un grafico della solubilità in funzione della pressione parziale del gas corrisponde ad una retta

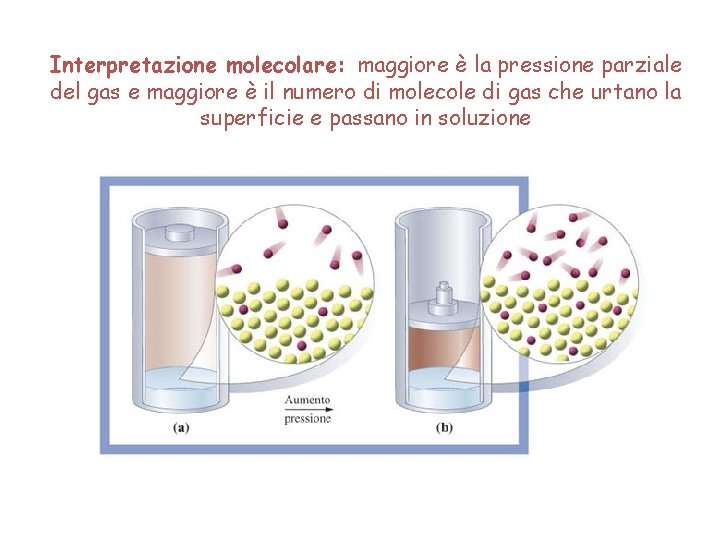
Interpretazione molecolare: maggiore è la pressione parziale del gas e maggiore è il numero di molecole di gas che urtano la superficie e passano in soluzione

Principio di Le Chatelier-Braun Se si esercita un’azione su un sistema all’equilibrio che tenda a cambiare uno dei parametri da cui l’equilibrio dipende, il sistema reagisce in modo tale da rendere minore quel cambiamento, o comunque da opporvisi. Se aumento la P, diminuendo il V o aumentando il numero di particelle in fase gassosa, il principio mi dice che il sistema evolverà in modo tale da minimizzare l’aumento di P e quindi ciò avviene se piu’ gas si scioglie nel solvente, aumentando di fatto la sua solubilità

Esempio: 27 g di acetilene si sciolgono in un litro di acetone ad 1 atm. Quanti grammi si sciolgono a 12 atm? P 1= 1 atm s 1= k. H P 1 P 2= 12 atm s 2= k. H P 2 Dividendo la seconda equazione per la prima: A P 1= 1 atm si ha s 1= 27 g/ 1 litro = 27 g/l. Dalla relazione sopra si ha: Quindi a 12 atm 1 litro di acetone scioglie 324 g di acetilene

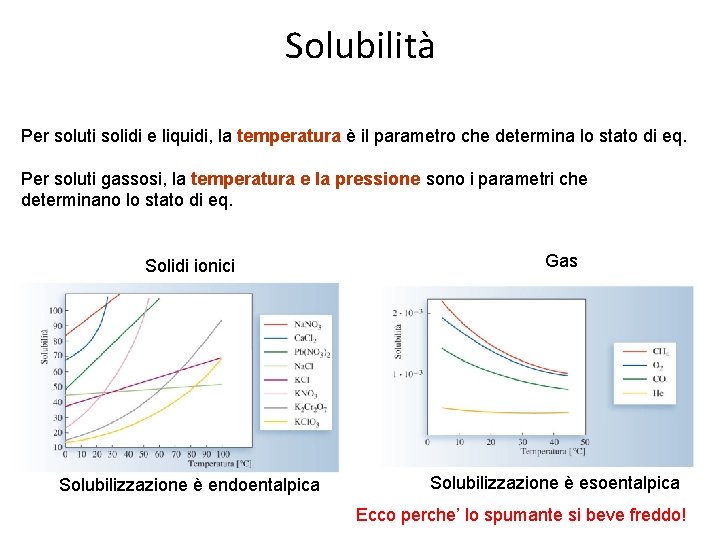
Solubilità Per soluti solidi e liquidi, la temperatura è il parametro che determina lo stato di eq. Per soluti gassosi, la temperatura e la pressione sono i parametri che determinano lo stato di eq. Solidi ionici Solubilizzazione è endoentalpica Gas Solubilizzazione è esoentalpica Ecco perche’ lo spumante si beve freddo!

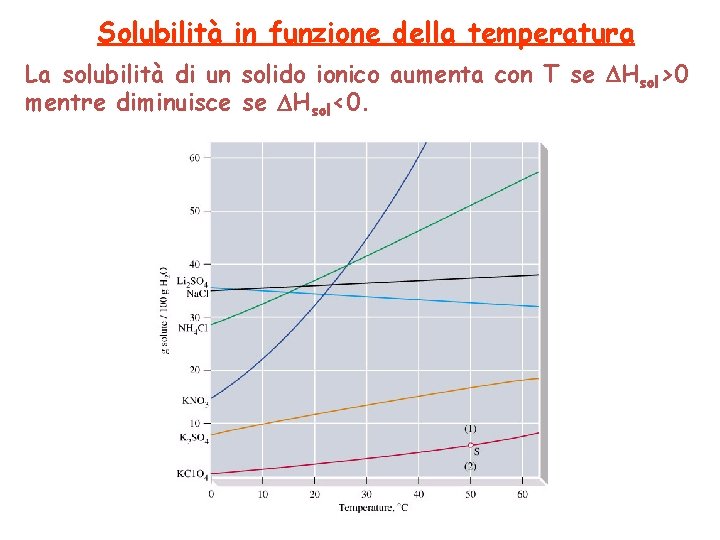
Solubilità in funzione della temperatura La solubilità di un solido ionico aumenta con T se Hsol>0 mentre diminuisce se Hsol<0.

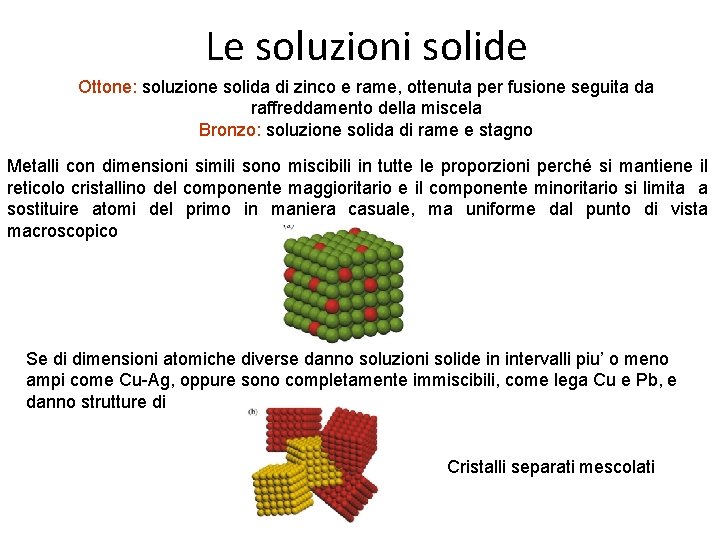
Le soluzioni solide Ottone: soluzione solida di zinco e rame, ottenuta per fusione seguita da raffreddamento della miscela Bronzo: soluzione solida di rame e stagno Metalli con dimensioni simili sono miscibili in tutte le proporzioni perché si mantiene il reticolo cristallino del componente maggioritario e il componente minoritario si limita a sostituire atomi del primo in maniera casuale, ma uniforme dal punto di vista macroscopico Se di dimensioni atomiche diverse danno soluzioni solide in intervalli piu’ o meno ampi come Cu-Ag, oppure sono completamente immiscibili, come lega Cu e Pb, e danno strutture di Cristalli separati mescolati

Le soluzioni solide Altre soluzioni solide sono i vetrioli: MSO 4 7 H 2 O con M = Mn, Fe, Co, Ni, Cu, Zn Hanno strutture cristalline del tutto simili e 6 molecole d’acqua sono coordinate al metallo. Es. se prendo solfato di Zn e Cu gli sciolgo in acqua in certi rapporti e poi evaporo l’acqua, ottengo composto (Zn(1 -x), Cux)SO 4 7 H 2 O dove x è la frazione in moli di Cu rispetto alla quantità totale di metallo. Si dice che i due ioni metallici sono vicarianti Allumi MIMIII(SO 4)2 12 H 2 O con MI = K, Na, Rb, Cs, Tl ecc. e MIII = Al, Cr, Fe, Tl ecc. I rapporti tra i componenti di una soluzione solida sono espressi in % o in frazione molare, con definizioni analoghe a quelle usate per le soluzioni liquide.
 I fondamenti dell'ict
I fondamenti dell'ict Repetto
Repetto Analisi componenti principali
Analisi componenti principali Green village cittadella
Green village cittadella Componenti del sangue
Componenti del sangue Parte della fisica che studia il moto dei corpi
Parte della fisica che studia il moto dei corpi Componenti fortemente connesse
Componenti fortemente connesse Chimica zanichelli soluzioni capitolo 16
Chimica zanichelli soluzioni capitolo 16 Leganti chimica
Leganti chimica Mappa concettuale nomenclatura chimica
Mappa concettuale nomenclatura chimica Soluzioni capitolo a1 chimica organica
Soluzioni capitolo a1 chimica organica Chimica più dalla mole alla nomenclatura soluzioni
Chimica più dalla mole alla nomenclatura soluzioni Moli/litro
Moli/litro Chimica più soluzioni capitolo 8
Chimica più soluzioni capitolo 8 Storia materie plastiche
Storia materie plastiche Chimica
Chimica Serie di bowen
Serie di bowen Soluzione satura
Soluzione satura Ce sunt produsii de reactie
Ce sunt produsii de reactie Sapone di marsiglia in inglese
Sapone di marsiglia in inglese Appelli ingegneria unipv
Appelli ingegneria unipv Elettrolisi idrogeno
Elettrolisi idrogeno Barriere postzigotiche
Barriere postzigotiche Soluzioni il racconto della chimica
Soluzioni il racconto della chimica Soluzioni chimica zanichelli capitolo 19
Soluzioni chimica zanichelli capitolo 19 Chimica più soluzioni capitolo 8
Chimica più soluzioni capitolo 8 Costante di faraday
Costante di faraday Dipartimento di chimica pavia
Dipartimento di chimica pavia Reazione di riduzione
Reazione di riduzione Formule chimica
Formule chimica Formula di struttura alcani
Formula di struttura alcani Capitolo 10 chimica zanichelli
Capitolo 10 chimica zanichelli Beuta codata chimica
Beuta codata chimica Chimica piu capitolo 10 soluzioni
Chimica piu capitolo 10 soluzioni Pesi atomici
Pesi atomici Una branca della chimica
Una branca della chimica Pipetta con palla di peleo
Pipetta con palla di peleo Tecniche di separazione chimica
Tecniche di separazione chimica Una branca della chimica
Una branca della chimica Legge di boltzmann
Legge di boltzmann