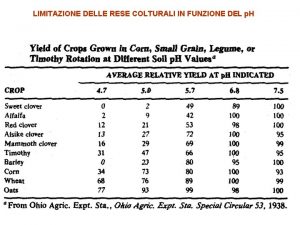
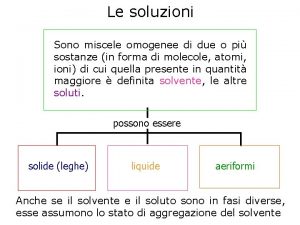
Il valore di p H di una soluzione











- Slides: 18

Il valore di p. H di una soluzione ottenuta mescolando 25 ml di una soluzione di HCl 0, 2 M con 20 ml di una soluzione di ammoniaca 0, 5 M è circa …. 1, 94 4, 44 5, 04 9, 26 10, 05

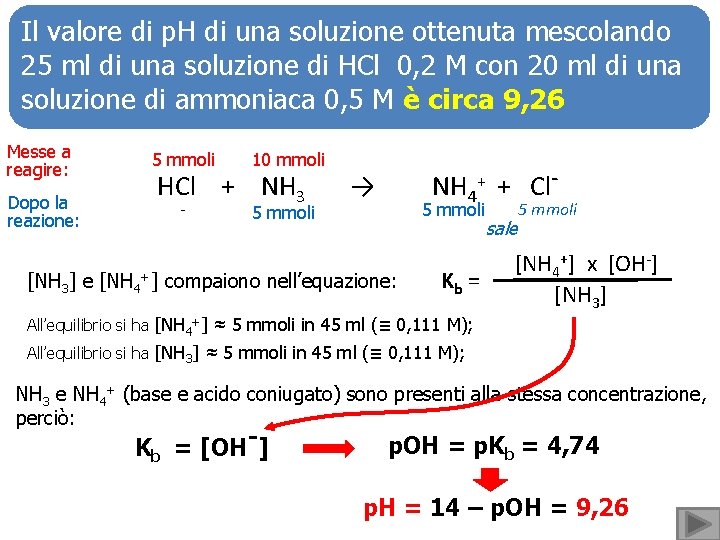
Il valore di p. H di una soluzione ottenuta mescolando 25 ml di una soluzione di HCl 0, 2 M con 20 ml di una soluzione di ammoniaca 0, 5 M è circa 9, 26 Messe a reagire: 5 mmoli 10 mmoli Dopo la reazione: - 5 mmoli HCl + NH 3 NH 4+ + Cl- → 5 mmoli [NH 3] e [NH 4+] compaiono nell’equazione: Kb = sale 5 mmoli [NH 4+] x [OH-] [NH 3] All’equilibrio si ha [NH 4+] ≈ 5 mmoli in 45 ml (≡ 0, 111 M); All’equilibrio si ha [NH 3] ≈ 5 mmoli in 45 ml (≡ 0, 111 M); NH 3 e NH 4+ (base e acido coniugato) sono presenti alla stessa concentrazione, perciò: Kb = [OH-] p. OH = p. Kb = 4, 74 p. H = 14 – p. OH = 9, 26

Il valore di p. H di una soluzione ottenuta mescolando 30 ml di una soluzione di KOH 100 m. M con 18, 0 ml di una soluzione di acido acetico 0, 50 M è circa. . . 1, 94 4, 43 7, 50 9, 26 10, 05

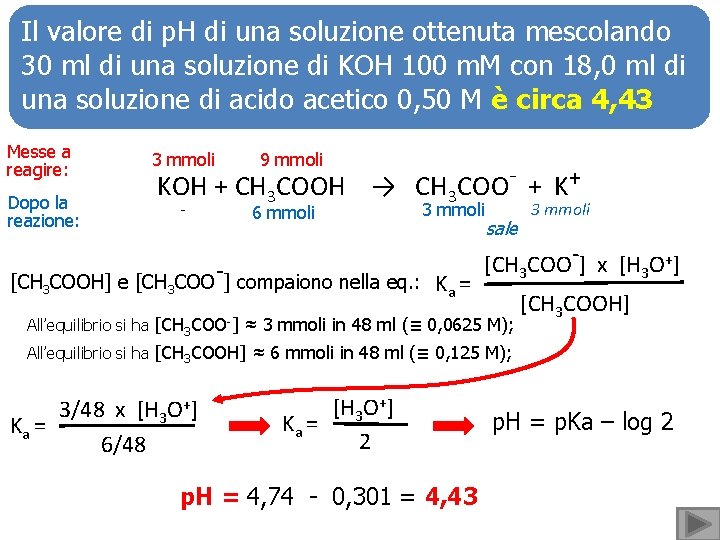
Il valore di p. H di una soluzione ottenuta mescolando 30 ml di una soluzione di KOH 100 m. M con 18, 0 ml di una soluzione di acido acetico 0, 50 M è circa 4, 43 Messe a reagire: 3 mmoli Dopo la reazione: - 9 mmoli KOH + CH 3 COOH → CH 3 COO- + K+ 6 mmoli [CH 3 COOH] e [CH 3 COO-] compaiono nella eq. : 3 mmoli Ka = sale 3 mmoli [CH 3 COO-] x [H 3 O+] All’equilibrio si ha [CH 3 COO-] ≈ 3 mmoli in 48 ml (≡ 0, 0625 M); [CH 3 COOH] All’equilibrio si ha [CH 3 COOH] ≈ 6 mmoli in 48 ml (≡ 0, 125 M); 3/48 x [H 3 O+] Ka = 6/48 [H 3 O+] Ka = 2 p. H = 4, 74 - 0, 301 = 4, 43 p. H = p. Ka – log 2

Il valore di p. H di una soluzione ottenuta mescolando 20 ml di una soluzione di KOH 500 m. M con 7, 5 ml di una soluzione di acido acetico 2, 00 M è circa …. 1, 94 4, 44 4, 64 5, 04 7, 50

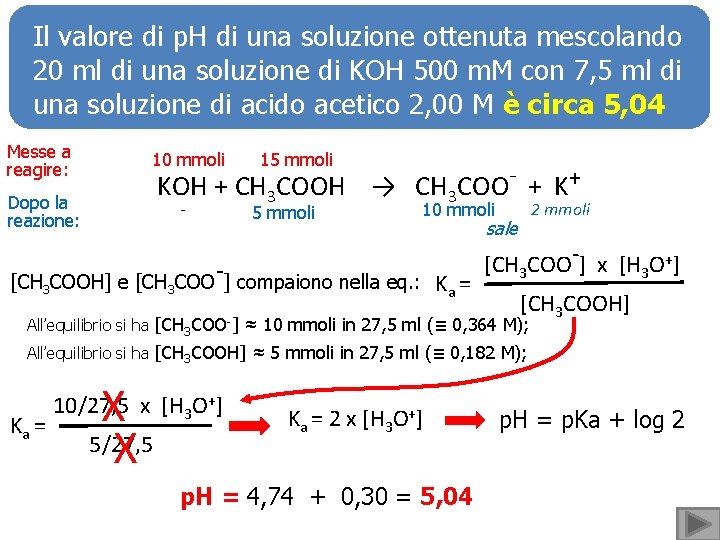
Il valore di p. H di una soluzione ottenuta mescolando 20 ml di una soluzione di KOH 500 m. M con 7, 5 ml di una soluzione di acido acetico 2, 00 M è circa 5, 04 Messe a reagire: 10 mmoli 15 mmoli KOH + CH 3 COOH → CH 3 COO- + K+ Dopo la reazione: - 5 mmoli 2 mmoli 10 mmoli [CH 3 COOH] e [CH 3 COO-] compaiono nella eq. : sale Ka = [CH 3 COO-] x [H 3 O+] [CH 3 COOH] All’equilibrio si ha [CH 3 COO-] ≈ 10 mmoli in 27, 5 ml (≡ 0, 364 M); All’equilibrio si ha [CH 3 COOH] ≈ 5 mmoli in 27, 5 ml (≡ 0, 182 M); Ka = X 5/27, 5 X 10/27, 5 x [H 3 O+] Ka = 2 x [H 3 O+] p. H = 4, 74 + 0, 30 = 5, 04 p. H = p. Ka + log 2

Il valore di p. H di una soluzione ottenuta mescolando 25 ml di una soluzione di HCl 0, 2 M con 30 ml di una soluzione di ammoniaca 0, 5 M è circa … 1, 94 4, 44 4, 63 7, 50 9, 66

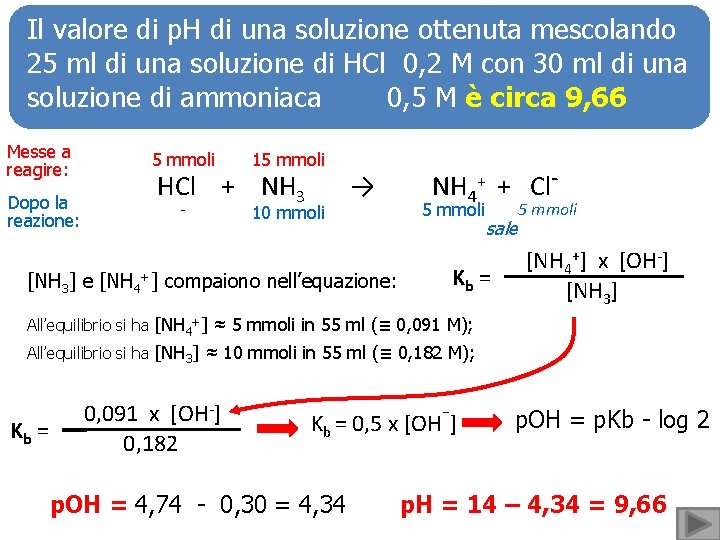
Il valore di p. H di una soluzione ottenuta mescolando 25 ml di una soluzione di HCl 0, 2 M con 30 ml di una soluzione di ammoniaca 0, 5 M è circa 9, 66 Messe a reagire: 5 mmoli 15 mmoli Dopo la reazione: - 10 mmoli HCl + NH 3 → [NH 3] e [NH 4+] compaiono nell’equazione: NH 4+ + Cl- 5 mmoli sale Kb = 5 mmoli [NH 4+] x [OH-] [NH 3] All’equilibrio si ha [NH 4+] ≈ 5 mmoli in 55 ml (≡ 0, 091 M); All’equilibrio si ha [NH 3] ≈ 10 mmoli in 55 ml (≡ 0, 182 M); Kb = 0, 091 x [OH-] 0, 182 Kb = 0, 5 x [OH-] p. OH = 4, 74 - 0, 30 = 4, 34 p. OH = p. Kb - log 2 p. H = 14 – 4, 34 = 9, 66

Il valore di p. H di una soluzione ottenuta mescolando 20 ml di una soluzione di Na. OH 0, 2 M con 20 ml di una soluzione di H 3 PO 4 0, 5 M è circa … 1, 94 3, 15 4, 54 7, 50 9, 46

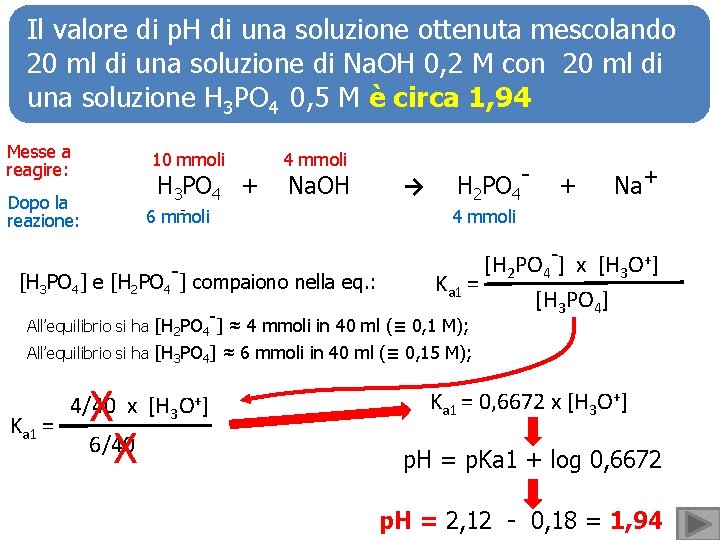
Il valore di p. H di una soluzione ottenuta mescolando 20 ml di una soluzione di Na. OH 0, 2 M con 20 ml di una soluzione H 3 PO 4 0, 5 M è circa 1, 94 Messe a reagire: 10 mmoli H 3 PO 4 + Dopo la reazione: 6 mmoli 4 mmoli Na. OH [H 3 PO 4] e [H 2 PO 4 -] compaiono nella eq. : - → H 2 PO 4 - + Na+ 4 mmoli [H 2 PO 4 -] x [H 3 O+] Ka 1 = [H 3 PO 4] All’equilibrio si ha [H 2 PO 4 ] ≈ 4 mmoli in 40 ml (≡ 0, 1 M); All’equilibrio si ha [H 3 PO 4] ≈ 6 mmoli in 40 ml (≡ 0, 15 M); Ka 1 = X 6/40 X 4/40 x [H 3 O+] Ka 1 = 0, 6672 x [H 3 O+] p. H = p. Ka 1 + log 0, 6672 p. H = 2, 12 - 0, 18 = 1, 94

Il valore di p. H di una soluzione ottenuta mescolando 100 ml di una soluzione di Na. OH 4 M con 100 ml di una soluzione di H 3 PO 4 2 M è circa … 4, 6 7, 6 9, 2 9, 6 10, 6

Il valore di p. H di una soluzione ottenuta mescolando 100 ml di una soluzione di Na. OH 4 M con 100 ml di una soluzione H 3 PO 4 2 M è circa 10, 6 Messe a reagire: Dopo la reazione: 200 mmoli 400 mmoli H 3 PO 4 + Na. OH → H 2 PO 4 - + Na+ 200 mmoli La reazione procede, essendoci un eccesso di Na. OH 200 mmoli H 2 PO 4 - + Na. OH → HPO 42 - + Dopo la reazione: Na+ 200 mmoli [HPO 42 -] (0. 2/0. 2 = 1 M) compare in due equilibri → H 2 PO 4 - + OHHPO 42 - + H 2 O ← HPO 42 - + H 2 O → PO 43 - + H 3 O+ ← p. Kb 2= 6. 8 p. Ka 3= 12. 35

Il valore di p. H di una soluzione ottenuta mescolando 100 ml di una soluzione di Na. OH 4 M con 100 ml di una soluzione H 3 PO 4 2 M è circa 10, 6 HPO 42 - + H 2 O → ← H 2 PO 4 - + HPO 42 - + H 2 O → ← PO 43 - + H 3 O+ OH- p. Kb 2= 6. 8 p. Ka 3= 12. 35 L’equilibrio da considerare per calcolare il p. H è quello che ha il più basso valore di p. K [H 2 PO 4 -] x [OH-] Kb 2 = [HPO 42 -] p. OH ≈ ½ p. Kb 2 – ½ log Cs = 3. 4 – ½ log 1 = 3. 4 p. H = 14 – p. OH = 10. 6

Il valore di p. H di una soluzione ottenuta mescolando 200 ml di una soluzione di Na. OH 0, 05 M con 900 ml di una soluzione di H 3 PO 4 0, 01 M è circa … 2, 13 3, 28 6, 25 7, 20 7, 50

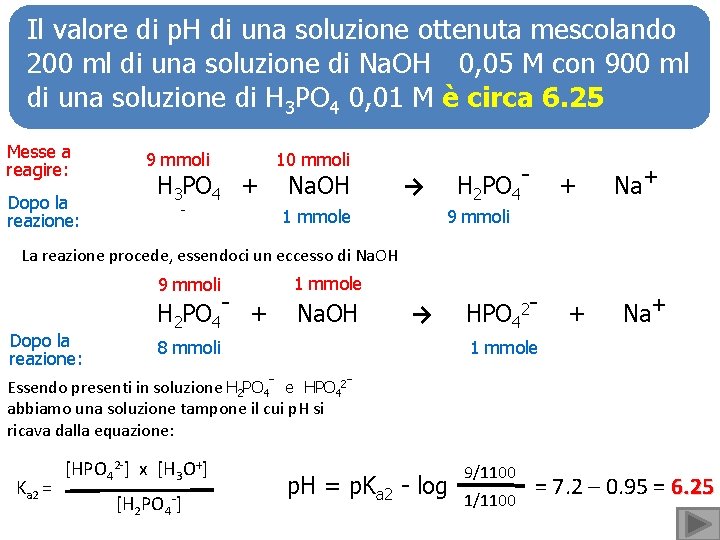
Il valore di p. H di una soluzione ottenuta mescolando 200 ml di una soluzione di Na. OH 0, 05 M con 900 ml di una soluzione di H 3 PO 4 0, 01 M è circa 6. 25 Messe a reagire: 9 mmoli Dopo la reazione: - H 3 PO 4 + 10 mmoli Na. OH H 2 PO 4 - → 1 mmole + Na+ 9 mmoli La reazione procede, essendoci un eccesso di Na. OH 9 mmoli Dopo la reazione: H 2 PO 4 - + 1 mmole Na. OH → 8 mmoli HPO 42 - + Na+ 1 mmole Essendo presenti in soluzione H 2 PO 4 - e HPO 42 abbiamo una soluzione tampone il cui p. H si ricava dalla equazione: Ka 2 = [HPO 42 -] x [H 3 O+] [H 2 PO 4 -] p. H = p. Ka 2 - log 9/1100 1/1100 = 7. 2 – 0. 95 = 6. 25

Il valore di p. H di una soluzione ottenuta mescolando 20 ml di una soluzione di H 3 PO 4 0, 2 M con 80 ml di una soluzione di idrossido di sodio 83 m. M è circa … 5, 3 6, 4 7, 5 8, 6 9, 7

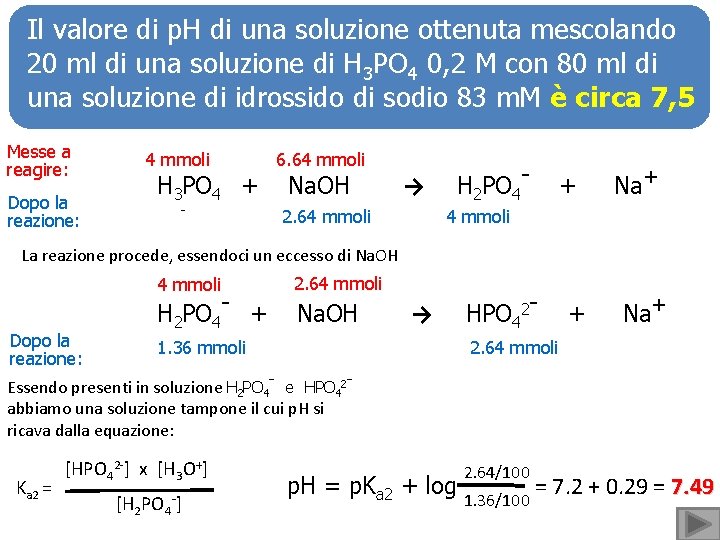
Il valore di p. H di una soluzione ottenuta mescolando 20 ml di una soluzione di H 3 PO 4 0, 2 M con 80 ml di una soluzione di idrossido di sodio 83 m. M è circa 7, 5 Messe a reagire: 4 mmoli Dopo la reazione: - H 3 PO 4 + 6. 64 mmoli Na. OH → 2. 64 mmoli H 2 PO 4 - + Na+ 4 mmoli La reazione procede, essendoci un eccesso di Na. OH 4 mmoli Dopo la reazione: H 2 PO 4 - + 2. 64 mmoli Na. OH 1. 36 mmoli → HPO 42 - + Na+ 2. 64 mmoli Essendo presenti in soluzione H 2 PO 4 - e HPO 42 abbiamo una soluzione tampone il cui p. H si ricava dalla equazione: Ka 2 = [HPO 42 -] x [H 3 O+] [H 2 PO 4 -] 2. 64/100 p. H = p. Ka 2 + log 1. 36/100 = 7. 2 + 0. 29 = 7. 49

Torna alla prima domanda
 Titolazione acido base zanichelli
Titolazione acido base zanichelli Normalità di una soluzione
Normalità di una soluzione Normalità di una soluzione
Normalità di una soluzione Mappa concettuale acidi e basi
Mappa concettuale acidi e basi Curva di riscaldamento miscuglio
Curva di riscaldamento miscuglio Tabelle di frequenza
Tabelle di frequenza Soluzioni chimica più
Soluzioni chimica più Polaresale.com
Polaresale.com Soluzione tampone
Soluzione tampone Soluzione satura
Soluzione satura Funzione
Funzione Soluzione satura
Soluzione satura Soluzione gassosa esempio
Soluzione gassosa esempio Dimensioni campo bernabeu
Dimensioni campo bernabeu Osmolarità
Osmolarità Kw= ka x kb
Kw= ka x kb Rettangolo con 12 pentamini
Rettangolo con 12 pentamini Il paradosso del barbiere soluzione
Il paradosso del barbiere soluzione Il paradosso del barbiere
Il paradosso del barbiere