LE SOLUZIONI LE SOLUZIONI Gassose solide o liquide


















- Slides: 20

LE SOLUZIONI

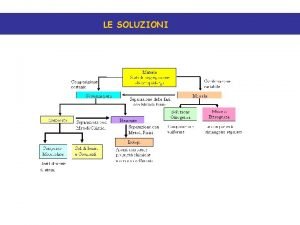
LE SOLUZIONI Gassose, solide o liquide Stato della soluzione Stato del solvente Stato del soluto Esempio Gas Gas aria Liquido Gas Ossigeno nell’acqua Liquido Alcool i acqua Liquido Solido Sale in acqua Solido Gas Idrogeno nel platino Solido Liquido Mercurio nell’argento Solido Argento nell’oro (certe leghe) Solvente: è il componente che all’atto della dissoluzione conserva il proprio stato di aggregazione oppure quello che fra componenti tutti nello stesso stato di aggregazione è presente in misura maggiore Soluti: tutti gli altri componenti

LE SOLUZIONI Nel considerare una soluzione è necessario introdurre il termine CONCENTRAZIONE Serve a designare la quantità di soluto presente in una certa quantità di solvente o di soluzione gr di soluto NORMALITA’ (N) ---------n (eq) Come si esprime? Peso equivalente Normalità = --------------------Insoluzione termini quantitativi si usano L di soluzione L di In termini qualitativi si usano termini come diverse espressioni come Diluito Il peso equivalente corrisponde a peso molecolare / valenza Percentuale in peso p/p % concentrato Peso di soluto (gr) in 100 gr di Valenza dipende dalla tipologia del soluto: MOLARITA’ (M) soluzione per gli acidi: numero ioni H+ rilasciati gr didi soluto per i sali: numero-------di cariche (+) o (-) Moli di soluto PM soluto Percentuale in volume v/v % per gli idrossidi: numero di ioni OH- rilasciati Molarità = --------= -------Volume di soluto (m. L) in 100 m. L di le reazioni redox: numero di elettroni scambiati L per di soluzione L di soluzione Calcolare la massa equivalente dell'acido solforico H 2 SO 4 (Mm = 98, 0 g/mol) nella seguente reazione di dissociazione: soluzione H 2 SO 4 → 2 H+ + SO 42 In questa reazione l'acido solforico libera due ioni H+. Pertanto, la sua massa equivalente sarà: meq = Mm /n. H+ = 98, 0 / 2 = 49, 0 (g/eq) Molarità e normalità possono essere messe in relazione: N (eq/L) = M x Valenza Cl- nel siero 98 -106 m. Eq/L Percentuale peso/volume p/v % Peso di soluto (gr) in 100 m. L di soluzione 98 -106 mmol/L. . altre basate sul numero di moli…

LE SOLUZIONI Concentrazione di una soluzione basata sul numero di moli: FRAZIONE MOLARE (X) Moli del componente Frazione molare del componente (Χ) = ---------------Moli di tutti i componenti MOLALITA’ (m) Moli di soluto Molalità = -------------------1 kg (o 1000 gr) di solvente

LE SOLUZIONI Principi di solubilità: massima quantità (gr) di soluto che a una data temperatura e disciolta in 100 gr di solvente La natura delle particelle di solvente, di soluto e dalle loro interazioni Dalla temperatura alla quale si prepara una soluzione Dalla pressione di un soluto gassoso (Legge di Henry) Interazioni soluto-solvente “il simile scioglie il simile” Due sostanze che hanno forze intermolecolari simili e di entità paragonabili sono facilmente più solubili una nell’altra Acqua Na. Cl metanolo Na. OH Ca. CO 3 glicole etilenico Ba. SO 4 butanolo pentano ed esano in acqua dipende dal bilanciamento di due forze di natura elettrica: attrazione tra ioni e H 2 O, forze elettrostatiche tra ioni

LE SOLUZIONI Influenza della temperatura sulle solubilità Gas: la temperatura diminuisce la solubilità Soluti: la solubilità aumenta con l’aumentare della temperatura, se la solubilizzazione è un processo endotermico, mentre la diminuisce se il processo è esotermico Soluto + solvente + calore ↔ soluzione endotermica Soluto + solvente ↔ soluzione + calore esotermica Principio di Le Chatelier: un sistema in equilibrio che venga perturbato mediante un cambiamento della temperatura, della pressione o della concentrazione di uno dei suoi componenti, tenderà a modificare la posizione del proprio equilibrio nel senso idoneo a contrastare il perturbamento

Grande importanza in fisiologia e medicina ha la Legge gi Henry: Tale legge mette in relazione la solubilità di un gas in un liquido con la pressione. Ad una data temperatura, un aumento della pressione provoca un aumento della solubilità di un gas. A pressioni basse o moderate la solubilità di un gas è direttamente proporzionale alla pressione Cg= k Pg Ritorna la pressione parziale

LE SOLUZIONI Influenza delle pressione sulla solubilità La solubilità di un gas in un solvente qualsiasi si avvantaggia di un aumento della pressione con la quale esso grava sul solvente stesso Aumentando la pressione aumenta la concentrazione delle molecole in fase gassosa, per mantenere perciò l’equilibrio gas/liquido devono entrare nella soluzione un maggior numero di molecole di gas. La relazione tra solubilità di un gas e la pressione è descritta dalla Legge di Henry: Cg = k. Pg

I livelli ematici di O 2 e CO 2 dipendono da fattori diversi Gli scambi avvengono tra ambienti diversi separati da membrana permeabile in cui sussista una differenza di pressione parziale per quei gas

O 2 97% legato all’Hb Letto capillare sangue 3% sciolto nel plasma CO 2 Prodotta dal metabolismo cellulare: (legge di Henry) 7% sciolta nel plasma 23% legata all’Hb 70% HCO-3 (legge di Henry) Tutte le forme di trasporto sono proporzionali alle rispettive pressioni parziali Implicazioni ? Per esempio immersioni

LE SOLUZIONI Le proprietà delle soluzioni: COLLIGATIVE Dipendono dal numero delle particelle ma non dalla loro identità Abbassamento della tensione di vapore Innalzamento ebullioscopico Abbassamento crioscopico Pressione osmotica

LE SOLUZIONI Abbassamento della tensione di vapore Abbiamo visto che a tensione di vapore: è una grandezza caratteristica di ogni liquido aumenta all’aumentare della temperatura diminuisce con l’aumentare delle forze intermolecolari Le soluzioni acquose concentrate evaporano più lentamente rispetto all’acqua pura! Dal punto di vista quantitativo la tensione di vapore delle soluzioni contenenti soluti NON VOLATILI è data dalla Legge di RAOULT PA = XA P°A PA pressione (o tensione di vapore) della soluzione XA frazione molare del solvente P°A la tensione di vapore del solvente puro La tensione di vapore della soluzione è inferiore a quella del solvente puro

XA = n solvente/ n solvente+ nsoluto Poiché stiamo considerando una soluzione XA < 1 perciò PA < P°A Inoltre ricordando che XA + XB =1 perciò XA = 1 - XB se PA = XA P°A = (1 – XB )P°A PA= P°A - XB P°A – PA = XB P°A dove P°A – PA = ΔPA è l’abbassamento della tensione di vapore Allora ∆PA= XBP°A

LE SOLUZIONI Innalzamento punto di ebollizione (non elettroliti) Poiché la temperatura di ebollizione è legata al valore della tensione di vapore, e poichè per una soluzione la tensione di vapore è sempre minore della tensione di vapore del solvente puro Costanti molali del punto di ebollizione Per raggiungere la medesima ∆Te= Te – T°e › 0 pressione di 1 atm sarà necessaria una Solvente Te (°C) Keb (°C/m) temperatura maggiore Acqua 100 0. 52 molalità Acido acetico 117. 9 2. 53 Benzene 80. 10 2. 53 Cicloesano 80. 72 2. 75 Canfora 207. 42 5. 61 naftalina 217. 96 5. 8

LE SOLUZIONI Abbassamento punto di congelamento Il punto di solidificazione o di congelamento alla temperatura Costanti corrisponde molali del punto di fusione alla quale si uguagliano le tensioni di vapore della fase solida e liquida. Esso subisce un abbassamento perché di norma il Solvente (°C) Kf (°C/m) soluto non riesce a sciogliersi nella fase solida del Pf solvente Acqua 0. 00 Acido acetico 16. 66 3. 90 Benzene 5. 50 5. 10 Cicloesano 6. 50 20. 2 Canfora 178. 40 40 naftalina 80. 29 6. 94 0 ΔT 1. 86 c= Tc –T c ‹ 0

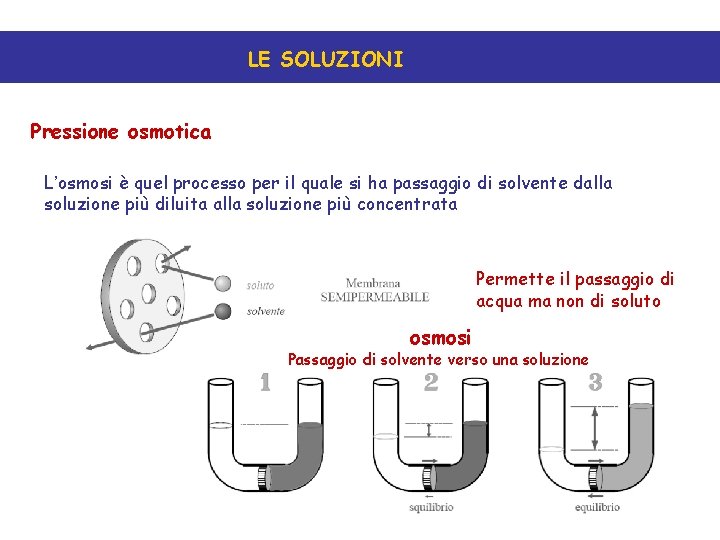
LE SOLUZIONI Pressione osmotica L’osmosi è quel processo per il quale si ha passaggio di solvente dalla soluzione più diluita alla soluzione più concentrata Permette il passaggio di acqua ma non di soluto osmosi Passaggio di solvente verso una soluzione

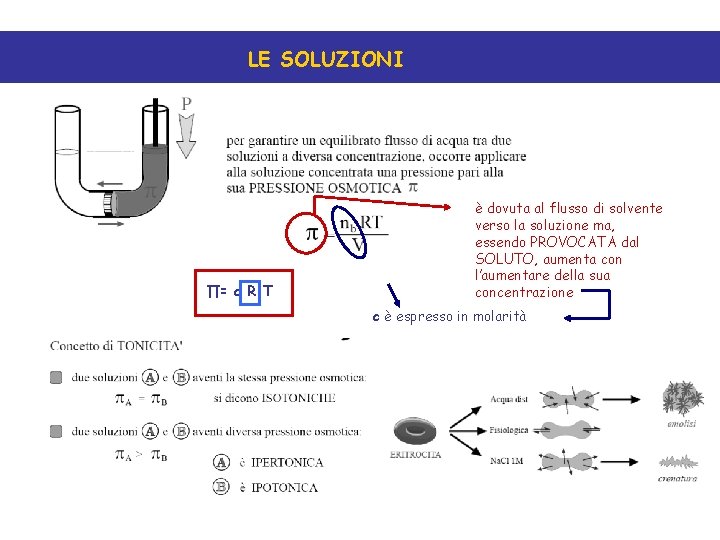
LE SOLUZIONI ∏= c R T è dovuta al flusso di solvente verso la soluzione ma, essendo PROVOCATA dal SOLUTO, aumenta con l’aumentare della sua concentrazione c è espresso in molarità

Pressione osmotica π= c. RT Richiamano acqua nel lume intestinale: I sali di sodio o magnesio sono solfati, citrati, o fosfati che hanno appunto questa azione dopo assunzione orale (lassativi naturali inorganici. Lattulosio e Lattitolo sono zuccheri che agiscono da profarmaci, la flora batterica intestinale li metabolizza con liberazione di acidi organici (lattico, formico, acetico) che hanno effetto osmotico. Gli alcoli come glicerina, sorbitolo e mannitolo sono usati per via rettale, sempre con effetto osmotico e anche lubrificante.

Applicazioni OSMOSI INVERSA: LASSATIVI OSMOTICI: ○ Mg. SO₄ (solfato di magnesio). ○ Sorbitolo. ○ Mannitolo. PRESSIONE COLLOIDO OSMOTICA • il nostro corpo è composto per il 60% di acqua • 2/3 intracellulare = 28 L 1/3 extracellulare = 14 L ¼ plasma = 3, 5 L ¾ liquido interstiziale = 10, 5 L

Calcoli la concentrazione in grammi al litro di una soluzione di glucosio (MM = 180) isotonica con il sangue avente π = 7, 65 atm a 37 °C. Π=c. RT c =π /R T c = p V / R T = 7, 65 atm x 1 L/ 0, 082 (273 + 37) K = 0, 3 mol/l x 180 = 54 g/l
 Legge henry
Legge henry Solide liquide gaz
Solide liquide gaz Solide ionique
Solide ionique Tp équilibre d'un solide soumis à trois forces
Tp équilibre d'un solide soumis à trois forces Notation rpev
Notation rpev Dynamique du solide
Dynamique du solide Corp gazos
Corp gazos Prisme et pyramide exercices
Prisme et pyramide exercices Eau solide
Eau solide Sinonimo solido
Sinonimo solido Pont hydrogene
Pont hydrogene Principe fondamental de la dynamique
Principe fondamental de la dynamique Dilatarea corpurilor solide lichide si gazoase
Dilatarea corpurilor solide lichide si gazoase Ademe pompe à chaleur
Ademe pompe à chaleur Ltube8
Ltube8 Scintillation liquide
Scintillation liquide Liquide amniotique teinté
Liquide amniotique teinté Infection du liquide d'ascite
Infection du liquide d'ascite Air liquide lebanon
Air liquide lebanon Liquide de montage microscope
Liquide de montage microscope Liquide exuvial
Liquide exuvial