Chapitre 6 Solutions et concentrations Activit 1 Le
































- Slides: 53

Chapitre 6 : Solutions et concentrations.

Activité 1 : Le METACUPROL est médicament que l’on trouvait encore récemment en pharmacie : MÉTACUPROL Ce médicament contient un antiseptique local. Il est utilisé pour assurer l'antisepsie des lésions de la peau ou des muqueuses, infectées ou exposées à un risque d'infection. Présentations du médicament MÉTACUPROL : comprimé effervescent (turquoise) pour solution pour application locale ; boîte de 18 Composition du médicament MÉTACUPROL pcp Sulfate de cuivre Cu. SO 4 490 mg Acide citrique 190 mg Bicarbonate de sodium 220 mg Acide borique (conservateur) 100 mg Pour un comprimé Contre-indications du médicament MÉTACUPROL Ce médicament ne doit pas être utilisé dans les cas suivants : chez l'enfant de moins de 3 ans, pour l'antisepsie de la peau avant une piqûre, pour désinfecter du matériel médicochirurgical Mode d'emploi et posologie du médicament MÉTACUPROL Dissoudre 1 comprimé dans 1 litre d'eau froide ou tiède. La solution obtenue peut être utilisée en application ou en bain local. Effets indésirables possibles du médicament MÉTACUPROL Eczéma de contact. Ce médicament a été supprimé le 05/07/2010. D’après la publication : « Vidal » et « thérapeutique. info » . Quelle est la concentration de la solution obtenue d’après la posologie ?

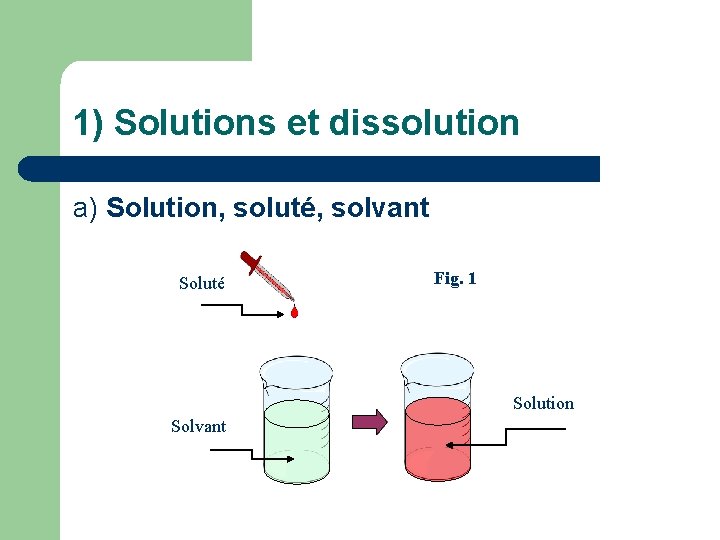
1) Solutions et dissolution a) Solution, soluté, solvant Soluté Fig. 1 Solution Solvant


Une solution est … Doc. 1 : Dans une solution HOMOGENE , on ne peut pas distinguer plusieurs constituants à l’œil nu. Elle peut être … ou incolore. COLOREE Le , le plus souvent un liquide, est SOLVANT l’espèce chimique dont la quantité de matière est majoritaire. Les sont des espèces chimiques SOLUTES moléculaires ou , qui peuvent être à IONIQUES LIQUIDE GAZEUX l’état solide, ou avant dissolution.

La dissolution est généralement favorisée par … Contre-indications du médicament MÉTACUPROL Ce médicament ne doit pas être utilisé dans les cas suivants : chez l'enfant de moins de 3 ans, pour l'antisepsie de la peau avant une piqûre, pour désinfecter du matériel médicochirurgical Mode d'emploi et posologie du médicament MÉTACUPROL Dissoudre 1 comprimé dans 1 litre d'eau froide ou tiède. La solution obtenue peut être utilisée en application ou en bain local. Effets indésirables possibles du médicament MÉTACUPROL Eczéma de contact. Ce médicament a été supprimé le 05/07/2010. D’après la publication : « Vidal » et « thérapeutique. info » .

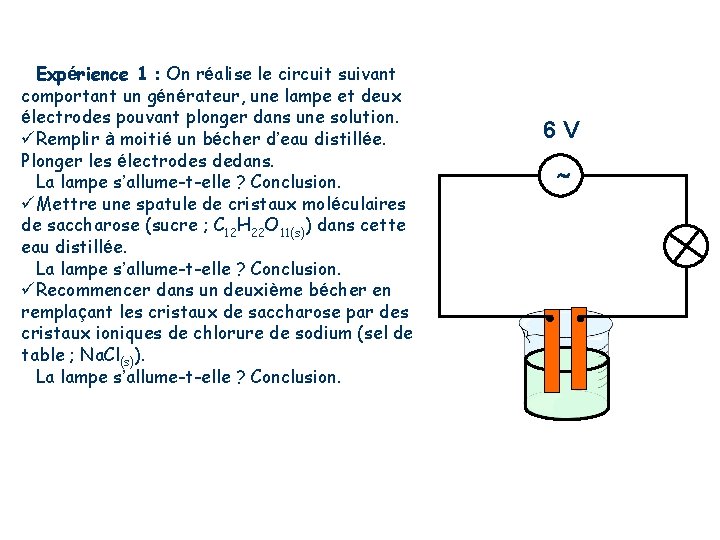
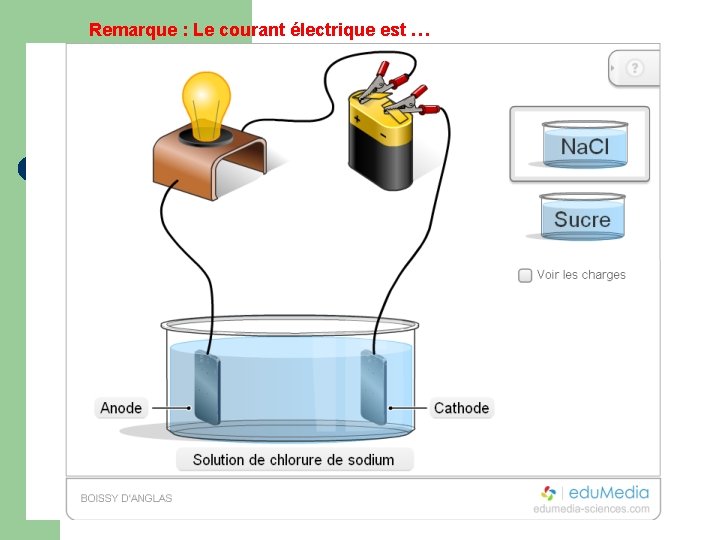
Expérience 1 : On réalise le circuit suivant comportant un générateur, une lampe et deux électrodes pouvant plonger dans une solution. Remplir à moitié un bécher d’eau distillée. Plonger les électrodes dedans. La lampe s’allume-t-elle ? Conclusion. Mettre une spatule de cristaux moléculaires de saccharose (sucre ; C 12 H 22 O 11(s)) dans cette eau distillée. La lampe s’allume-t-elle ? Conclusion. Recommencer dans un deuxième bécher en remplaçant les cristaux de saccharose par des cristaux ioniques de chlorure de sodium (sel de table ; Na. Cl(s)). La lampe s’allume-t-elle ? Conclusion. 6 V +

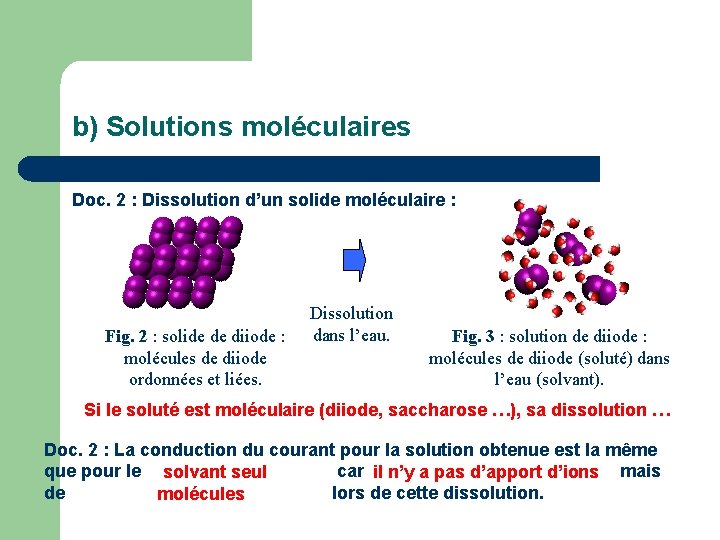
b) Solutions moléculaires Doc. 2 : Dissolution d’un solide moléculaire : Fig. 2 : solide de diiode : molécules de diiode ordonnées et liées. Dissolution dans l’eau. Fig. 3 : solution de diiode : molécules de diiode (soluté) dans l’eau (solvant). Si le soluté est moléculaire (diiode, saccharose …), sa dissolution … Doc. 2 : La conduction du courant pour la solution obtenue est la même que pour le solvant seul car il n’y a pas d’apport d’ions mais de lors de cette dissolution. molécules

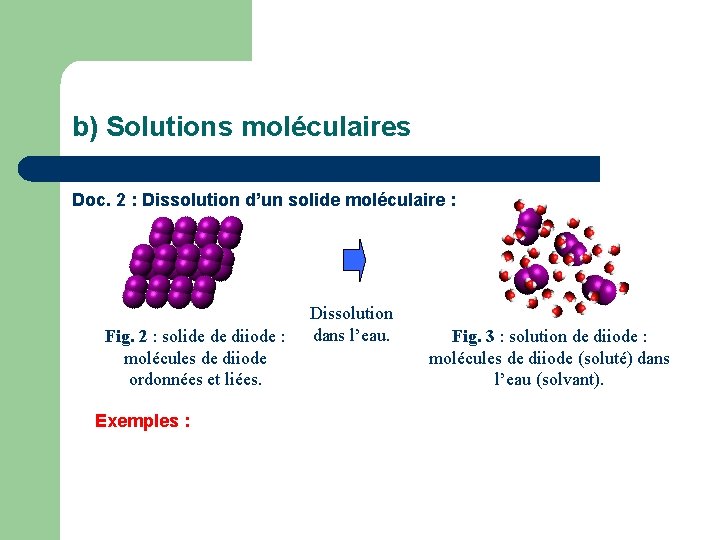
b) Solutions moléculaires Doc. 2 : Dissolution d’un solide moléculaire : Fig. 2 : solide de diiode : molécules de diiode ordonnées et liées. Exemples : Dissolution dans l’eau. Fig. 3 : solution de diiode : molécules de diiode (soluté) dans l’eau (solvant).

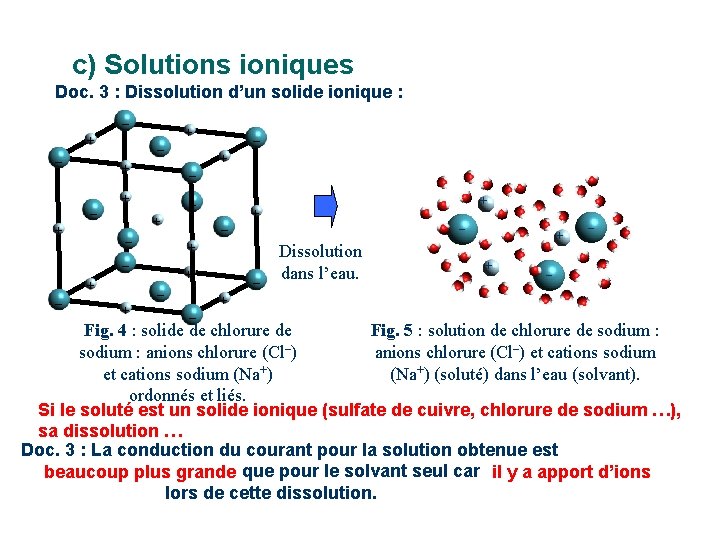
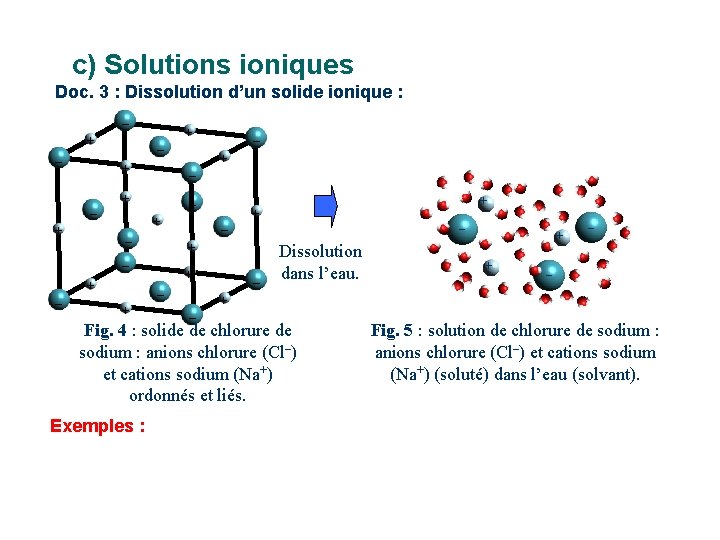
c) Solutions ioniques Doc. 3 : Dissolution d’un solide ionique : – + – + – + – – – + + + + – – Dissolution dans l’eau. + + – – + – Fig. 4 : solide de chlorure de Fig. 5 : solution de chlorure de sodium : anions chlorure (Cl–) et cations sodium (Na+) (soluté) dans l’eau (solvant). ordonnés et liés. Si le soluté est un solide ionique (sulfate de cuivre, chlorure de sodium …), sa dissolution … Doc. 3 : La conduction du courant pour la solution obtenue est beaucoup plus grande que pour le solvant seul car il y a apport d’ions lors de cette dissolution.

c) Solutions ioniques Doc. 3 : Dissolution d’un solide ionique : – + – + – + – – – + + + + – – Dissolution dans l’eau. + – – + – Fig. 4 : solide de chlorure de sodium : anions chlorure (Cl–) et cations sodium (Na+) ordonnés et liés. Exemples : + Fig. 5 : solution de chlorure de sodium : anions chlorure (Cl–) et cations sodium (Na+) (soluté) dans l’eau (solvant).


Remarque : Le courant électrique est …

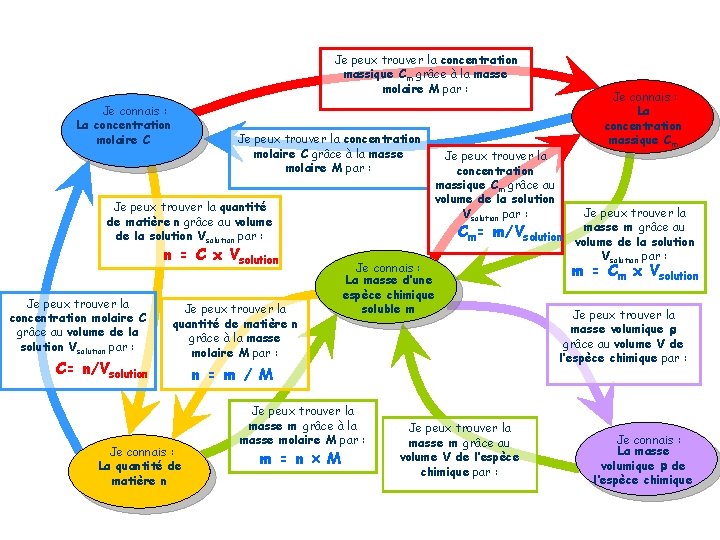
2. Concentration massique, concentration molaire a) La concentration massique Cm d’un soluté est … Exercice 1 : Quelle est la concentration massique du sulfate de cuivre lors de la préparation de la solution S 1 de Métacuprol respectant la posologie ? Quelle serait celle d’une solution S 2 obtenue en dissolvant un comprimé dans 500 m. L d’eau ?

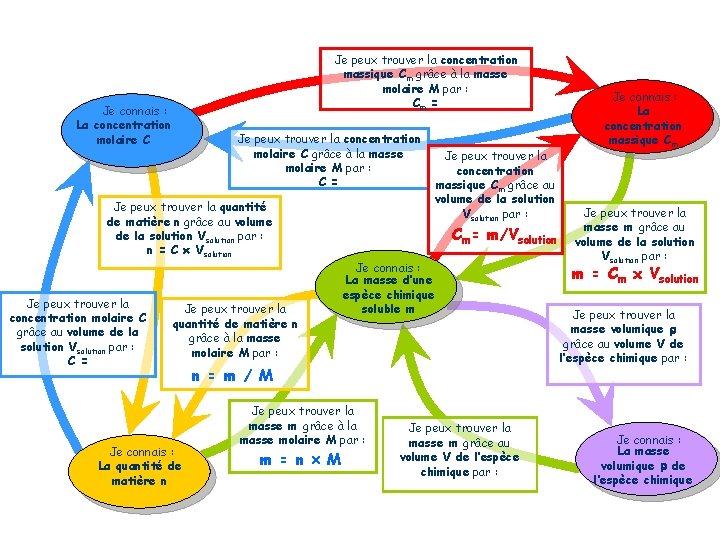
Je peux trouver la concentration massique Cm grâce à la masse molaire M par : Cm = Je connais : La concentration molaire C Je peux trouver la concentration molaire C grâce à la masse molaire M par : C = Je peux trouver la quantité de matière n grâce au volume de la solution Vsolution par : n = C Vsolution Je peux trouver la concentration molaire C grâce au volume de la solution Vsolution par : C = Je peux trouver la quantité de matière n grâce à la masse molaire M par : Je connais : La quantité de matière n Je peux trouver la concentration massique Cm grâce au volume de la solution Vsolution par : Cm= m/Vsolution Je connais : La masse d’une espèce chimique soluble m n = m / M Je peux trouver la masse m grâce à la masse molaire M par : m = n M Je peux trouver la masse m grâce au volume V de l’espèce chimique par : Je connais : La concentration massique Cm Je peux trouver la masse m grâce au volume de la solution Vsolution par : m = Cm x Vsolution Je peux trouver la masse volumique r grâce au volume V de l’espèce chimique par : Je connais : La masse volumique r de l’espèce chimique

b) La concentration molaire C d’un soluté est …

Je peux trouver la concentration massique Cm grâce à la masse molaire M par : Je connais : La concentration molaire C Je peux trouver la concentration molaire C grâce à la masse molaire M par : Je peux trouver la quantité de matière n grâce au volume de la solution Vsolution par : n = C x Vsolution Je peux trouver la concentration molaire C grâce au volume de la solution Vsolution par : C= n/Vsolution Je peux trouver la quantité de matière n grâce à la masse molaire M par : Je connais : La quantité de matière n Je peux trouver la concentration massique Cm grâce au volume de la solution Vsolution par : Cm= m/Vsolution Je connais : La masse d’une espèce chimique soluble m n = m / M Je peux trouver la masse m grâce à la masse molaire M par : m = n M Je connais : La concentration massique Cm Je peux trouver la masse m grâce au volume V de l’espèce chimique par : Je peux trouver la masse m grâce au volume de la solution Vsolution par : m = Cm x Vsolution Je peux trouver la masse volumique r grâce au volume V de l’espèce chimique par : Je connais : La masse volumique r de l’espèce chimique

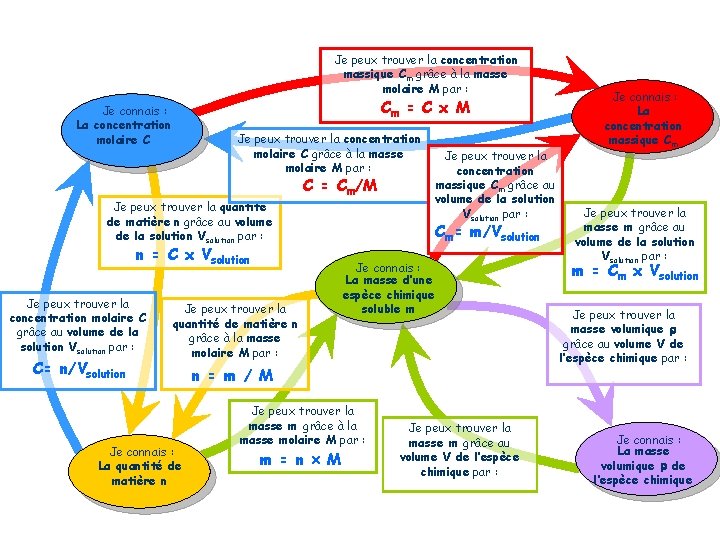
Exercice 2 : Quelle est la concentration molaire de S 1 ? De S 2 ? Donnée : M(Cu) = 63, 5 g. mol– 1 ; M(S) = 32, 1 g. mol– 1 ; M(O) = 16, 0 g. mol– 1. On a donc :

Je peux trouver la concentration massique Cm grâce à la masse molaire M par : Cm = C x M Je connais : La concentration molaire C Je peux trouver la concentration molaire C grâce à la masse molaire M par : C = Cm/M Je peux trouver la quantité de matière n grâce au volume de la solution Vsolution par : n = C x Vsolution Je peux trouver la concentration molaire C grâce au volume de la solution Vsolution par : C= n/Vsolution Je peux trouver la quantité de matière n grâce à la masse molaire M par : Je connais : La quantité de matière n Je peux trouver la concentration massique Cm grâce au volume de la solution Vsolution par : Cm= m/Vsolution Je connais : La masse d’une espèce chimique soluble m n = m / M Je peux trouver la masse m grâce à la masse molaire M par : m = n M Je peux trouver la masse m grâce au volume V de l’espèce chimique par : Je connais : La concentration massique Cm Je peux trouver la masse m grâce au volume de la solution Vsolution par : m = Cm x Vsolution Je peux trouver la masse volumique r grâce au volume V de l’espèce chimique par : Je connais : La masse volumique r de l’espèce chimique

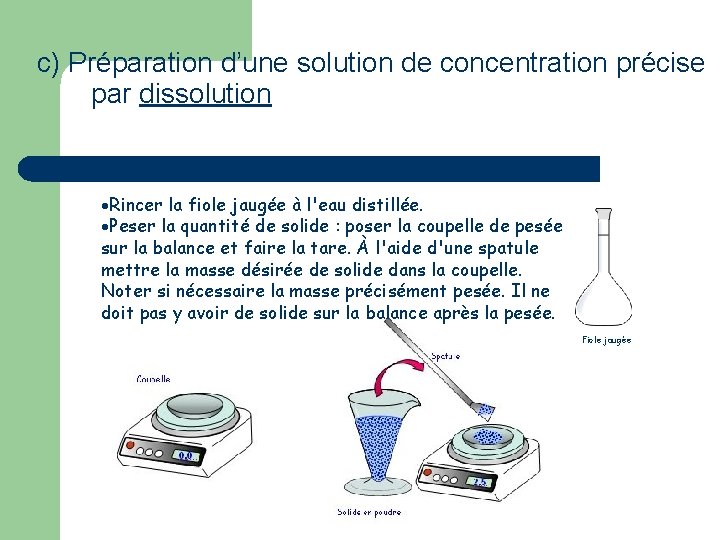
c) Préparation d’une solution de concentration précise par dissolution Expérience 2 : Le sulfate de cuivre que l’on a en laboratoire est un solide ionique bleu car il est hydraté. Sa formule est Cu. SO 4, 5 H 2 O(s). Combien de molécules d’eau (en moyenne) sont capturées par un cristal de sulfate de cuivre ? Quelle est la masse molaire de ce solide hydraté ? Donnée : M(H) = 1, 0 g. mol– 1. On veut réaliser V 3 = 100 m. L d’une solution S 3 de sulfate de cuivre de concentration C 3 = 0, 10 mol. L– 1. Quelle masse m 3 doit-on peser de sulfate de cuivre hydraté ? En suivant bien le protocole « préparation d’une solution par dissolution d’un solide » , réaliser la solution S 3.

c) Préparation d’une solution de concentration précise par dissolution Rincer la fiole jaugée à l'eau distillée. Peser la quantité de solide : poser la coupelle de pesée sur la balance et faire la tare. À l'aide d'une spatule mettre la masse désirée de solide dans la coupelle. Noter si nécessaire la masse précisément pesée. Il ne doit pas y avoir de solide sur la balance après la pesée. Fiole jaugée

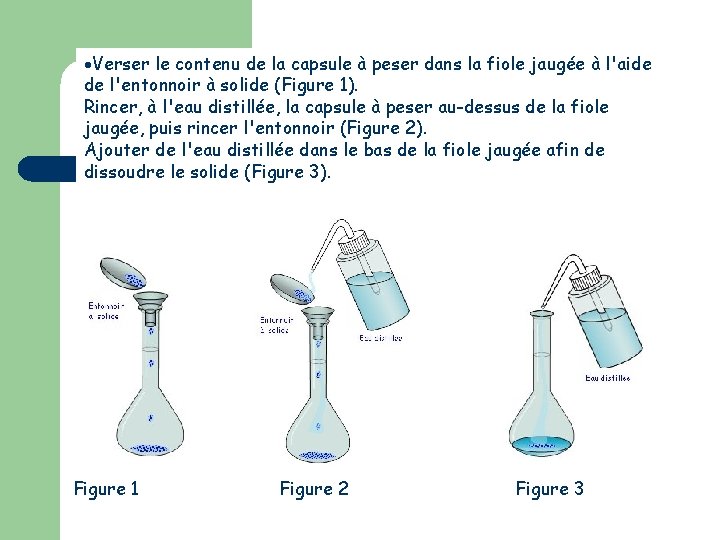
Verser le contenu de la capsule à peser dans la fiole jaugée à l'aide de l'entonnoir à solide (Figure 1). Rincer, à l'eau distillée, la capsule à peser au-dessus de la fiole jaugée, puis rincer l'entonnoir (Figure 2). Ajouter de l'eau distillée dans le bas de la fiole jaugée afin de dissoudre le solide (Figure 3). Figure 1 Figure 2 Figure 3

Agiter la fiole jaugée par petite rotation pour dissoudre totalement le solide. Ne pas boucher la fiole. Lors de l'agitation, le liquide ne doit passer au dessus du trait de jauge. Ajouter éventuellement de l'eau si tout n'est pas dissous et agiter à nouveau jusqu'à totale dissolution du solide.

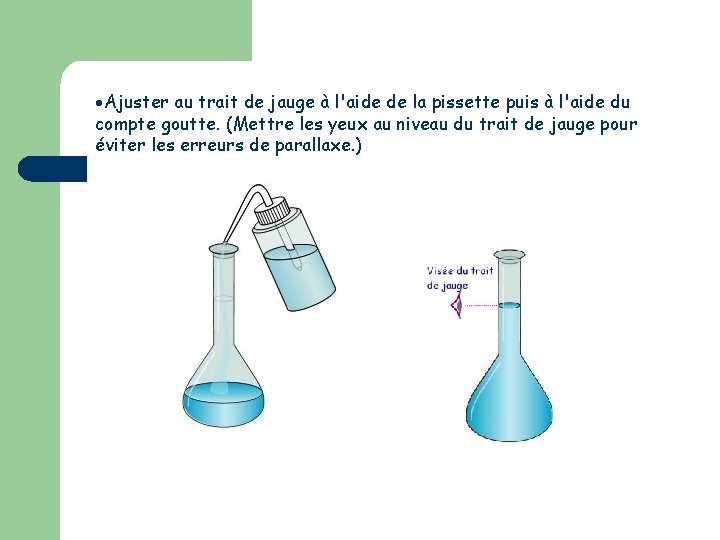
Ajuster au trait de jauge à l'aide de la pissette puis à l'aide du compte goutte. (Mettre les yeux au niveau du trait de jauge pour éviter les erreurs de parallaxe. )

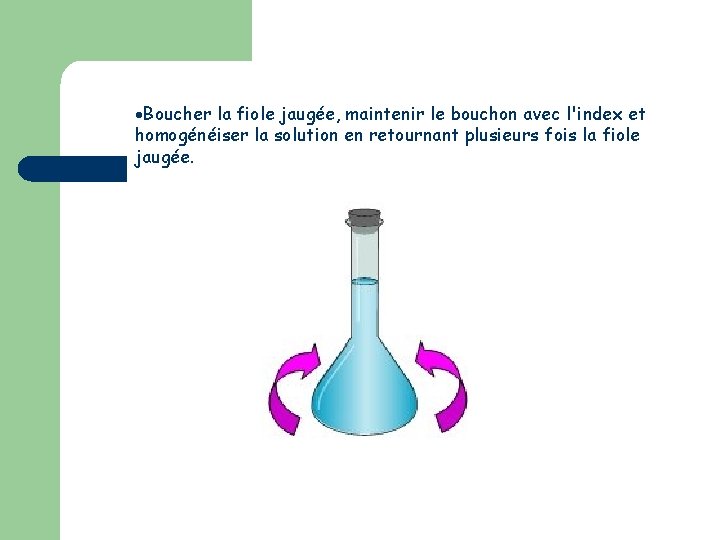
Boucher la fiole jaugée, maintenir le bouchon avec l'index et homogénéiser la solution en retournant plusieurs fois la fiole jaugée.

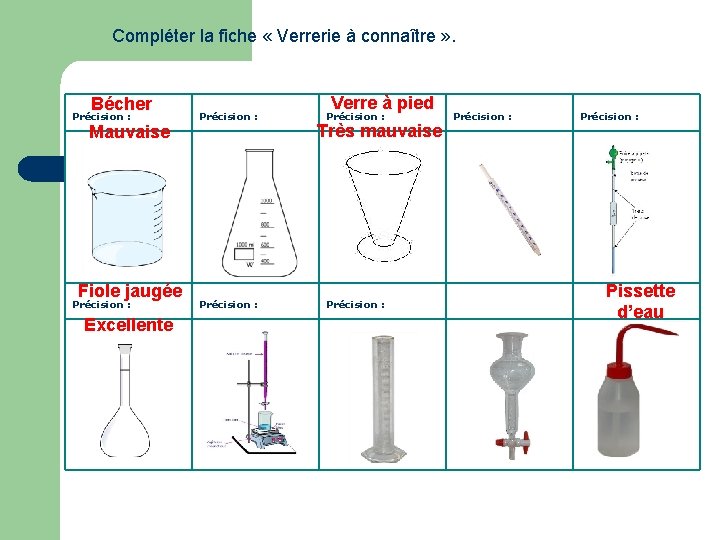
Compléter la fiche « Verrerie à connaître » . Bécher Précision : Mauvaise Fiole jaugée Précision : Excellente Précision : Verre à pied Précision : Très mauvaise Précision : Pissette d’eau

Pour les groupes les plus rapide, réaliser V 4 = 50 m. L d’une solution S 4 de permanganate de potassium (KMNO 4) de concentration C 4 = 0, 060 mol. L– 1. Donnée : M(KMn. O 4) = 158, 0 g. mol– 1. Quelle est la concentration massique de cette solution S 4 ?

Serait-il possible de réaliser V 5 = 100 m. L d’une solution de sulfate de cuivre de concentration molaire C 5 = 1, 0. 10 -3 mol. L-1 ? Justifier.

3. Détermination de la concentration d’une solution inconnue par comparaison sur une échelle de teintes Détermination de la concentration d’une solution (Partie 1). On prépare une solution dans une fiole jaugée de V = 50 m. L par dissolution d’un comprimé de « Métacuprol » . La solution S obtenue est bleu « cyan » . On veut évaluer sa concentration massique Cm afin de retrouver la valeur de la masse m de sulfate de cuivre contenu dans ce comprimé. Proposez un protocole expérimental nous permettant d’évaluer C m.

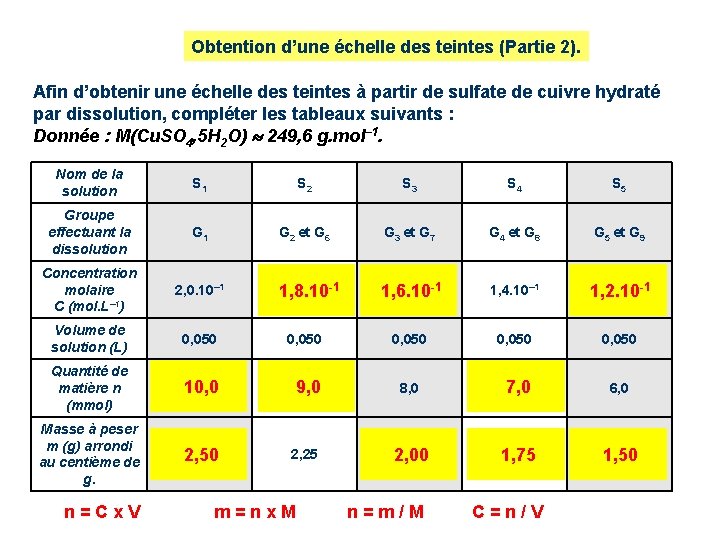
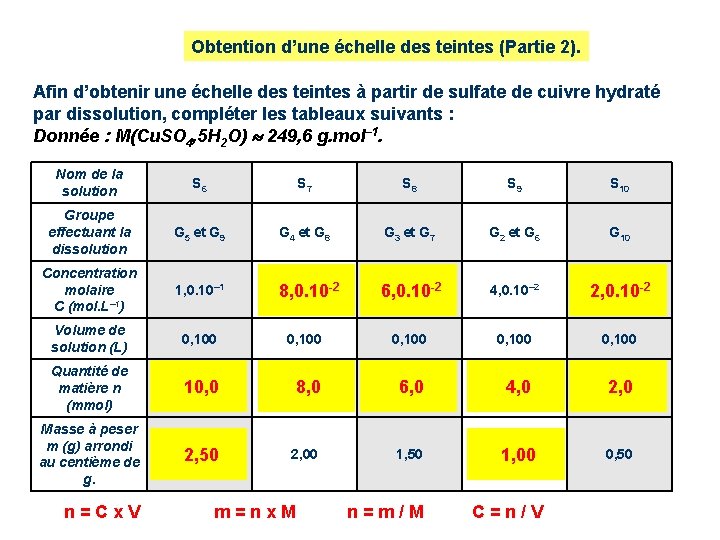
Obtention d’une échelle des teintes (Partie 2). Afin d’obtenir une échelle des teintes à partir de sulfate de cuivre hydraté par dissolution, compléter les tableaux suivants : Donnée : M(Cu. SO 4, 5 H 2 O) 249, 6 g. mol– 1. Nom de la solution S 1 S 2 S 3 S 4 S 5 Groupe effectuant la dissolution G 1 G 2 et G 6 G 3 et G 7 G 4 et G 8 G 5 et G 9 Concentration molaire C (mol. L– 1) 2, 0. 10– 1 1, 8. 10 -1 1, 6. 10 -1 1, 4. 10– 1 1, 2. 10 -1 Volume de solution (L) 0, 050 0, 050 Quantité de matière n (mmol) 10, 0 9, 0 Masse à peser m (g) arrondi au centième de g. 2, 50 2, 25 n = C x V m = n x M 8, 0 7, 0 6, 0 2, 00 1, 75 1, 50 n = m / M C = n / V

Obtention d’une échelle des teintes (Partie 2). Afin d’obtenir une échelle des teintes à partir de sulfate de cuivre hydraté par dissolution, compléter les tableaux suivants : Donnée : M(Cu. SO 4, 5 H 2 O) 249, 6 g. mol– 1. Nom de la solution S 6 S 7 S 8 S 9 S 10 Groupe effectuant la dissolution G 5 et G 9 G 4 et G 8 G 3 et G 7 G 2 et G 6 G 10 Concentration molaire C (mol. L– 1) 1, 0. 10– 1 8, 0. 10 -2 6, 0. 10 -2 4, 0. 10– 2 2, 0. 10 -2 Volume de solution (L) 0, 100 0, 100 Quantité de matière n (mmol) 10, 0 8, 0 6, 0 4, 0 2, 0 Masse à peser m (g) arrondi au centième de g. 2, 50 2, 00 1, 50 1, 00 0, 50 n = C x V m = n x M n = m / M C = n / V

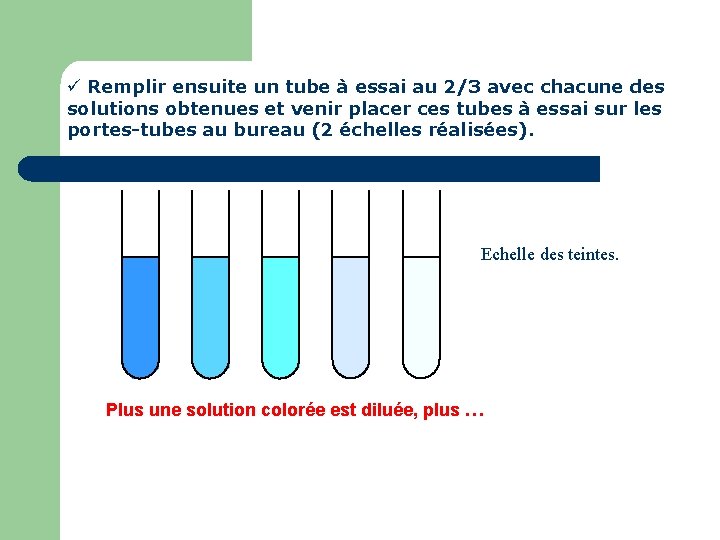
Remplir ensuite un tube à essai au 2/3 avec chacune des solutions obtenues et venir placer ces tubes à essai sur les portes-tubes au bureau (2 échelles réalisées). Echelle des teintes. Plus une solution colorée est diluée, plus …

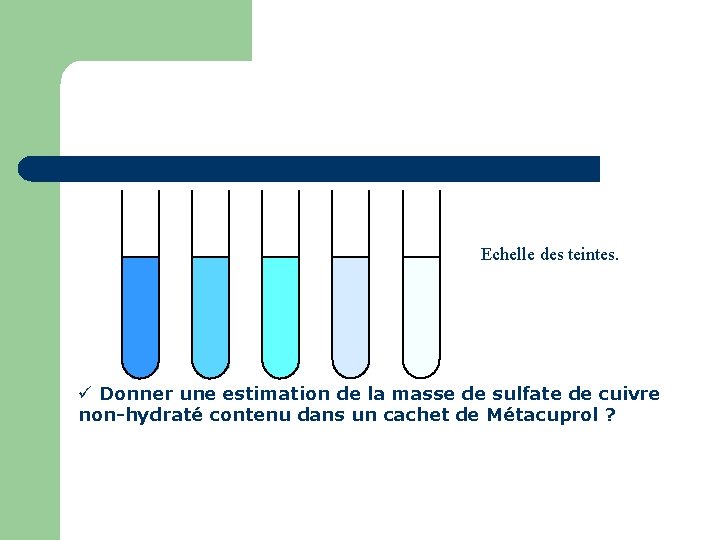
Echelle des teintes. Donner une estimation de la masse de sulfate de cuivre non-hydraté contenu dans un cachet de Métacuprol ?

4) Solubilité d’une espèce chimique Lorsque le solvant ne peut plus dissoudre de … Exercice 3 : Le chlorure de potassium est un solide ionique de formule KCl très soluble dans l’eau. Ecrire l’équation de la dissolution de chlorure de potassium. Sa solubilité est de 345 g. L– 1 à 25 °C. Qu’observe-t-on si on dissout dans 1, 00 L d’eau à 25°C : • 100 g de chlorure de potassium ? • 400 g de chlorure de potassium ?

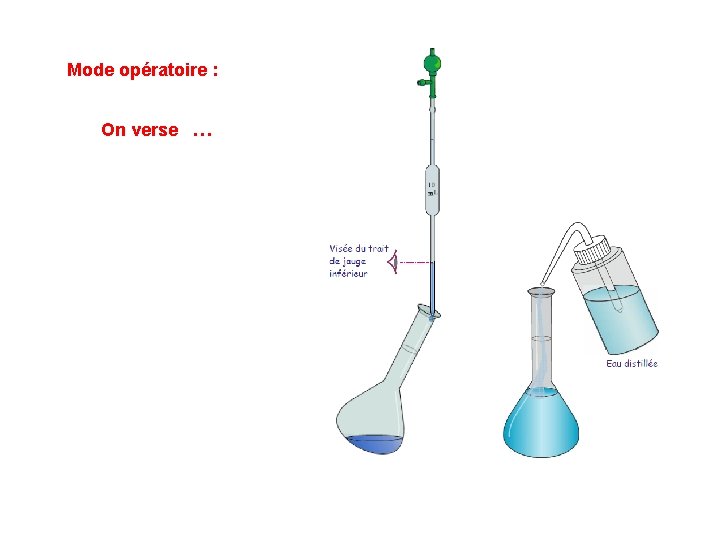
5) Préparation d’une solution de concentration précise par dilution. Diluer une solution dite « mère » de concentration C 0 consiste … On a toujours : … Mode opératoire : On prélève … La quantité de matière en …

Mode opératoire : On homogénéise … Cette solution fille … Au cours d’une dilution, la …

Mode opératoire : On verse …

TP : effectuer une dilution. Un « cycliste » vient de faire une chute. Sans grande gravité mais il est un peu sonné et sa jambe et son bras présentent des plaies avec saignements. Les pompiers arrivent sur les lieux et décident de l’amener vers l’hôpital le plus proche par précaution. Le docteur House prescrit le nettoyage de la plaie avec une compresse imbibée d’eau Dakin contenant du permanganate de potassium à la concentration C, ceci plusieurs fois par jour.

SOLUTE DE DAKIN STABILISE COOPER COMPOSITION Principes actifs Hypochlorite de sodium …… 0, 500 g de chlore actif pour 100 m. L Principes non actifs Permanganate de Potassium ………… 0, 0010 g pour 100 m. L Dihydrogénophosphate de sodium dihydraté ……………… Excipient Eau purifiée ……………………………… Excipient MODE D’EMPLOI Posologie habituelle : en application cutanée sans dilution, soit en lavages, en bains locaux ou en irrigation, soit en compresses imbibées ou en pansements humides. Les flacons doivent être conservés fermés dans des endroits frais et à l’abri de la lumière. Une fois ouvert, la stabilité du soluté est réduite à deux mois. Le blessé remis de ses émotions, va cher la solution nécessaire pour son traitement à la pharmacie de l’hôpital. Hélas, il n’y a qu’une solution à la concentration CO = 4, 0. 10 -3 mol. L-1 en permanganate de potassium.

Le préparateur doit intervenir et doit : Lire attentivement l’ordonnance du médecin. Ecrire le protocole expérimental pour préparer la solution à la concentration C. Etablir la liste du matériel nécessaire à la préparation et aller le cher. Préparer la solution pour la totalité du traitement. Mettre un peu de solution dans un tube à essai et le montrer à la pharmacienne en chef. Lorsque la verrerie est rincée avec soin et rangée, le préparateur peut quitter la pharmacie.

Liste des ordonnances possibles : Ordonnance du docteur HOUSE A : « Nettoyer la plaie à l’aide d’une compresse imbibée avec 5 m. L de solution contenant du permanganate de potassium à la concentration C = 4, 0. 10 -4 mol. L-1 Ceci 2 fois par jour pendant 5 jours » . Ordonnance du docteur HOUSE B : « Nettoyer la plaie à l’aide d’une compresse imbibée avec 10 m. L de solution contenant du permanganate de potassium à la concentration C = 2, 0. 10 -4 mol. L-1 Ceci 2 fois par jour pendant 5 jours » . Ordonnance du docteur HOUSE C : « Nettoyer la plaie à l’aide d’une compresse imbibée avec 10 m. L de solution contenant du permanganate de potassium à la concentration C = 1, 0. 10 -4 mol. L-1 Ceci 4 fois par jour pendant 5 jours » . Ordonnance du docteur HOUSE D : « Nettoyer la plaie à l’aide d’une compresse imbibée avec 5 m. L de solution contenant du permanganate de potassium à la concentration C = 8, 0. 10 -4 mol. L-1 Ceci 2 fois par jour pendant 5 jours » . Ordonnance du docteur HOUSE E : « Nettoyer la plaie à l’aide d’une compresse imbibée avec 10 m. L de solution contenant du permanganate de potassium à la concentration C = 4, 0. 10 -4 mol. L-1 Ceci 2 fois par jour pendant 5 jours » . Ordonnance du docteur HOUSE F : « Nettoyer la plaie à l’aide d’une compresse imbibée avec 10 m. L de solution contenant du permanganate de potassium à la concentration C = 2, 0. 10 -4 mol. L-1 Ceci 4 fois par jour pendant 5 jours » . Ordonnance du docteur HOUSE G : « Nettoyer la plaie à l’aide d’une compresse imbibée avec 5 m. L de solution contenant du permanganate de potassium à la concentration C = 1, 6. 10 -3 mol. L-1 Ceci 2 fois par jour pendant 5 jours » . Ordonnance du docteur HOUSE H : « Nettoyer la plaie à l’aide d’une compresse imbibée avec 10 m. L de solution contenant du permanganate de potassium à la concentration C = 8, 0. 10 -4 mol. L-1 Ceci 2 fois par jour pendant 5 jours » . Ordonnance du docteur HOUSE I : « Nettoyer la plaie à l’aide d’une compresse imbibée avec 10 m. L de solution contenant du permanganate de potassium à la concentration C = 4, 0. 10 -4 mol. L-1 Ceci 4 fois par jour pendant 5 jours » .

Par exemple : Ordonnance du docteur HOUSE F : « Nettoyer la plaie à l’aide d’une compresse imbibée avec 10 m. L de solution contenant du permanganate de potassium à la concentration C = 2, 0. 10 -4 mol. L-1 Ceci 4 fois par jour pendant 5 jours » . Volume de solution fille V 1 à préparer : V 1 = 4 x 5 x 10 = 200 m. L Dans une … Concentration de la solution fille C 1 à préparer : C 1 = C = 2, 0. 10 -4 mol. L-1 Concentration de la solution mère C 0 = 4, 0. 10 -3 mol. L-1 On cherche donc V 0 , volume de solution mère à prélever : Au cours d’une dilution, la … On a donc … Dans une …










