Le Soluzioni SOLUZIONI Una soluzione una miscela omogenea



























- Slides: 37

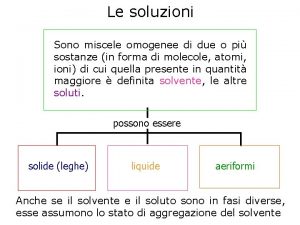
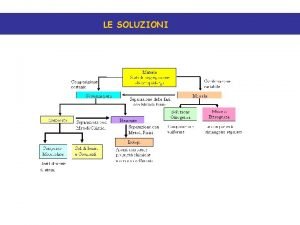
Le Soluzioni

SOLUZIONI Una soluzione è una miscela omogenea di più composti chimici SOLUZIONI GASSOSE: le miscele gassose sono sempre omogenee e quindi formano sempre una soluzione SOLUZIONI LIQUIDE: si possono formare sciogliendo in un liquido, chiamato solvente, gas, solidi o altri liquidi. SOLUZIONI SOLIDE: sono abbastanza comuni: per esempio le leghe metalliche sono una miscela omogenea solida di più metalli.

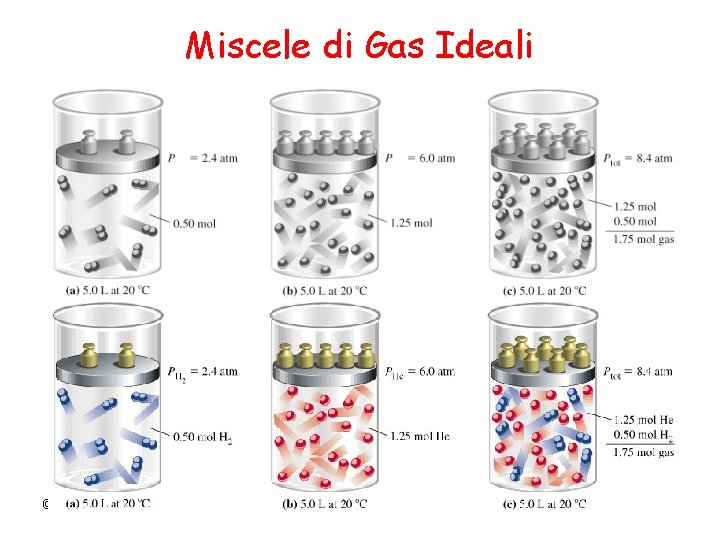
Miscele di Gas Ideali © Dario Bressanini 3

Pressione Parziale Consideriamo due gas ideali in un recipiente di volume V La Pressione parziale è la pressione che il gas eserciterebbe nel recipiente se fosse da solo, alla stessa temperatura p 1 = n 1 RT/V p 2 = n 2 RT/V © Dario Bressanini 4

Frazioni Molari Calcoliamo il rapporto tra la pressione parziale di un gas e la pressione totale pi ptot = ni. RT V ntot. RT V ni = n tot Frazione Molare © Dario Bressanini 5

Frazioni Molari e Pressioni Parziali

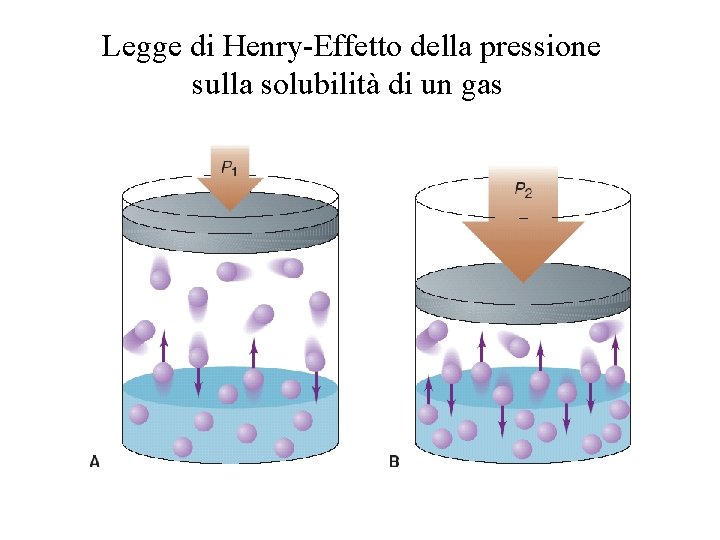
Solubilità in funzione della pressione La pressione ha poco effetto sulla solubilità di solidi e di liquidi. E’ invece importante per la solubilità dei gas. Solubilità dei gas La solubilità di un gas in un liquido dipende dalla pressione parziale del gas secondo la legge di Henry. La solubilità di un gas è direttamente proporzionale alla pressione parziale del gas, P, sopra la soluzione: s=k. HP La solubilità s è generalmente espressa in grammi di soluto per litro di soluzione e k. H è una costante.

Legge di Henry-Effetto della pressione sulla solubilità di un gas

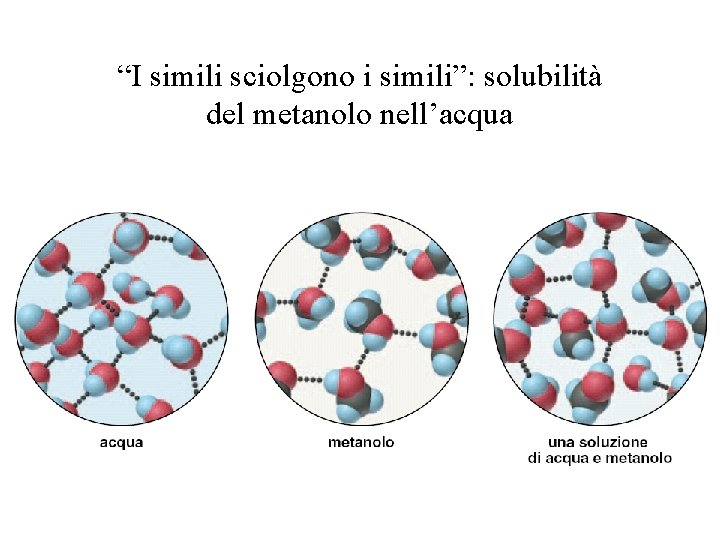
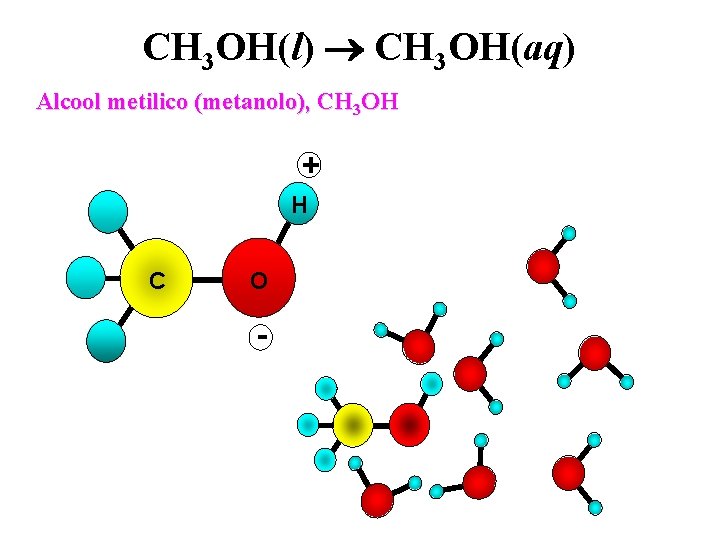
“I simili sciolgono i simili”: solubilità del metanolo nell’acqua


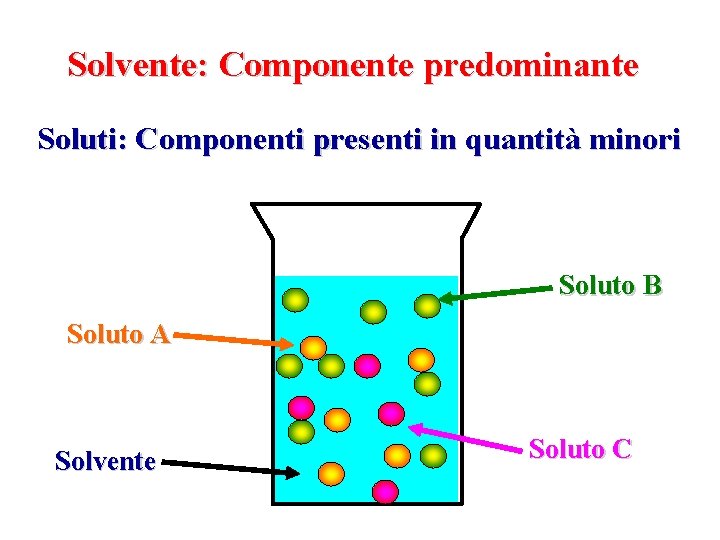
Solvente: Componente predominante Soluti: Componenti presenti in quantità minori Soluto B Soluto A Solvente Soluto C

Solubilità In generale solo una quantità finita di un solido si scioglie in un dato volume di solvente dando luogo ad una soluzione satura, cioè una soluzione in equilibrio con un eventuale solido in eccesso. Equilibrio dinamico La concentrazione del soluto nella soluzione satura è detta solubilità. Ad esempio la solubilità di Na. Cl in acqua è di 36 g per 100 ml di acqua a 20°C.

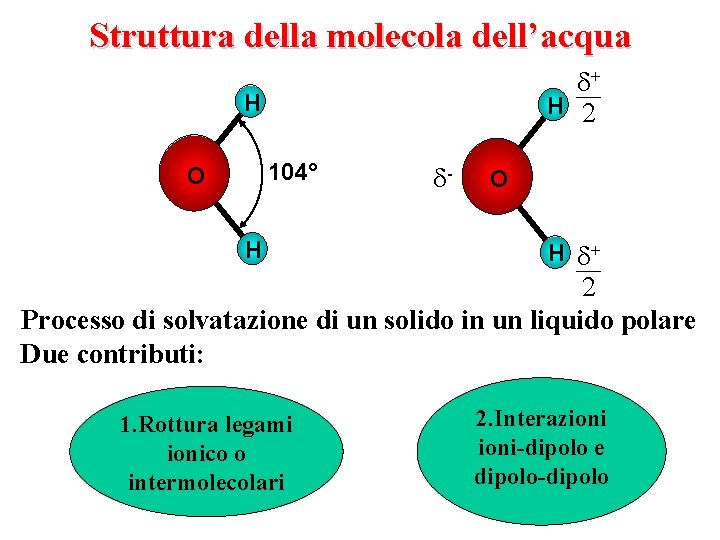
Struttura della molecola dell’acqua + H 2 H 104° O H - O H + 2 Processo di solvatazione di un solido in un liquido polare Due contributi: 1. Rottura legami ionico o intermolecolari 2. Interazioni-dipolo e dipolo-dipolo

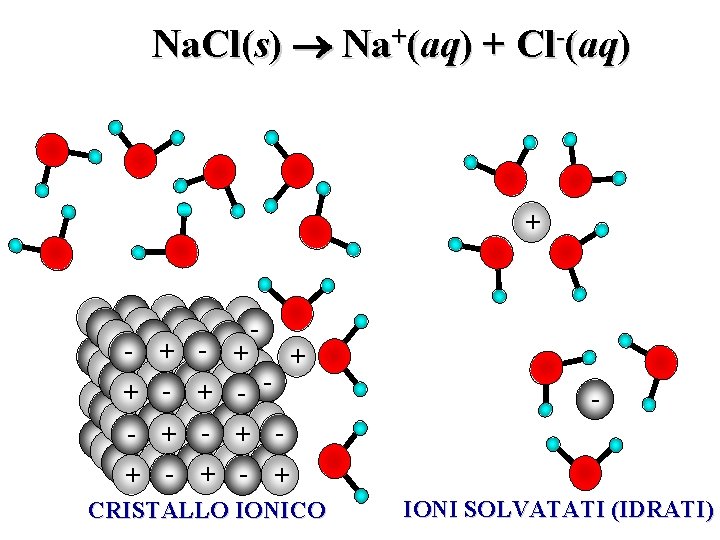
Na. Cl(s) Na+(aq) + Cl-(aq) + - - + - + - + - + CRISTALLO IONICO IONI SOLVATATI (IDRATI)

CH 3 OH(l) CH 3 OH(aq) Alcool metilico (metanolo), CH 3 OH + H C O -

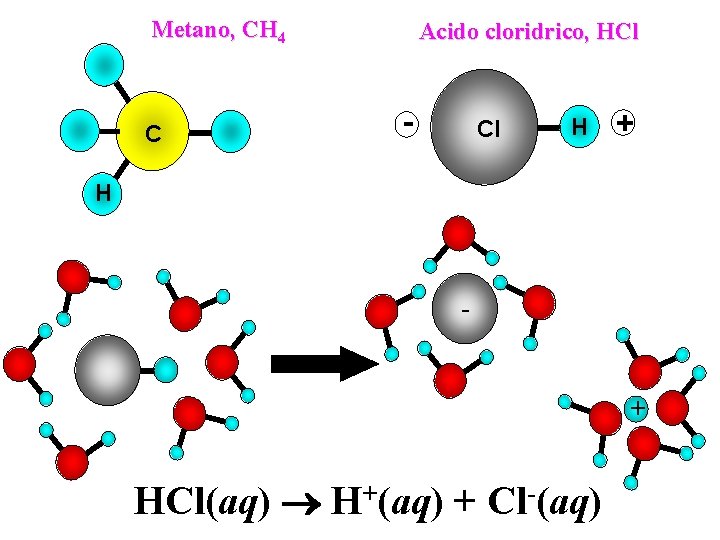
Metano, CH 4 C Acido cloridrico, HCl - Cl H + H - + HCl(aq) H+(aq) + Cl-(aq)

La dissociazione elettrolitica influenza la conducibilità elettrica: ü L’acqua pura, H 2 O, è un debole conduttore di elettricità (contiene pochissimi ioni, cioè cariche mobili). ü Il saccarosio, C 12 H 22 O 11, sciolto in acqua non dà luogo a dissociazione elettrolitica, quindi una sua soluzione acquosa è un debole conduttore di elettricità. ü Il cloruro di sodio, Na. Cl, dà luogo a dissociazione elettrolitica, quindi una sua soluzione acquosa è un buon conduttore di elettricità.

Le soluzioni ideali ü Il volume della soluzione è uguale alla somma dei volumi delle singole sostanze che la costituiscono ü Il processo di formazione di una soluzione, a partire dai componenti, è atermico (non c’è scambio calore) Conseguenza: Nelle soluzioni ideali non ci sono interazioni soluto-soluto Si avvicinano al comportamento ideale le soluzioni diluite con componenti di natura chimica simile

CONCENTRAZIONE DELLE SOLUZIONI In generale la concentrazione di una soluzione è una misura della quantità di soluto presente in una data quantità di solvente (o di soluzione). La quantità di soluto o di solvente possono essere espresse in numero di moli, massa o volume per cui vi sono diversi modi di esprimere la concentrazione di una soluzione: • Molarità • Percentuale in massa (peso) • Molalità • Frazione molare

Concentrazione di una soluzione • Concentrazione dell’ammontare di sostanza o Molarità: L’ammontare di soluto (Numero di moli) disciolto in un litro di soluzione; solitamente indicata con M è anche nota come CONCENTRAZIONE MOLARE ; V = L di soluzione • Molalità: Numero di moli di soluto disciolto in un’unità di massa di solvente ; Q = kg di solvente

Concentrazione di una soluzione • Concentrazione percentuale in massa (m/m): Rapporto tra la massa in grammi di soluto e la massa della soluzione espresso in termini percentuali • Frazione molare: Rapporto tra le moli di un soluto ed le moli totali dei componenti di una soluzione. Assume valori da 0 a 1

Concentrazione di una soluzione • Concentrazione percentuale in volume (V/V): Rapporto tra il volume del soluto ed il volume totale della soluzione espresso in termini percentuali • Concentrazione percentuale in massa volume (m/V): Rapporto tra la massa del soluto espressa in grammi ed il volume totale della soluzione espresso in millitri. Il rapporto è espresso in termini percentuali

Molarità E’ il numero di moli di soluto presenti in un litro di soluzione: Le unità sono mol/litro ma sono generalmente indicate con M. Ad esempio una soluzione ottenuta sciogliendo 0, 20 moli di Na. Cl in acqua sino ad un volume di 2, 0 l ha molarità:

Preparazione in laboratorio di una soluzione 0, 01 M di di K 2 Mn. O 4 0, 0025 moli (0, 395 g) in 250 ml di acqua

Percentuale in massa di soluto E’ definita come: Ad esempio per una soluzione ottenuta mescolando 3, 5 g di Na. Cl e 96, 5 g di acqua si ha: Tale soluzione contiene 3, 5 g di Na. Cl per 100 g di soluzione

Molalità E’ il numero di moli di soluto per chilo di solvente: Le unità sono mol/Kg ma sono generalmente indicate con m. Ad esempio una soluzione ottenuta sciogliendo 0, 20 moli di Na. Cl in 2000 g di acqua ha molalità:

Esempio: Calcolare la molalità di una soluzione ottenuta sciogliendo 5, 67 g di glucosio (C 6 H 12 O 6) in 25, 2 g di acqua

Frazione molare Per una soluzione fra due componenti A e B la frazione molare di A è definita: Ad esempio in una soluzione ottenuta sciogliendo 0, 0315 moli di glucosio in 25, 2 g di acqua la frazione molare del glucosio è:

Conversione fra unità di concentrazione Conviene far riferimento ad una certa quantità di solvente o di soluzione, determinare le quantità di soluto e di solvente corrispondenti e riutilizzarle per il calcolo della nuova concentrazione. Le quantità di riferimento per le concentrazioni da convertire sono: Molalità Molarità Frazione molare % massa 1 Kg di solvente 1 litro di soluzione 1 mole di soluzione 100 g di soluzione Quando è implicata la molarità è necessario conoscere la densità della soluzione (mette in relazione massa e volume).

Molalità Frazione molare Una soluzione di glucosio è 0, 120 m. Calcolare le frazioni molari di glucosio e acqua. Tale soluzione contiene 0, 120 moli di glucosio per 1 Kg di solvente (acqua). Si ha quindi:

Molalità % massa Calcolare la % in massa di una soluzione di glucosio 0, 120 m. Tale soluzione contiene 0, 120 moli di glucosio per 1 Kg di solvente (acqua). Si ha quindi:

Frazione molare Molalità Calcolare la molalità di una soluzione acquosa di glucosio la cui frazione molare è 0, 150. 1 mole di tale soluzione contiene 0, 150 moli di glucosio e (1 - 0, 150) = 0, 850 moli di acqua. Si ha quindi:

Frazione molare % massa Calcolare la % in massa di una soluzione acquosa di glucosio la cui frazione molare è 0, 150. 1 mole di tale soluzione contiene 0, 150 moli di glucosio e (1 - 0, 150) = 0, 850 moli di acqua. Si ha quindi:

Molalità Molarità Calcolare la molarità di una soluzione 0, 273 m di KCl in acqua, avente densità 1, 011 103 g/l. Per 1 Kg di solvente vi sono 0, 273 moli di KCl e quindi: La massa totale di soluzione è: Nell’espressione per il calcolo della molarità c’è però il volume in litri della soluzione, calcolabile tramite la densità: Si noti che per soluzioni diluite molarità molalità

Molarità Molalità Calcolare la molalità di una soluzione 0, 907 M di Pb(NO 3)2 in acqua, avente densità 1, 252 g/ml. Per 1 litro di soluzione vi sono 0, 907 moli di Pb(NO 3)2. La massa di un litro di soluzione è: La massa di Pb(NO 3)2 è: La massa di acqua è: La molalità è quindi:

Esercizi sulle soluzioni Calcolare la concentrazione molare e la concentrazione molale di una soluzione di H 2 SO 4 8. 8 % in massa (d= 1. 070 g/m. L). Calcolare inoltre la frazione molare del soluto. Calcolare la concentrazione molare di ioni ioduro di una soluzione acquosa ottenuta mescolando 250. 0 m. L di una soluzione 0. 100 M di ioduro di sodio con 240. 0 m. L di una soluzione 0. 070 M di ioduro di calcio. Considerare i volumi additivi e tenere presente che, tra i due soluti, non avviene alcuna reazione chimica. Indicare che volume di acqua bisogna aggiungere a 200. 0 m. L di una soluzione di acido cloridrico al 15 % in peso e con densità di 1. 20 Kg/L per ottenere una soluzione a concentrazione 1. 50 M. Indicare come mescolare due soluzioni di acido cloridrico, la prima a concentrazione 2. 54 M e la seconda al 17. 0 % in peso e densità 1. 40 Kg/L per ottenere 2. 0 L di soluzione di acido cloridrico a concentrazione 2. 3 M

Esercizi sulle soluzioni Calcolare la molalità di una soluzione acquosa di 0. 415 M di un composto non elettrolita il cui peso molecolare è 342, sapendo che la densità della soluzione è pari a 1. 15 g/m. L Calcolare la concentrazione finale, espressa in molarità di una soluzione ottenuta dal mescolamento di 300. 0 m. L di una soluzione di Na. Cl 1. 40 M con 200. 0 m. L di una soluzione di Na. Cl al 15. 0% in peso e con densità 1. 20 Kg/L e a cui vengono poi aggiunti 25. 0 g di Na. Cl solido. Quali sono le frazioni molari di etanolo (C 2 H 5 OH) e acqua in una soluzione preparata mescolando 85. 0 g di etanolo e 65. 0 g di acqua? Una soluzione di HNO 3 al 27% in peso ha una densità di 1. 16 g/m. L. Calcolare il volume necessario da prelevare per ottenere 1. 00 L di una soluzione 0. 150 M di acido nitrico
 Soluzione omogenea
Soluzione omogenea Ipnoinduttori
Ipnoinduttori Catalizzatori omogenei
Catalizzatori omogenei Miscela di idrocarburi
Miscela di idrocarburi Ionizzazione dell'acqua zanichelli
Ionizzazione dell'acqua zanichelli Normalità di una soluzione
Normalità di una soluzione Soluzioni
Soluzioni Mappa concettuale acidi e basi
Mappa concettuale acidi e basi Curva riscaldamento acquavite
Curva riscaldamento acquavite Cinetica ordine zero
Cinetica ordine zero L'equilibrio chimico zanichelli capitolo 19
L'equilibrio chimico zanichelli capitolo 19 Posca fiorani chimica più soluzioni
Posca fiorani chimica più soluzioni Soluzione tampone
Soluzione tampone Spontaneita
Spontaneita Soluzione geometria
Soluzione geometria Soluzione satura
Soluzione satura Legge di henry
Legge di henry Una pentola piena d'olio viene messa a raffreddare
Una pentola piena d'olio viene messa a raffreddare Giuseppe valitutti
Giuseppe valitutti Kw= ka x kb
Kw= ka x kb Pentamini scuola primaria
Pentamini scuola primaria Il paradosso del barbiere soluzione
Il paradosso del barbiere soluzione Paradosso di russell insiemi
Paradosso di russell insiemi Energia reticolare
Energia reticolare Soluzione immagine
Soluzione immagine Soluzione satura
Soluzione satura Soluzioni chimica posca
Soluzioni chimica posca Soluzione
Soluzione Soluzione
Soluzione Maura danese
Maura danese Risolvere equazione pura
Risolvere equazione pura Soluzione
Soluzione Soluzione
Soluzione Soluzione terzo strato cubo di rubik
Soluzione terzo strato cubo di rubik Sistemi di disequazione
Sistemi di disequazione La molarità
La molarità La stella nascosta di samuel loyd soluzione
La stella nascosta di samuel loyd soluzione Soluzione
Soluzione