TEMA 1 FORMULACIN INORGNICA GUIN DEL TEMA 1













































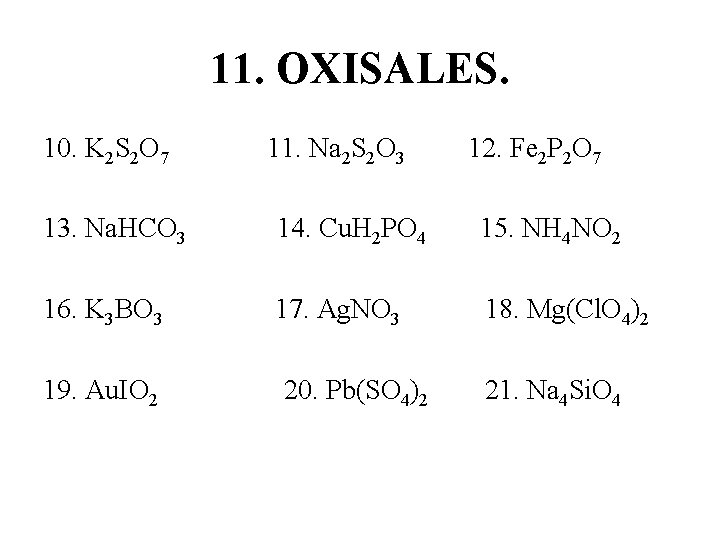




- Slides: 51

TEMA 1. FORMULACIÓN INORGÁNICA

GUIÓN DEL TEMA 1. 2. 3. 4. 5. 6. NÚMEROS DE OXIDACIÓN. IONES POLIATÓMICOS. SUSTANCIAS SIMPLES. ÓXIDOS. PERÓXIDOS. COMBINACIONES BINARIAS DEL HIDRÓGENO. 6. 1. HIDRUROS METÁLICOS. 6. 2. HIDRÓGENO CON NO METALES. 6. 2. 1. SIN CARÁCTER ÁCIDO. 6. 2. 2. CON CARÁCTER ÁCIDO. 7. SALES BINARIAS (METAL CON NO METAL). 8. NO METAL CON NO METAL. 9. HIDRÓXIDOS. 10. OXÁCIDOS. 11. OXISALES. 12. SALES ÁCIDAS.

1. NÚMEROS DE OXIDACIÓN. LOS ESTADOS DE OXIDACIÓN MÁS IMPORTANTES DE ALGUNOS ELEMENTOS METÁLICOS SON: Litio Li Sodio Na Potasio K Rubidio Rb Cesio Cs Francio Fr Plata Ag +1 Cobre Cu Mercurio Hg Oro Au +1, +2 +1, +3 Berilio Magnesio Calcio Estroncio Bario Radio Cinc Cadmio Be Mg Ca Sr Ba Ra Zn Cd Estaño Plomo Paladio Platino Germanio Sn Pb Pd Pt Ge Aluminio Al Galio Ga Indio In +3 Titanio Ti +2, +3, +4 +2 Hierro Cobalto Niquel Fe Co Ni +2, +3 -ico Cromo Cr +2, +3, +6 +2, +4 -ico Manganeso Mn +2, +3, +4, +6, +7 per. Vanadio V +3, +5 -ico

1. NÚMEROS DE OXIDACIÓN. LOS ESTADOS DE OXIDACIÓN MÁS IMPORTANTES DE ALGUNOS ELEMENTOS NO METÁLICOS SON: Hidrógeno H Carbono Silicio -1, +1 C -4, +2, +4 Si - ico Nitrógeno N Fósforo P Arsénico As Antimonio Sb Oxígeno Azufre Selenio Teluro O Boro B -3, +3 -ico S -oso –oso -ico Se -2, 2, 4, 6 Te hipo- -3, 1, 2, 3, 4, 5 -oso -ico -3, 3, 5 -oso -ico -2 Flúor F Cloro Cl Bromo Br Yodo I -1 -oso -ico -1, 1, 3, 5, 7 hipo-per

2. IONES MONOATÓMICOS. CATIONES MONOATÓMICOS • Se nombran con la palabra “catión” seguida del nombre del elemento. • Si el elemento tiene más de un número de oxidación, entonces se añade un número romano entre paréntesis para indicarlo. • EJEMPLOS: Na+ catión sodio Ca 2+ catión calcio Fe 2+ catión hierro (II) Fe 3+ catión hierro (III)

2. IONES MONOATÓMICOS. ANIONES MONOATÓMICOS • Se nombran utilizando la palabra “anión” seguida de la raíz del elemento acabada en –uro. • EJEMPLOS: Cl- anión cloruro S 2 - anión sulfuro N 3 - anión nitruro • EXCEPCIÓN: anión óxido O 2 OTROS IONES IMPORTANTES Catión amonio NH 4+ anión cianuro CNanión hidróxido OH-

3. SUSTANCIAS SIMPLES. • Las sustancias simples son las que están formadas por un solo elemento. • La mayoría son monoatómicas (ejemplo: sodio Na). • Algunas son diatómicas: flúor F 2, cloro Cl 2, bromo Br 2, yodo I 2, oxígeno O 2, nitrógeno N 2 e hidrógeno H 2 • Algunas pueden ser triatómicas (ejemplo: ozono O 3)

4. ÓXIDOS. • Están formados por un elemento y el oxígeno. • Para escribir la fórmula se pone primero el símbolo del elemento y después el del oxígeno. Finalmente, se intercambian los números de oxidación y, si es posible, se simplifica. • EJEMPLOS: Na 2 O Ca 2 O 2 → Ca. O Pb 2 O 4 → Pb. O 2 S 2 O 6 → SO 3

4. ÓXIDOS. • Para escribir el nombre se utilizan la nomenclatura Stock o la nomenclatura sistemática. • NOMENCLATURA STOCK. Se escribe “óxido de” seguido del nombre del elemento. Si éste tiene más de un número de oxidación, al final se añade un número romano entre paréntesis para indicar dicho número. Na 2 O óxido de sodio Ca. O óxido de calcio Pb. O 2 óxido de plomo (IV) SO 3 óxido de azufre (VI)

4. ÓXIDOS. • NOMENCLATURA SISTEMÁTICA. Se utilizan prefijos griegos (mono-, di-, tri-, tetra-, penta-, hexa-, hepta-) para indicar el número de átomos de cada elemento en la fórmula. • NOTA: el prefijo mono- no se utiliza nunca en la segunda palabra, y sólo se utiliza en la primera palabra cuando el elemento que acompaña al oxígeno tiene más de un número de oxidación. Mg. O óxido de magnesio Mn. O monóxido de manganeso Mn 2 O 3 trióxido de dimanganeso

4. ÓXIDOS. EJERCICIO. • Cr 2 O 3 • Hg 2 O • Pb. O • Cu 2 O • Pt. O 2 • Ni 2 O 3 • Sn. O • Mg. O • Ag 2 O EJERCICIO. • Óxido de cobre (II) • Óxido de sodio • Óxido de mercurio (II) • Dióxido de manganeso Óxido de calcio Trióxido de dihierro Monóxido de niquel

4. ÓXIDOS. EJERCICIO. Nombra los siguientes óxidos no metálicos: • N 2 O 3 • NO 2 • N 2 O 5 • Cl 2 O 7 • SO 3 • P 2 O 5 • Se. O 2

5. PERÓXIDOS. • El anión peróxido es (el subíndice no se simplifica). • Los peróxidos están formados, generalmente, por un metal y el anión peróxido. • Se nombran del siguiente modo: “peróxido de (nombre del metal) (nºromano si es necesario)” • EJEMPLOS: K 2 O 2 Peróxido de potasio H 2 O 2 Peróxido de oxígeno (agua oxigenada) Ba O 2 Peróxido de bario Cu O 2 Peróxido de cobre (II) Zn O 2 Peróxido de cinc • Se puede utilizar, por supuesto, la nomenclatura sistemática

6. COMBINACIONES BINARIAS CON HIDRÓGENO. 6. 2. 1. HIDRUROS METÁLICOS. • Se utiliza nomenclatura sistemática o Stock (también se puede utilizar la nomenclatura tradicional, que está en desuso). • EJEMPLOS: Na. H hidruro de sodio Ca. H 2 hidruro de calcio/ dihidruro de calcio Fe. H 3 hidruro de hierro (III)/ trihidruro de hierro Pt. H 4 hidruro de platino (IV) / tetrahidruro de platino

6. COMBINACIONES BINARIAS CON HIDRÓGENO. 6. 2. 1. HIDRUROS METÁLICOS. EJERCICIO. Nombrar y formular los siguientes hidruros: • • • KH Cu H Ni H 2 Au H Cd H 2 Pt H 4 Hg H 2 Co H 3 Sr H 2 • • Hidruro de cesio Hidruro de magnesio Hidruro de cobalto (II) Hidruro de estaño (II) Hidruro de cinc Hidruro de plomo (IV) Hidruro de cromo (III) Hidruro de oro (III)

6. COMBINACIONES BINARIAS CON HIDRÓGENO. 6. 2. HIDRÓGENO CON NO METALES. 6. 2. 1. SIN CARÁCTER ÁCIDO. • A continuación se presentan nueve sustancias que nombraremos de forma tradicional, aunque también puede admitirse la nomenclatura sistemática o la nomenclatura Stock. BH 3 borano CH 4 metano PH 3 fosfina Si. H 4 silano As. H 3 arsina Sb. H 3 estibina NH 3 amoníaco Bi. H 3 bismutina H 2 O agua

6. COMBINACIONES BINARIAS CON HIDRÓGENO. 6. 2. 2. CON CARÁCTER ÁCIDO. • ¡OJO! Estas sustancias no se nombran sistemáticamente o con la nomenclatura Stock. • Se pueden nombrar de dos formas, la primera es aplicable cuando la sustancia está aislada, y la segunda cuando está disuelta en agua. HF fluoruro de hidrógeno/ HF(aq) ácido fluorhídrico HCl cloruro de hidrógeno/ HCl(aq) ácido clorhídrico H Br bromuro de hidrógeno/ HBr(aq) ácido bromhídrico HI yoduro de hidrógeno/ HI(aq) ácido yodhídrico H 2 S sulfuro de hidrógeno/ H 2 S(aq) ácido sulfhídrico H 2 Se seleniuro de hidrógeno/ H 2 Se(aq) ác. selenhídrico H 2 Te telururo de hidrógeno/ H 2 Te(aq) ác. telurhídrico HCN cianuro de hidrógeno/ HCN(aq) ác. cianhídrico

7. SALES BINARIAS (METAL CON NO METAL) • Se nombran utilizando la raíz del no metal acabada en –uro seguida del nombre del metal. • Se utilizan la nomenclatura sistemática y la nomenclatura Stock (también la nomenclatura tradicional). Ca F 2 Fe Cl 3 Pb I 2 Cu Br Mn S 2 Mg 3 P 2 Fluoruro de calcio Difluoruro de calcio Cloruro de hierro (III) Tricloruro de hierro Yoduro de plomo (II) Diyoduro de plomo Bromuro de cobre (I) Monobromuro de cobre Sulfuro de manganeso (IV) Disulfuro de manganeso Fosfuro de magnesio Difosfuro de trimagnesio

7. SALES BINARIAS (METAL CON NO METAL) EJERCICIO. Nombra y formula las siguientes sales: Hg S Cd Te Sn S Pb S Cu 3 P Fe 2 S 3 Au 2 S Nitruro de cinc Cloruro de niquel (III) Yoduro de plata Monosulfuro de hierro Fosfuro de cromo (III)

8. NO METAL CON NO METAL. • Estas combinaciones se nombran de igual modo que las anteriores haciendo terminar en –uro el elemento que figure delante en la lista siguiente: F, Cl, Br, I, S, Se, Te, N, P, As, Sb, C, Si, B. • Ejemplos: Br Cl PCl 3 Cloruro de bromo (I) Cloruro de fósforo (III) Monocloruro de bromo Tricloruro de fósforo EJERCICIO. Nombra y formula las siguientes sales: S I 2 As 2 S 5 S F 6 Sulfuro de nitrógeno (III) Trisulfuro de diboro Bromuro de antimonio (III)

9. HIDRÓXIDOS. • Están formados, normalmente, por un metal y el anión hidróxido OH-. • Se utiliza nomenclatura sistemática o Stock (también se admite nomenclatura tradicional). • EJEMPLOS: Pb (OH)4 Hidróxido de plomo (IV)/ Tetrahidróxido de plomo Mg (OH)2 Hidróxido de magnesio/ Dihidróxido de magnesio

9. HIDRÓXIDOS. EJERCICIO. Nombrar o formular los siguientes compuestos: • Hidróxido de amonio • Pt (OH)2 • Zn (OH)2 • Cu (OH)2 • Hidróxido de niquel (II) • Trihidróxido de aluminio • Hidróxido de hierro (III)

EJERCICIOS PARA PRACTICAR Escribe el nombre de los siguientes compuestos: Ca O NH 4 Cl N O 2 N H 3 Cr P H 2 S Fe 2 S 3 Pb O 2 HI Cu Cl 2 C H 4 Hg H Sb H 3 I 2 O 5 Au (OH)3

EJERCICIOS PARA PRACTICAR Escribe la fórmula de las siguientes sustancias: Hidróxido de plata Hidruro de niquel (III) Trióxido de dihierro Óxido de azufre (VI) Metano Óxido de aluminio Óxido de cobre ( I ) Sulfuro de plomo (IV) Dicloruro de cobalto Cloruro de niquel (II) Hidruro de plomo (IV) Ácido sulfhídrico Bromuro de hidrógeno Dióxido de azufre Ácido clorhídrico Hidróxido de estroncio

EJERCICIOS PARA PRACTICAR • EJERCICIO 1. Óxido de calcio 3. Óxido ferroso 5. Hidruro de niquel (III) 7. Amoníaco 9. Ác. Bromhídrico 11. Peróxido de potasio 13. Ác. cianhídrico 2. Óxido de aluminio 4. Hidruro de cinc 6. Ác. Sulfhídrico 8. Silano 10. Óxido de estaño (IV) 12. Peróxido de magnesio 14. Sulfuro férrico

EJERCICIOS PARA PRACTICAR • EJERCICIO. 15. Seleniuro de oro (III) 16. Cianuro sódico 17. Cloruro de níquel (II) 18. Tetrafluoruro de silicio 19. Hidróxido de mercurio (II) 20. Sulfuro de amonio 21. Hidróxido sódico 22. Dicloruro de triazufre 23. Hidróxido amónico 24. Hidróxido de cobre (II) 25. Trisulfuro de diantimonio 26. Cianuro de magnesio 27. Tetracloruro de carbono 28. Arseniuro de cadmio

EJERCICIOS PARA PRACTICAR • Nombra los siguientes compuestos: 1. Cu. O 2. Co 2 O 3 3. N 2 O 5. SO 3 6. I 2 O 7. HCl 9. V 2 O 5 10. HI 11. H 2 O 2 13. PH 3 14. BH 3 15. Sn. S 2 17. NH 4 Br 18. Ag. Cl 19. PBr 5 21. Cd(OH)2 22. Pt. S 2 23. Ti. O 2 25. (NH 4)2 Se 4. Pb. O 2 8. Fe. H 3 12. Zn. O 2 16. Mn. Se 2 20. KCN 24. Pb(OH)2

10. OXÁCIDOS. • Son compuestos ternarios que tienen fórmula Ha. Xb. Oc siendo X un no metal, aunque también puede ser un metal como Cr, Mn o V (cuando actúan con una valencia superior a 4). • NOTA: los elementos X utilizarán los números de oxidación que aparecen subrayados en la tabla inicial.

10. OXÁCIDOS. • Los oxoácidos pueden suponerse formados mediante la combinación de un óxido (sólo con algunos números de oxidación) y una o más moléculas de agua. • Ejemplos: SO 3 + H 2 O → H 2 SO 4 N 2 O 5 + H 2 O → H 2 N 2 O 6 → HNO 3 • Algunos óxidos (P, As, Sb, B, V o Si) pueden combinarse con un número mayor de moléculas de agua. • Ejemplo: P 2 O 5 + 3 H 2 O → H 6 P 2 O 8 → H 3 PO 4

10. OXÁCIDOS. • NOMENCLATURA TRADICIONAL. Se utilizan prefijos y sufijos (tabla de números de oxidación) para indicar el estado de oxidación del elemento X. FORMA I. Se obtiene la fórmula del óxido y le sumamos la molécula o moléculas de agua correspondientes. Ej. Ácido nítrico: N 2 O 5 + H 2 O → H 2 N 2 O 6 → HNO 3 Ej. Acido sulfúrico: SO 3 + H 2 O → H 2 SO 4

10. OXÁCIDOS. • Los elementos (B, P, As, Sb y V) pueden formar el ácido con una, dos o tres moléculas de agua. En este caso, se añade el prefijo meta- cuando se trata de una molécula de agua, di- o piro- cuando se trata de dos y orto- cuando se trata de tres. En este caso, ortopuede omitirse. • El elemento Si puede formar el ácido con una o dos moléculas de agua. En este caso, se utiliza meta cuando se trata de una molécula de agua y orto, cuando se trata de dos. En este caso, meta puede omitirse.

10. OXÁCIDOS. • EJEMPLO: Ácido metafosfórico P 2 O 5 + H 2 O → H 2 P 2 O 6 → HPO 3 Ácido difosfórico o pirofosfórico P 2 O 5 + 2 H 2 O → H 4 P 2 O 7 Ácido ortofosfórico o fosfórico P 2 O 5 + 3 H 2 O → H 6 P 2 O 8 → H 3 PO 4 • EJEMPLO: Ácido metasilícico o silícico Si. O 2 + H 2 O→ H 2 Si. O 3 Ácido ortosilícico Si. O 2 + 2 H 2 O → H 4 Si. O 4

10. OXÁCIDOS. • Para obtener el nombre a partir de la fórmula debemos obtener el número de oxidación del elemento X, y tener en cuenta el número de moléculas de agua utilizadas. • HCl. O 4 → → → 1· 1+1·x +(-2)· 4 = 0 → x = 7 → ácido perclórico

10. OXÁCIDOS. NOTA: llamamos diácidos a algunos ácidos cuya fórmula se obtiene multiplicando x 2 la fórmula original del ácido y restando una molécula de agua. EJEMPLO: ácido sulfúrico H 2 SO 4 Ácido disulfúrico H 2 SO 4 x 2 → H 4 S 2 O 8 H 2 S 2 O 7 NOTA: todos los diácidos tienen un dos como subíndice del elemento X.

10. OXÁCIDOS. NOTA: llamamos tioácidos a aquellos ácidos en los que un átomo de oxígeno se sustituye por uno de azufre. EJEMPLO: ácido sulfúrico H 2 SO 4 ácido tiosulfúrico H 2 S 2 O 3

10. OXÁCIDOS. • FORMA II Ácidos normales o meta- Diácidos o ácidos di- o piro- Ácidos orto- VALENCIA IMPAR HXOc H 4 X 2 O c H 3 XOc VALENCIA PAR H 2 XOc H 2 X 2 O c H 4 XOc • Esta tabla puede servir para todos los oxóacidos (a excepción de los tioácidos).

10. OXÁCIDOS. • EJERCICIOS 1. 3. 5. 7. 9. Ácido sulfúrico Ácido nítrico Ácido selenioso Ácido perclórico Ácido hiposulfuroso 2. Ácido clórico 4. Ácido bromoso 6. Ácido hipoyodoso 8. Ácido carbónico 10. Ácido crómico

10. OXÁCIDOS. • EJERCICIOS. 1. 3. 5. 7. 9. H 2 SO 3 HIO 2 HCl. O 2 HBr. O 4 H 2 Mn. O 4 2. HCl. O 4. H 2 Se. O 4 6. HIO 4 8. H 2 CO 3 10. HBr. O 3

10. OXÁCIDOS. • EJERCICIOS. 1. Ácido permangánico 3. Ácido nitroso 5. Ácido disulfuroso 7. Ácido antimónico 9. Ácido tiosulfúrico 11. Ácido metasilícico 2. Ácido fosfórico 4. Ácido bórico 6. Ácido difosfórico 8. Ácido metafosfórico 10. Ácido silícico

10. OXÁCIDOS. • EJERCICIOS. 1. H 2 Cr. O 4 3. H 4 As 2 O 7 5. H 2 S 2 O 7 7. H 3 BO 3 9. H 3 Sb. O 4 11. H 4 Si. O 4 2. H 4 P 2 O 5 4. HPO 3 6. H 3 PO 3 8. H 2 S 2 O 3 10. H 2 Si. O 3

10. OXÁCIDOS. • NOMENCLATURA SISTEMÁTICA: la IUPAC (Unión Internacional de Química Pura y Aplicada) sistematiza la nomenclatura de los ácidos: • Se escribe el prefijo di-, tri-, tetra-, … (para indicar el número de oxígenos) seguida de la raíz del elemento X (puede ir precedida del prefijo -di- si el subíndice de X es un 2) seguida de la terminación –ato y el número de oxidación de X con números romanos, seguido de la terminación “de hidrógeno”. • EJEMPLOS: H 2 SO 4 tetraoxosulfato (VI) de hidrógeno H 4 P 2 O 7 heptaoxodifosfato (V) de hidrógeno

11. OXISALES. • NOMENCLATURA TRADICIONAL. A partir del oxoácido, se eliminan los hidrógenos y se obtiene el anión correspondiente que se combina con un metal. TERMINACIÓN DEL ÁCIDO TERMINACIÓN DEL ANIÓN -oso -ito -ico -ato • EJEMPLO. Ácido sulfúrico H 2 SO 4 anión sulfato SO 42 sulfato de sodio Na 2 SO 4

11. OXISALES. • Para conseguir la fórmula a partir del nombre, primero debemos obtener el ácido correspondiente. Después obtener el anión y combinarlo con el metal correspondiente. • EJERCICIOS: 1. Sulfato de cobre (II) 2. Perclorato de potasio 3. Hiposulfito de níquel (III) 4. Nitrato de estaño (IV) 5. Fosfato de cinc 6. Disulfato de magnesio 7. Hipoclorito de sodio 8. Dicromato potásico

11. OXISALES. 9. Permanganato amónico 10. Borato de mercurio (II) 11. Carbonato de cobalto (III) 12. Sulfito de hierro (III) 13. Selenito de bario 15. Clorato de estroncio 14. Nitrato de plata 16. Peryodato de cromo (III) 17. Vanadato de platino (IV) 18. Silicato de calcio

11. OXISALES. • Para obtener el nombre a partir de la fórmula lo primero es conocer el nombre del anión. Para ello debemos quitar el metal y conocer el número de oxidación del elemento X. En caso de duda, reconstruir a partir del ácido correspondiente. • EJERCICIO. 1. Fe 2(SO 4)3 2. KNO 3 3. Cu. Se. O 3 4. Sn(Cl. O 4)2 5. Ni 2(SO 2)3 6. KMn. O 4 7. Ca 3(PO 4)2 8. Li. Cl. O 9. Hg(Br. O 3)2
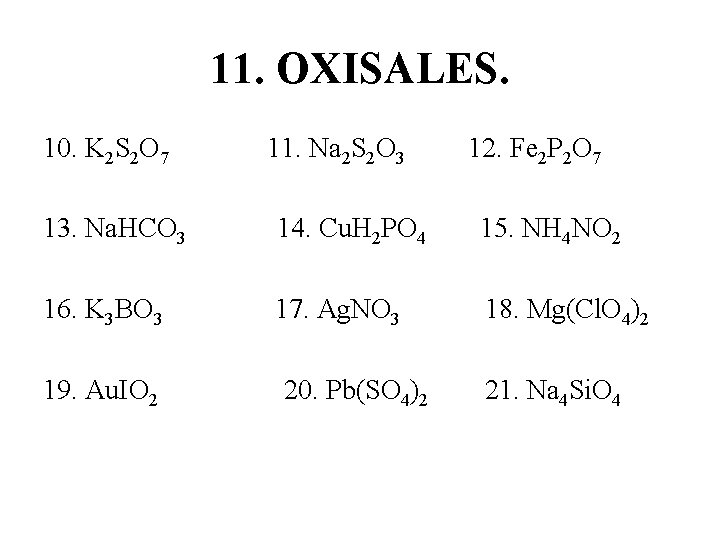
11. OXISALES. 10. K 2 S 2 O 7 11. Na 2 S 2 O 3 12. Fe 2 P 2 O 7 13. Na. HCO 3 14. Cu. H 2 PO 4 15. NH 4 NO 2 16. K 3 BO 3 17. Ag. NO 3 18. Mg(Cl. O 4)2 19. Au. IO 2 20. Pb(SO 4)2 21. Na 4 Si. O 4

11. OXISALES. • NOMENCLATURA SISTEMÁTICA. Se procede de igual forma que con los ácidos, pero al final, si el metal tiene más de una valencia se indica mediante un número romano. KNO 3 trioxonitrato (V) de potasio Fe SO 4 tetraoxosulfato (VI) de hierro (II)

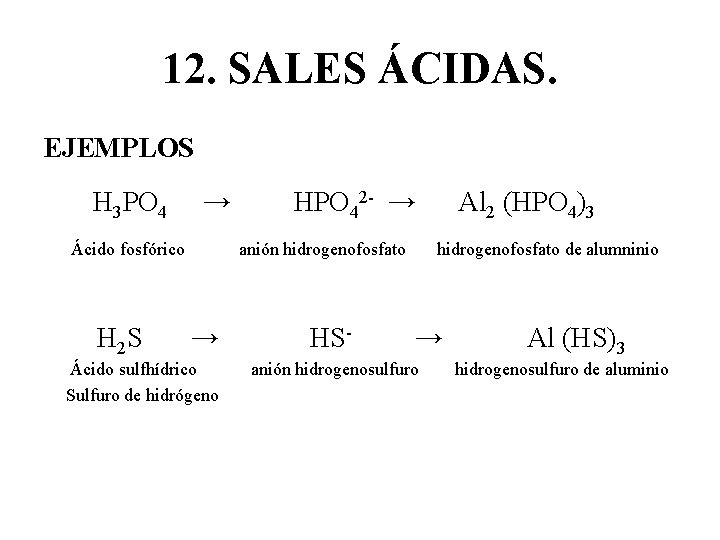
12. SALES ÁCIDAS. • Se forman a partir de ácidos que tienen más de un hidrógeno, cuando uno o más de esos hidrógenos se queda formando parte del anión. • EJEMPLO: H 2 SO 4 → HSO 4→ Ca (HSO 4)2 Ácido sulfúrico H 3 PO 4 → Ácido fosfórico anión hidrogenosulfato H 2 PO 4 - → anión dihidrogenofosfato hidrogenosulfato de calcio Al (H 2 PO 4)3 dihidrogenofosfato de alumninio

12. SALES ÁCIDAS. EJEMPLOS H 3 PO 4 → Ácido fosfórico H 2 S HPO 42 - → anión hidrogenofosfato → Ácido sulfhídrico Sulfuro de hidrógeno HS- Al 2 (HPO 4)3 hidrogenofosfato de alumninio → anión hidrogenosulfuro Al (HS)3 hidrogenosulfuro de aluminio

12. SALES ÁCIDAS. • EJERCICIO. Escribe el nombre o la fórmula de las siguientes sales ácidas: - Hidrogenosulfato de hierro (III) - Dihidrogenotrioxofosfato (III) de estaño (II) - Hidrogenoheptaoxodisulfato (VI) de cobre (II) - Sn (HSO 4)2 - Fe. H 2 P 2 O 7 - (NH 4)HCO 3

12. SALES ÁCIDAS. • EJERCICIO. Escribe el nombre o la fórmula de las siguientes sales ácidas: - Hidrogenocarbonato de hierro (II) - Dihidrogenofosfato de oro (I) - Trihidrogenodifosfato de plomo (II) - Na. HCO 3 - Cu. H 2 PO 4
 The wife's story quiz
The wife's story quiz El guin
El guin A wifes story
A wifes story Conclusiones de un trabajo
Conclusiones de un trabajo El guin
El guin Formulacin
Formulacin Formulacin
Formulacin Formulacin
Formulacin Formulacin
Formulacin Peroxidos 3 eso
Peroxidos 3 eso Acidos binarios
Acidos binarios Tema-tema teologi perjanjian lama
Tema-tema teologi perjanjian lama El tema y sub tema
El tema y sub tema Cuáles son las características de una entrevista
Cuáles son las características de una entrevista Vladimir tattin
Vladimir tattin Ejemplos de temas delimitados
Ejemplos de temas delimitados Temas del cantar del mio cid
Temas del cantar del mio cid Tema del varco montale
Tema del varco montale Tema del diverso
Tema del diverso Tema della diversità nella letteratura italiana
Tema della diversità nella letteratura italiana Contenido de mateo
Contenido de mateo Contenido del evangelio de marcos
Contenido del evangelio de marcos Tema del mensaje
Tema del mensaje Que es un tema objetivo
Que es un tema objetivo Testo argomentativi struttura
Testo argomentativi struttura Laberintos de los reyes magos
Laberintos de los reyes magos Resumen de aparecida
Resumen de aparecida Analisi testo argomentativo esempi
Analisi testo argomentativo esempi Trípticos de
Trípticos de Viaje a los infiernos en la literatura
Viaje a los infiernos en la literatura Tema el amor del padre
Tema el amor del padre Que son los versos
Que son los versos Ejemplos de preguntas cerradas
Ejemplos de preguntas cerradas Romance del conde arnaldos tema
Romance del conde arnaldos tema Nord e sud del mondo - schema
Nord e sud del mondo - schema Qué ideas del tema para este día te sugiere la imagen
Qué ideas del tema para este día te sugiere la imagen Perez cervantes abel
Perez cervantes abel Cual es el tema del poema la jardinera
Cual es el tema del poema la jardinera A un olmo seco metrica
A un olmo seco metrica Tema zdravlje je najvece bogatstvo
Tema zdravlje je najvece bogatstvo Mala voćka poslije kiše
Mala voćka poslije kiše Conclusion sobre un tema
Conclusion sobre un tema Utjeha kose pjesma
Utjeha kose pjesma Contoh topik dan tema
Contoh topik dan tema Tema y rema ejemplos
Tema y rema ejemplos Tema sociologjike
Tema sociologjike Contoh penelitian sejarah untuk sma
Contoh penelitian sejarah untuk sma Finalidad de la novela
Finalidad de la novela Tema poeziei floare albastra
Tema poeziei floare albastra Honeywell tema server installation manual
Honeywell tema server installation manual Tema e problema
Tema e problema Amamos porque ele nos amou primeiro
Amamos porque ele nos amou primeiro






































































