Proteasas de Helmintos Parsitos El caso de Fasciola


















- Slides: 58

Proteasas de Helmintos Parásitos. El caso de Fasciola hepatica

Fasciola hepatica • Causa la Fasciolosis • Afecta rumiantes • Zoonosis emergente, varios millones infectados en Bolivia y Perú • Produce pérdidas multimillonarias a nivel global

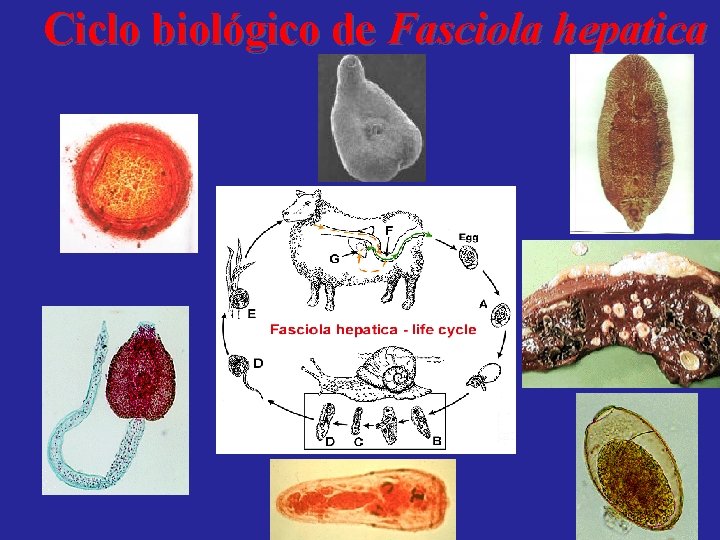
Ciclo biológico de Fasciola hepatica

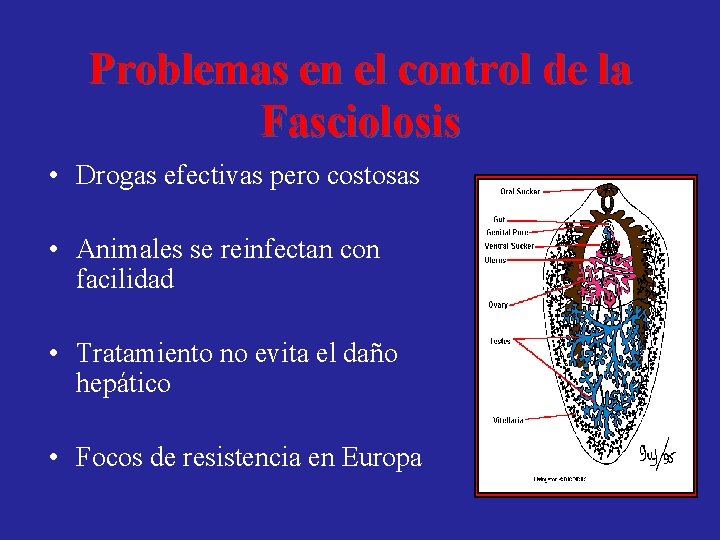
Problemas en el control de la Fasciolosis • Drogas efectivas pero costosas • Animales se reinfectan con facilidad • Tratamiento no evita el daño hepático • Focos de resistencia en Europa

Selección de los productos de excreción/ secreción (E/S) como objeto de estudio • Se pueden obtener en forma relativamente sencilla en cantidades aceptables a partir de gusanos adultos • La fasciola tiene intestino ciego por tanto regurgita el contenido. • Sus componentes entran en contacto con el medio interno del huésped. • Tienen composición menos compleja que el homogeneizado somático


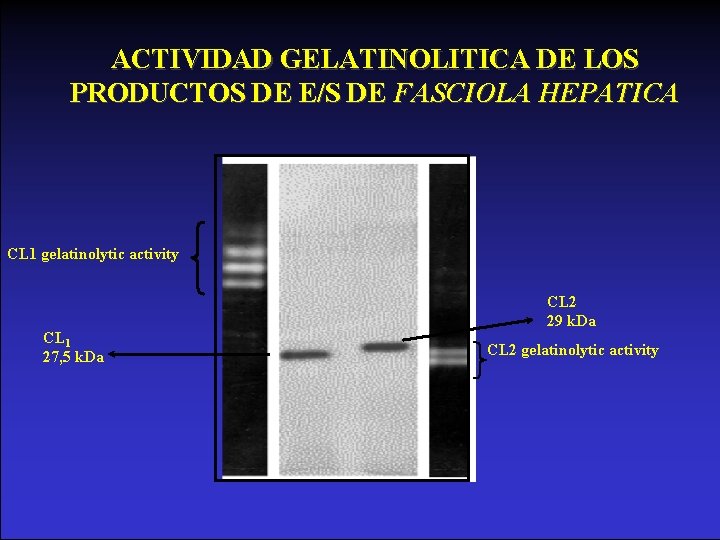
ACTIVIDAD GELATINOLITICA DE LOS PRODUCTOS DE E/S DE FASCIOLA HEPATICA CL 1 gelatinolytic activity CL 1 27, 5 k. Da CL 2 29 k. Da CL 2 gelatinolytic activity

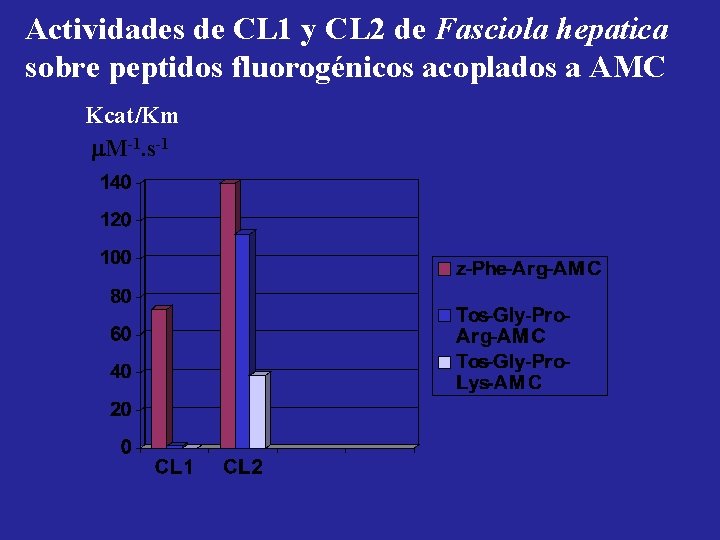
Catepsinas L de Fasciola • Son el 80% de los productos de E/S • Producidas y secretadas por células del tubo digestivo • CL 1 de 27, 5 k. Da es mayoritaria • CL 2 de 29 k. Da • Se diferencian por actividad sobre péptidos fluorogenicos sintéticos

Actividades de CL 1 y CL 2 de Fasciola hepatica sobre peptidos fluorogénicos acoplados a AMC Kcat/Km M-1. s-1

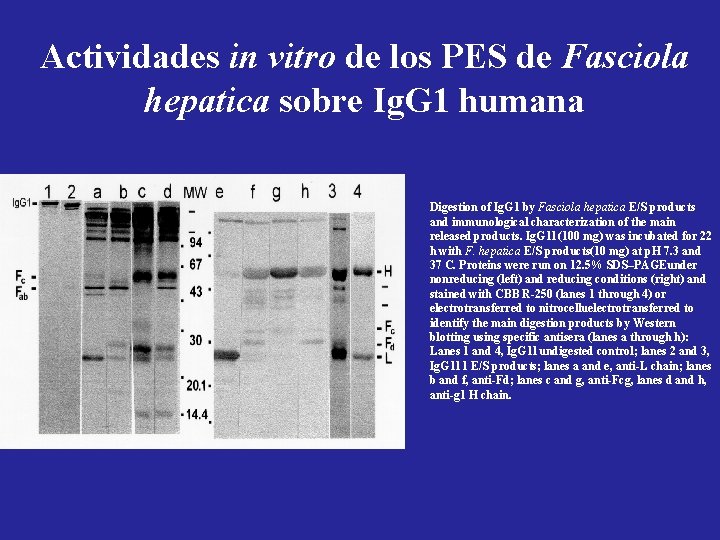
Actividades in vitro de los PES de Fasciola hepatica sobre Ig. G 1 humana Digestion of Ig. G 1 by Fasciola hepatica E/S products and immunological characterization of the main released products. Ig. G 1 l (100 mg) was incubated for 22 h with F. hepatica E/S products(10 mg) at p. H 7. 3 and 37 C. Proteins were run on 12. 5% SDS–PAGEunder nonreducing (left) and reducing conditions (right) and stained with CBB R-250 (lanes 1 through 4) or electrotransferred to nitrocelluelectrotransferred to identify the main digestion products by Western blotting using specific antisera (lanes a through h): Lanes 1 and 4, Ig. G 1 l undigested control; lanes 2 and 3, Ig. G 1 l 1 E/S products; lanes a and e, anti-L chain; lanes b and f, anti-Fd; lanes c and g, anti-Fcg, lanes d and h, anti-g 1 H chain.

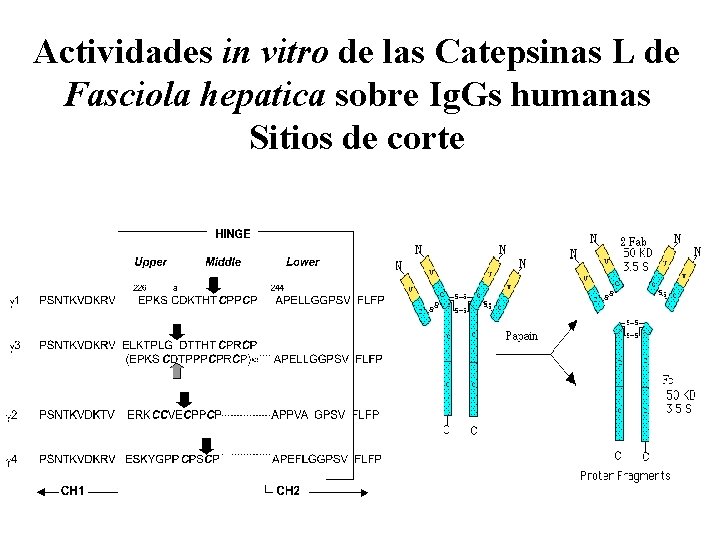
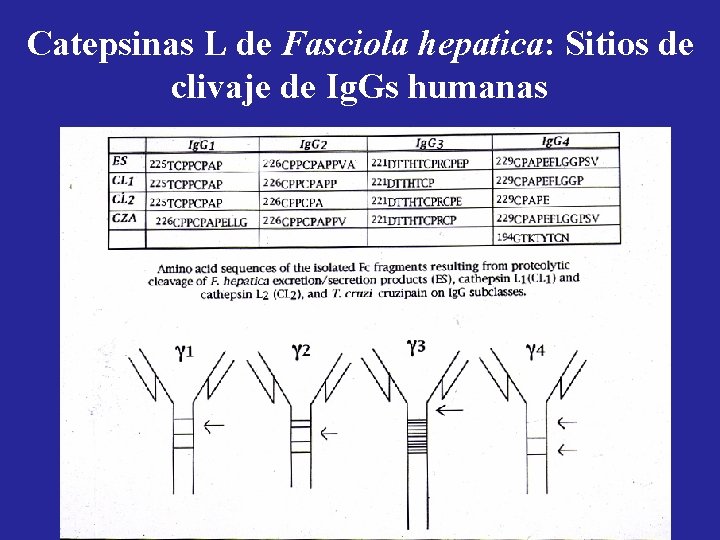
Actividades in vitro de las Catepsinas L de Fasciola hepatica sobre Ig. Gs humanas Sitios de corte

Catepsinas L de Fasciola hepatica: Sitios de clivaje de Ig. Gs humanas

Actividades de PES y Catepsinas L de Fasciola hepatica sobre inmunoglobulinas humanas de clase Ig. G Conclusiones • CL 1 y CL 2 son las principales responsables de la degradación de las subclases de Ig. G con PES a p. H 7. 2 a manera de la papaína produciendo los fragmentos Fab y Fc • A p. H 5. 5 los PES producen la degradación adicional a fragmentos pequeños derivados de la porción Fc • Sólo Ig. G 3 es clivada en ausencia de DTT • Los sitios de corte determinados para CL 1 y CL 2 no se corresponden con los aa P 1 y P 2 de los sustratos sintéticos utilizados para determinar la actividad catepsina L (Phe-Arg )

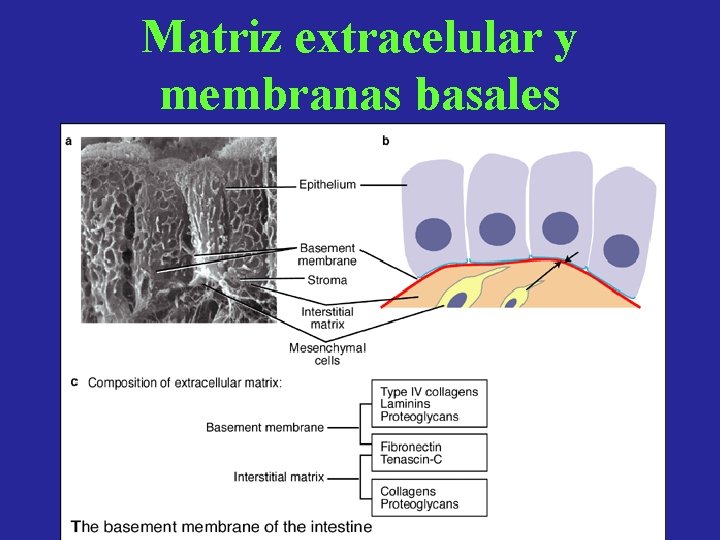
Matriz extracelular y membranas basales

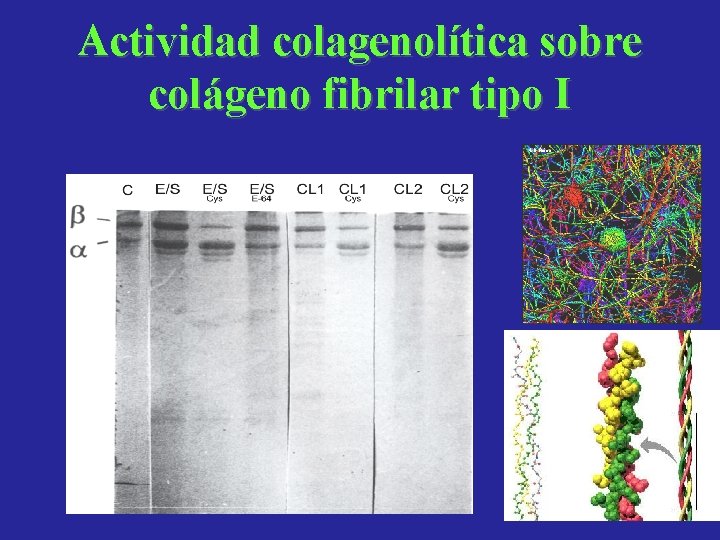
Actividad colagenolítica sobre colágeno fibrilar tipo I

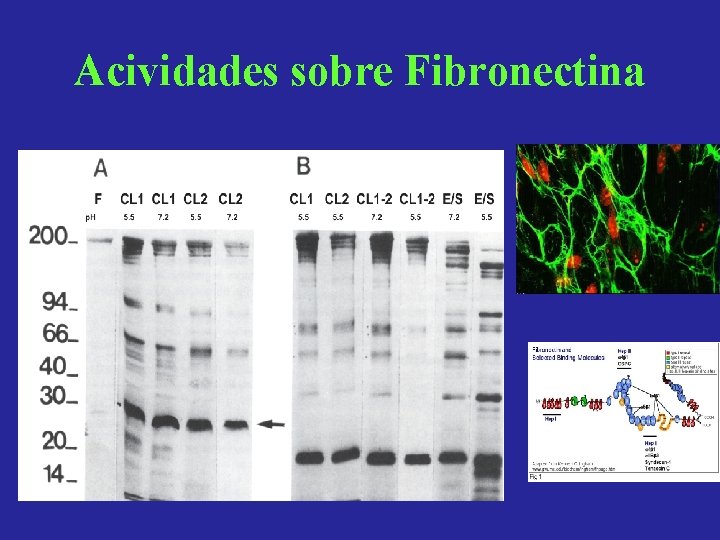
Acividades sobre Fibronectina

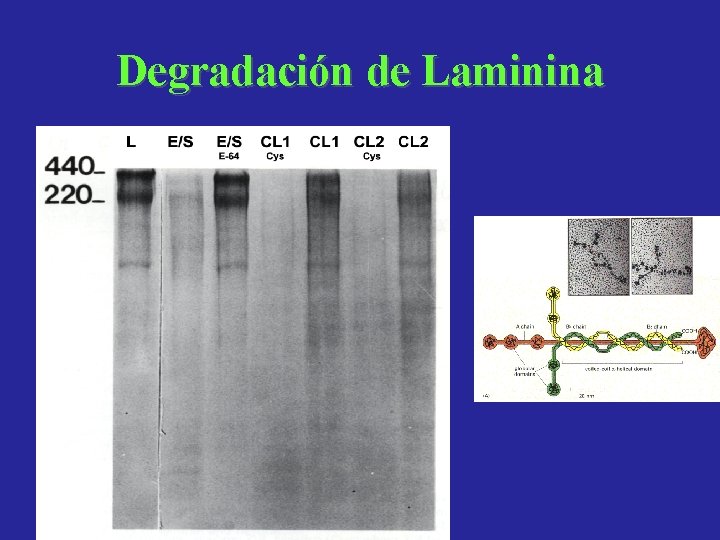
Degradación de Laminina

Catepsinas L de Fasciola: Actividad proteolitica sobre componentes de la matriz extraceular y las membranas basales Conclusiones • Colágeno I: es degradado por los PES y en menor medida por CL 1 y CL 2 en presencia de Cys. • Colageno III: es clivado tanto por PES como por las CLs. • Colágeno IV: degradado completamente por los PES sin Cys, y por CL 1 y CL 2 en presencia de Cys. • Elastina: No se observa actividad proteolitica. • Laminina: Es cortada por PES, CL 1 y CL 2. • Fibronectina: Es atacada por PES, CL 1 y CL 2 produciendo patrones de corte diferentes.

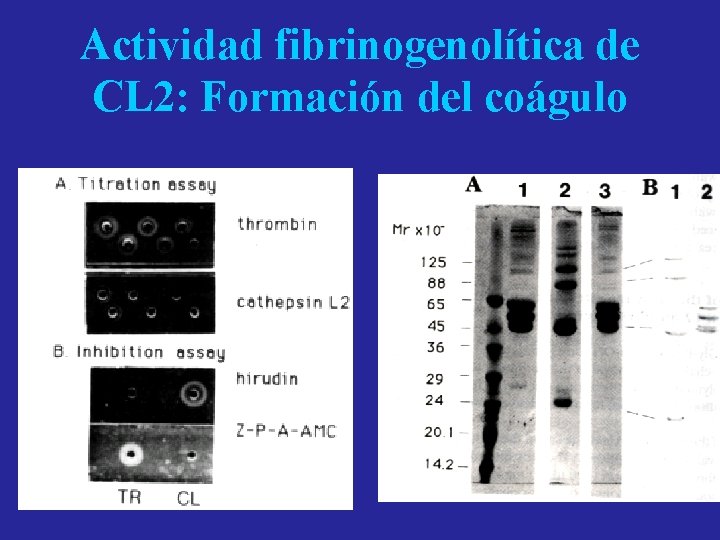
Actividad fibrinogenolítica de CL 2: Formación del coágulo

Inhibición de las Catepsinas L de Fasciola hepatica por anticuerpos de conejos infectados • Conejos infectados con 30 MT c/u y sangrados hasta s 20 • Ig. Gs purificadas por afinidad • Incubación Ig. Gs con CLs, 20 min, relación 10: 1

Inhibición de las Catepsinas L de Fasciola hepatica por anticuerpos de conejos infectados y tratados • La actividad gelatinolítica de ambas catepsinas desaparece a las 4 -5 semanas postinfección y reaparece 2 -4 semanas después del tratamiento con triclabendazol

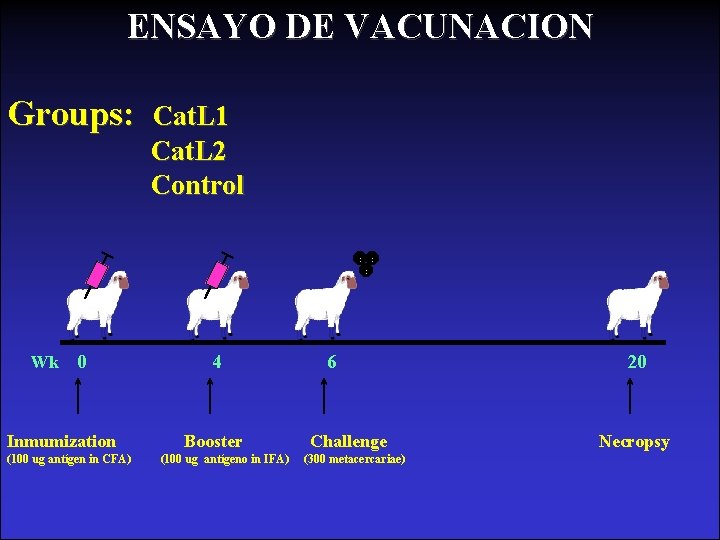
ENSAYO DE VACUNACION Groups: Wk 0 Inmumization (100 ug antígen in CFA) Cat. L 1 Cat. L 2 Control 4 Booster (100 ug antígeno in IFA) 6 Challenge (300 metacercariae) 20 Necropsy

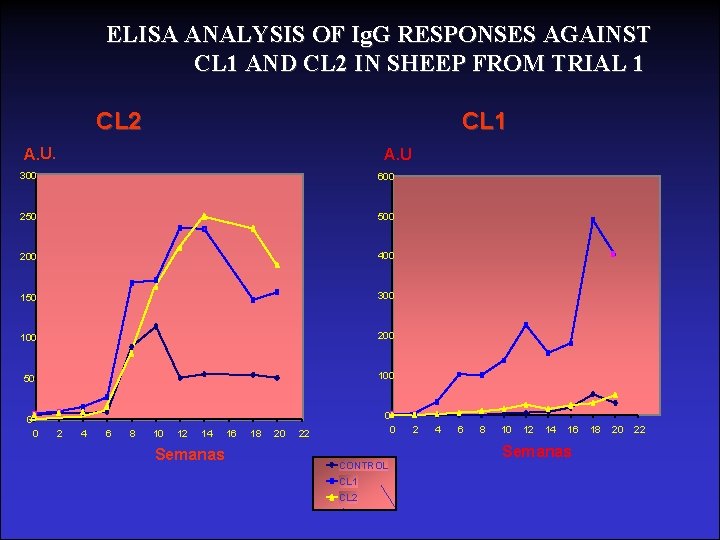
ELISA ANALYSIS OF Ig. G RESPONSES AGAINST CL 1 AND CL 2 IN SHEEP FROM TRIAL 1 CL 2 CL 1 A. U. 300 600 250 500 200 400 150 300 100 200 50 100 0 2 4 6 8 10 12 14 Semanas 16 18 20 0 22 CONTROL CL 1 CL 2 2 4 6 8 10 12 14 16 Semanas 18 20 22

Worm burdens and FEC in sheep vaccinated against F. hepatica with CL 1 and CL 2 in Trial 1 Group Eggs/g Feces Egg output reducción (%) Flukes recovered % worm reduction CL 1 41, 8+/-41, 2 71 109, 1+/-24, 6 34 CL 2 28, 0+/-38 81 107+/-40, 1 33 Control 141, 8+/-75, 6 100 161, 4+/-21, 4 100

OTRAS PROTEASAS DE FASCIOLA HEPATICA • • DIPEPTIDIL PEPTIDASA (DPP) LEUCIN AMINOPEPTIDASA (LAP) CATEPSINA B LEGUMAINA

DIPEPTIDIL PEPTIDASA (DPP) • • Actividad presente en PES de adultos Clivaje preferncial de Gly-Pro y Lys-Ala Novel con relación a las DPPs de mamíferos Aún sin caracterización molecular

LAP de Fasciola hepatica • Metaloproteasa Zn++ dependiente purificada de extracto soluble en deoxicolato • Holoenzima hexamérica formada por subunidades de 67 k. Da • Asociada a tubo digestivo • Purificada por columna de afinidad con su inhibidor Bestatina • Trazas en los PES

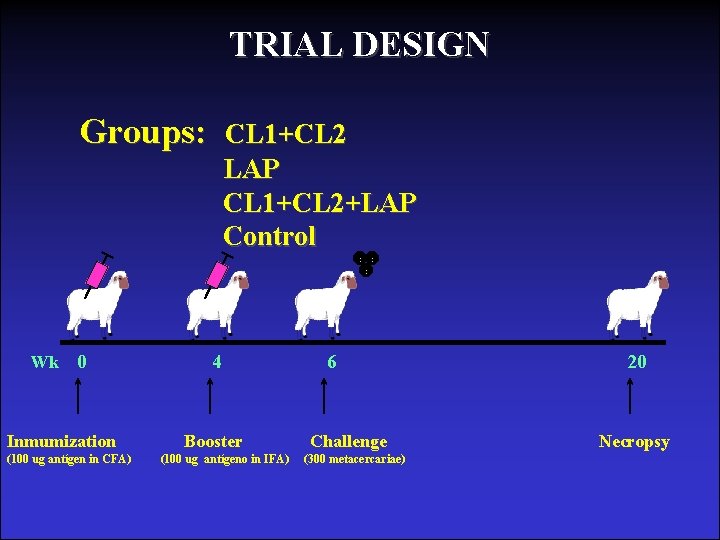
TRIAL DESIGN Groups: Wk 0 Inmumization (100 ug antígen in CFA) CL 1+CL 2 LAP CL 1+CL 2+LAP Control 4 Booster (100 ug antígeno in IFA) 6 Challenge (300 metacercariae) 20 Necropsy

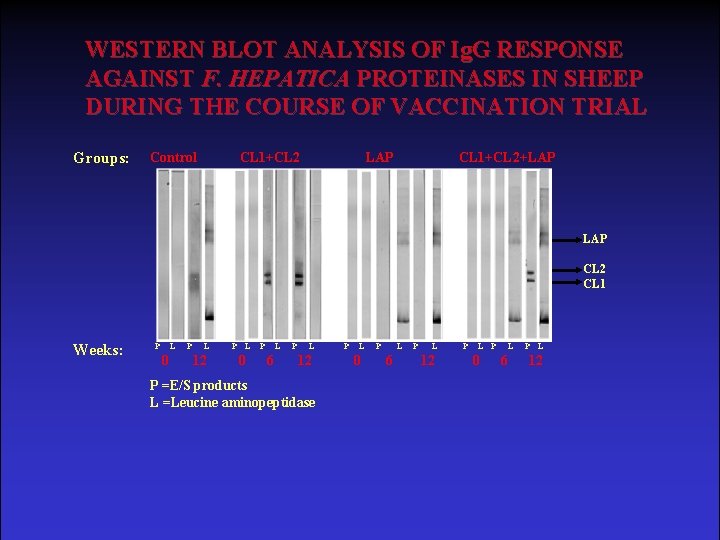
WESTERN BLOT ANALYSIS OF Ig. G RESPONSE AGAINST F. HEPATICA PROTEINASES IN SHEEP DURING THE COURSE OF VACCINATION TRIAL Groups: Control CL 1+CL 2 LAP CL 1+CL 2+LAP CL 2 CL 1 Weeks: P L 0 P L 12 P L 0 P L 6 P L 12 P =E/S products L =Leucine aminopeptidase P L 0 P L 6 P L 12

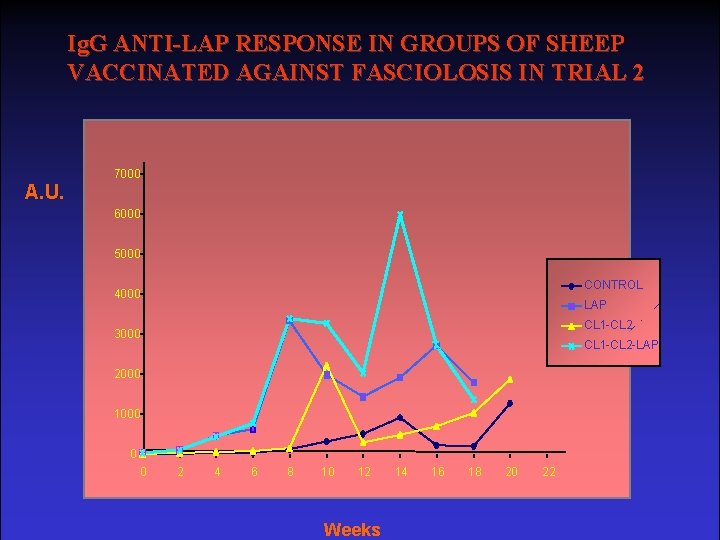
Ig. G ANTI-LAP RESPONSE IN GROUPS OF SHEEP VACCINATED AGAINST FASCIOLOSIS IN TRIAL 2 7000 A. U. 6000 5000 CONTROL 4000 LAP CL 1 -CL 2 3000 CL 1 -CL 2 -LAP 2000 1000 0 0 2 4 6 8 10 12 Weeks 14 16 18 20 22

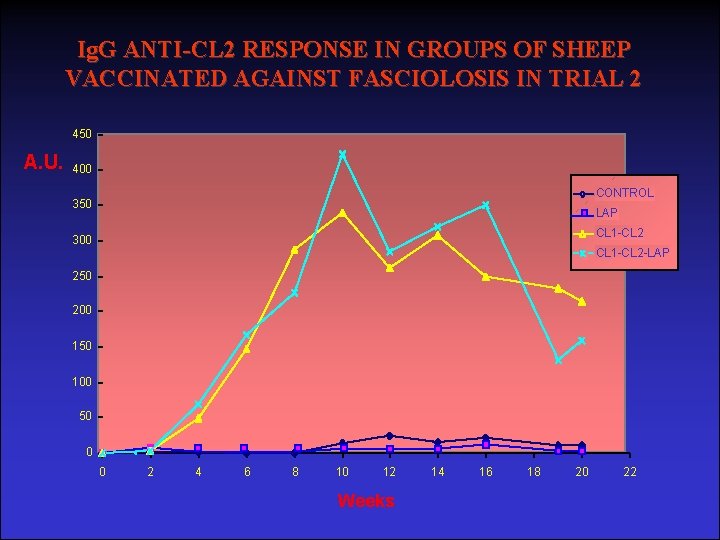
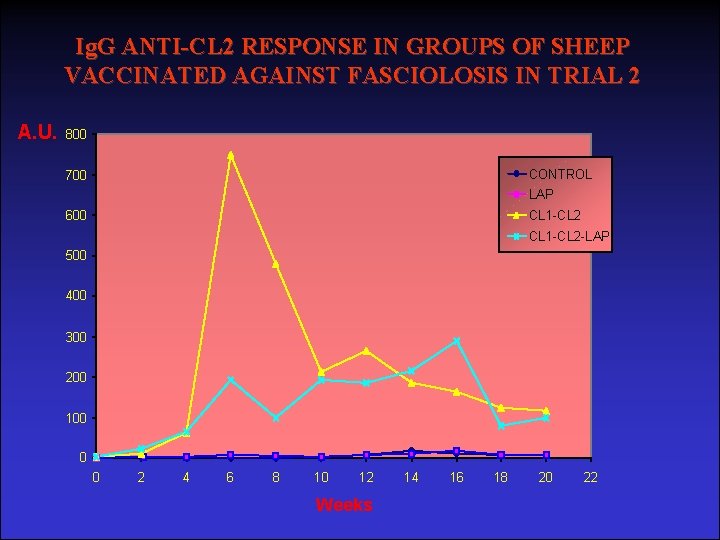
Ig. G ANTI-CL 2 RESPONSE IN GROUPS OF SHEEP VACCINATED AGAINST FASCIOLOSIS IN TRIAL 2 450 A. U. 400 CONTROL 350 LAP CL 1 -CL 2 300 CL 1 -CL 2 -LAP 250 200 150 100 50 0 0 2 4 6 8 10 12 Weeks 14 16 18 20 22

Ig. G ANTI-CL 2 RESPONSE IN GROUPS OF SHEEP VACCINATED AGAINST FASCIOLOSIS IN TRIAL 2 A. U. 800 CONTROL 700 LAP 600 CL 1 -CL 2 -LAP 500 400 300 200 100 0 0 2 4 6 8 10 12 Weeks 14 16 18 20 22

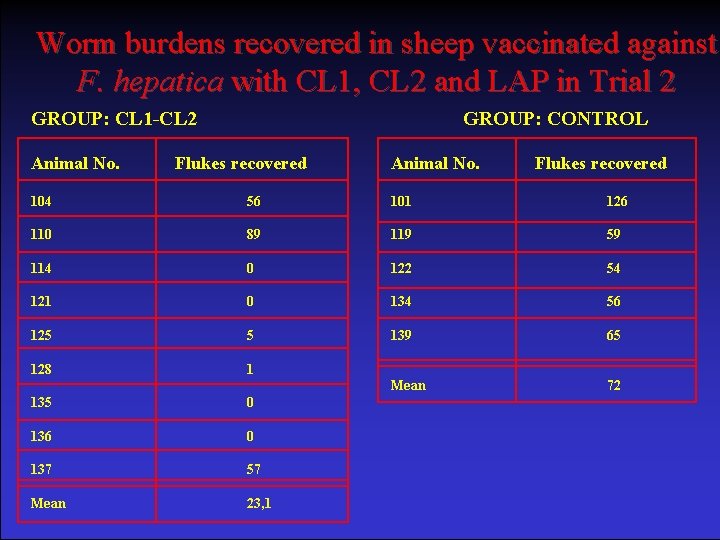
Worm burdens recovered in sheep vaccinated against F. hepatica with CL 1, CL 2 and LAP in Trial 2 GROUP: CL 1 -CL 2 Animal No. GROUP: CONTROL Flukes recovered Animal No. Flukes recovered 104 56 101 126 110 89 119 59 114 0 122 54 121 0 134 56 125 5 139 65 128 1 Mean 72 135 0 136 0 137 57 Mean 23, 1

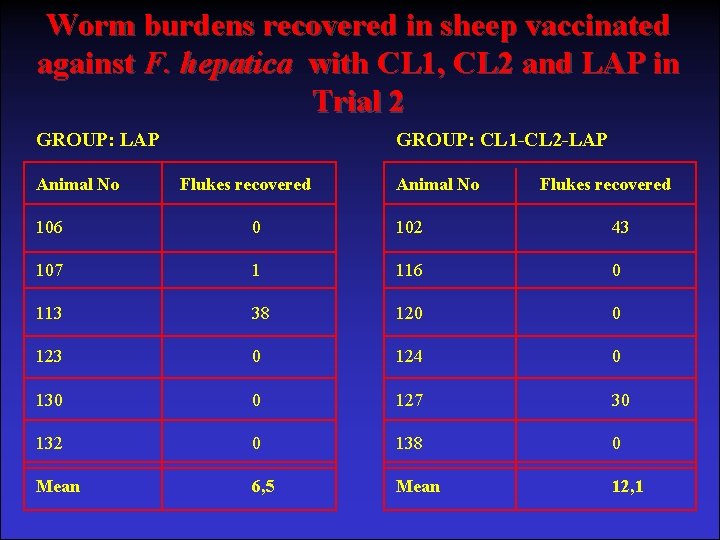
Worm burdens recovered in sheep vaccinated against F. hepatica with CL 1, CL 2 and LAP in Trial 2 GROUP: LAP Animal No GROUP: CL 1 -CL 2 -LAP Flukes recovered Animal No Flukes recovered 106 0 102 43 107 1 116 0 113 38 120 0 123 0 124 0 130 0 127 30 132 0 138 0 Mean 6, 5 Mean 12, 1

Reduction in F. hepatica worm burdens obtained in Trial 2 with CL 1, CL 2 and LAP Group Reduction (%) LAP 89, 6 CL 1 -CL 2 60, 1 CL 1 -CL 2 -LAP 79, 3

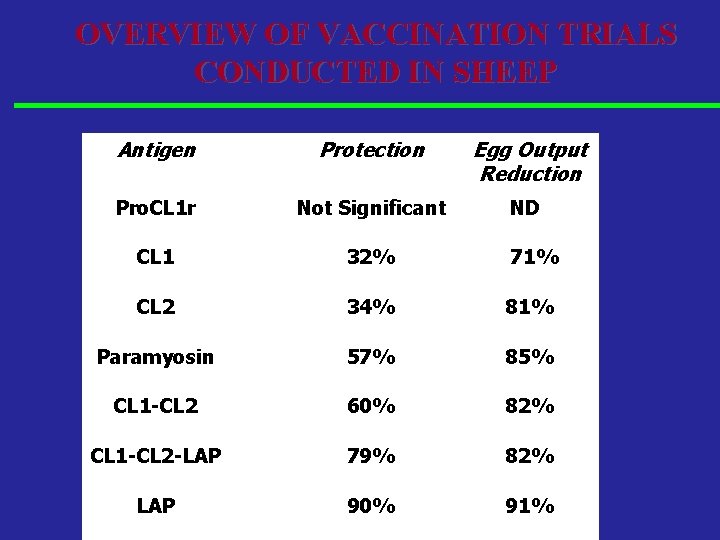
OVERVIEW OF VACCINATION TRIALS CONDUCTED IN SHEEP Antigen Protection Egg Output Reduction Pro. CL 1 r Not Significant ND CL 1 32% 71% CL 2 34% 81% Paramyosin 57% 85% CL 1 -CL 2 60% 82% CL 1 -CL 2 -LAP 79% 82% LAP 90% 91%

Ensayos in vitro muestran una correlación positiva entre la capacidad de inhibición de la actividad enzimática por parte de los anticuerpos LAP específicos y los niveles de protección alcanzados

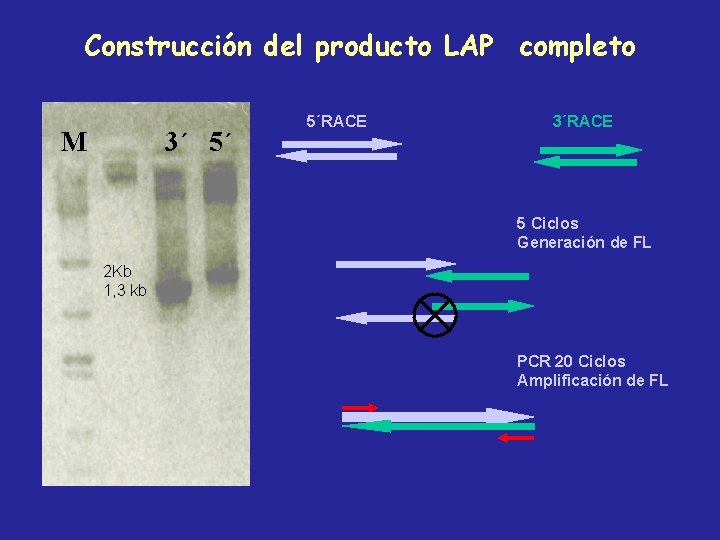
Construcción del producto LAP completo M 3´ 5´ 5´RACE 3´RACE 5 Ciclos Generación de FL 2 Kb 1, 3 kb PCR 20 Ciclos Amplificación de FL

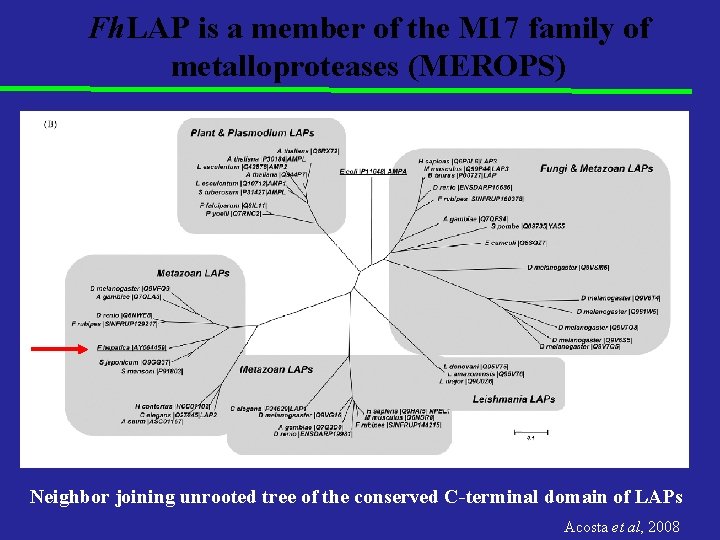
Fh. LAP is a member of the M 17 family of metalloproteases (MEROPS) Neighbor joining unrooted tree of the conserved C-terminal domain of LAPs Acosta et al, 2008

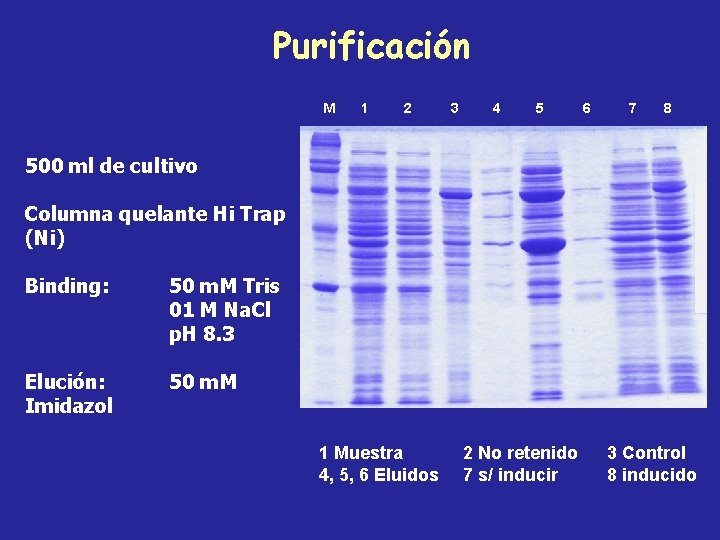
Purificación M 1 2 3 4 5 6 7 8 500 ml de cultivo Columna quelante Hi Trap (Ni) Binding: 50 m. M Tris 01 M Na. Cl p. H 8. 3 Elución: Imidazol 50 m. M 1 Muestra 4, 5, 6 Eluidos 2 No retenido 7 s/ inducir 3 Control 8 inducido

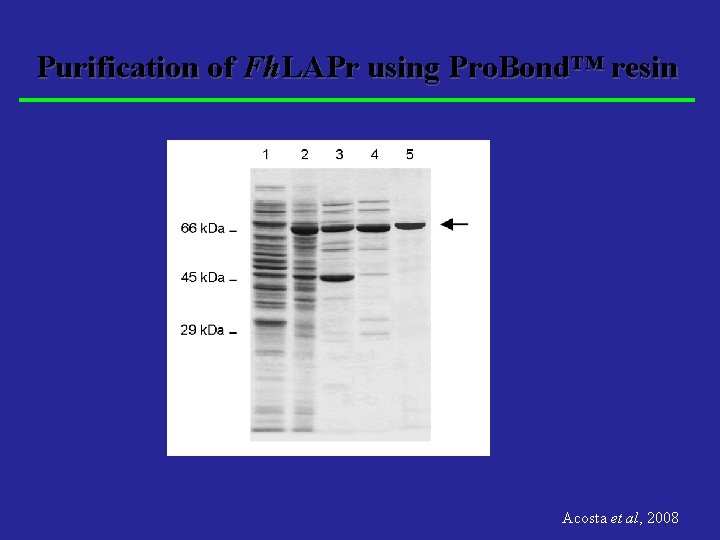
Purification of Fh. LAPr using Pro. Bond™ resin Acosta et al, 2008

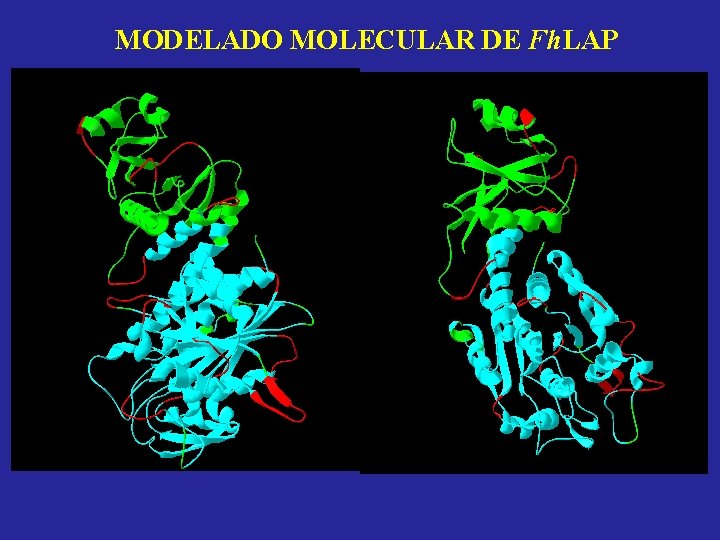
MODELADO MOLECULAR DE Fh. LAP

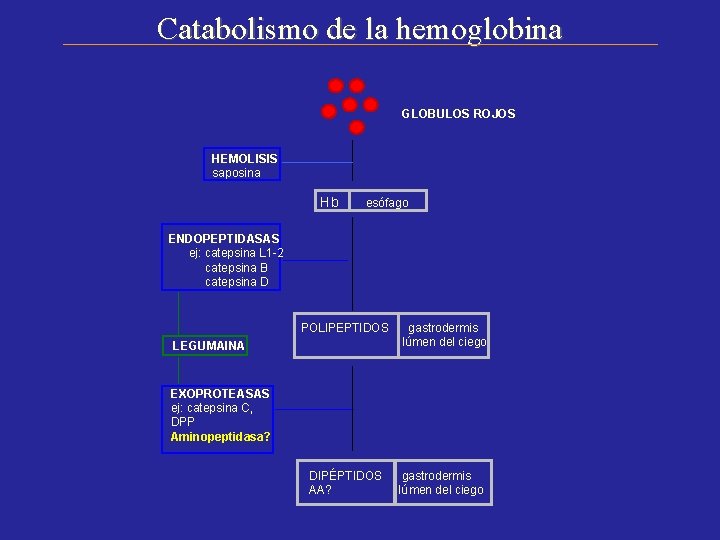
Catabolismo de la hemoglobina GLOBULOS ROJOS HEMOLISIS saposina Hb esófago ENDOPEPTIDASAS ej: catepsina L 1 -2 catepsina B catepsina D POLIPEPTIDOS LEGUMAINA gastrodermis lúmen del ciego EXOPROTEASAS ej: catepsina C, DPP Aminopeptidasa? DIPÉPTIDOS AA? gastrodermis lúmen del ciego

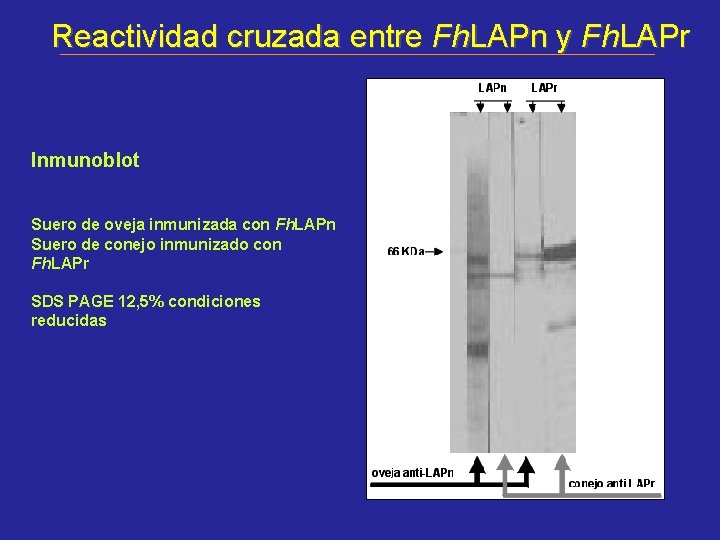
Reactividad cruzada entre Fh. LAPn y Fh. LAPr Inmunoblot Suero de oveja inmunizada con Fh. LAPn Suero de conejo inmunizado con Fh. LAPr SDS PAGE 12, 5% condiciones reducidas

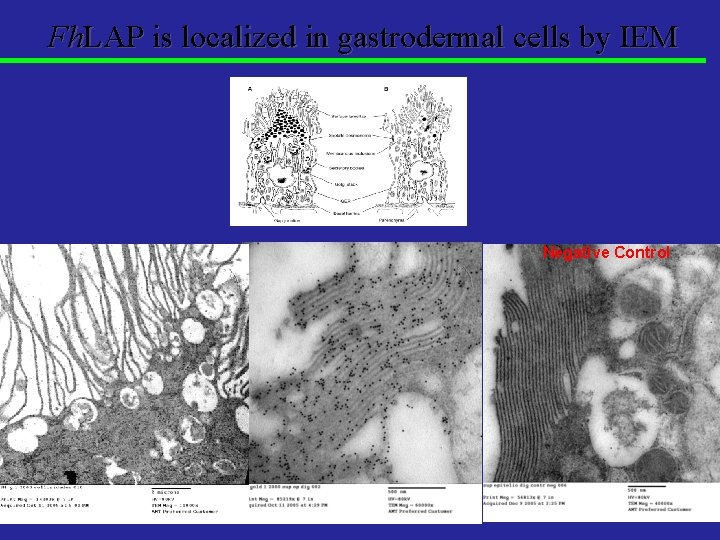
Fh. LAP is localized in gastrodermal cells by IEM Negative Control

Maldi-Tof de Fh. LAPn 14 péptidos 192 residuos reconocidos en 523 36, 7% de cobertura >Fhe. LAPr MAALAVGVSDLSDKRFDVVIFINDDADEGCAKDAAVYEALKSFSKINPNLGSELSIVPFPAHPSGRLIYSPTGALNTDTADIR NVYDAACAGVKRALSMGCHAPLLYLGSLRSASFGFEWMQRKHLLLNALLGAYHALYLPLEVREMRPTTGLKAQHLGVKEDTKG SDELVLRLAMALEEGRWLARDIGGSDPERMAAPRIVDYLKTSLGGMKGITMSVEKVDIQKYPLMAAVNRAASVVARHDGRVVH LKYEPPNPTEVDTTLYLIGKGITYDTGGADIKANGVMAGMHRDKCGAAAIAGLFKTLGELQPPGLSVSAALAFVRNSVGADSY VADEILVARSGQRIRVGNTDAEGRMVMTDLLCEAKEKAINATNPFLFTIATLTGHVVRAYKHYTAVMDNGPPRIHRVSQSLQE AGDRISDMAEISTVRKEDYEFNRGKTEYEDTLQCNNLPSSATPRGHQIPAAFMALASGLDKHGLGSAKPIPYTHVDVAGSATE IHVLPTAAPLLMFASRYVLPRLGFK

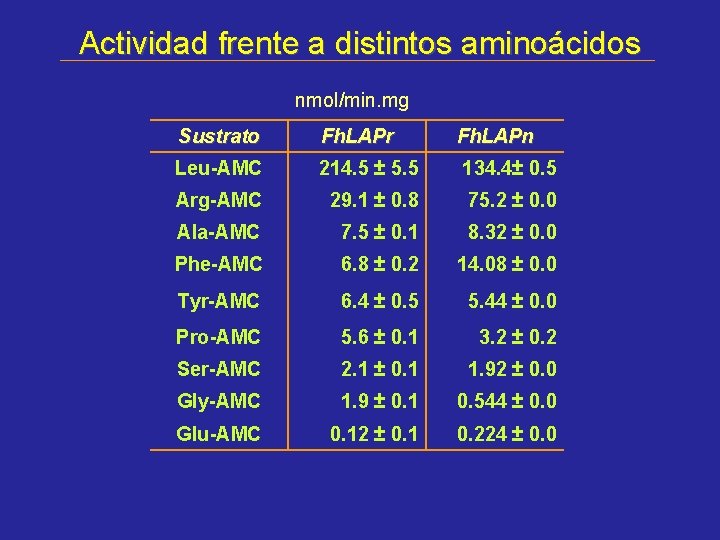
Actividad frente a distintos aminoácidos nmol/min. mg Sustrato Fh. LAPr Fh. LAPn Leu-AMC 214. 5 ± 5. 5 134. 4± 0. 5 Arg-AMC 29. 1 ± 0. 8 75. 2 ± 0. 0 Ala-AMC 7. 5 ± 0. 1 8. 32 ± 0. 0 Phe-AMC 6. 8 ± 0. 2 14. 08 ± 0. 0 Tyr-AMC 6. 4 ± 0. 5 5. 44 ± 0. 0 Pro-AMC 5. 6 ± 0. 1 3. 2 ± 0. 2 Ser-AMC 2. 1 ± 0. 1 1. 92 ± 0. 0 Gly-AMC 1. 9 ± 0. 1 0. 544 ± 0. 0 Glu-AMC 0. 12 ± 0. 1 0. 224 ± 0. 0

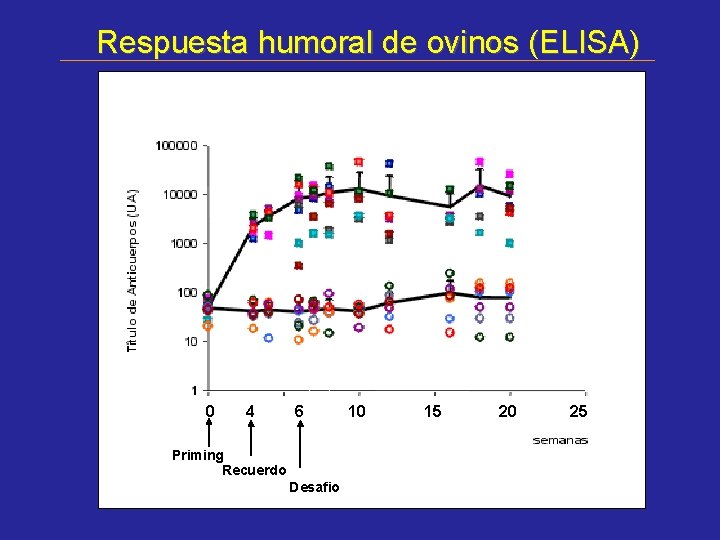
Respuesta humoral de ovinos (ELISA) 0 44 6 Priming Recuerdo Desafio 10 15 20 25

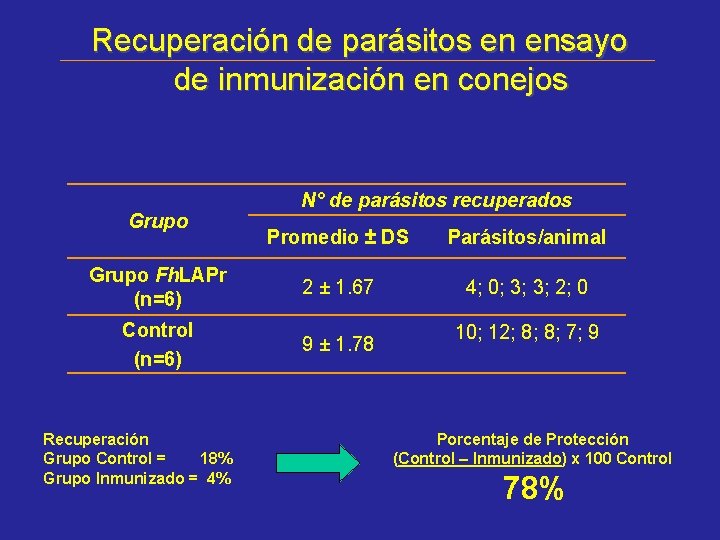
Recuperación de parásitos en ensayo de inmunización en conejos Grupo N° de parásitos recuperados Promedio ± DS Parásitos/animal Grupo Fh. LAPr (n=6) 2 ± 1. 67 4; 0; 3; 3; 2; 0 Control (n=6) 9 ± 1. 78 Recuperación Grupo Control = 18% Grupo Inmunizado = 4% 10; 12; 8; 8; 7; 9 Porcentaje de Protección (Control – Inmunizado) x 100 Control 78%

Vaccine trial using Fh. LAPr mixed with different adjuvants GROUPS FCA + FIA Adyuvac 50 Alum Ribi DEAE-Dextran Control (FCA + FIA) n = 10 Wk 0 Inmumization 100 ug Ag 4 Booster 100 ug Ag 6 Challenge n = 10 n = 10 18 Necropsy 200 metacercariae Maggioli et al, 2011

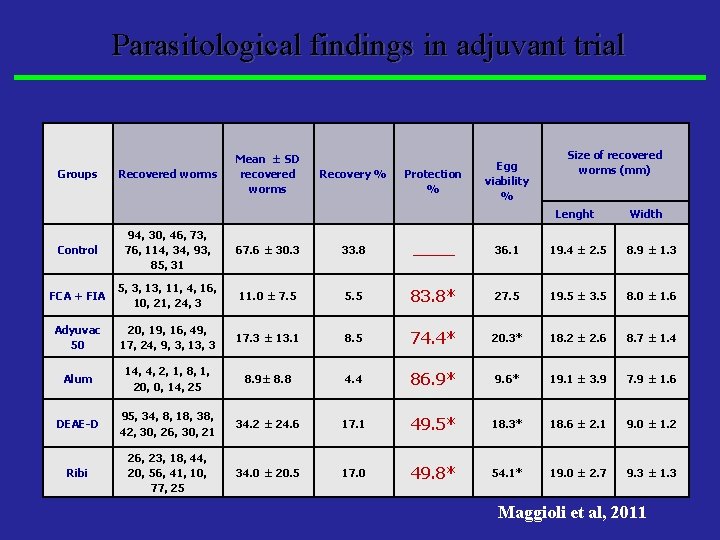
Parasitological findings in adjuvant trial Groups Recovered worms Mean ± SD recovered worms Recovery % Protection % Egg viability % Size of recovered worms (mm) Lenght Width Control 94, 30, 46, 73, 76, 114, 34, 93, 85, 31 67. 6 ± 30. 3 33. 8 ______ 36. 1 19. 4 ± 2. 5 8. 9 ± 1. 3 FCA + FIA 5, 3, 11, 4, 16, 10, 21, 24, 3 11. 0 ± 7. 5 5. 5 83. 8* 27. 5 19. 5 ± 3. 5 8. 0 ± 1. 6 Adyuvac 50 20, 19, 16, 49, 17, 24, 9, 3, 13, 3 17. 3 ± 13. 1 8. 5 74. 4* 20. 3* 18. 2 ± 2. 6 8. 7 ± 1. 4 Alum 14, 4, 2, 1, 8, 1, 20, 0, 14, 25 8. 9± 8. 8 4. 4 86. 9* 9. 6* 19. 1 ± 3. 9 7. 9 ± 1. 6 DEAE-D 95, 34, 8, 18, 38, 42, 30, 26, 30, 21 34. 2 ± 24. 6 17. 1 49. 5* 18. 3* 18. 6 ± 2. 1 9. 0 ± 1. 2 Ribi 26, 23, 18, 44, 20, 56, 41, 10, 77, 25 34. 0 ± 20. 5 17. 0 49. 8* 54. 1* 19. 0 ± 2. 7 9. 3 ± 1. 3 Maggioli et al, 2011

Total Ig. G response against Fh. LAPr in vaccinated groups FCA/FIA Adyuvac 50 Alum DEAE-D RIBI Control Maggioli et al, 2011

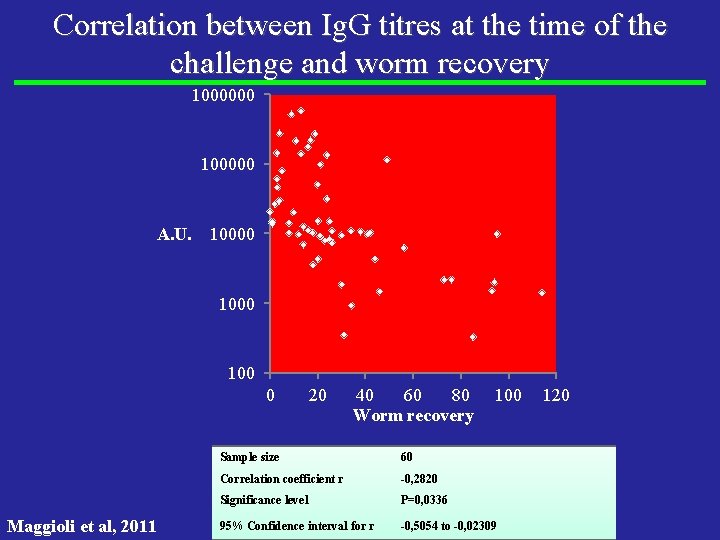
A. U. Worm recovery Sample size 60 Correlation coefficient r -0, 2820 Significance level P=0, 0336 95% Confidence interval for r -0, 5054 to -0, 02309

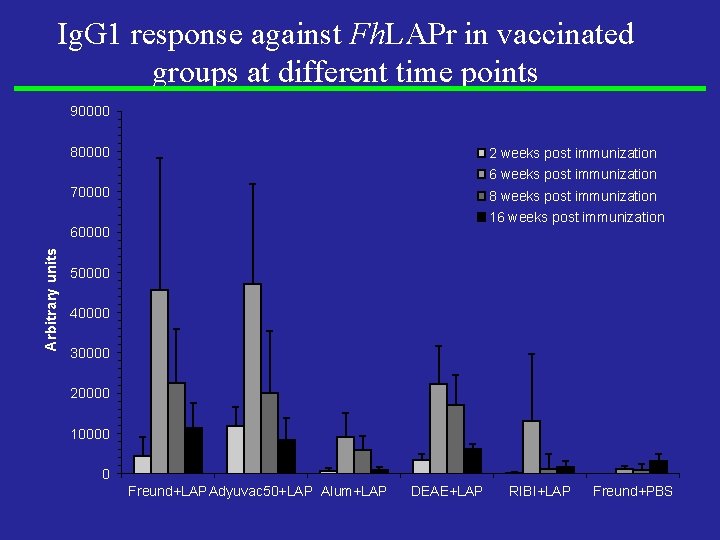
Ig. G 1 response against Fh. LAPr in vaccinated groups at different time points 90000 80000 2 weeks post immunization 6 weeks post immunization 70000 8 weeks post immunization 16 weeks post immunization Arbitrary units 60000 50000 40000 30000 20000 10000 0 Freund+LAP Adyuvac 50+LAP Alum+LAP DEAE+LAP RIBI+LAP Freund+PBS

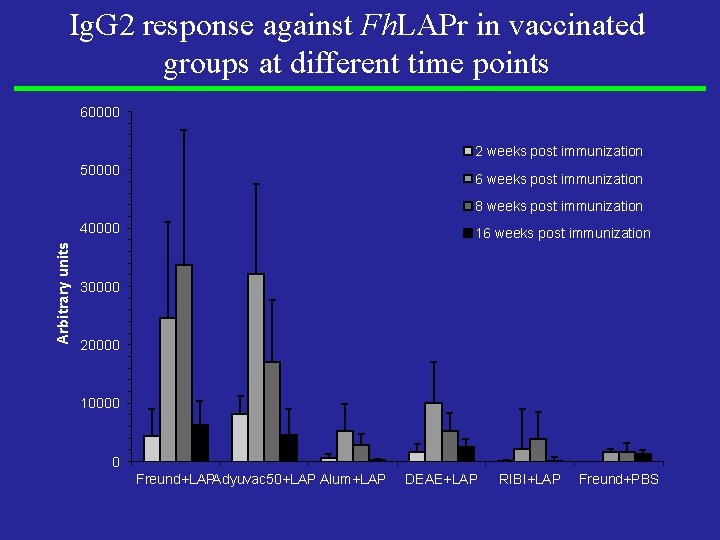
Ig. G 2 response against Fh. LAPr in vaccinated groups at different time points 60000 2 weeks post immunization 50000 6 weeks post immunization 8 weeks post immunization Arbitrary units 40000 16 weeks post immunization 30000 20000 10000 0 Freund+LAPAdyuvac 50+LAP Alum+LAP DEAE+LAP RIBI+LAP Freund+PBS

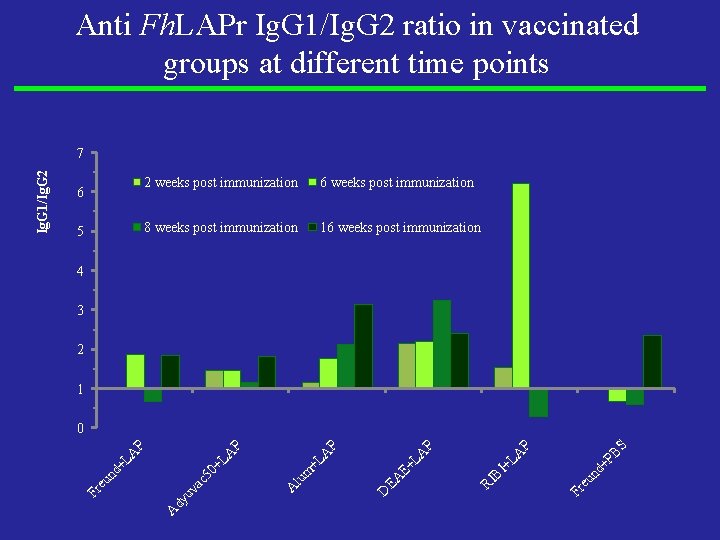
Anti Fh. LAPr Ig. G 1/Ig. G 2 ratio in vaccinated groups at different time points 6 5 2 weeks post immunization 6 weeks post immunization 8 weeks post immunization 16 weeks post immunization 4 3 2 1 PB S P Fr eu nd + A +L A E+ L EA D RI BI P P A m +L lu A 50 +L A dy uv ac A un d+ L A P P 0 Fr e Ig. G 1/Ig. G 2 7

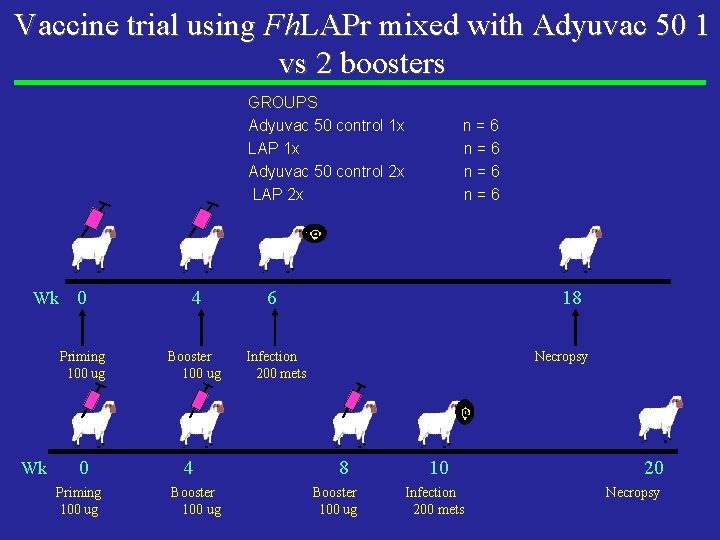
Vaccine trial using Fh. LAPr mixed with Adyuvac 50 1 vs 2 boosters GROUPS Adyuvac 50 control 1 x LAP 1 x Adyuvac 50 control 2 x LAP 2 x Wk Wk 0 4 Priming 100 ug Booster 100 ug 0 Priming 100 ug 4 Booster 100 ug n=6 n=6 6 18 Infection 200 mets Necropsy 8 Booster 100 ug 10 Infection 200 mets 20 Necropsy

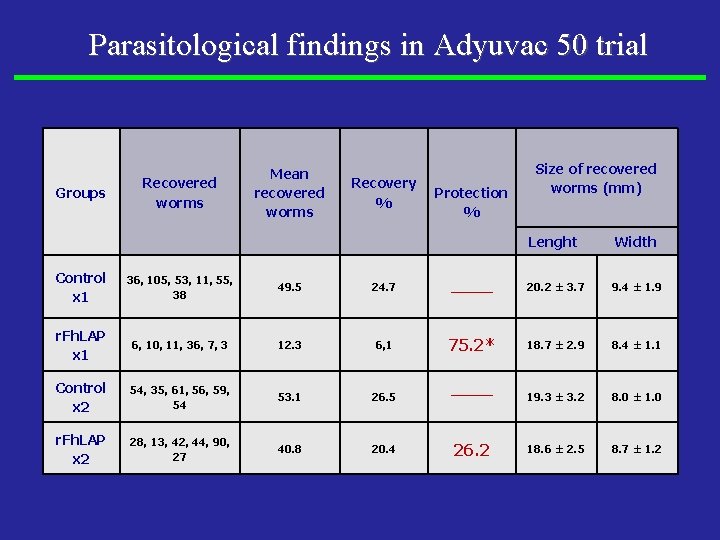
Parasitological findings in Adyuvac 50 trial Groups Recovered worms Mean recovered worms Recovery % Protection % Size of recovered worms (mm) Lenght Width Control x 1 36, 105, 53, 11, 55, 38 49. 5 24. 7 ______ 20. 2 ± 3. 7 9. 4 ± 1. 9 r. Fh. LAP x 1 6, 10, 11, 36, 7, 3 12. 3 6, 1 75. 2* 18. 7 ± 2. 9 8. 4 ± 1. 1 Control x 2 54, 35, 61, 56, 59, 54 53. 1 26. 5 19. 3 ± 3. 2 8. 0 ± 1. 0 r. Fh. LAP x 2 28, 13, 42, 44, 90, 27 40. 8 20. 4 18. 6 ± 2. 5 8. 7 ± 1. 2 ______ 26. 2
 Entamoeba histolytica que produce
Entamoeba histolytica que produce Subreino metazoa
Subreino metazoa Clasificacion de parasitologia
Clasificacion de parasitologia Helmintos taxonomia
Helmintos taxonomia Proteasas
Proteasas Proteasas
Proteasas Emulsificación de grasas
Emulsificación de grasas Exopeptidasas
Exopeptidasas Proteasas
Proteasas Life cycle of fasciola hepatica
Life cycle of fasciola hepatica Peranan echinodermata
Peranan echinodermata Obelia sp
Obelia sp Pradera templada mapamundi
Pradera templada mapamundi Fasciola hepatica
Fasciola hepatica Esquistossomulo
Esquistossomulo Cacing dengan bentuk seperti daun
Cacing dengan bentuk seperti daun Bdelloura
Bdelloura Fasciola hepatica que es
Fasciola hepatica que es Medical
Medical Daur hidup taenia saginata
Daur hidup taenia saginata Siklus hidup fasciola hepatica
Siklus hidup fasciola hepatica Fasciolidae
Fasciolidae Heliplas
Heliplas Fasciola hepatica class
Fasciola hepatica class Fasciola hepatica
Fasciola hepatica Dorsoventrally flattened
Dorsoventrally flattened Democrito de abdera teoria
Democrito de abdera teoria Gerencia participativa
Gerencia participativa Organigrama de recursos humanos de un restaurante
Organigrama de recursos humanos de un restaurante Contrastar
Contrastar Suma o diferencia de cubos
Suma o diferencia de cubos Discusión metodologia
Discusión metodologia Como escribir un reporte
Como escribir un reporte Caso ford pinto
Caso ford pinto Cosa fare in caso di allagamento
Cosa fare in caso di allagamento Conclusão de estudo de caso
Conclusão de estudo de caso Vision tripartita del lenguaje
Vision tripartita del lenguaje Rass escala
Rass escala Formulazione del caso
Formulazione del caso Estudo de caso exemplo
Estudo de caso exemplo Casos prácticos pas primeros auxilios
Casos prácticos pas primeros auxilios Caso especial
Caso especial Tumor vasoproliferativo
Tumor vasoproliferativo Caso especial
Caso especial Antes durante y después de un incendio
Antes durante y después de un incendio Caso clinico asma bronquial
Caso clinico asma bronquial Neutropenia febril
Neutropenia febril Brainly
Brainly Estudio de caso ejemplo
Estudio de caso ejemplo Razão de chance
Razão de chance El caso de hablar miguel angel asturias
El caso de hablar miguel angel asturias Teoría del caso ejemplo
Teoría del caso ejemplo Caso especial
Caso especial Farsa y justicia del corregidor análisis
Farsa y justicia del corregidor análisis Caso fortuito
Caso fortuito Norme di comportamento in caso di terremoto a scuola
Norme di comportamento in caso di terremoto a scuola Exemplos de estudo de caso prontos
Exemplos de estudo de caso prontos Amata per caso
Amata per caso Il caso del piccolo albert
Il caso del piccolo albert