Proteasas Parasitarias Proteasas Definicin Se trata de enzimas




















- Slides: 38

Proteasas Parasitarias


Proteasas Definición • Se trata de enzimas capaces de hidrolizar los enlaces peptídicos (subclase E. C 3. 4) • Proteólisis limitada: limitado número de enlaces hidrolizables • Proteólisis ilimitada: proteasoma, lisosomas

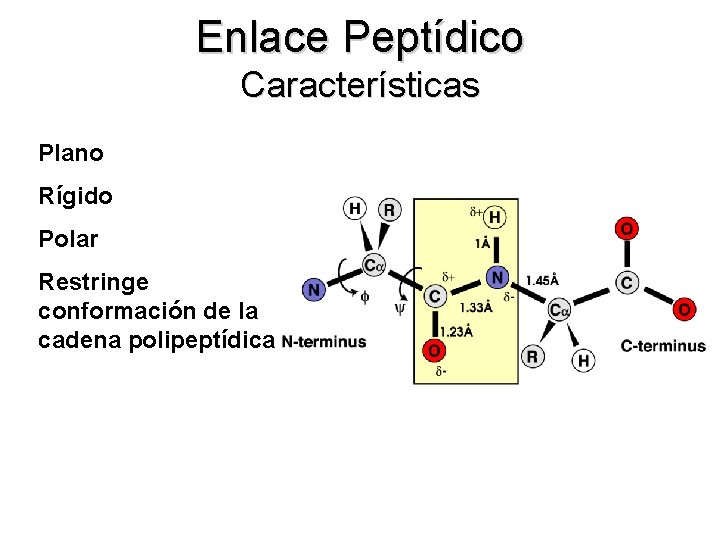
Enlace Peptídico Características Plano Rígido Polar Restringe conformación de la cadena polipeptídica

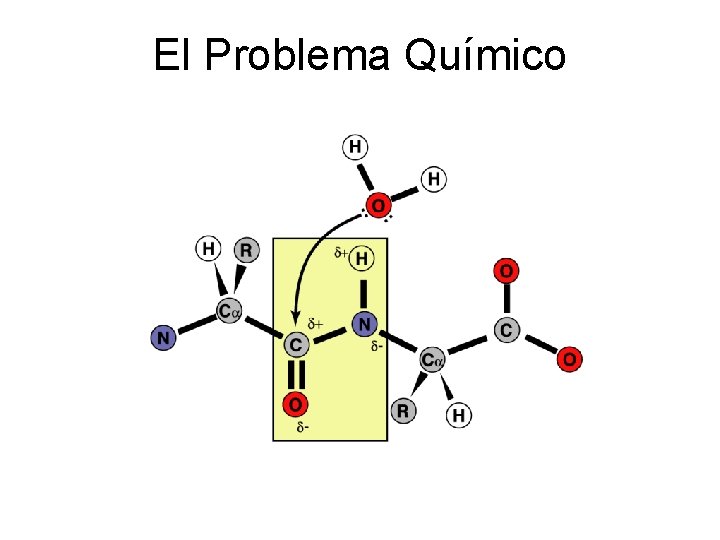
El Problema Químico

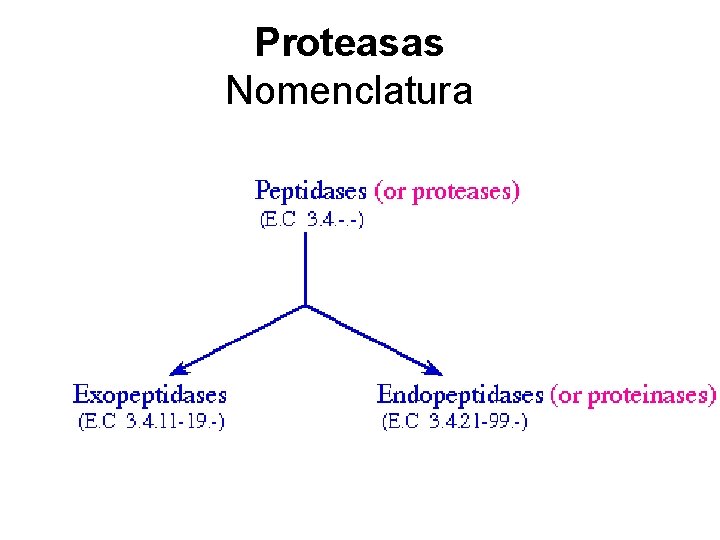
Proteasas Nomenclatura

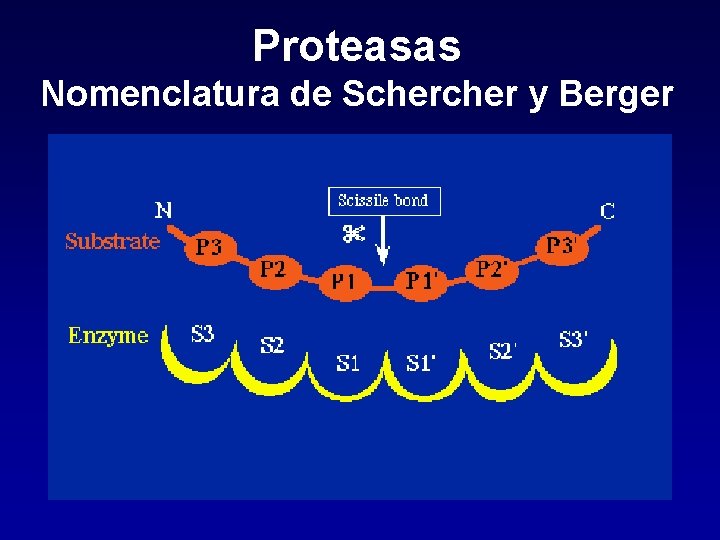
Proteasas Nomenclatura de Scher y Berger

Proteasas Clasificación según mecanismo de acción • • • Serina proteasas Cisteína proteasas Metaloproteasas Aspártico proteasas Treonina proteasas Glutámico proteasas

Proteasas Clasificación • Familia: homología significativa a nivel de secuencia de amino ácidos en la porción catalítica. • Clan: Grupos de familias que han evolucionado a partir de una proteína ancestral. Similitud a nivel de estructura tridimensional

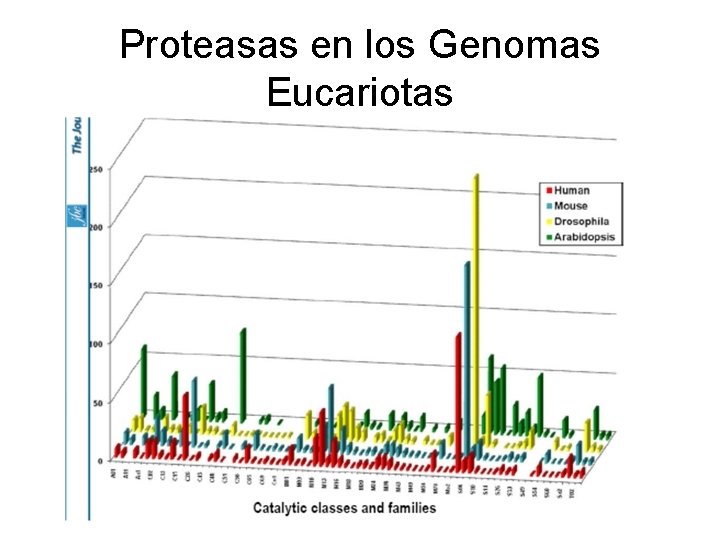
Proteasas en los Genomas Eucariotas

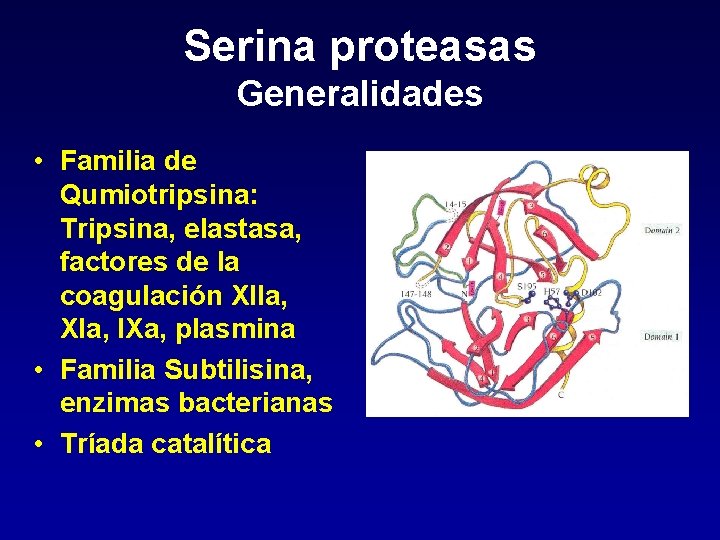
Serina proteasas Generalidades • Familia de Qumiotripsina: Tripsina, elastasa, factores de la coagulación XIIa, XIa, IXa, plasmina • Familia Subtilisina, enzimas bacterianas • Tríada catalítica

Cisteína Proteasas Generalidades Papaína, catepsinas lisosomales B, H y L Calpaínas citosólicas • Díada catalítica: Cis 25, His 159 juegan los mismos roles que Ser e His en serina proteasas

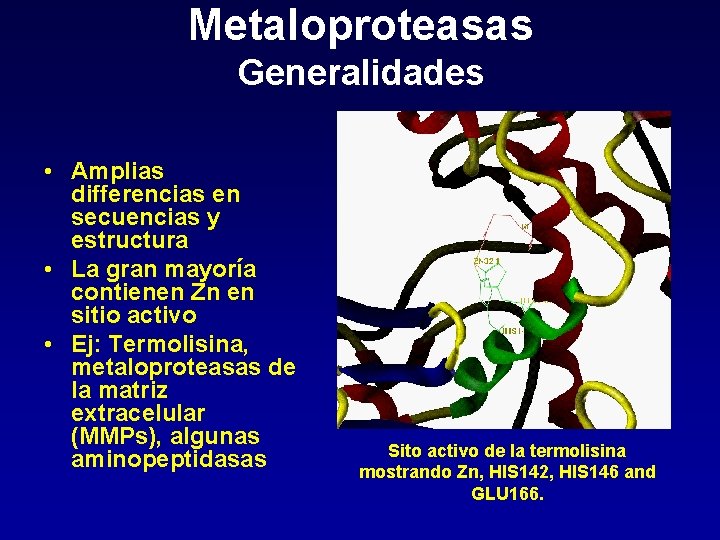
Metaloproteasas Generalidades • Amplias differencias en secuencias y estructura • La gran mayoría contienen Zn en sitio activo • Ej: Termolisina, metaloproteasas de la matriz extracelular (MMPs), algunas aminopeptidasas Sito activo de la termolisina mostrando Zn, HIS 142, HIS 146 and GLU 166.

Aspártico Proteasas Generalidades • Ejemplos: Familia de la Pepsina: catepsina D, renina • Familia de proteasas del HIV (retropepsina). Son monoméricas, por lo que la dimerización se requiere para formar la enzima activa • Se trata de enzimas bilobuladas donde el sitio activo está entre dos lóbulos homólogos. Cada lóbulo contribuye con un aspartato • El p. H óptimo es ácido para la mayoría de las aspártico proteasas, donde un protón está compartido por los dos aspartatos del sitio activo • El agua es activada por los aspartatos para realizar el ataque nucleofílico

Inhibidores de Proteasas Bajo Peso Molecular • Cisteína: E-64, Leupeptin • Serina: Di isopropilfluorofosfato (DFP), PMSF, Benzamidina, Dicloroisocumarina • Metalo: EDTA, EGTA, Fenantrolina, Bestatina • Aspártico: Pepstatina

Inhibidores de Proteasas Inhibidores Naturales • Mas de 100 compuestos naturales identificados • Desde bacterias a animales y plantas • Reversibles o seudo-irreversibles • Impiden acceso al sitio activo • Proteicos, de 50 a 400 aa • Clase específicos excepto familia de αMacroglobulina • Inhibidores de Serina y Cisteína proteasas son los mejor caracterizados. Ej. α-1 antitripsina y cistatinas

Metodología de Estudio Substratos Cromogénicos Estos substratos, al clivarse generan un compuesto cromogénico. La tasa de hidrólisis se mide en Los más utilizados son péptidos 4 -nitroanilides p. NA) y péptidos thioesteres

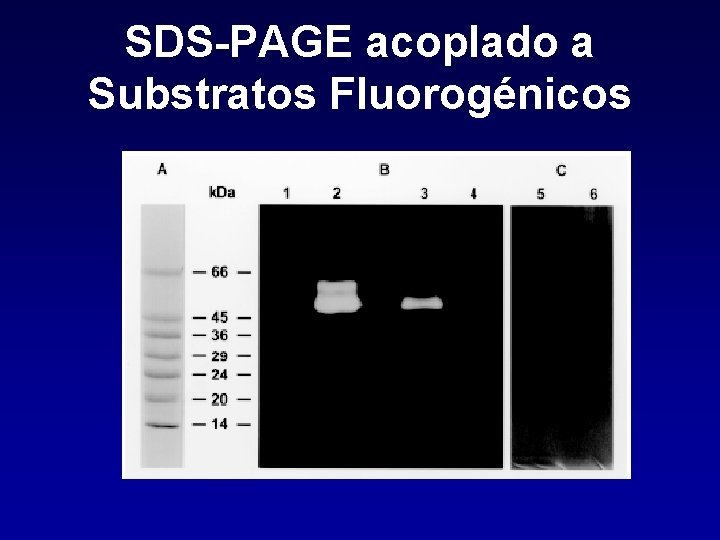
Metodología de Estudio Sustratos Fluorgénicos Generan un compuesto fluorogénico al producirse el clivaje. La tasa de hidrólisis se cuantifica por medio de un espectrofluorómetro o fluorómetro en forma continua o ensayos puntuales. Los sustratos más usados son los que tienen acoplado AMC (peptidyl 4 -metil-7 cumarilamidas).

Metodología de Estudio Sustratos con Quenching intramolecular En estos substratos, la secuencia peptídica separa un grupo fluorescente dador de un grupo aceptor que actúa como mitigador (quencher) de fluorescencia. El fenómeno se llama transferencia de energía resonante. El clivaje del enlace peptídico lleva a separación del par dadoraceptor produciendo un incremento de la fluorescencia. Existen varios pares de dadoraceptor reportadoss, por ej. o-aminobenzoic acid (Abz) como dador y 2, 4 dinitrophenyl (Dnp) como aceptor.

Substratos sintéticos Ejemplos • Cathepsin B Bz-Arg-p. NA Pyr-Phe-Leu-p. NA Z-Arg-p. NA Z-Phe-Arg-p. NA Z-Arg-MCA Z-Phe-Arg-MCA • Cathepsin G Me. OSuc-Ala-Pro-Met-p. NA Suc-Ala-Pro-Phe-p. NA Suc-Ala-Val-Pro-Phe-p. NA Suc-Phe-Leu-Phe-p. NA – • Cathepsin H H-Arg-p. NA Bz-Arg-p. NA H-Arg-MCA • Cathepsin L Z-Phe-Arg-p. NA Z-Phe-Arg-AMC »

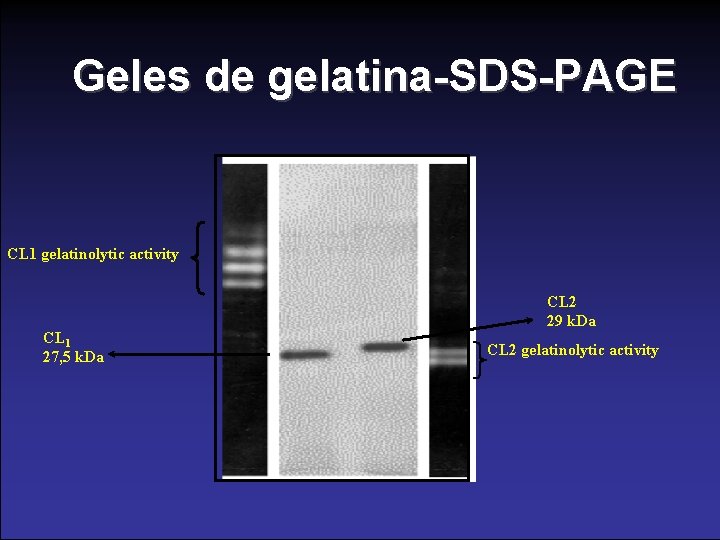
Geles de gelatina-SDS-PAGE CL 1 gelatinolytic activity CL 1 27, 5 k. Da CL 2 29 k. Da CL 2 gelatinolytic activity

SDS-PAGE acoplado a Substratos Fluorogénicos

Acciones de las Proteasas Parasitarias en el Contexto del Parasitismo • • • Invasión Migración Nutrición Evasión de la respuesta inmune Inmunomodulación

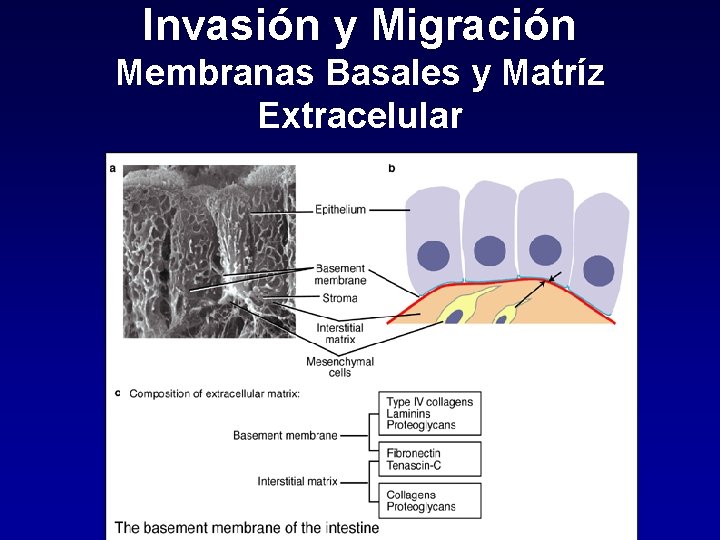
Invasión y Migración Membranas Basales y Matríz Extracelular

Nutrición • Hemoblobina • Proteínas del suero • Proteínas intracelulares • Proteínas extracelulares (MEC)

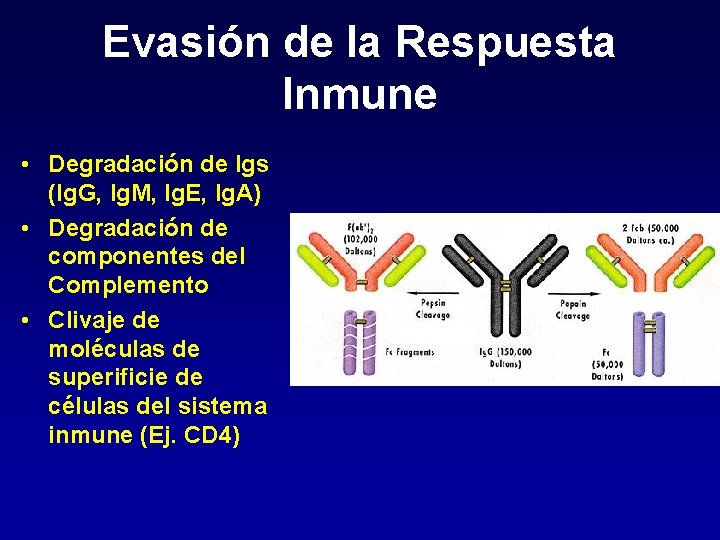
Evasión de la Respuesta Inmune • Degradación de Igs (Ig. G, Ig. M, Ig. E, Ig. A) • Degradación de componentes del Complemento • Clivaje de moléculas de superificie de células del sistema inmune (Ej. CD 4)

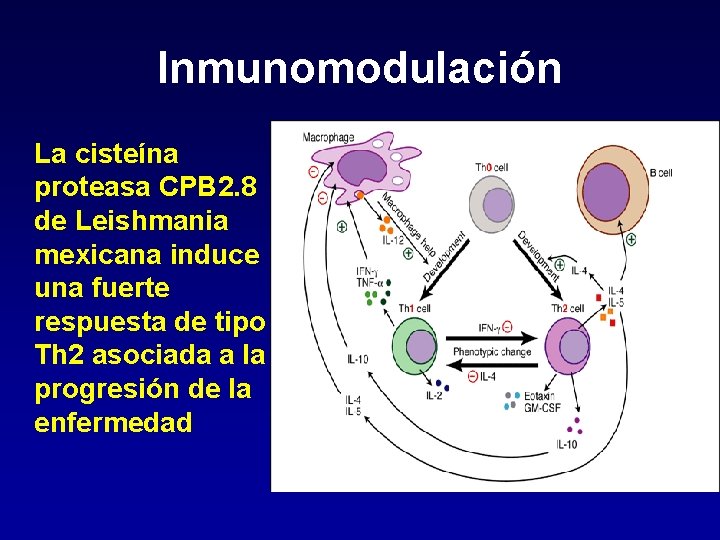
Inmunomodulación La cisteína proteasa CPB 2. 8 de Leishmania mexicana induce una fuerte respuesta de tipo Th 2 asociada a la progresión de la enfermedad

Enfermedad de Chagas • Causada por el flagelado Trypanosoma cruzi • Parásito heteroxeno • 3 formas: Forma replicativa intracelular obligatoria amastigote, forma tripomastigote circulante y forma epimastigota replicativa en el insecto vector

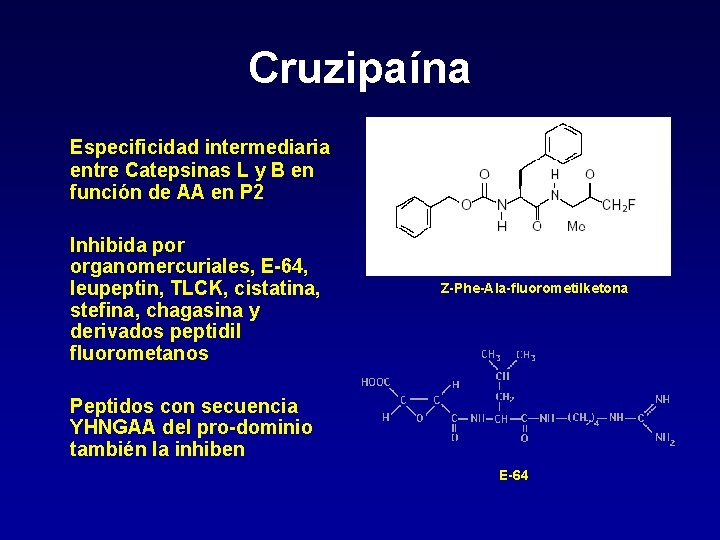
Cruzipaína Responsable de la actividad cisteína proteasa más promienente de T. Cruzi Se expresa en todos los estadíos parasitarios La mayoría tiene localización lisosomal, pero hay isoformas asociadas a membrana plasmática y habría alguna secretada Endoproteasa, digiere proteínas como caseína, SAP, hemoglobina y sustratos sintéticos a p. H 7 -9. Prefiere Arg o Lys en P 1 y un hidrofóbico o con carga + en P 2 (Leu>Tyr>Phe>Val)

Cruzipaína Especificidad intermediaria entre Catepsinas L y B en función de AA en P 2 Inhibida por organomercuriales, E-64, leupeptin, TLCK, cistatina, stefina, chagasina y derivados peptidil fluorometanos Z-Phe-Ala-fluorometilketona Peptidos con secuencia YHNGAA del pro-dominio también la inhiben E-64

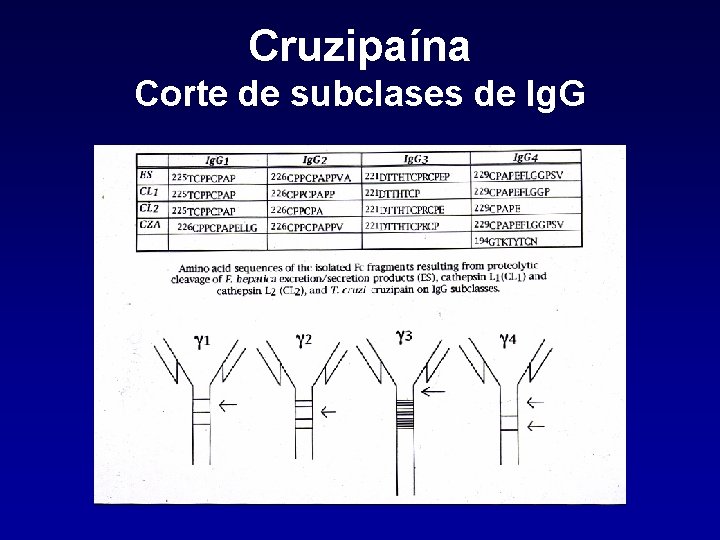
Cruzipaína Corte de subclases de Ig. G

Malaria • Causada por protozoarios apicomplexa del género Plasmodium • 300 millones de infectados, más de un millón de muertes anuales • Ciclo complejo, transmitidos por vector invertebrado (mosquito Anopheles)

Proteasas de Plasmodium en la Digestión de la Hemoglobina Se desarrolla en la vacuola alimenticia Consume el 75% de la Hb Se producen pequeños péptidos pero no AA por lo que existirían transportadores Las Plasmepsinas I - IV son aspártico proteasas implicadas en la primera fase de la digestión Las Falcipaínas I y II son cisteína proteasas que degradan los polipéptidos grandes generados La Falcilysina, una metaloproteasa de la familia M 16, degrada los pequeños péptidos Una aminopeptidasa citosólica completaría el proceso produciendo AA libres

Plasmepsinas Nutrición • Degradación inicial de Hb nativa (plasmepsina I) • Clivan enlace Leu 203 -His 204 en región bisagra de cadena α

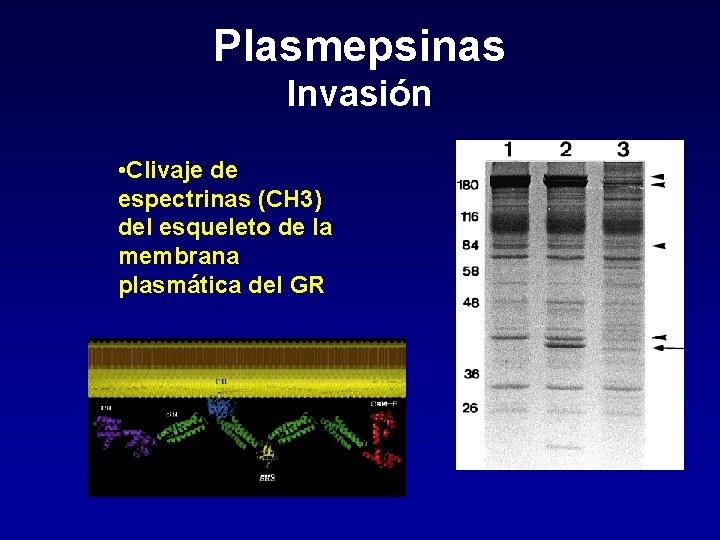
Plasmepsinas Invasión • Clivaje de espectrinas (CH 3) del esqueleto de la membrana plasmática del GR

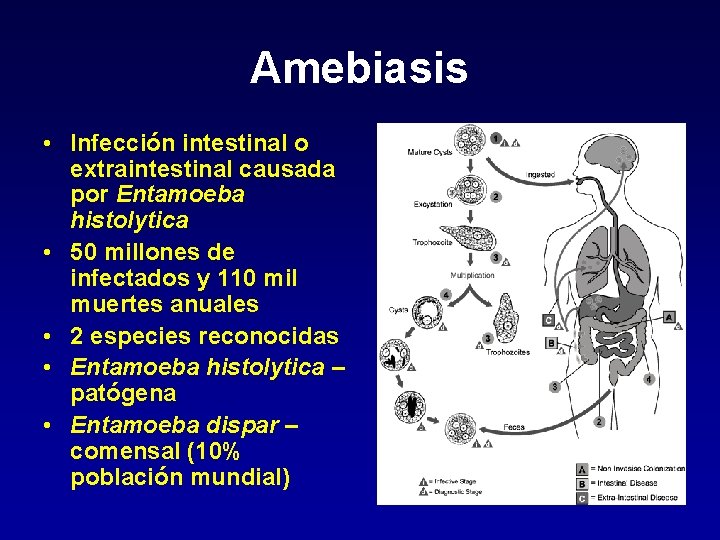
Amebiasis • Infección intestinal o extraintestinal causada por Entamoeba histolytica • 50 millones de infectados y 110 mil muertes anuales • 2 especies reconocidas • Entamoeba histolytica – patógena • Entamoeba dispar – comensal (10% población mundial)

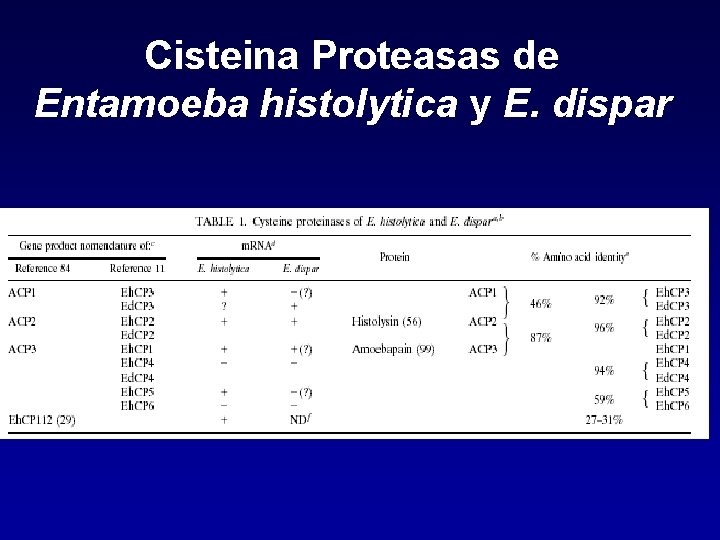
Cisteina Proteasas de Entamoeba histolytica y E. dispar

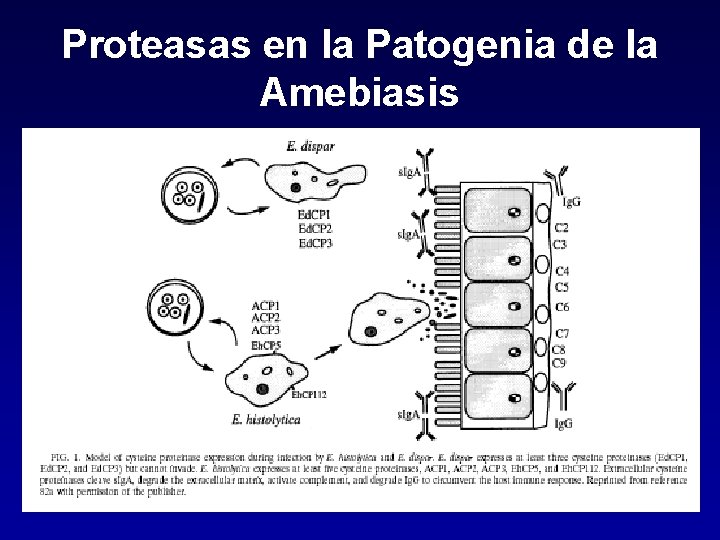
Proteasas en la Patogenia de la Amebiasis
 Alfa-cetoácidos
Alfa-cetoácidos Tipos de contenido gástrico
Tipos de contenido gástrico Proteasas
Proteasas Ch3ch2h2o
Ch3ch2h2o Proteasas
Proteasas Definici9
Definici9 Los monemas
Los monemas Definicin de derecho
Definicin de derecho Cultura aprendida
Cultura aprendida Imagenes
Imagenes Sexo definicin
Sexo definicin Definicin
Definicin Definicin de cultura
Definicin de cultura Definicin de estado
Definicin de estado El amor quevedo
El amor quevedo Definicin
Definicin Definicin
Definicin Puntos cardinales chile
Puntos cardinales chile Comedia griega
Comedia griega Caracteristicas del cantar del mio cid
Caracteristicas del cantar del mio cid Buscarla
Buscarla Las oscuras golondrinas
Las oscuras golondrinas Do que se trata essa imagem
Do que se trata essa imagem Espacio y tiempo de la celestina
Espacio y tiempo de la celestina La lluvia – arturo uslar pietrí
La lluvia – arturo uslar pietrí ¿de qué crees que tratará el texto?
¿de qué crees que tratará el texto? Em tomamos 3 garrafas de coca-cola temos
Em tomamos 3 garrafas de coca-cola temos Tematica del mio cid
Tematica del mio cid Factor comun de 4m52-20am
Factor comun de 4m52-20am Figuras retoricas de sor juana ines dela cruz
Figuras retoricas de sor juana ines dela cruz A mi me gusta a mi me encanta dios
A mi me gusta a mi me encanta dios Efesios de que trata
Efesios de que trata Cuáles son las características del aprendizaje
Cuáles son las características del aprendizaje De que trata
De que trata Bucles en visual basic
Bucles en visual basic Cuatro respuestas autobiográficas
Cuatro respuestas autobiográficas Análisis literario de espejo de paciencia
Análisis literario de espejo de paciencia Pentateuco
Pentateuco Caracteristicas de layo
Caracteristicas de layo