Enzimas Marta Gutirrez del Campo Enzimas Las enzimas








- Slides: 17

Enzimas Marta Gutiérrez del Campo

Enzimas Las enzimas en biología sirven para controlar, acelerándolas, las reacciones químicas. Son sustancias de naturaleza proteica que catalizan reacciones químicas siempre que sea termodinámicamente posible. En estas reacciones, las moléculas sobre las que actúa la enzima en el comienzo del proceso son llamadas sustratos, y estas los convierten en diferentes moléculas, los productos. Casi todos los procesos en las células necesitan enzimas para que ocurran en tasas significativas. A las reacciones mediadas por enzimas se las denomina reacciones enzimáticas

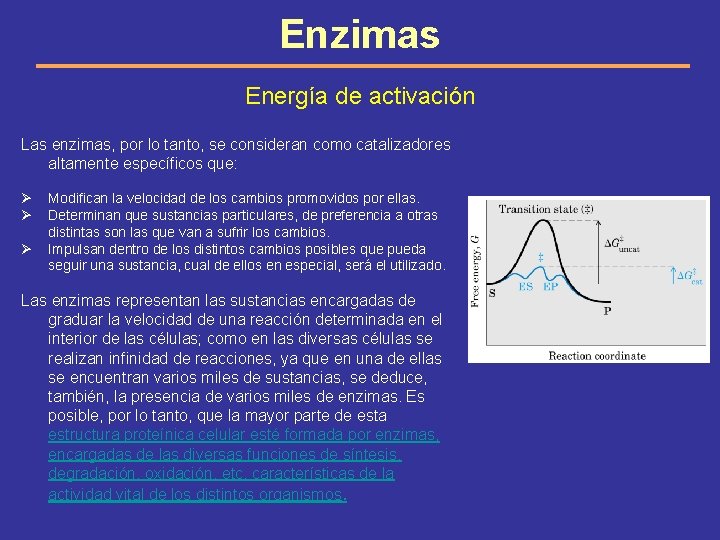
Enzimas Energía de activación Las enzimas, por lo tanto, se consideran como catalizadores altamente específicos que: Ø Ø Ø Modifican la velocidad de los cambios promovidos por ellas. Determinan que sustancias particulares, de preferencia a otras distintas son las que van a sufrir los cambios. Impulsan dentro de los distintos cambios posibles que pueda seguir una sustancia, cual de ellos en especial, será el utilizado. Las enzimas representan las sustancias encargadas de graduar la velocidad de una reacción determinada en el interior de las células; como en las diversas células se realizan infinidad de reacciones, ya que en una de ellas se encuentran varios miles de sustancias, se deduce, también, la presencia de varios miles de enzimas. Es posible, por lo tanto, que la mayor parte de esta estructura proteínica celular esté formada por enzimas, encargadas de las diversas funciones de síntesis, degradación, oxidación, etc. características de la actividad vital de los distintos organismos.

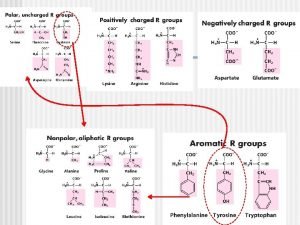
Enzimas Funciones Es de destacar que las enzimas son específicas. 1. Una enzima puede actuar sobre un substrato o un grupo de substratos relacionados (especificidad de substrato) pero no sobre otros. 2. Otras enzimas, sin embargo, tienen especificidad de acción al realizar una acción determinada pero sobre múltiples substratos; Debido a esta especificidad de las enzimas existen en la célula miles de enzimas diferentes. La especificidad de las enzimas ha llevado a comparar a éstas con llaves y a los substratos con cerraduras (modelo de la llave y la cerradura).

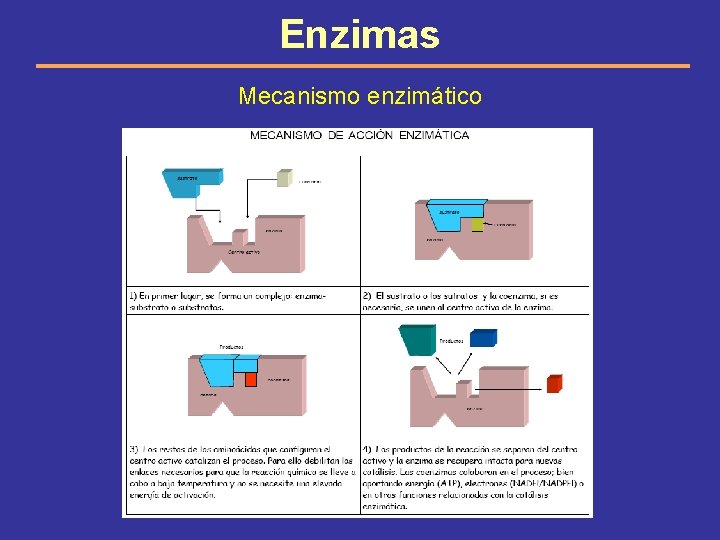
Enzimas Mecanismo enzimático

Enzimas Cofactores Un cofactor es un componente no proteico, termoestable y de baja masa molecular, necesario para la acción de una enzima. El cofactor se une a una estructura proteica denominada apoenzima, y a este complejo se le denomina holoenzima. Entre los cofactores mencionables se encuentran: Iones metálicos (Fe 2+, Cu 2+, K+, Mn 2+, Mg 2+, entre otros) y moléculas orgánicas ó coenzimas. El ion metálico puede actuar como: ØCentro catalítico primario ØGrupo puente para reunir el sustrato y la enzima, formando un complejo de coordinación ØAgente estabilizante de la conformación de la proteína enzimática en su forma catalíticamente activa Los enzimas que precisan de iones metálicos se llaman a veces metaloenzimas.

Enzimas Coenzimas Los coenzimas son cofactores orgánicos no proteicos, termoestables, que unidos a una apoenzima constituyen la holoenzima o forma catalíticamente activa de la enzima. Tienen en general baja masa molecular (al menos comparada con la apoenzima) y son claves en el mecanismo de catálisis, por ejemplo, aceptando o donando electrones o grupos funcionales, que transportan de un enzima a otro. A diferencia de las enzimas, los coenzimas se modifican y consumen durante la reacción química; por ejemplo, el NAD+ se reduce a NADH cuando acepta dos electrones (y un protón) y por tanto se agota; cuando el NADH libera sus electrones se recupera el NAD+, que de nuevo puede actuar como coenzima.

Enzimas Mecanismos de acción de las coenzimas El mecanismo de acción básico de los coenzimas es el siguiente: 1. 2. 3. 4. 5. 6. 7. El coenzima se une a un enzima, El enzima capta su substrato específico, El enzima ataca a dicho substrato, arrancándole algunos de sus átomos, El enzima cede al coenzima dichos átomos provenientes del substrato, El coenzima acepta dichos átomos y se desprende del enzima. El coenzima no es el aceptor final de esos átomos, sino que debe liberarlos tarde o temprano, El coenzima transporta dichos átomos y acaba cediéndolos, recuperando así su capacidad para aceptar nuevos átomos. Este último paso es esencial para no agotar la dotación de coenzimas de una célula ya que las enzimas junto con las que actúa no pueden realizar la reacción química sin el concurso de su coenzima. Algunos coenzimas están fuerte y permanentemente unidos a su enzima, constituyendo en la práctica un grupo prostético; tal es el caso del FMN al enzima NADH deshidrogenasa o el FAD a la succinato deshidrogenasa. Cada coenzima está especializado en aceptar y transportar un tipo de átomos determinado; unos aceptan hidrógenos, otros grupos acetilo, amino, etc. No obstante, los coenzimas no son nada específicos respecto a los enzimas a los que se unen, de modo que un mismo coenzima puede unirse a un gran número de enzimas distintos y es por ello que el número de coenzimas diferentes es relativamente bajo.

Enzimas Coenzimas importantes 1. 2. 3. 4. 5. FAD (flavín-adenín dinucleótido): transferencia de electrones y protones. FMN (Flavín mononucleótido): transferencia de electrones y protones. NAD+(nicotín-adenín dinucleótido): transferencia de electrones y protones. NADP+ (nicotín-adenín dinucleótido fosfato): transferencia de electrones y protones. Coenzima A: transferencia de grupos acetilo (por ejemplo, en la descarboxilación del ácido pirúvico). 6. 7. 8. Coenzima Q: transferencia de electrones en la cadena respiratoria. Coenzima B 12: transferencia de grupos metilo o hidrógenos entre moléculas. TPP (Pirofosfato de tiamina): transferencia de grupos aldehido; forma parte, entre otros, del complejo piruvato deshidrogenasa. 9. Vitamina C 10. PLP (fosfato de piridoxal): transferencia de grupos amino. 11. PMP (fosfato de piridoxamina): transferencia de grupos amino. 12. FH 4 (ácido tetrahidrofólico): transferencia de grupos formilo, metenilo y metileno. 13. Biocitina: transferencia de dióxido de carbono. 14. Ácido lipoico: transferencia de hidrógenos, grupos acilo y metilamina.

Enzimas Factores que condicionan la actividad enzimática La actividad es afectada por: 1. La temperatura La elevación de la temperatura incrementa la velocidad de una reacción catalizada por enzimas. Al principio la velocidad de reacción aumenta cuando la temperatura se eleva debido al incremento de la energía cinética de la energía de las moléculas reactantes.

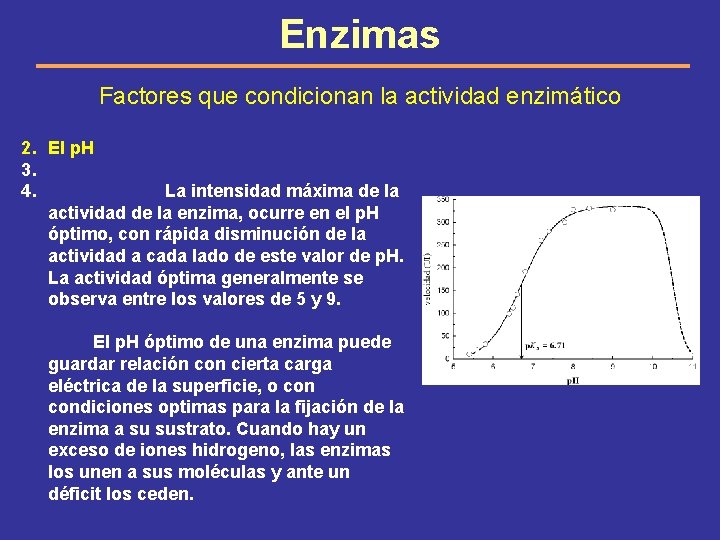
Enzimas Factores que condicionan la actividad enzimático 2. El p. H 3. 4. La intensidad máxima de la actividad de la enzima, ocurre en el p. H óptimo, con rápida disminución de la actividad a cada lado de este valor de p. H. La actividad óptima generalmente se observa entre los valores de 5 y 9. El p. H óptimo de una enzima puede guardar relación con cierta carga eléctrica de la superficie, o condiciones optimas para la fijación de la enzima a su sustrato. Cuando hay un exceso de iones hidrogeno, las enzimas los unen a sus moléculas y ante un déficit los ceden.

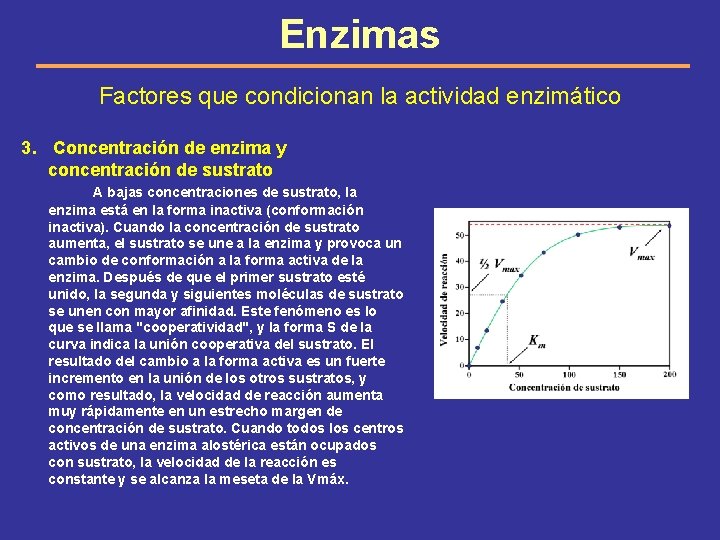
Enzimas Factores que condicionan la actividad enzimático 3. Concentración de enzima y concentración de sustrato A bajas concentraciones de sustrato, la enzima está en la forma inactiva (conformación inactiva). Cuando la concentración de sustrato aumenta, el sustrato se une a la enzima y provoca un cambio de conformación a la forma activa de la enzima. Después de que el primer sustrato esté unido, la segunda y siguientes moléculas de sustrato se unen con mayor afinidad. Este fenómeno es lo que se llama "cooperatividad", y la forma S de la curva indica la unión cooperativa del sustrato. El resultado del cambio a la forma activa es un fuerte incremento en la unión de los otros sustratos, y como resultado, la velocidad de reacción aumenta muy rápidamente en un estrecho margen de concentración de sustrato. Cuando todos los centros activos de una enzima alostérica están ocupados con sustrato, la velocidad de la reacción es constante y se alcanza la meseta de la Vmáx.

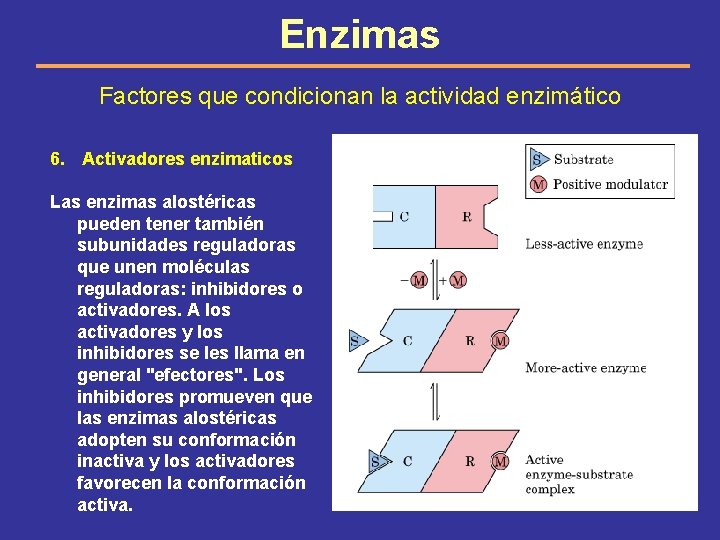
Enzimas Factores que condicionan la actividad enzimático 6. Activadores enzimaticos Las enzimas alostéricas pueden tener también subunidades reguladoras que unen moléculas reguladoras: inhibidores o activadores. A los activadores y los inhibidores se les llama en general "efectores". Los inhibidores promueven que las enzimas alostéricas adopten su conformación inactiva y los activadores favorecen la conformación activa.

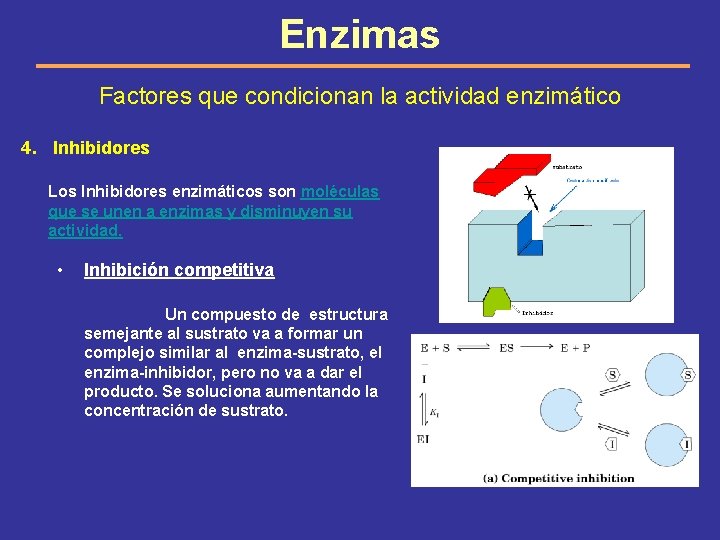
Enzimas Factores que condicionan la actividad enzimático 4. Inhibidores Los Inhibidores enzimáticos son moléculas que se unen a enzimas y disminuyen su actividad. • Inhibición competitiva Un compuesto de estructura semejante al sustrato va a formar un complejo similar al enzima-sustrato, el enzima-inhibidor, pero no va a dar el producto. Se soluciona aumentando la concentración de sustrato.

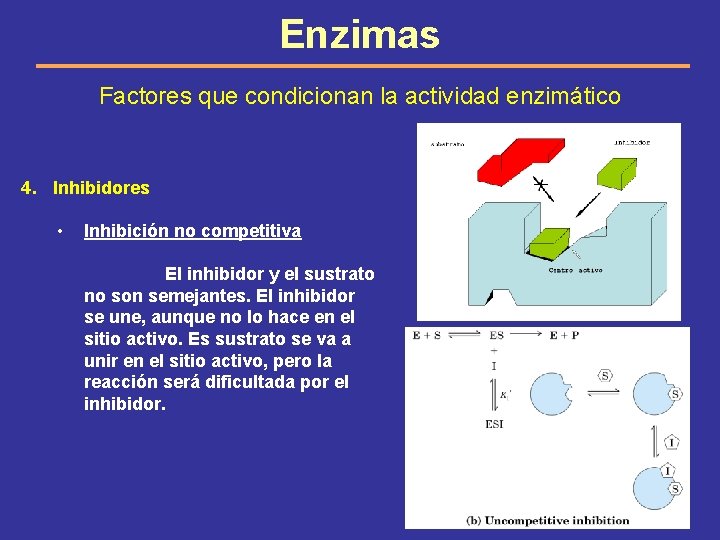
Enzimas Factores que condicionan la actividad enzimático 4. Inhibidores • Inhibición no competitiva El inhibidor y el sustrato no son semejantes. El inhibidor se une, aunque no lo hace en el sitio activo. Es sustrato se va a unir en el sitio activo, pero la reacción será dificultada por el inhibidor.

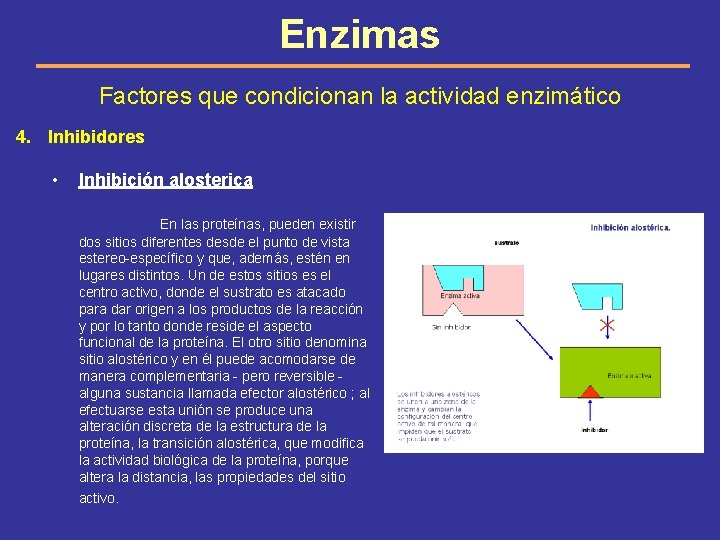
Enzimas Factores que condicionan la actividad enzimático 4. Inhibidores • Inhibición alosterica En las proteínas, pueden existir dos sitios diferentes desde el punto de vista estereo-específico y que, además, estén en lugares distintos. Un de estos sitios es el centro activo, donde el sustrato es atacado para dar origen a los productos de la reacción y por lo tanto donde reside el aspecto funcional de la proteína. El otro sitio denomina sitio alostérico y en él puede acomodarse de manera complementaria - pero reversible alguna sustancia llamada efector alostérico ; al efectuarse esta unión se produce una alteración discreta de la estructura de la proteína, la transición alostérica, que modifica la actividad biológica de la proteína, porque altera la distancia, las propiedades del sitio activo.

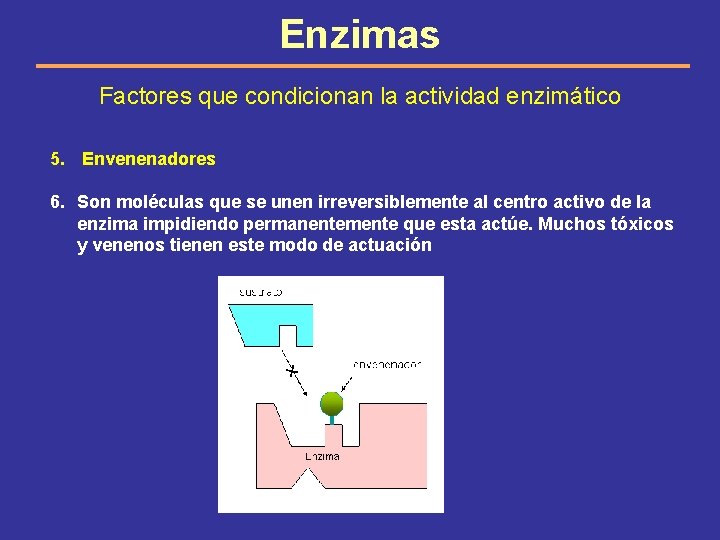
Enzimas Factores que condicionan la actividad enzimático 5. Envenenadores 6. Son moléculas que se unen irreversiblemente al centro activo de la enzima impidiendo permanentemente que esta actúe. Muchos tóxicos y venenos tienen este modo de actuación
 Autor
Autor Monserrat gutirrez
Monserrat gutirrez Monserrat gutirrez
Monserrat gutirrez Esterilizadores discontinuos
Esterilizadores discontinuos Poesia de la amapola
Poesia de la amapola Central university of las villas
Central university of las villas Catálisis enzimática ejemplos
Catálisis enzimática ejemplos Como se clasifican las enzimas
Como se clasifican las enzimas Como actúan las enzimas
Como actúan las enzimas Concentracion de enzimas
Concentracion de enzimas Metabolismo de nucleótidos
Metabolismo de nucleótidos Inhibidor enzimatico ejemplos
Inhibidor enzimatico ejemplos Objetivos de las enzimas
Objetivos de las enzimas Enzimas clasificacion y funcion
Enzimas clasificacion y funcion Enzimas introducción
Enzimas introducción Nomenclatura de enzimas
Nomenclatura de enzimas Retroinhibicion
Retroinhibicion Enzima
Enzima