Tema 7 Enzimas DEFINICIN n LAS ENZIMAS son





![n Los procesos bioquímicos son reversibles [A] k 1 k--1 [B] Donde k 1 n Los procesos bioquímicos son reversibles [A] k 1 k--1 [B] Donde k 1](https://slidetodoc.com/presentation_image_h/1352e027277329a5cb418d8af1ee1c25/image-13.jpg)





![Cinética de la Catálisis Enzimática V 2 = k 2 [ES] Podría Expresarse V Cinética de la Catálisis Enzimática V 2 = k 2 [ES] Podría Expresarse V](https://slidetodoc.com/presentation_image_h/1352e027277329a5cb418d8af1ee1c25/image-25.jpg)



![Cinética de la Catálisis Enzimática Significado de KM, Kcat/KM n Kcat [segundos-1] n Medida Cinética de la Catálisis Enzimática Significado de KM, Kcat/KM n Kcat [segundos-1] n Medida](https://slidetodoc.com/presentation_image_h/1352e027277329a5cb418d8af1ee1c25/image-30.jpg)











- Slides: 53

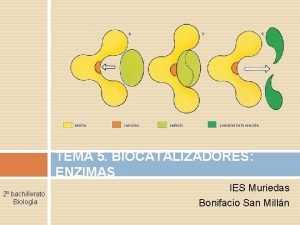
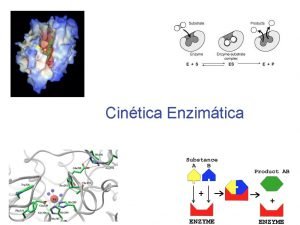
Tema 7 Enzimas

DEFINICIÓN n LAS ENZIMAS son proteínas que se comportan como catalizadores muy potentes y eficaces de las reacciones químicas de los sistemas biológicos. n La CATÁLISIS ENZIMÁTICA es esencial para los sistemas vivos. n La mayoría de las R. Q. ocurrirían muy lento en condiciones biológicamente significativas. n Hace posible que en condiciones fisiológicas tengan lugar reacciones que sin catalizador requerirían condiciones extremas de presión, temperatura o p. H. n Las biomoléculas son muy estables a p. H neutro, temperatura suave y ambiente acuoso

Características n Como catalizadores, los enzimas actúan en pequeña cantidad y se recuperan indefinidamente. n No llevan a cabo reacciones que sean energéticamente desfavorables, sino que solamente aceleran las que espontáneamente podrían producirse. n Los enzimas son catalizadores específicos: cada enzima cataliza un solo tipo de reacción, y casi siempre actúa sobre un único sustrato o sobre un grupo muy reducido de ellos.

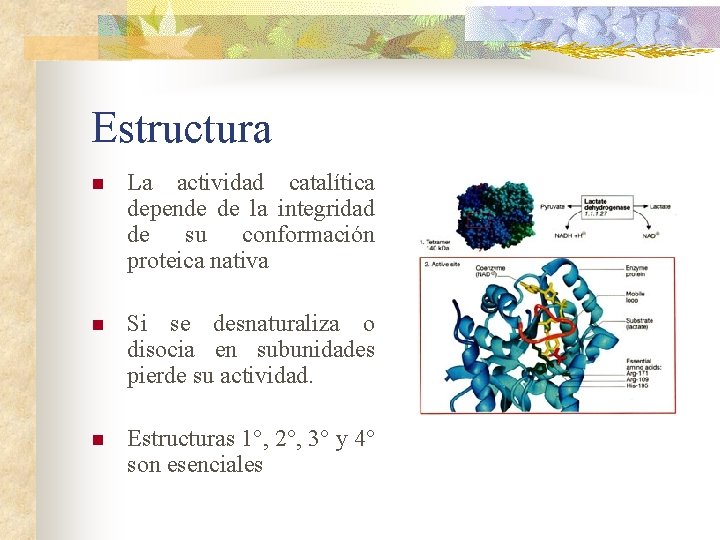
Estructura n La actividad catalítica depende de la integridad de su conformación proteica nativa n Si se desnaturaliza o disocia en subunidades pierde su actividad. n Estructuras 1°, 2°, 3° y 4° son esenciales

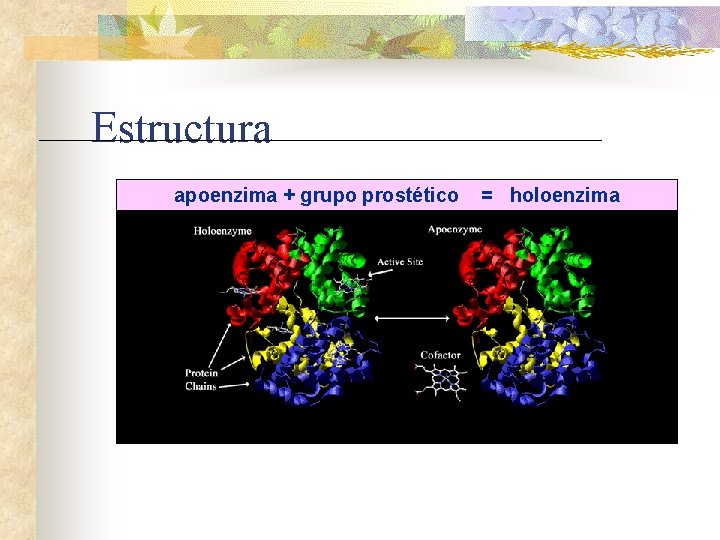
Estructura apoenzima + grupo prostético = holoenzima

Estructura

Localización Histoenzimología por Diagnósticos enfermedades Catalizadores en síntesis industrial reacciones metabólicas y su regulación Estructuras y mecanismos de acción Extractos se usa para Estudios de : Se pueden extraer sin perder actividad biol{ogica Distribución intracelular de las enzimas

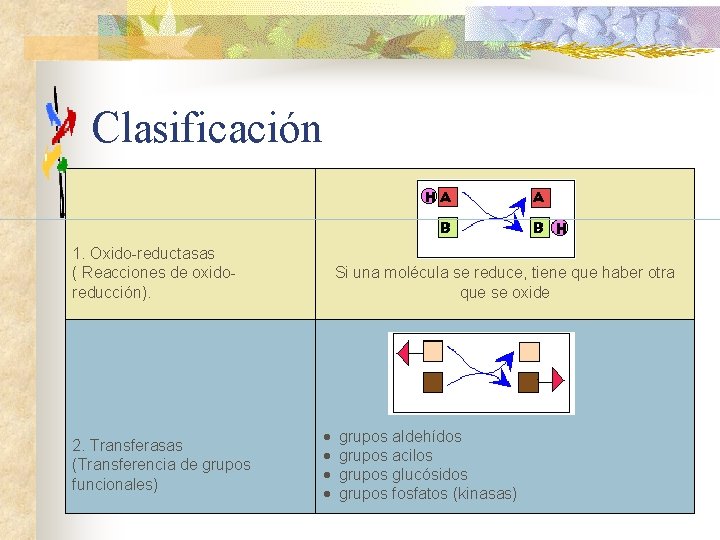
Clasificación 1. Oxido-reductasas ( Reacciones de oxidoreducción). 2. Transferasas (Transferencia de grupos funcionales) Si una molécula se reduce, tiene que haber otra que se oxide · · grupos aldehídos grupos acilos grupos glucósidos grupos fosfatos (kinasas)

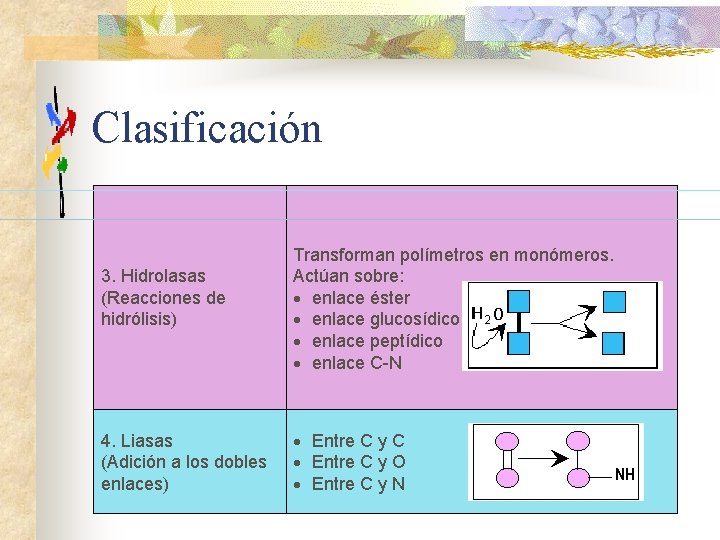
Clasificación 3. Hidrolasas (Reacciones de hidrólisis) 4. Liasas (Adición a los dobles enlaces) Transforman polímetros en monómeros. Actúan sobre: · enlace éster · enlace glucosídico · enlace peptídico · enlace C-N · Entre C y C · Entre C y O · Entre C y N

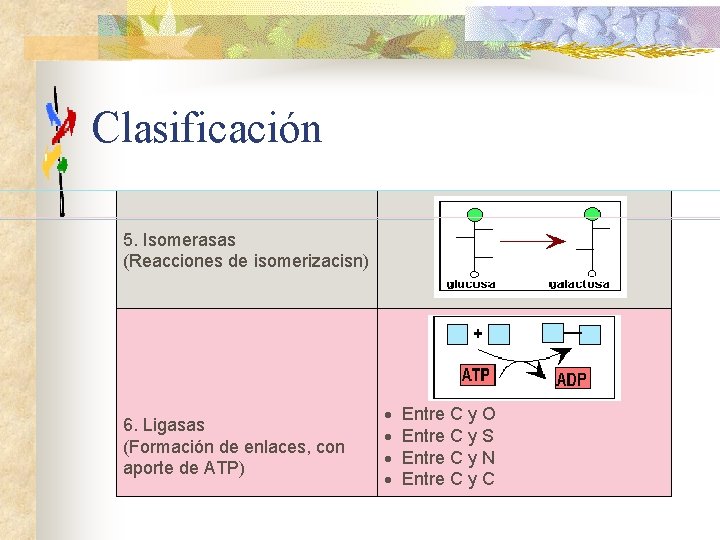
Clasificación 5. Isomerasas (Reacciones de isomerizacisn) 6. Ligasas (Formación de enlaces, con aporte de ATP) · · Entre C y O Entre C y S Entre C y N Entre C y C

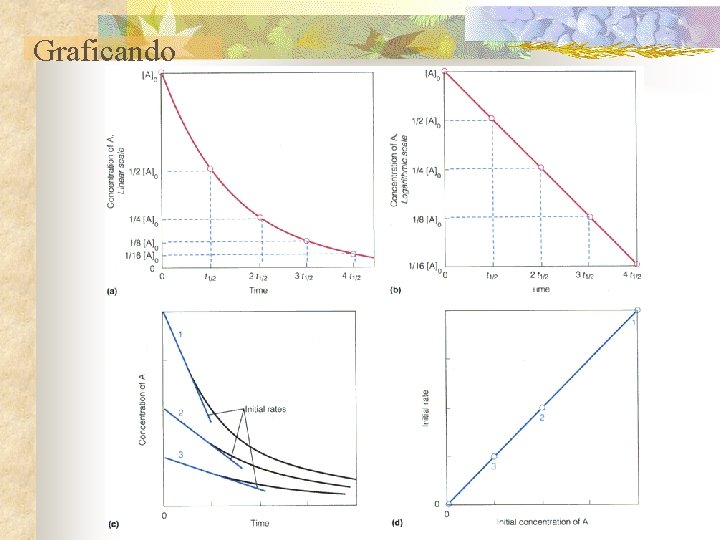
Velocidades de las reacciones químicas efecto de los catalizadores n Velocidades de reacción y orden de reacción Reacciones de 1º Orden n Para la reacción irreversible: n A B Integrando [A]/[A] 0 = e -(k-1 t) k 1 [s-1] donde [A]0 = concentración inicial de A cuando t = 0.

Graficando
![n Los procesos bioquímicos son reversibles A k 1 k1 B Donde k 1 n Los procesos bioquímicos son reversibles [A] k 1 k--1 [B] Donde k 1](https://slidetodoc.com/presentation_image_h/1352e027277329a5cb418d8af1ee1c25/image-13.jpg)
n Los procesos bioquímicos son reversibles [A] k 1 k--1 [B] Donde k 1 y k-1 son ctts de v de 1° directa e inversa En equilibrio

Velocidades de las reacciones químicas efecto de los catalizadores n Reacciones de 2° Orden 2 A k 2 B Donde k 2 es ctt de v de 2° orden [(mol/L)-1 s-1] Los esquemas de reacciones complejas se simplifican con un paso limitante de la velocidad

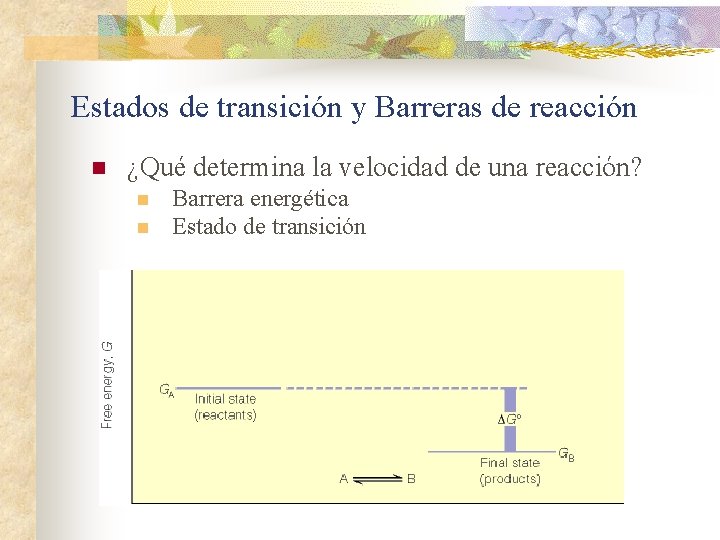
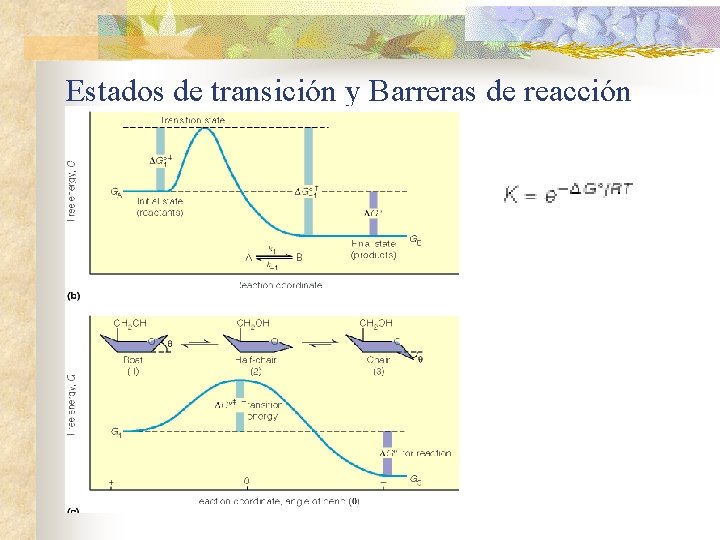
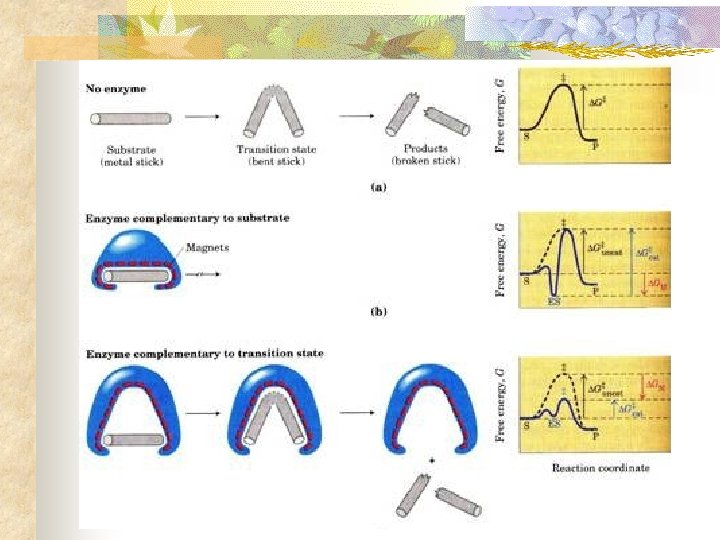
Estados de transición y Barreras de reacción n ¿Qué determina la velocidad de una reacción? n n Barrera energética Estado de transición

Estados de transición y Barreras de reacción

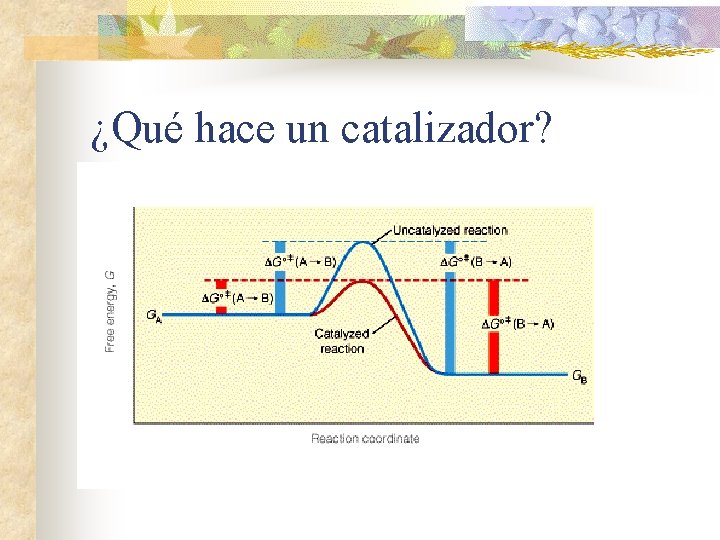
¿Qué hace un catalizador?

Cómo funcionan n Los enzimas disminuyen la energía de activación de las reacciones Reacción a) Energía de activación (Kcal*mol-1) el peróxido de hidrógeno se descompone en: H 2 O 2 H 2 O + O 2 18 b) el hierro catalítico (Fe) realiza la reacción 13 H 2 O 2 H 2 O + O 2 c) el platino catalítico (Pt) realiza la reacción : H 2 O 2 H 2 O + O 2 d) la catalasa una enzima hepática la realiza H 2 O 2 12 H 2 O + O 2 5

¿Qué hace un catalizador? n ¿Cómo reduce el catalizador la barrera energética? n n Reducción de entropía Desolvatación Se compensa tensión o distorsión del sustrato Consigue alineamiento entre grupos funcionales cataliticos del E y el S

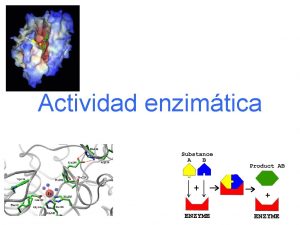
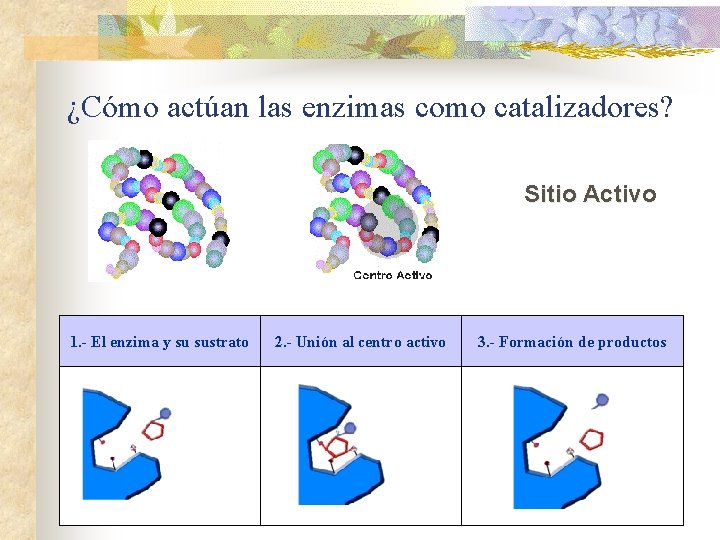
¿Cómo actúan las enzimas como catalizadores? Sitio Activo 1. - El enzima y su sustrato 2. - Unión al centro activo 3. - Formación de productos

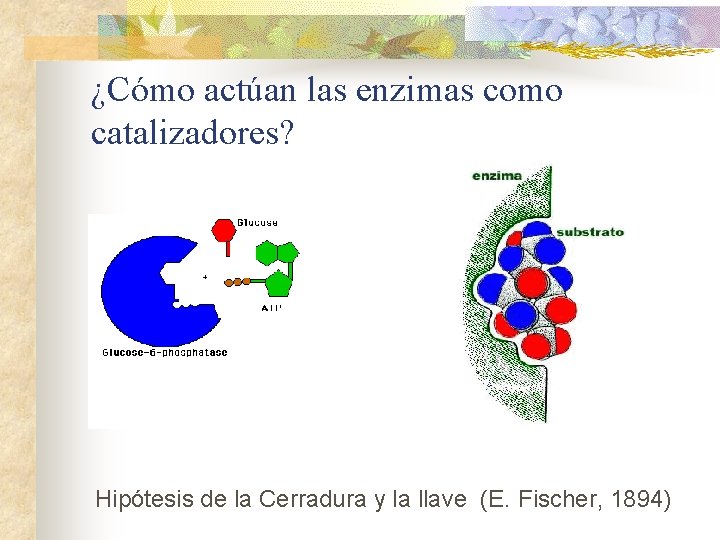
¿Cómo actúan las enzimas como catalizadores? Hipótesis de la Cerradura y la llave (E. Fischer, 1894)


¿Cómo actúan las enzimas como catalizadores? n Hipótesis del Ajuste Inducido (Daniel Koshland, 1958) n 1. 2. 3. 4. 5. E Induce al S a configuración aproximada al Edo. Transición UNE S REDUCE Ea IMPULSA Catalisis LIBERA P SE REGENERA

Cinética de la Catálisis Enzimática n Cinética de Michaelis-Menten n 1º etapa se forma el complejo enzima-sustrato. n 2º etapa, el complejo enzima-sustrato da lugar a la formación del producto, liberando el enzima libre: V 1 = k 1 [E] [S] V-1 = k-1 [ES] k 1 K -1 k 2 Paso lento V 2 = k 2 [ES]
![Cinética de la Catálisis Enzimática V 2 k 2 ES Podría Expresarse V Cinética de la Catálisis Enzimática V 2 = k 2 [ES] Podría Expresarse V](https://slidetodoc.com/presentation_image_h/1352e027277329a5cb418d8af1ee1c25/image-25.jpg)
Cinética de la Catálisis Enzimática V 2 = k 2 [ES] Podría Expresarse V como función de [E]t y [S] Asumiendo que E y S estan en equilibrio cuando k 2<< k-1 Ks ctte de disociación

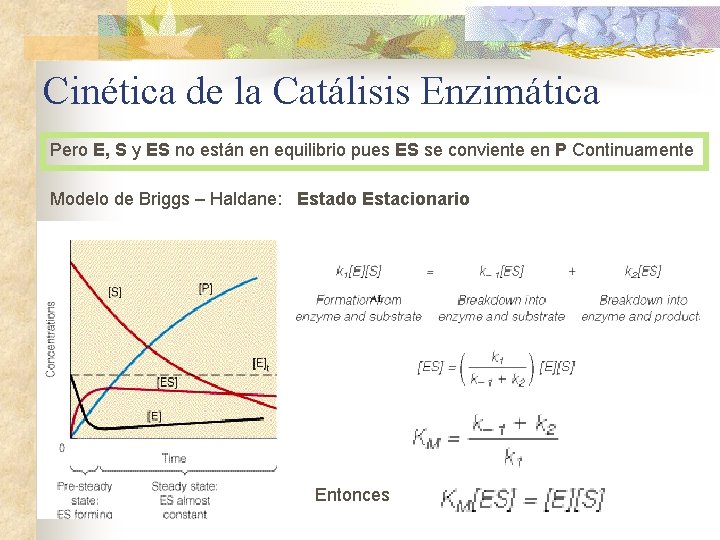
Cinética de la Catálisis Enzimática Pero E, S y ES no están en equilibrio pues ES se conviente en P Continuamente Modelo de Briggs – Haldane: Estado Estacionario Entonces

Cinética de la Catálisis Enzimática Ecuación de Michaelis - Menten n KM es característica de cada reacción Tiene unidades de concentración Cuando KM >> [S] se alcanza Vmax

Cinética de la Catálisis Enzimática n Para reacciones de pasos múltiples: K 2 es un caso particular la Kcat

Cinética de la Catálisis Enzimática Significado de KM, Kcat/KM n Cuando k 2 << k-1 Entonces KM k-1/k 1 = K n Afinidad n de la enzima por el sustrato KM = [S] cuando V = ½ Vmax n Es una medida de la [S] necesaria para catálisis eficaz
![Cinética de la Catálisis Enzimática Significado de KM KcatKM n Kcat segundos1 n Medida Cinética de la Catálisis Enzimática Significado de KM, Kcat/KM n Kcat [segundos-1] n Medida](https://slidetodoc.com/presentation_image_h/1352e027277329a5cb418d8af1ee1c25/image-30.jpg)
Cinética de la Catálisis Enzimática Significado de KM, Kcat/KM n Kcat [segundos-1] n Medida directa de la producción catalítica en condiciones {optimas (enzima saturada) n Tiempo necesario para cambiar S en P n Número de recambio (N° moléc de S recamb por seg)

Cinética de la Catálisis Enzimática Significado de KM, Kcat/KM n Kcat/ KM n Cuando [S] << KM Entonces [E]t << [E] n Medida directa de eficiencia y especifidad de la enzima n Permite comparar eficiencia de una enzima con diferentes sustratos n Valor máximo entre 108 y 109 (mol/L)-1 s-1

Cinética de la Catálisis Enzimática

Cinética de la Catálisis Enzimática

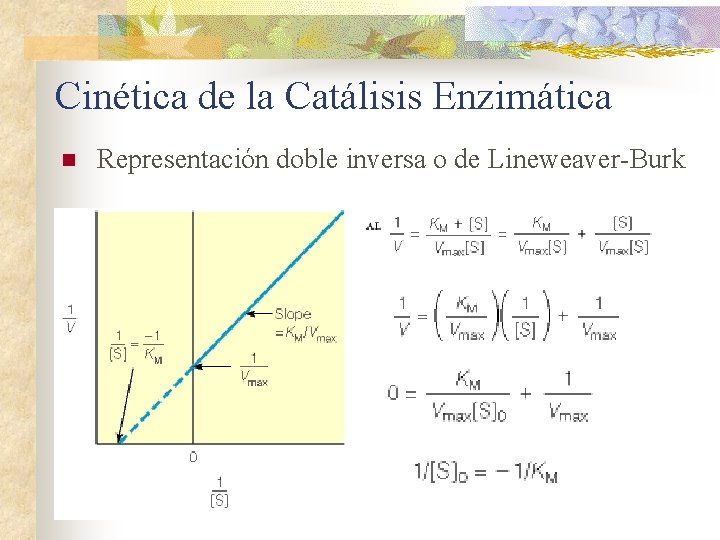
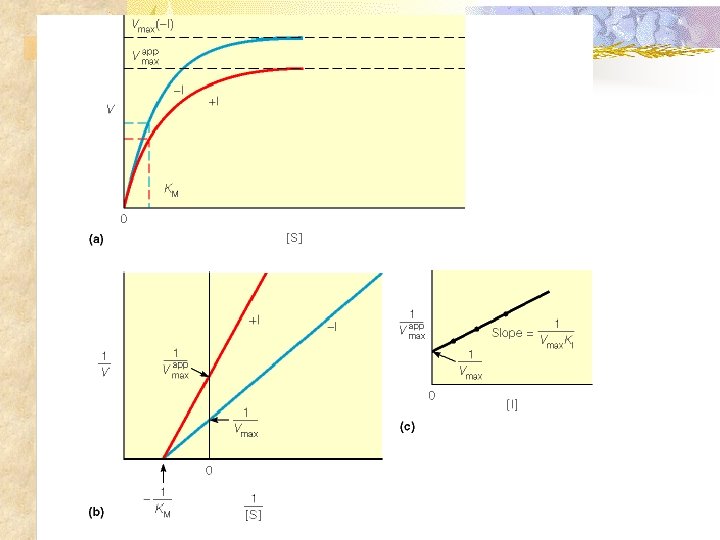
Cinética de la Catálisis Enzimática n Representación doble inversa o de Lineweaver-Burk

Cinética de la Catálisis Enzimática n Representación de Eadie- Hofstee

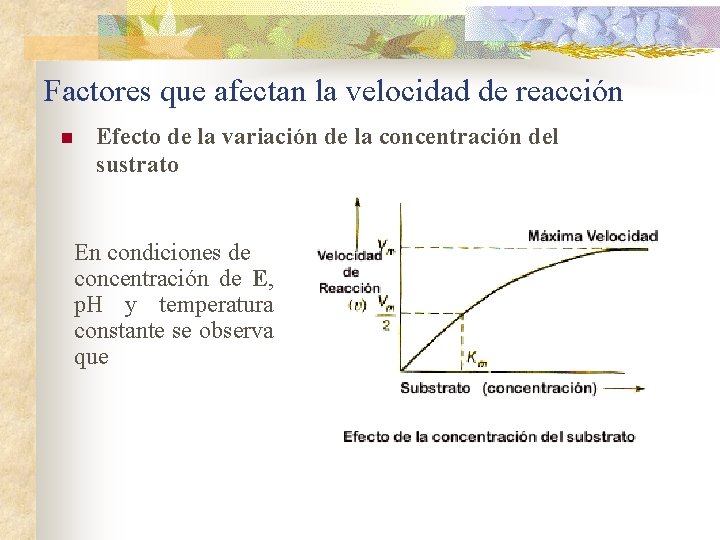
Factores que afectan la velocidad de reacción n Efecto de la variación de la concentración del sustrato En condiciones de concentración de E, p. H y temperatura constante se observa que

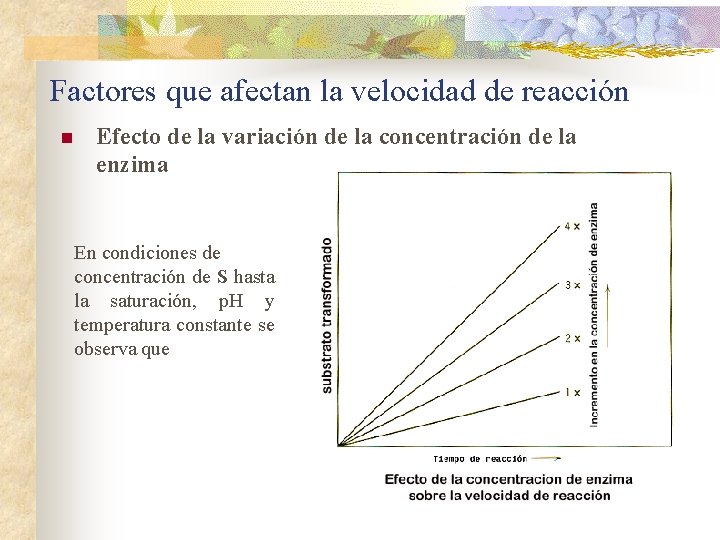
Factores que afectan la velocidad de reacción n Efecto de la variación de la concentración de la enzima En condiciones de concentración de S hasta la saturación, p. H y temperatura constante se observa que

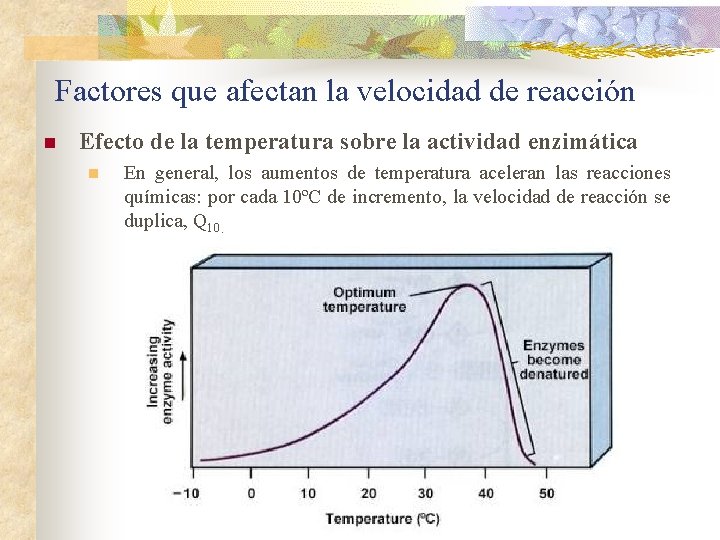
Factores que afectan la velocidad de reacción n Efecto de la temperatura sobre la actividad enzimática n En general, los aumentos de temperatura aceleran las reacciones químicas: por cada 10ºC de incremento, la velocidad de reacción se duplica, Q 10.

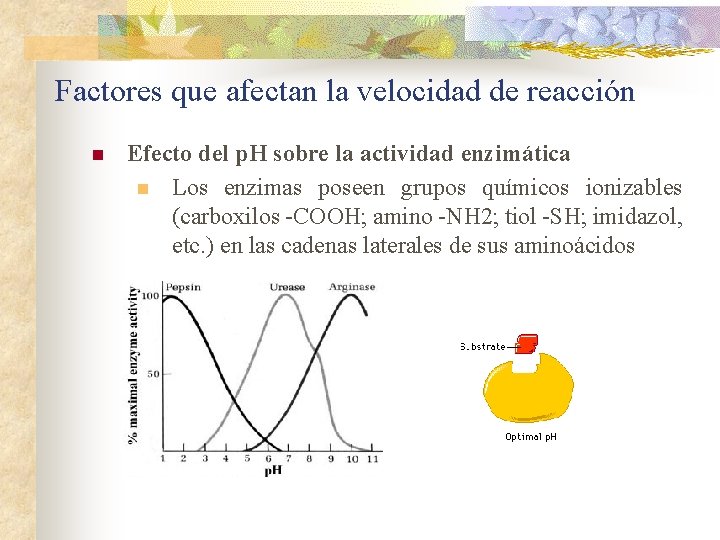
Factores que afectan la velocidad de reacción n Efecto del p. H sobre la actividad enzimática n Los enzimas poseen grupos químicos ionizables (carboxilos -COOH; amino -NH 2; tiol -SH; imidazol, etc. ) en las cadenas laterales de sus aminoácidos

Cinética Enzimática n Reacciones en que intervienen dos o más sustratos n Unión aleatória de los sustratos La fosforilación de la glucosa con ATP, catalizada con hexokinase, con tendencia a unirse a la glucosa en primer lugar.

Cinética Enzimática n Reacciones en que intervienen dos o más sustratos n Unión ordenada de los sustratos Se observa en oxidaciones de sustratos con la coenzima nicotinamide adenine dinucleotide (NAD+).

Cinética Enzimática n Reacciones en que intervienen dos o más sustratos n Mecanismo “ping-pong” La ruptura de una cadena polipetídica con una serina proteasa, tal como la trypsina o chymotrypsina.

Cinética Enzimática Análisis cinético en el estado estacionario de las reacciones bisustrato

Cinética Enzimática n Mecanismos de Inhibición

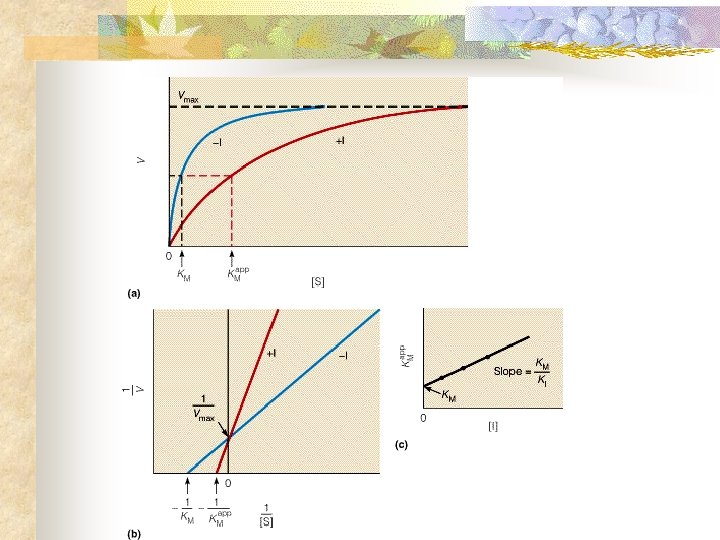
Cinética Enzimática n Mecanismos de Inhibición Inhibidor competitivo Inhibidor no competitivo

Cinética Enzimática n Mecanismos de Inhibición Reversibles n Inhibición competitiva


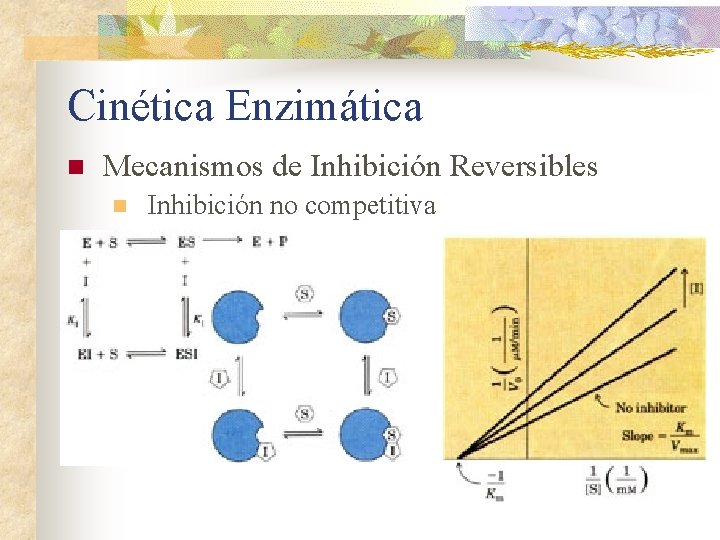
Cinética Enzimática n Mecanismos de Inhibición Reversibles n Inhibición no competitiva


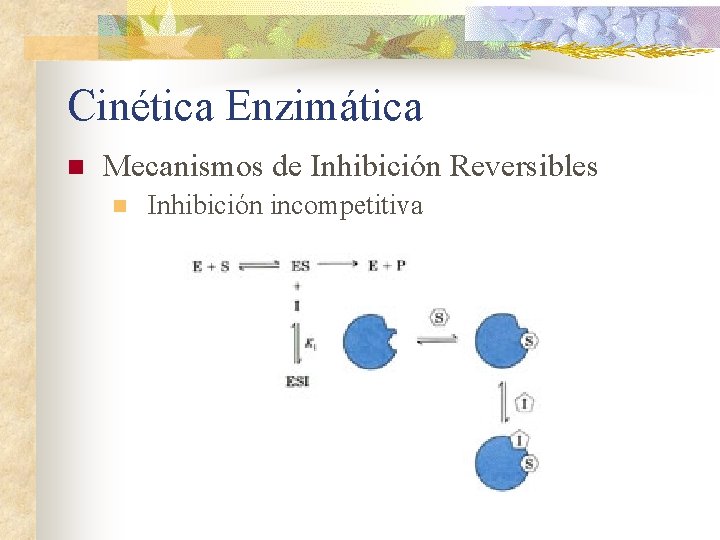
Cinética Enzimática n Mecanismos de Inhibición Reversibles n Inhibición incompetitiva

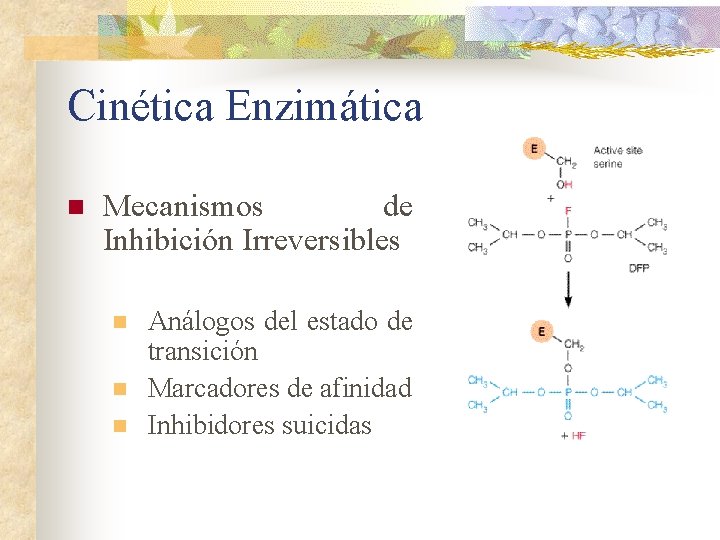
Cinética Enzimática n Mecanismos de Inhibición Irreversibles n n n Análogos del estado de transición Marcadores de afinidad Inhibidores suicidas

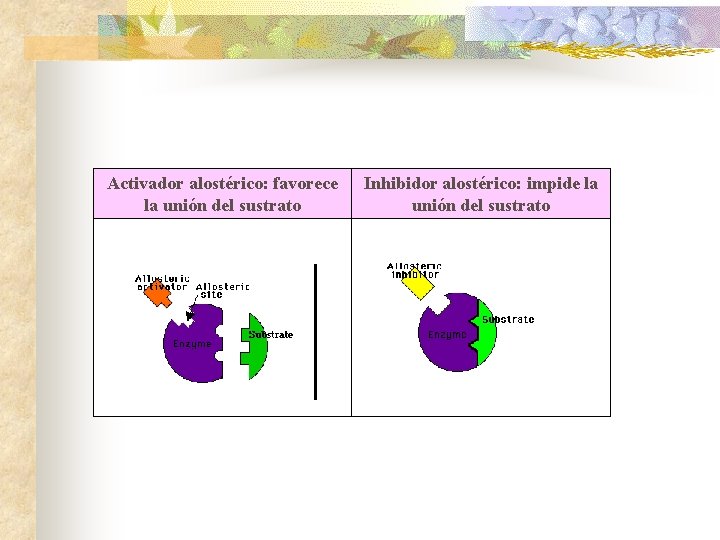
Activador alostérico: favorece la unión del sustrato Inhibidor alostérico: impide la unión del sustrato

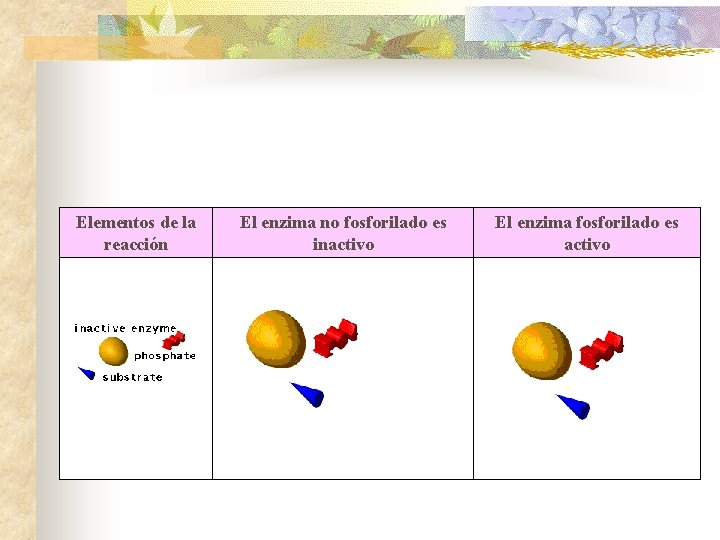
Elementos de la reacción El enzima no fosforilado es inactivo El enzima fosforilado es activo
 Las enzimas son
Las enzimas son Imagenes
Imagenes Definicin de estado
Definicin de estado Teoria semitica
Teoria semitica Definicion de monemas
Definicion de monemas Sexo definicin
Sexo definicin Amor amor ruben morre
Amor amor ruben morre Definici9
Definici9 Aprendida
Aprendida Definicin de cultura
Definicin de cultura Definicin
Definicin Definicin de derecho
Definicin de derecho Errores de truncamiento ejemplos
Errores de truncamiento ejemplos Tema 1 las familias y las comunidades
Tema 1 las familias y las comunidades Tema-tema teologi perjanjian lama
Tema-tema teologi perjanjian lama Subtema
Subtema Ventajas de la entrevista
Ventajas de la entrevista Translate
Translate Delimitacion del tema ejemplo
Delimitacion del tema ejemplo Fotolitótrofo
Fotolitótrofo Oxidoreductasas
Oxidoreductasas Como se clasifican las enzimas
Como se clasifican las enzimas Como actúan las enzimas
Como actúan las enzimas Metabolismo de nucleótidos
Metabolismo de nucleótidos Tipos de inhibición enzimática
Tipos de inhibición enzimática Riboenzimas
Riboenzimas Funciones de las enzimas
Funciones de las enzimas Enzimas introducción
Enzimas introducción Got y gpt
Got y gpt Tipos de enzimas
Tipos de enzimas Las enzimas disminuyen la energia de activacion
Las enzimas disminuyen la energia de activacion Funcion catalizadora de las proteinas
Funcion catalizadora de las proteinas Las enzimas disminuyen la energia de activacion
Las enzimas disminuyen la energia de activacion Extremos romos y cohesivos
Extremos romos y cohesivos Funcion de las enzimas
Funcion de las enzimas Inhibicion anticompetitiva
Inhibicion anticompetitiva Nosotros somos estudiantes
Nosotros somos estudiantes Comparación en los poemas
Comparación en los poemas Las emociones para que sirven
Las emociones para que sirven Recursos estéticos
Recursos estéticos Cuáles son las edades en las que se divide la prehistoria
Cuáles son las edades en las que se divide la prehistoria Fuentes de los contratos mercantiles
Fuentes de los contratos mercantiles Division de la prehistoria
Division de la prehistoria Compuertas y tablas de verdad
Compuertas y tablas de verdad Que fraccion es
Que fraccion es Recomendaciones de las tics
Recomendaciones de las tics Son las once y media
Son las once y media No es una propiedad coligativa de las soluciones
No es una propiedad coligativa de las soluciones ¿cuáles son las claves del éxito para integrar las tics?
¿cuáles son las claves del éxito para integrar las tics? Valor posicional decimal
Valor posicional decimal Objetivos de una leyenda
Objetivos de una leyenda Coplas definición y características
Coplas definición y características Los procesos emocionales
Los procesos emocionales La semilla y sus partes
La semilla y sus partes