nergie CINTIQUE CHIMIQUE ractifs Chapitre 2 produits temps









![Les réactions quasi-monomoléculaires énergie • La théorie de LINDEMANN : [1] M + M Les réactions quasi-monomoléculaires énergie • La théorie de LINDEMANN : [1] M + M](https://slidetodoc.com/presentation_image_h2/8ee2b6c9aeb6562f3d7e1886fdc7d0fc/image-17.jpg)
![Les réactions quasi-monomoléculaires (suite) • d[M*]/dt = 0 = k 1 [M] 2 - Les réactions quasi-monomoléculaires (suite) • d[M*]/dt = 0 = k 1 [M] 2 -](https://slidetodoc.com/presentation_image_h2/8ee2b6c9aeb6562f3d7e1886fdc7d0fc/image-18.jpg)
![Les réactions quasi-monomoléculaires (suite) k 2 k 1 [M]2 v =k = k exp Les réactions quasi-monomoléculaires (suite) k 2 k 1 [M]2 v =k = k exp](https://slidetodoc.com/presentation_image_h2/8ee2b6c9aeb6562f3d7e1886fdc7d0fc/image-19.jpg)













- Slides: 41

énergie CINÉTIQUE CHIMIQUE réactifs Chapitre 2 produits temps. Théorie des vitesses de réaction Guy COLLIN, 2014 -12 -29

THÉORIE DES VITESSES DE RÉACTION énergie • Quels sont les paramètres importants dans l’expression réactifs de la vitesse d’une réaction ? • produits La température, certes ! Mais encore ? • temps Peut-on calculer a priori une vitesse de réaction ? 2014 -12 -29

Collision entre deux particules énergie v d. A A On peut supposer que la collision physique est nécessaire. Peut-on calculer la vitesse de collision de deux molécules en phase gazeuse ? d. B B réactifs • Mouvement brownien : produits – v = vx + vy + vz temps – v 2 = vx 2 + vy 2 + vz 2 2014 -12 -29

Théorie cinétique des gaz Vitesse de collision énergie • Le nombre de collision par unité de temps ZAA : réactifs • Le libre parcours moyen l : produits temps 2014 -12 -29

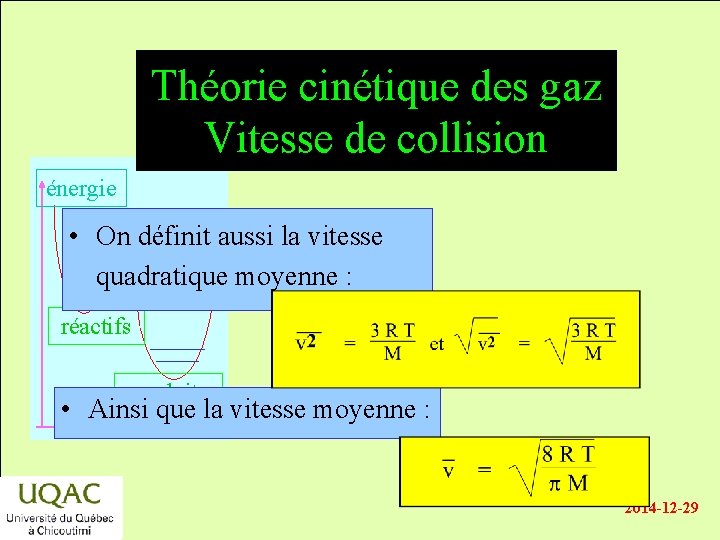
Théorie cinétique des gaz Vitesse de collision énergie • On définit aussi la vitesse quadratique moyenne : réactifs produits • Ainsi que la vitesse moyenne : temps 2014 -12 -29

Les collisions efficaces énergie • Énergie cinétique de collision : – 1/2 m v 2 Ec m est la masse réduite m = m 1 m 2 / (m 1 + m 2 ) • Terme de BOLTZMANN : réactifs – la probabilité de trouver cette collision : - Ec / RT e produits temps Vitesse de réaction vitesse de collision × e-Ec/RT 2014 -12 -29

Comparaison avec la réalité • Exemples de réaction : vmes/vcal énergie réactifs produits temps 2014 -12 -29

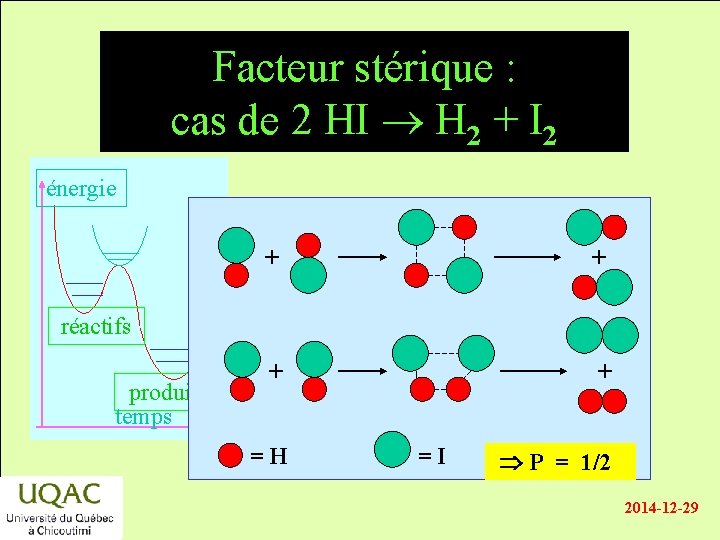
Introduction du facteur stérique énergie • L’orientation réciproque des réactifs dans la collision est un facteur géométrique important. • Si P est le facteur stérique : réactifs Vitesse de réaction vitesse de collision × e-Ec/RT × P produits temps • Le cas de HI + HI est évident. 2014 -12 -29

Facteur stérique : cas de 2 HI H 2 + I 2 énergie + + réactifs produits temps =H =I P = 1/2 2014 -12 -29

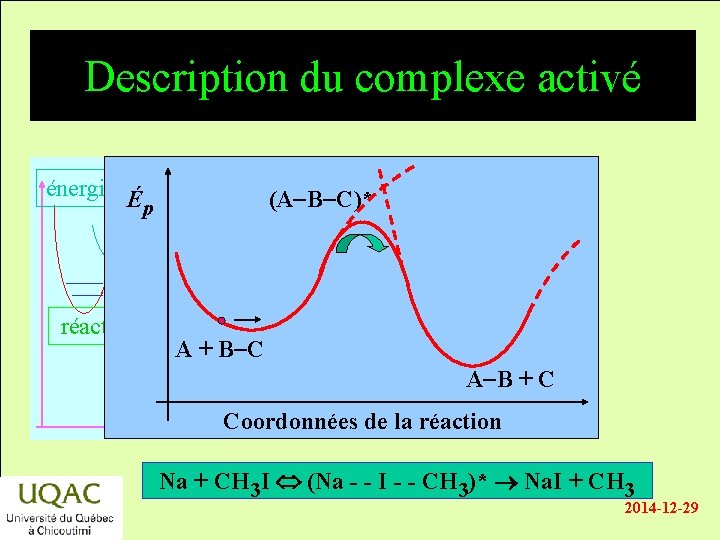
Description du complexe activé énergie É p réactifs (A-B-C)* A + B-C A-B + C produits temps Coordonnées de la réaction Na + CH 3 I (Na - - I - - CH 3)* Na. I + CH 3 2014 -12 -29

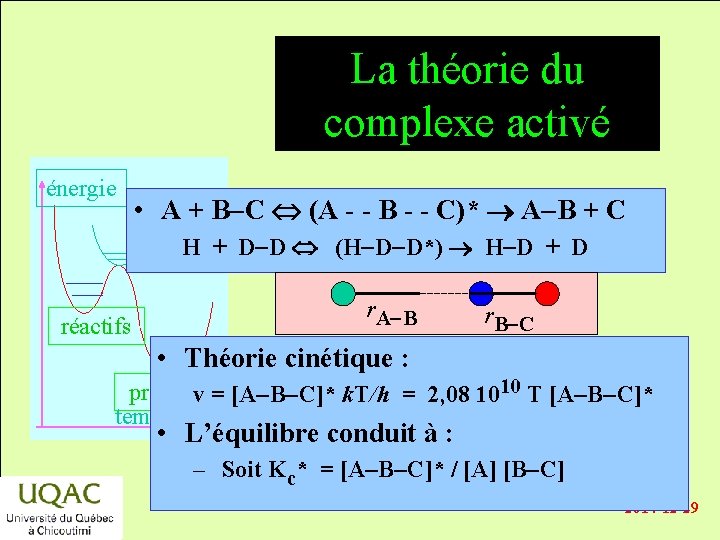
La théorie du complexe activé énergie • A + B-C (A - - B - - C)* A-B + C H + D-D (H-D-D*) H-D + D réactifs r. A-B r. B-C • Théorie cinétique : produits v = [A-B-C]* k. T/h = 2, 08 1010 T [A-B-C]* temps • L’équilibre conduit à : – Soit Kc* = [A-B-C]* / [A] [B-C] 2014 -12 -29

La théorie du complexe activé • Il faut évaluer Kc*. Cela est possible -D Go* K * = e énergie c [A] [B-C] V = P V V (d. A + d. B) 2 8 p. RT é 1 ê ëMA 1 ù - /RT + M ú e Ec BCû • La théorie des collisions conduit à : réactifs produits • Si ECtemps = D H 0* 2014 -12 -29

L’entropie de la réaction énergie • La vitesse de collision doit être corrigée pour la variation d’entropie. réactifs produits Vitesse de réaction vitesse de collision × e-Ec/RT× P × e+ DS°/ R temps 2014 -12 -29

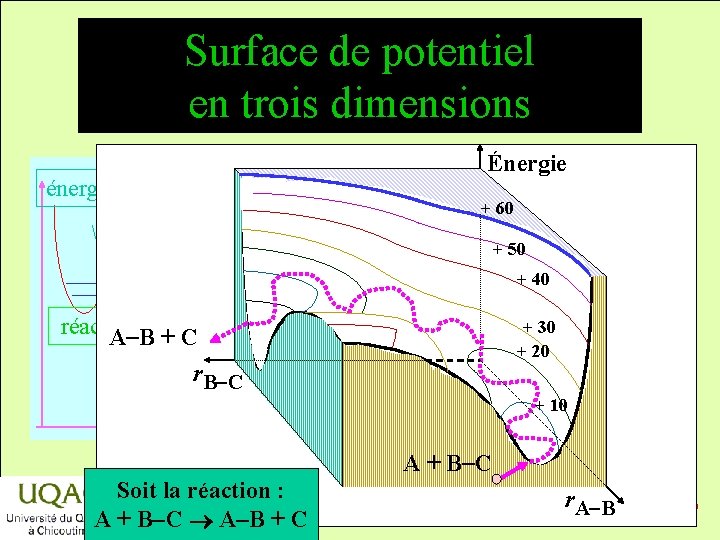
Surface de potentiel en trois dimensions énergie Énergie + 60 + 50 + 40 réactifs A-B + C r. B-C produits temps + 30 + 20 + 10 A + B-C Soit la réaction : A + B-C A-B + C r. A-B 2014 -12 -29

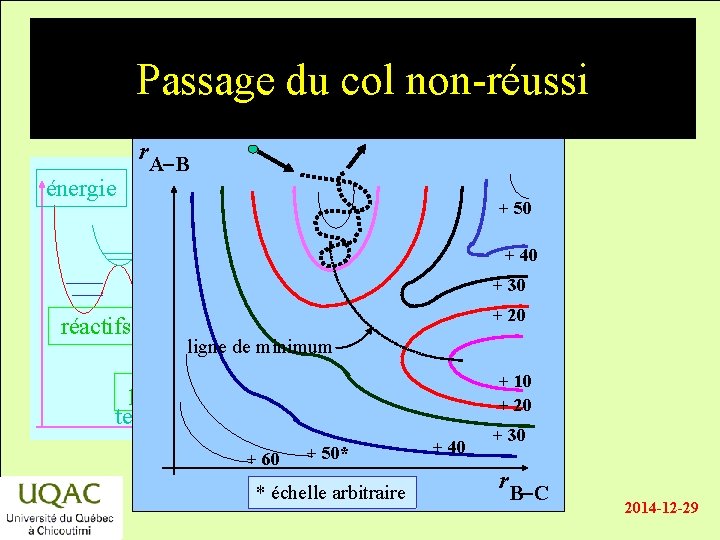
Passage du col non-réussi énergie r. A-B + 50 + 40 + 30 réactifs + 20 ligne de minimum + 10 + 20 produits temps + 60 + 50* * échelle arbitraire + 40 + 30 r. B-C 2014 -12 -29

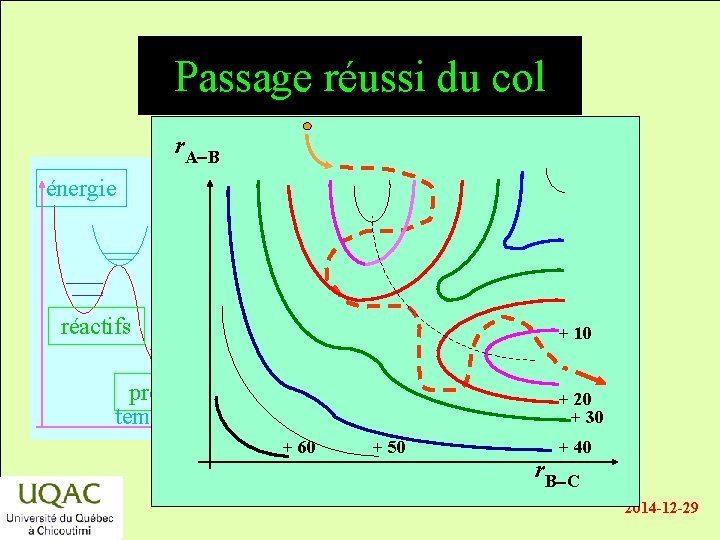
Passage réussi du col r. A-B énergie réactifs + 10 produits temps + 20 + 30 + 60 + 50 + 40 r. B-C 2014 -12 -29
![Les réactions quasimonomoléculaires énergie La théorie de LINDEMANN 1 M M Les réactions quasi-monomoléculaires énergie • La théorie de LINDEMANN : [1] M + M](https://slidetodoc.com/presentation_image_h2/8ee2b6c9aeb6562f3d7e1886fdc7d0fc/image-17.jpg)
Les réactions quasi-monomoléculaires énergie • La théorie de LINDEMANN : [1] M + M M* + M, activation [2] M* N, réaction [3] M* + M M + M, désactivation • Pour évaluer la vitesse de formation de N, faisons la réactifs supposition suivante : produits d[M*]/dt = 0 = v 1 - v 2 - v 3 • C’est l’hypothèse de l’état stationnaire, temps la concentration de M*, [M*], reste constante. 2014 -12 -29
![Les réactions quasimonomoléculaires suite dMdt 0 k 1 M 2 Les réactions quasi-monomoléculaires (suite) • d[M*]/dt = 0 = k 1 [M] 2 -](https://slidetodoc.com/presentation_image_h2/8ee2b6c9aeb6562f3d7e1886fdc7d0fc/image-18.jpg)
Les réactions quasi-monomoléculaires (suite) • d[M*]/dt = 0 = k 1 [M] 2 - k 2 [M*] - k 3 [M] [M*] énergie • k 1 [M] 2 = k 2 [M*] + k 3 [M] [M*] k 1 [M]2 [M*] = k + k [M] 2 3 • ou encore : réactifs • La vitesse de formation de N est donc : produits temps d[N] dt k 2 k 1 [M]2 = v 2 = k 2 [M*] = k 2 + k 3 [M] 2014 -12 -29
![Les réactions quasimonomoléculaires suite k 2 k 1 M2 v k k exp Les réactions quasi-monomoléculaires (suite) k 2 k 1 [M]2 v =k = k exp](https://slidetodoc.com/presentation_image_h2/8ee2b6c9aeb6562f3d7e1886fdc7d0fc/image-19.jpg)
Les réactions quasi-monomoléculaires (suite) k 2 k 1 [M]2 v =k = k exp [M] énergie k + [M] 2 3 • Si k 3 [M] >> k 2 , si P est grand réactifs v = k 2 k 1 [M] / k 3 La réaction est d’ordre 1. • Si k 3 [M] << k 2 , si P est petit produits 2 – v = k [M] 1 temps – La réaction est d’ordre 2. 2014 -12 -29

Les réactions quasi-monomoléculaires (suite) • Si P est quelconque : énergie k 2 k 1 [M]2 v =k = k exp [M] k + [M] 2 3 • Lorsque P , k = k 1 k 2 / k 3 réactifs k exp k 2 k 3 [M] = 1 k k 2 + k 3 [M] = k 2 + k 3 [M] produits temps • On observe que kexp / k = 1/2 à la pression P 1/2 : P 1/2 = k 2 / k 3 = k / k 1 2014 -12 -29

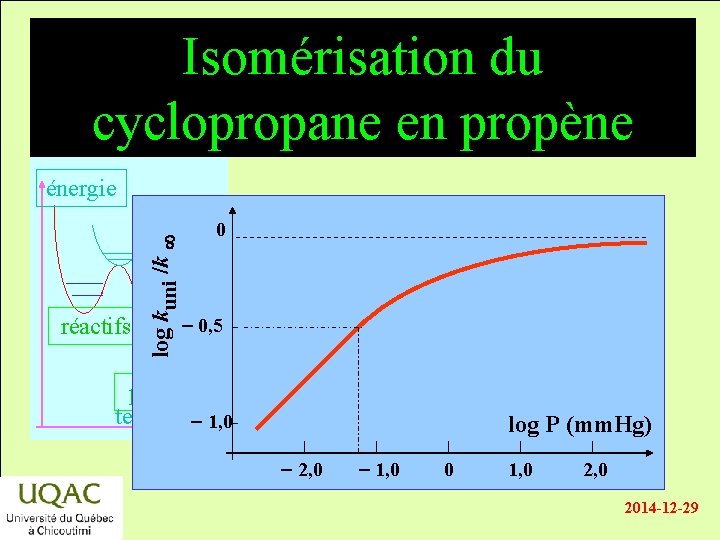
Isomérisation du cyclopropane en propène réactifs log kuni /k énergie 0 - 0, 5 produits temps - 1, 0 log P (mm. Hg) - 2, 0 - 1, 0 0 1, 0 2014 -12 -29

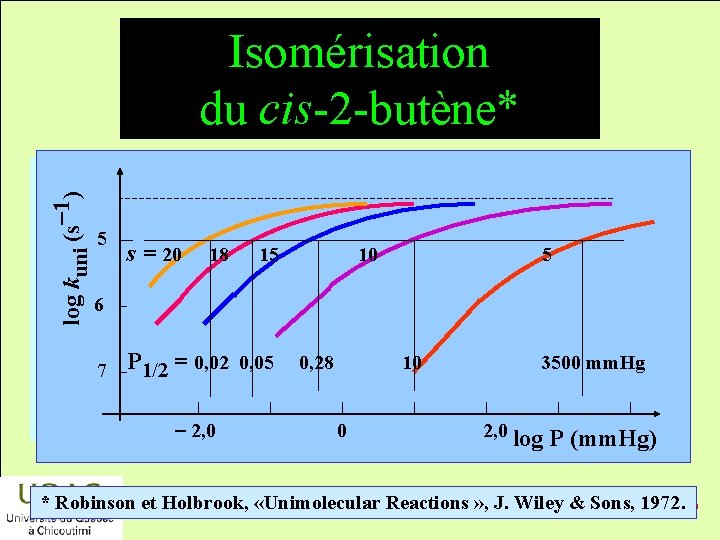
Cas de l’isomérisation du cis-2 -butène énergie • La valeur de P 1/2 calculée est : P 1/2 = 9 106 mm. Hg réactifs • La valeur expérimentale de P 1/2 est : P 1/2 = 0, 04 mm. Hg ! produits temps • La correction proposée est insuffisante. 2014 -12 -29

La correction d’HINSHELWOOD • La correction de Boltzmann ajoute l’énergie cinétique de collision e E 0 /RT • Hinshelwood ajoute l’énergie vibrationnelle : réactifs produits temps (Eo/RT)s-1 -Eo/RT = ƒ e-Eo/RT PE = e s (s-1)! où s est le nombre de degrés de liberté de vibration participant à l’énergie critique. 2014 -12 -29

Isomérisation du cis-2 -butène* log kuni (s-1) énergie 5 s = 20 18 15 10 5 6 réactifs 7 P 1/2 = 0, 02 0, 05 produits temps - 2, 0 0, 28 10 0 3500 mm. Hg 2, 0 log P (mm. Hg) * Robinson et Holbrook, «Unimolecular Reactions » , J. Wiley & Sons, 1972. 2014 -12 -29

Exemples de réactions thermiques énergie réactifs produits temps 2014 -12 -29

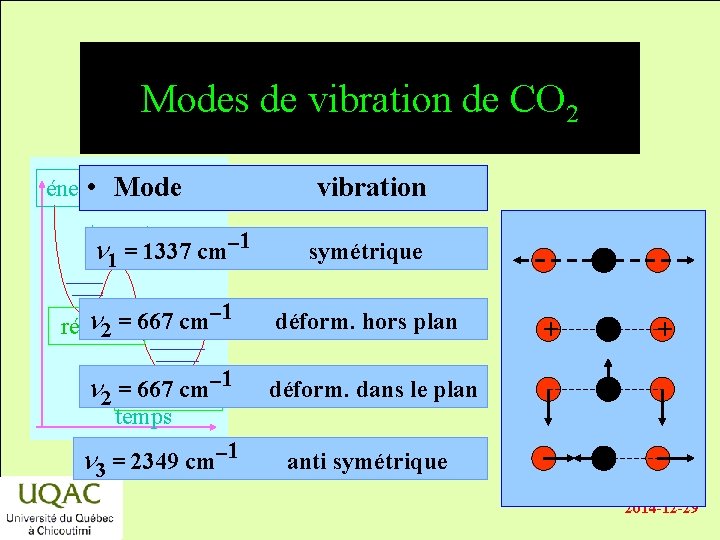
Modes de vibration de CO 2 • Mode énergie n 1 = 1337 cm-1 -1 n = 667 cm réactifs 2 vibration symétrique déform. hors plan n 2 =produits 667 cm-1 déform. dans le plan n 3 = 2349 cm-1 anti symétrique + - + temps 2014 -12 -29

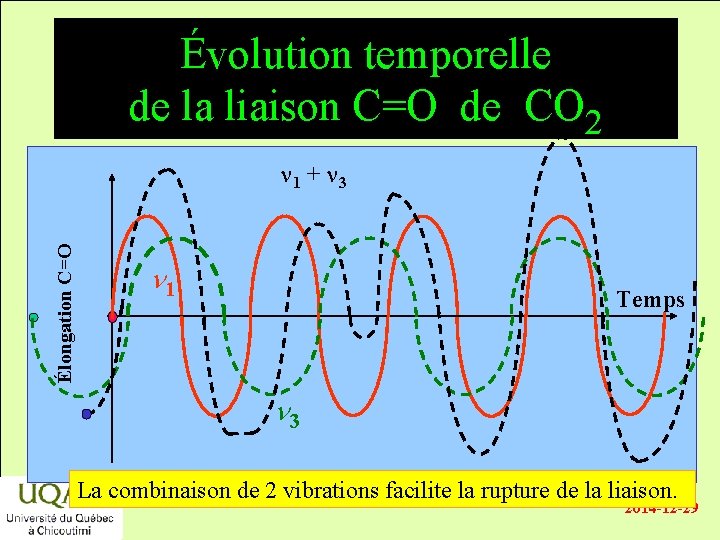
Évolution temporelle de la liaison C=O de CO 2 n 1 + n 3 Élongation C=O énergie n 1 Temps réactifs produits temps n 3 La combinaison de 2 vibrations facilite la rupture de la liaison. 2014 -12 -29

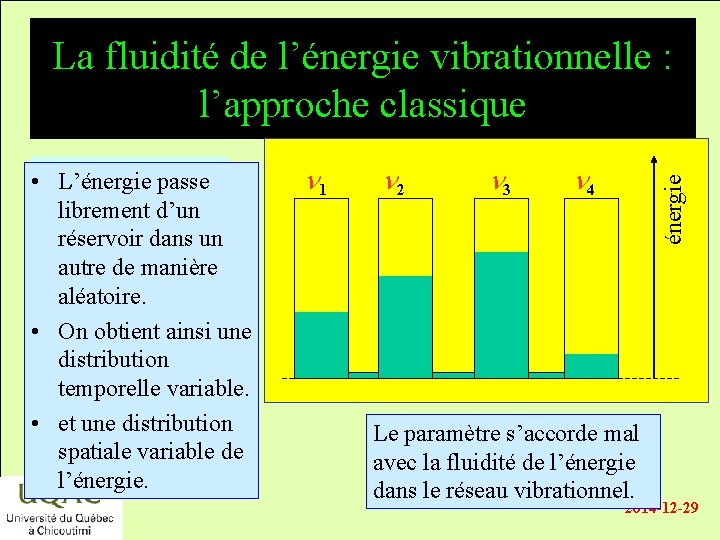
La fluidité de l’énergie vibrationnelle : l’approche classique n 1 n 2 n 3 n 4 énergie • énergie L’énergie passe librement d’un réservoir dans un autre de manière aléatoire. réactifs • On obtient ainsi une distribution temporelle variable. produits • et unetemps distribution spatiale variable de l’énergie. Le paramètre s’accorde mal avec la fluidité de l’énergie dans le réseau vibrationnel. 2014 -12 -29

La théorie RRK énergie • La théorie de Hinshelwood suppose que kuni est constant quelle que soit l’énergie interne de la molécule. • On peut penser que kuni croît avec réactifs l’énergie interne. Le facteur correctif est (1 s-1 pourvu que E >> E E /E) produits c c temps • C’est l’approche de Rice et Rampsperger. 2014 -12 -29

La théorie RRK • KASSEL complète la théorie par une énergie amorce de quantification. • Si la molécule contient n quanta et s’il faut m quanta pour atteindre Ec, réactifs alors la probabilité de trouver ces n quanta dans la bonne liaison est : produits temps Note : m < n 2014 -12 -29

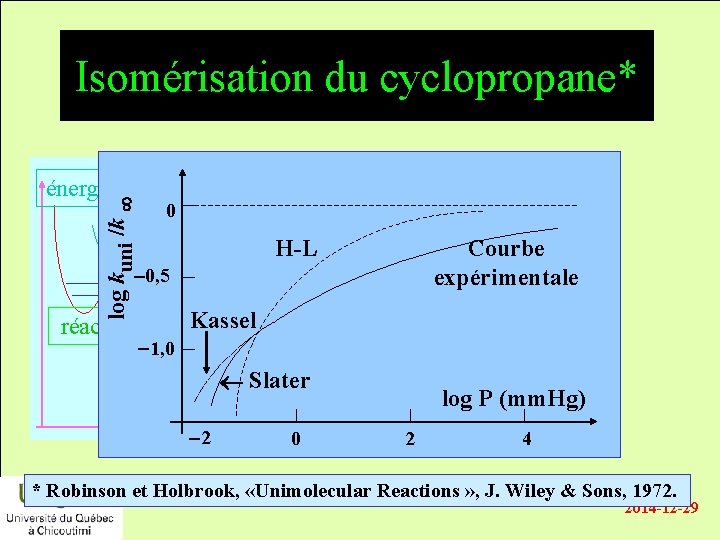
Isomérisation du cyclopropane* log kuni /k énergie 0 H-L Courbe expérimentale -0, 5 réactifs Kassel -1, 0 produits Slater temps -2 0 log P (mm. Hg) 2 4 * Robinson et Holbrook, «Unimolecular Reactions » , J. Wiley & Sons, 1972. 2014 -12 -29

La théorie RRKM énergie • MARCUS reprend le calcul précédent de façon complètement quantique : réactifs produits temps s k. BT ƒ¹ -E /RT k = k. RRKM = ¹ h ƒ e c s s #, s sont des facteurs de symétrie ; ƒ #, ƒ sont des fonctions de partition. 2014 -12 -29

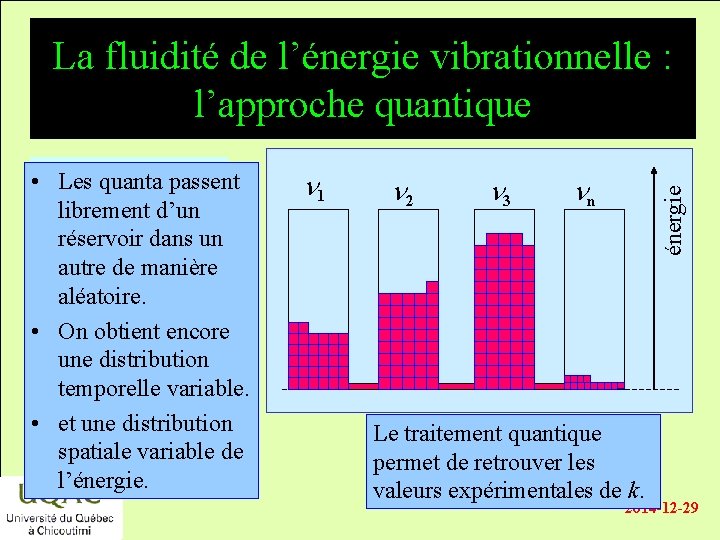
La fluidité de l’énergie vibrationnelle : l’approche quantique n 1 n 2 n 3 nn énergie • énergie Les quanta passent librement d’un réservoir dans un autre de manière aléatoire. réactifs • On obtient encore une distribution temporelle variable. produits • et unetemps distribution spatiale variable de l’énergie. Le traitement quantique permet de retrouver les valeurs expérimentales de k. 2014 -12 -29

Collision élastique : transfert d’énergie cinétique • Conservation de la quantité de mouvement : énergie m v +m v = m v ’+m v ’ 1 1 2 2 • Conservation de l’énergie cinétique : réactifs – Si une particule est au repos par rapport à l’autre, le transfert DE est tel que : produits temps – On peut conclure que le transfert est maximum lorsque m 1 = 2014 -12 -29 m 2

Les collisions inélastiques Ø Soit la collision d’un atome avec énergie une molécule diatomique, Ø si la direction fait un angle de 90° par rapport à l’axe de la molécule, l’impact produit une réactifsde la molécule cible. rotation G Ø Il y a transformation au moins partielle produits d’énergie cinétique en temps énergie de rotation. 2014 -12 -29

Les collisions inélastiques énergie G ü Si la direction de la particule est colinéaire à l’axe de la molécule, l’impact produit une vibration de la molécule cible. réactifs ü Il y a transformation au moins partielle d’énergie cinétique en énergie de vibration. produits ütemps Sous un angle quelconque, l’énergie cinétique est partiellement transformée en énergie de rotation et de vibration. 2014 -12 -29

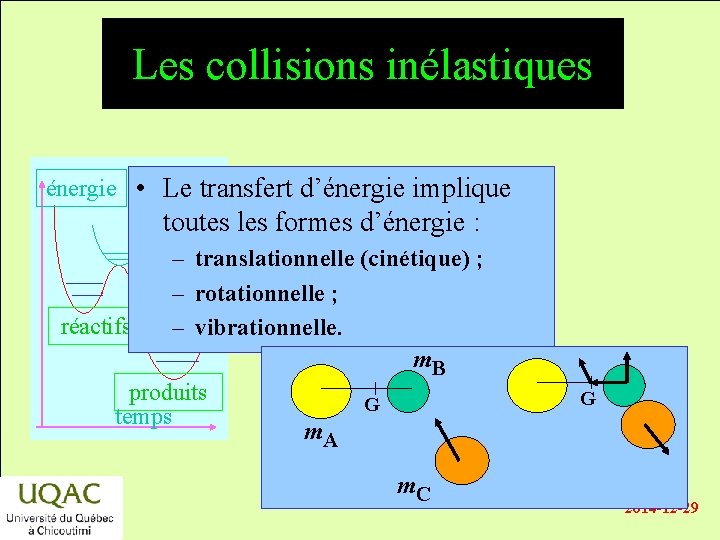
Les collisions inélastiques énergie • Le transfert d’énergie implique toutes les formes d’énergie : – translationnelle (cinétique) ; – rotationnelle ; réactifs – vibrationnelle. m. B produits G temps m. A m. C G 2014 -12 -29

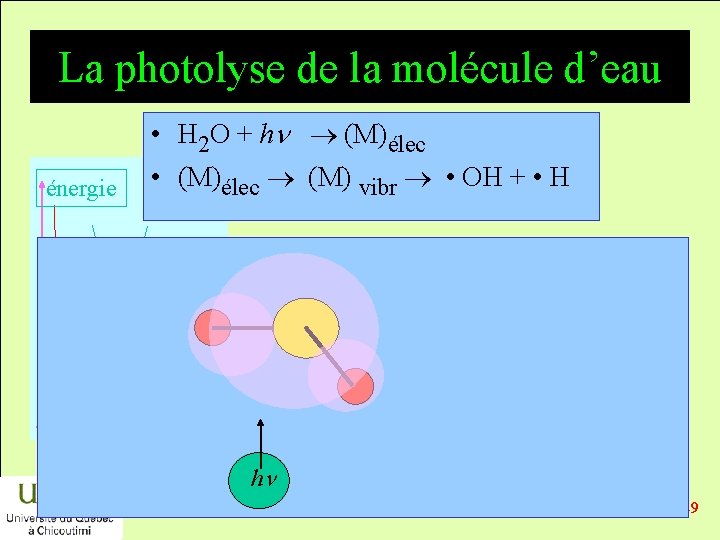
La photolyse de la molécule d’eau énergie • H 2 O + hn (M)élec • (M)élec (M) vibr • OH + • H réactifs produits temps hn 2014 -12 -29

Les réactions trimoléculaires énergie • La probabilité d’une rencontre simultanée de trois entités chimiques est faible : réactifs produits • On peut temps ignorer ce type de rencontre : pas de réactions trimoléculaires. 2014 -12 -29

Les réactions thermoléculaires • Réaction en deux étapes, la 2 e permettant énergied’évacuer le trop plein d’énergie interne. • H • + • H H 2# DH = -104 kcal/mol H 2# H • + • H DH = +104 kcal/mol H 2# + M H 2 + M # réactifs • Cl • + • Cl 2# DH = -58 kcal/mol # + M Cl + M #… Cl 2 2 produits temps • La deuxième collision doit survenir avant la terminaison de l’élongation de la liaison Cl-Cl #, soit donc dans un temps à 10 -13 secondes. 2014 -12 -29

Conclusion • La collision physique est nécessaire. énergie • L’orientation réciproque des réactifs doit être convenable. • L’énergie du complexe réactionnel doit être réactifs suffisante pour passer par-dessus la barrière de potentiel. produits • Toutes les formes d’énergie interne participent à temps la réaction. 2014 -12 -29
 Nergie merci emi
Nergie merci emi Temps fort temps faible
Temps fort temps faible Le petit prince chapitre 1
Le petit prince chapitre 1 Le petit prince résumé
Le petit prince résumé Lecture analytique petit pays chapitre 30
Lecture analytique petit pays chapitre 30 Résumé du livre tirez pas sur le scarabée
Résumé du livre tirez pas sur le scarabée Digestion chimique
Digestion chimique Constante dequilibre
Constante dequilibre Formule cuivre
Formule cuivre équilibre chimique
équilibre chimique Risque chimique définition
Risque chimique définition Famille chimique
Famille chimique Flu produit chimique
Flu produit chimique Procédé chimique
Procédé chimique Procédé chimique
Procédé chimique Les dérives du pétrole sont des matériaux synthétiques
Les dérives du pétrole sont des matériaux synthétiques Traceur chimique
Traceur chimique Composition d'un poisson
Composition d'un poisson Valence des corps chimiques
Valence des corps chimiques Déplacement chimique
Déplacement chimique Formule chimique basalte
Formule chimique basalte Affinité chimique
Affinité chimique Suc digestif
Suc digestif Elmet berango
Elmet berango Entretien professionnel quizz
Entretien professionnel quizz Classification des produits carnés
Classification des produits carnés Produits laitiers maroc
Produits laitiers maroc Aménagement durable des territoires et béton
Aménagement durable des territoires et béton Produits dérivés du palmier à huile
Produits dérivés du palmier à huile Pfc médical
Pfc médical Analyseur la texture des aliments
Analyseur la texture des aliments Cobb douglas fonction
Cobb douglas fonction Madame c.j. walker produits
Madame c.j. walker produits Liste des produits denk pharma pdf
Liste des produits denk pharma pdf Produits chimiques
Produits chimiques Liste des produits soumis au contrôle technique
Liste des produits soumis au contrôle technique Produits en croix
Produits en croix Temps vide
Temps vide Fonctionnement moteur 2 temps
Fonctionnement moteur 2 temps Attestation temps partiel
Attestation temps partiel Vivre au temps des mammouths
Vivre au temps des mammouths Histoire de la mesure du temps
Histoire de la mesure du temps