nergie Cintique chimique Chapitre 3 Cintique formelle produits



![Réaction de premier ordre A B • v = kexp [A] = - d[A]/dt Réaction de premier ordre A B • v = kexp [A] = - d[A]/dt](https://slidetodoc.com/presentation_image_h2/bcc17431ad6f4eadc7e418c759f9cb32/image-4.jpg)


![Cinétique d’une réaction d’ordre 2 [A]0 [B]0 [A]0 = [B]0 énergie t t 1 Cinétique d’une réaction d’ordre 2 [A]0 [B]0 [A]0 = [B]0 énergie t t 1](https://slidetodoc.com/presentation_image_h2/bcc17431ad6f4eadc7e418c759f9cb32/image-8.jpg)










![[A] énergie (a - x 1) log v Méthode par différence (dite aussi différentielle) [A] énergie (a - x 1) log v Méthode par différence (dite aussi différentielle)](https://slidetodoc.com/presentation_image_h2/bcc17431ad6f4eadc7e418c759f9cb32/image-20.jpg)
![Méthode de POWELL • v = - d[A] / dt = kexp [A] n Méthode de POWELL • v = - d[A] / dt = kexp [A] n](https://slidetodoc.com/presentation_image_h2/bcc17431ad6f4eadc7e418c759f9cb32/image-21.jpg)




![énergie réactifs [Concentration] Méthodes de relaxation (cas des systèmes réversibles) Perturbation d’un système à énergie réactifs [Concentration] Méthodes de relaxation (cas des systèmes réversibles) Perturbation d’un système à](https://slidetodoc.com/presentation_image_h2/bcc17431ad6f4eadc7e418c759f9cb32/image-27.jpg)

- Slides: 30

énergie Cinétique chimique Chapitre 3 Cinétique formelle produits temps La détermination expérimentale de l’ordre réactifs Guy COLLIN, 2014 -12 -29

CINÉTIQUE FORMELLE DÉTERMINATION EXPÉRIMENTALE DE L’ORDRE énergie • Comment traduire mathématiquement les réactions d’ordre simple ? réactifs • L’objet est donc de construire un modèle mathématique représentatif du phénomène produits temps observé. 2014 -12 -29

Rappels • Soit une réaction chimique : énergie – a A + b B + … m M + n N +. . . • Pourvu que la réaction soit élémentaire : – v = kexp [A]a [B] b … avec s = a + b. . . réactifs • L’expérience montre que l’on n’observe pas de produits réaction temps avec s > 3. 2014 -12 -29
![Réaction de premier ordre A B v kexp A dAdt Réaction de premier ordre A B • v = kexp [A] = - d[A]/dt](https://slidetodoc.com/presentation_image_h2/bcc17431ad6f4eadc7e418c759f9cb32/image-4.jpg)
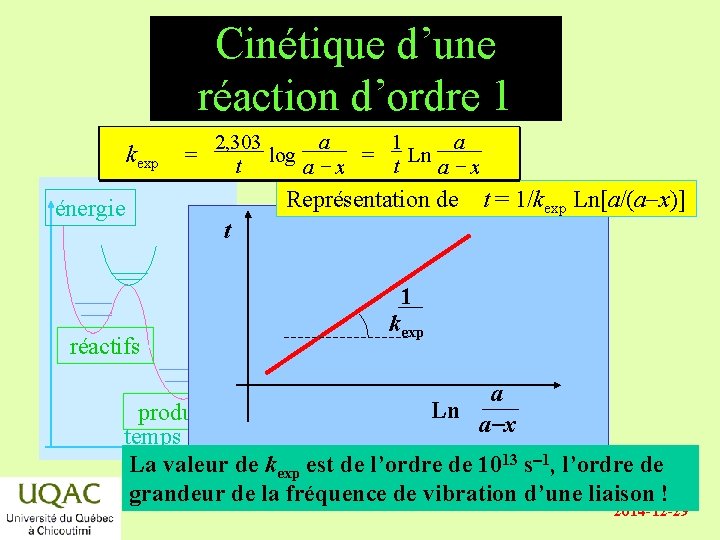
Réaction de premier ordre A B • v = kexp [A] = - d[A]/dt • Par intégration, il vient : énergie Ln [A] = Ln [A]0 - kexp t ou log [A] = log [A]0 - kexp t / 2, 303 réactifs produits temps kexp 2, 303 1 a a = t log a - x = t Ln a - x • ou a - x = a e – kexp t • avec [A]0 = a et [A] = a - x 2014 -12 -29

Cinétique d’une réaction d’ordre 1 kexp énergie réactifs = 2, 303 1 a a log = Ln t t a-x Représentation de t = 1/kexp Ln[a/(a-x)] t 1 kexp a Ln produits a-x temps La valeur de kexp est de l’ordre de 1013 s-1, l’ordre de grandeur de la fréquence de vibration d’une liaison ! 2014 -12 -29

Exemples de réactions d’ordre 1 • Décomposition énergie des radioéléments : – A* B + (hn, n, p, e-, etc. ) • Plusieurs réactions en phase gazeuse : – CH 3 OCH 3 CH 4 + HCHO réactifs • Réactions de pseudo 1 er ordre : produits – temps Cas de réactions en solutions diluées, . . . 2014 -12 -29

Réaction de deuxième ordre • Cas A + B M énergie v = kexp [A] [B] = kexp (a - x ) (b - x ) kexp = b(a - x) 2, 303 b(a - x) Ln = log t(a - b) a(b - x) 1 réactifs • Cas A + A M 2 = k (a - x )2 v = k [A] exp produits temps kexp 1 x = t a(a - x) 2014 -12 -29
![Cinétique dune réaction dordre 2 A0 B0 A0 B0 énergie t t 1 Cinétique d’une réaction d’ordre 2 [A]0 [B]0 [A]0 = [B]0 énergie t t 1](https://slidetodoc.com/presentation_image_h2/bcc17431ad6f4eadc7e418c759f9cb32/image-8.jpg)
Cinétique d’une réaction d’ordre 2 [A]0 [B]0 [A]0 = [B]0 énergie t t 1 kexp 1 / kexp réactifs b (a - x ) produits 1 temps(a - b ) Ln a (b - x ) t = [1/kexp (a-b)] Ln[b(a-x)/a(b-x)] x a (a - x) t = (1/kexp ) x/[a(a-x)] 2014 -12 -29

Exemples de réactions d’ordre 2 • Beaucoup de réactions sont d’ordre 2. énergie • Les réactions de type SN-2. • Les réactions de saponification : – RCOOC 2 H 5 + OH - RCOO- + C 2 H 5 OH réactifs • . . . produits temps Sur le webb : ? 2014 -12 -29

Réaction de troisième ordre • Cas A+B+C M 2 NO + Cl 2 2 NOCl – A+A+C M énergie 2 • v = kexp (a - x ) (c - x ) kexp = 1 t(c - a) é x(c - a) ê ë a(a - x) c(a - x) ù ú + Ln a(c x) û • Si [A] = [B] = [C], ou 3 A P réactifs kexp 1 é 1 1 ù = - ú ê 2 t ë (a - x)2 a 2 û produits Note temps : Cette fois la droite t = [ 1/(a-x)2] ne passera pas par l’origine. 2014 -12 -29

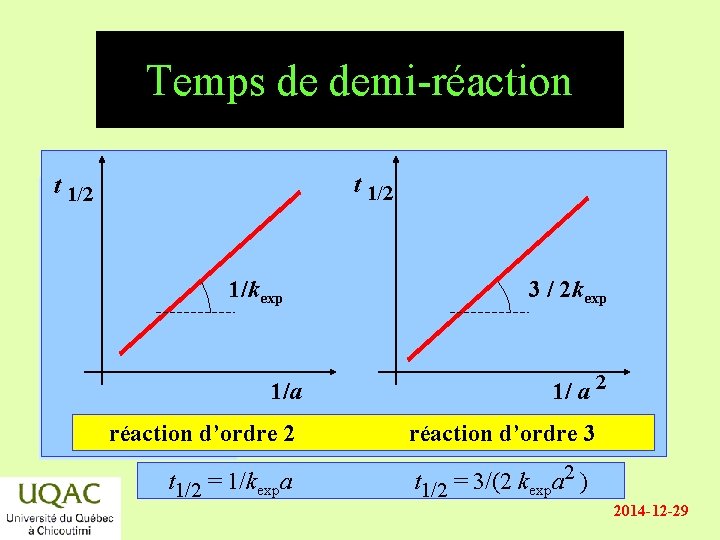
Temps de demi-réaction C’est le temps, t 1/2, au bout duquel la moitié des réactifs ont disparu. • énergie Si A B, la réaction est d’ordre 1 : v = kexp [A] t 1 / 2 = 0, 693 / kexp • Si 2 A B, la réaction est d’ordre 2 : réactifs v = kexp [A]2 t 1 / 2 = 1 / kexp a • Si 3 A B, la réaction est d’ordre 3 : produits temps v = kexp [A]3 t 1 / 2 = 3 / (2 kexp a 2) 2014 -12 -29

Quelle est l’unité de k ? • Réaction d’ordre 1 : t 1 / 2 = 0, 693 / kexp énergie unité de kexp : s-1 • Réaction d’ordre 2 : t 1 / 2 = 1 / kexp a unité de kexp : s -1 [a] -1 • réactifs Réaction d’ordre 0 : t 1 / 2 = a / 2 kexp -1 [a] +1 unité de k : s produits exp temps • Réaction d’ordre 3 : t 1 / 2 = 3 / (2 kexp a 2). . . 2014 -12 -29

Temps de demi-réaction t 1/2 énergie 1/kexp 3 / 2 kexp réactifs 1/a produits réaction temps d’ordre 2 t 1/2 = 1/kexpa 1/ a 2 réaction d’ordre 3 t 1/2 = 3/(2 kexpa 2 ) 2014 -12 -29

Dégénérescence d’ordre • Soit A + B P, v = kexp (a - x ) (b - x ) et si [A] >> [B], alors énergie v = k'(b - x ) car (a - x ) = constant La réaction d’ordre 2 devient d’ordre 1. • Soit A + B + C P + C réactifs v = kexp (a - x ) (b - x ) (c - x) Mais [C], (c - x) est constant, donc produits v = k' (a - x ) (b - x ) temps 2014 -12 -29

Exemples de dégénérescence d’ordre énergie • Cas de réactions en solution, où le solvant est l’un des réactifs : – hydrolyse en milieu dilué. réactifs • Certaines réactions catalysées : – M + H 2 O + H+ MHOH + H+ • Réactif produits temps régénéré dans la réaction. • . . . 2014 -12 -29

Réactions d’ordre zéro v = kexp (a - x )0 = kexp v = kexp = - d[A] / dt kexp = x / t et t 1 / 2 = a / 2 kexp C’est le cas de plusieurs réactions réactifs contrôlées par des processus physiques, enzymatiques, . . . • énergie • • produits temps N 2 O 5 (s) N 2 O 5 (g) 2 NO 2 + 1/2 O 2 2014 -12 -29

Détermination de l’ordre • Méthodes graphiques : énergie voir les descriptions précédentes. • Méthode numérique : constance de la constante kexp pendant la réaction. réactifs • Variation de t 1 / 2 ou constance de t 1 / 2. • Méthode par différence : produits voir ci-après. temps 2014 -12 -29

Détermination de l’ordre • Lorsqu’on ne connaît pas la valeur de la propriété observable aux temps t = 0 et au temps t = , on utilise la méthode de GUGGENHEIM (cas des réactions d’ordre 1). • Cette méthode connaît une variante appelée KEZDY réactifs - SWINBOURNE. • A travers un modèle simple, on obtient la constante produits de vitesse. énergie temps 2014 -12 -29

Détermination de l’ordre: Méthode différentielle énergie • v 1 = k (a - x 1)a à t 1 ou log v 1 = log k + a log (a - x 1) • v 2 = k (a - x 2)a à t 2 ou log v 2 = log k + a log (a - x 2) réactifs produits • a peut être entier, quelconque, fractionnaire, . . . temps 2014 -12 -29
![A énergie a x 1 log v Méthode par différence dite aussi différentielle [A] énergie (a - x 1) log v Méthode par différence (dite aussi différentielle)](https://slidetodoc.com/presentation_image_h2/bcc17431ad6f4eadc7e418c759f9cb32/image-20.jpg)
[A] énergie (a - x 1) log v Méthode par différence (dite aussi différentielle) v 1 (a - x 2) réactifs produits temps a v 2 t 1 t 2 t log (a - x) • Méthode qui ne se limite pas aux ordres entiers. 2014 -12 -29
![Méthode de POWELL v dA dt kexp A n Méthode de POWELL • v = - d[A] / dt = kexp [A] n](https://slidetodoc.com/presentation_image_h2/bcc17431ad6f4eadc7e418c759f9cb32/image-21.jpg)
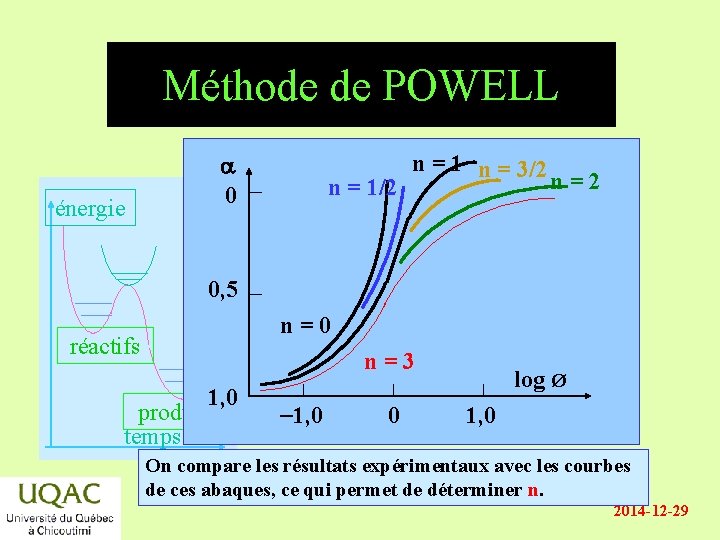
Méthode de POWELL • v = - d[A] / dt = kexp [A] n • Soient [A]/[A]0 = a et énergie Ø = kexp [A]0 n-1 t • Si l’ordre est différent de 1 et en remplaçant : réactifs produits temps kexp é 1 1 1 ù - - ú = (n -1) t ê n 1 ë (a - x) an 1û (n - 1 ) Ø = a - 1 2014 -12 -29

Méthode de POWELL énergie a 0 n = 1/2 n = 1 n = 3/2 n=2 0, 5 n=0 réactifs n=3 1, 0 produits temps -1, 0 0 log Ø 1, 0 On compare les résultats expérimentaux avec les courbes de ces abaques, ce qui permet de déterminer n. 2014 -12 -29

Méthode systématique basée sur la vitesse initiale • La vitesse est de la forme v = kexp [A]a [B] b • énergie Sous la forme logarithmique : • Ln v = Ln kexp + a Ln [A] + b Ln [B] • Lorsqu’il y a plusieurs réactifs, on applique la méthode en obtenant en premier lieu une série réactifs de vitesses initiales en fonction de concentrations initiales différentes d’un des produits tempsla concentration de l’autre étant gardée réactifs, constante. 2014 -12 -29

Méthode systématique basée sur la vitesse initiale (suite) • On porte en graphique Ln vo en fonction de Ln [A]o et obtenir une droite dont la pente énergie est égale à a et dont l’ordonnée à l’origine est Ln kexp + b Ln [B]o • Il s’agit ensuite de faire une seconde série réactifs d’expériences où cette fois la concentration initiale du réactif A, [A]o, sera gardée produits constante. temps 2014 -12 -29

Des méthodes pour des réactions rapides ou très rapides • Les méthodes précédentes s’adaptent bien énergie lorsque la réaction se déroule en une minute et plus. • Il faut construire un appareillage capable de suivre la réaction en des temps plus courts : réactifs – méthodes de relaxation, – produits méthode des tubes à choc, temps – méthode des faisceaux moléculaires. 2014 -12 -29

Relations entre les méthodes et les vitesses réactions énergie réactifs produits temps 2014 -12 -29
![énergie réactifs Concentration Méthodes de relaxation cas des systèmes réversibles Perturbation dun système à énergie réactifs [Concentration] Méthodes de relaxation (cas des systèmes réversibles) Perturbation d’un système à](https://slidetodoc.com/presentation_image_h2/bcc17431ad6f4eadc7e418c759f9cb32/image-27.jpg)
énergie réactifs [Concentration] Méthodes de relaxation (cas des systèmes réversibles) Perturbation d’un système à l’équilibre Perturbation de : - température ; - pression ; (Dx) - champ électrique, . . . produits temps t=0 Temps 2014 -12 -29

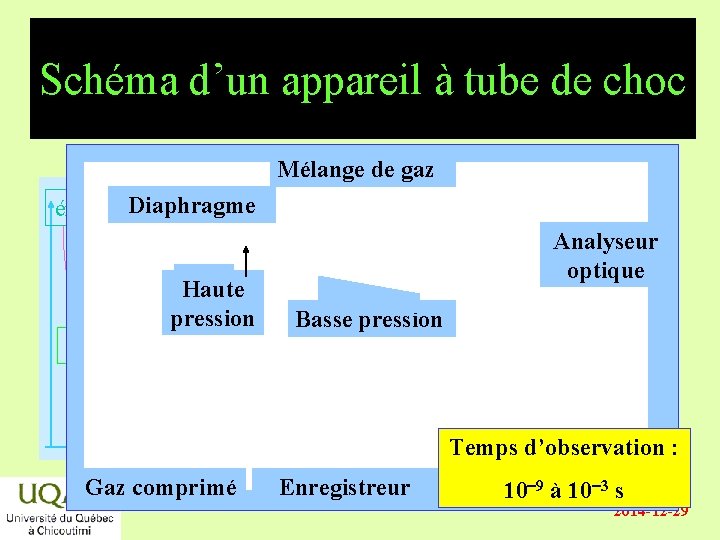
Schéma d’un appareil à tube de choc Mélange de gaz énergie Diaphragme Haute pression Analyseur optique Basse pression réactifs produits temps Gaz comprimé Temps d’observation : Enregistreur 10 -9 à 10 -3 s 2014 -12 -29

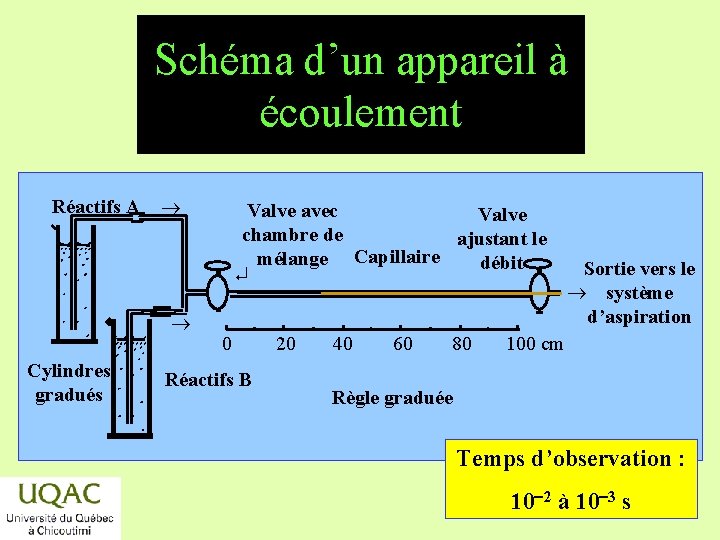
Schéma d’un appareil à écoulement Réactifs énergie. A réactifs Cylindres gradués Valve avec Valve chambre de ajustant le mélange Capillaire débit ¿ 0 Réactifs B produits temps 20 40 60 80 Sortie vers le système d’aspiration 100 cm Règle graduée Temps d’observation : 10 -2 à 10 -32014 -12 -29 s

Conclusion • Les réactions d’ordre simple se traduisent par énergie une mathématique simple. • Les constantes de vitesse s’expriment comme l’inverse d’un temps. réactifs • Les vitesse de réactions d’ordre 1 sont indépendantes de la concentration des réactifs. produits temps 2014 -12 -29
 Nergie merci emi
Nergie merci emi Le petit prince chapitre 5
Le petit prince chapitre 5 Le petit prince résumé
Le petit prince résumé Petit pays chapitre par chapitre
Petit pays chapitre par chapitre Résumé chapitre par chapitre tirez pas sur le scarabée
Résumé chapitre par chapitre tirez pas sur le scarabée Constante dequilibre
Constante dequilibre Formule cuivre
Formule cuivre Risque chimique définition
Risque chimique définition Famille chimique
Famille chimique Flu produit chimique
Flu produit chimique Procédé chimique
Procédé chimique Procédé chimique
Procédé chimique Les dérives du pétrole sont des matériaux synthétiques
Les dérives du pétrole sont des matériaux synthétiques Traceur chimique
Traceur chimique Poisson composition
Poisson composition Famille chimique
Famille chimique Déplacement chimique
Déplacement chimique Formule plagioclase
Formule plagioclase Affinité chimique
Affinité chimique Absorption intestinale
Absorption intestinale équilibre chimique
équilibre chimique Metallo chimique beerse
Metallo chimique beerse Systme digestif
Systme digestif Classification des produits carnés
Classification des produits carnés Entretien professionnel quizz
Entretien professionnel quizz Produits laitiers maroc
Produits laitiers maroc Aménagement durable des territoires et produits béton
Aménagement durable des territoires et produits béton Exacyl nedir
Exacyl nedir Produits dérivés du palmier à huile
Produits dérivés du palmier à huile Analyseur de texture pour produits alimentaires
Analyseur de texture pour produits alimentaires Cobb douglas fonction
Cobb douglas fonction