nergie ractifs Cours de Cintique chimique produits temps
























- Slides: 31

énergie réactifs Cours de Cinétique chimique produits temps Guy COLLIN, 2014 -12 -29

Cinétique chimique énergie Chapitre 1 réactifs Caractères généraux de la cinétique des réactions homogènes produits temps 2014 -12 -29

CARACTÈRES GÉNÉRAUX DE LA CINÉTIQUE DES RÉACTIONS HOMOGÈNES énergie • Quel est le lien, quels sont les liens qui existent entre le déroulement réactifs d’une réaction chimique et le temps ? produits temps 2014 -12 -29

Objectifs spécifiques • Assimiler le vocabulaire utilisé. • Comprendre les différentes définitions de vitesse énergie de réaction. • Aborder les relations qui existent entre : – la vitesse d’une réaction et le mécanisme réactionnel ; – la vitesse de réaction et la température de réaction ; réactifs – la thermochimie et la cinétique chimique ; produits – … temps 2014 -12 -29

Notions de mécanismes élémentaires • Réaction élémentaire : A+B M+N énergie C’est une réaction qui a lieu en une étape, par exemple, au moment de la collision des deux réactifs Autre exemple : cyclo-C 4 H 8 2 C 2 H 4 produits temps • Molécularité : H 2 + I 2 2 HI, molécularité : 2 2014 -12 -29

Notions de mécanismes élémentaires • La succession d’étapes élémentaires énergie forme un mécanisme global : • réactifs Autre exemple : produits temps Réaction globale : 2 NO· + 2 H 2 O + N 2 2014 -12 -29

Vitesses de réaction : définitions • Soit la réaction a A + b B m M + n N énergie • Par rapport à un réactif, la vitesse totale est : v. A = - d. NA/dt ; v. M = + d. NM/dt • Par unité de volume V, la vitesse spécifique est : réactifs VA = v. A /V ; VM = v. M /V • À volume constant : produits Ø -1/V d. NA/dt = - 1/dt d(d. NA/V) = - d[A]/dt temps • À pression constante (le volume V varie). 2014 -12 -29

L’ordre d’une réaction • Soit la réaction a A + b B m M + n N énergie • Si VA = k [A]a [B] b • L’ordre partiel de la réaction est : a est l’ordre partiel par rapport à A, . . . • L’ordre global de la réaction est : réactifs a + b = s, s est l’ordre global. produits temps L’ordre est une notion expérimentale ! 2014 -12 -29

Réaction globale = réaction élémentaire : La règle de Van’t Hoff • Condition nécessaire : – ordres partiels coefficients stœchiométriques; – ordre global molécularité de la réaction. énergie réactifs • L’ordre global est égal à la molécularité. produits temps • En fait, est-on bien sûr du mécanisme ? 2014 -12 -29

La règle de Van’t Hoff • C’est une condition insuffisante. Exemple : énergie réactifs KT = [C]/([A] [B]) ou encore [C] = KT [A] [B] produits temps v = k [C] [D] = k KT [A] [B] [D] 2014 -12 -29

La règle de Van’t Hoff (suite) • Ordre simple mais différent de la énergie stœchiométrie : – la réaction n’est pas élémentaire, mais une suite de réactions élémentaires ; – ordre peu ou pas simple : la réaction est globale et peut-être même complexe. réactifs produits H 2 + Br 2 2 HBr temps k [H 2] [Br 2]1/2 où v = [HBr] 1 + k' [Br ] 2 2014 -12 -29

Principes guidant le choix d’un mécanisme réactionnel énergie • Grande simplicité. • Respect de la thermodynamique. • Changement très simple dans les structures. • En résumé, exercer son sens critique de réactifs chimiste. produits temps 2014 -12 -29

Nature de l’activation des processus de réaction énergie • L’activation peut être de nature : – thermique (pyrolyse) • CH 3 -N=N-CH 3 C 2 H 6 + N 2 ( 400 ˚C) – photochimique (photolyse, radiolyse) • iso-C 4 H 8 + hn H + CH 3 + C 3 H 4 réactifs – électrochimique (l’électrolyse) • électrolyse de l’alumine –. . . produits temps 2014 -12 -29

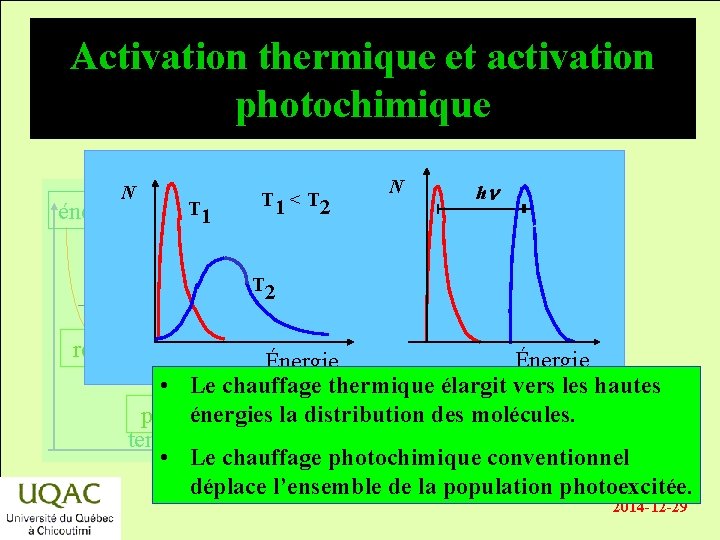
Activation thermique et activation photochimique N énergie T 1 < T 2 N hn T 2 réactifs Énergie • Le chauffage thermique élargit vers les hautes énergies la distribution des molécules. produits temps • Le chauffage photochimique conventionnel déplace l’ensemble de la population photoexcitée. 2014 -12 -29

Nature des entités participant aux actes élémentaires • Les formes réactives (en plus des espèces elles-mêmes). énergie • Les formes intermédiaires. – Exemple : forme énolisée des cétones. • Les atomes : réactifs produits temps – • H, • Cl, • Br, He, . . . • Les radicaux libres : – • CH 3, • C 2 H 5, . . . • Les ions positifs et négatifs : – NH 4+, Cl -, OH -, . . . 2014 -12 -29

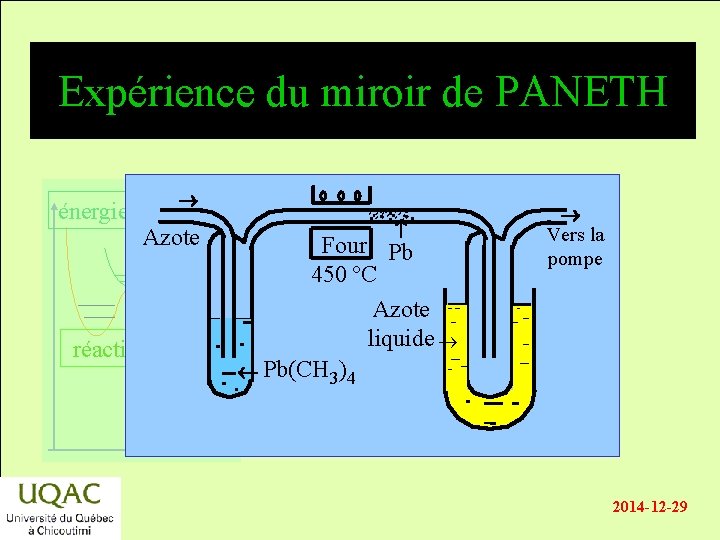
Expérience du miroir de PANETH énergie Azote réactifs Four Pb 450 ºC Azote liquide Pb(CH 3)4 Vers la pompe produits temps 2014 -12 -29

Dispositif de POLANYI énergie CH Cl 3 réactifs Na CH 3 Cl + Na CH 3 + I 2 CH 3 I Na. Cl I 2 produits temps La décomposition du CH 3 Cl libère des radicaux méthyles qui réagissent avec l’iode. 2014 -12 -29

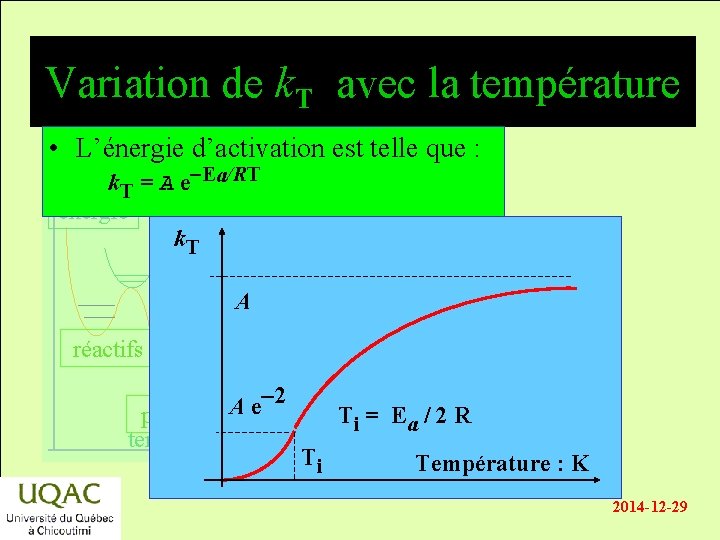
Influence de la température sur la vitesse de réaction • La constante de vitesse (coefficient de vitesse) : – V = k. T ƒ([A], [B], …); énergie – k. T ne dépend que de T. • L’équation d’ARRHÉNIUS : réactifs – Ln k. T = B - C/T • L’énergie d’activation : – k. T = A e-Ea/RT produits temps • L’influence de la température : – Si T croît, k. T croît. 2014 -12 -29

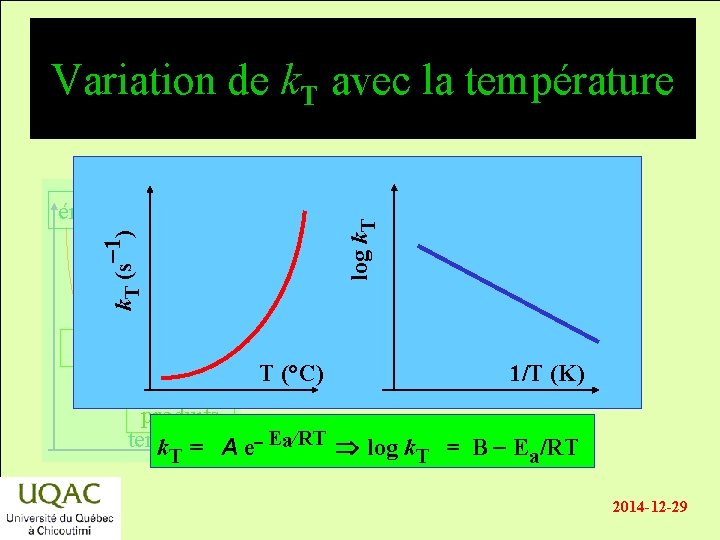
Variation de k. T avec la température k. T (s-1) log k. T énergie réactifs T (°C) 1/T (K) produits temps k. T = A e- Ea/RT log k. T = B - Ea/RT 2014 -12 -29

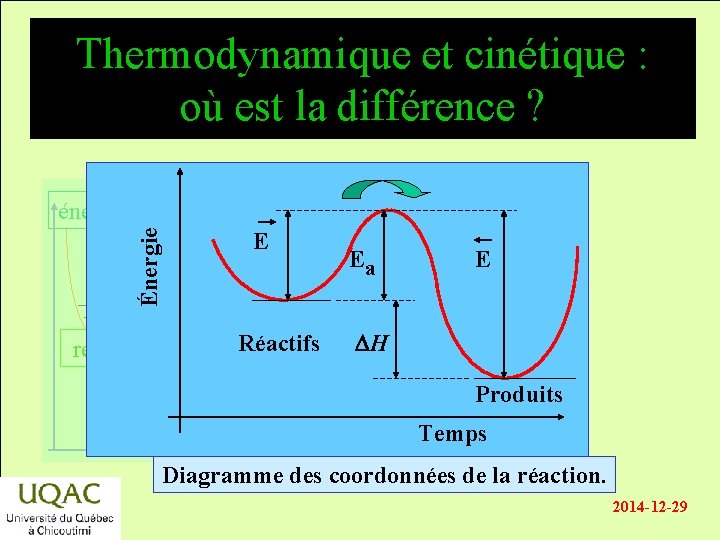
Thermodynamique et cinétique : où est la différence ? Énergie énergie E Réactifs réactifs produits temps Ea E DH Produits Temps Diagramme des coordonnées de la réaction. 2014 -12 -29

Variation de k. T avec la température • L’énergie d’activation est telle que : k. T = A e-Ea/RT énergie k. T A réactifs -2 A e produits temps Ti = E a / 2 R Ti Température : K 2014 -12 -29

Établissement d’un mécanisme réactionnel énergie • Méthodes expérimentales : – physiques : mesures électriques; – chimiques : titrages chimiques; – continues : spectroscopies; – discontinues : chromatographies; réactifs – destructives : titrages chimiques; produits – non destructives : mesures physiques. temps • Obligation du contrôle fin de T. 2014 -12 -29

Exemple de méthode expérimentale • Titrage acide – base : énergie – Exemple : hydrolyse en milieu acide, H+ ester + eau acide + alcool • Titrages chimiques : – Dosage de l’iode par le thiosulfate ; réactifs – Dosage des ions halogénures par Ag. NO 3 ; –. . . produits temps 2014 -12 -29

Exemple de méthode expérimentale • Variation de propriété physique : énergie – densité ; – Volume : • Acétal + eau aldéhyde + 2 alcools • Polymérisation en phase liquide, . . . réactifs – Masse : • Thermobalance : décomposition des carbonates Masse produits temps Température 2014 -12 -29

Exemple de méthode expérimentale Conductivité énergie Temps • Variation des propriétés électriques. • Par exemple, la conductivité électrique : Hydrolyse d’un ester par les ions OH - réactifs CH 3 COOC 2 H 5 + OH- CH 3 COO- + C 2 H 5 OH Les ions CH 3 COO- sont moins bons conducteurs que produits les ions OH -. temps 2014 -12 -29

Exemple de méthode expérimentale énergie • Variation dans le spectre d’absorption (infrarouge, visible, UV, Raman, RMN, …). Exemples : – CH 3 COCH 3 + Br 2 - + H+ CH COCH Br + Br réactifs 3 2 – On suit la disparition du brome par spectroscopie dans le visible. . . produits temps 2014 -12 -29

Exemple de méthode expérimentale énergie réactifs • Variations de l’indice de réfraction, du pouvoir rotatoire. • Exemple : inversion du sucrose C 12 H 22 O 11 + H 2 O + H+ C 6 H 12 O 6 + H + produits temps Le pouvoir rotatoire du sucrose est différent de la somme de ceux des deux sucres formés. 2014 -12 -29

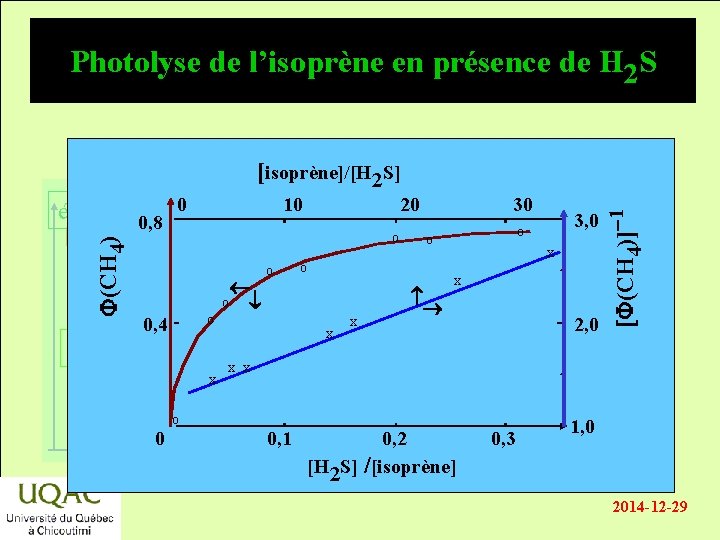
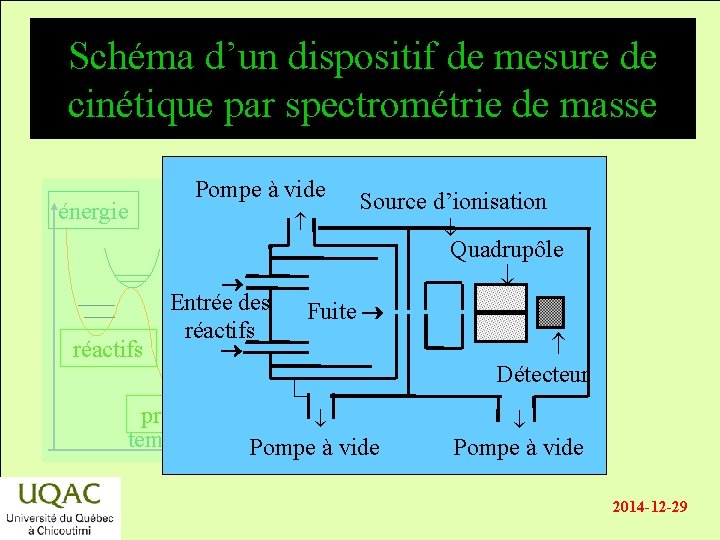
Exemple de méthode expérimentale • Chromatographie, spectrométrie de masse, . . . énergie – Exemple : photolyse de l’isoprène, cinétique de réaction des radicaux méthyles : [1] • CH 3 + H 2 S CH 4 + HS • [2] • CH 3 + C 5 H 8 • C 6 H 11 réactifs [F(CH 4)]-1 = a + a (k 2/k 1) [C 5 H 8]/[H 2 S] produits La figure ci-jointe donne k 2/k 1 temps 2014 -12 -29

Photolyse de l’isoprène en présence de H 2 S F(CH 4) énergie 0, 8 0 0, 4 10 20 o o réactifs x produits o 0 temps o ¯ o 30 o o x x 3, 0 o x x 2, 0 [F(CH 4)]-1 [isoprène]/[H 2 S] x x 0, 1 0, 2 [H 2 S] /[isoprène] 0, 3 1, 0 2014 -12 -29

Schéma d’un dispositif de mesure de cinétique par spectrométrie de masse énergie Pompe à vide Source d’ionisation Quadrupôle réactifs Entrée des réactifs produits temps Fuite Détecteur Pompe à vide 2014 -12 -29

Conclusion • L’ordre : une notion fondamentale. • La température intervient à travers énergie l’énergie d’activation. • En cinétique, l’énergie d’activation est le paramètre important. réactifs k T = A e-Ea/RT • Rappel : en thermodynamique, produits temps l’enthalpie est le paramètre important. 2014 -12 -29
 Nergie merci emi
Nergie merci emi Balais à tapis 1860
Balais à tapis 1860 Crise biologique
Crise biologique Temps fort temps faible
Temps fort temps faible Traceur chimique
Traceur chimique Composition chimique du poisson
Composition chimique du poisson Déplacement chimique
Déplacement chimique Valence des corps chimiques
Valence des corps chimiques Plagioclase formule
Plagioclase formule L'affinité chimique
L'affinité chimique Molécule simple
Molécule simple équilibre chimique
équilibre chimique Elmet berango
Elmet berango Digestion chimique
Digestion chimique Potentiel chimique
Potentiel chimique Formule chimique c
Formule chimique c Procédé chimique
Procédé chimique Risque chimique définition
Risque chimique définition Famille chimique
Famille chimique Flu produit chimique
Flu produit chimique Procédé chimique
Procédé chimique Les dérives du pétrole sont des matériaux synthétiques
Les dérives du pétrole sont des matériaux synthétiques Jutosité de la viande
Jutosité de la viande Liste des produits denk pharma
Liste des produits denk pharma Differenciation verticale et horizontale des produits
Differenciation verticale et horizontale des produits Madame jc walker
Madame jc walker Produits chimiques
Produits chimiques Liste des produits soumis au contrôle technique
Liste des produits soumis au contrôle technique Produits en croix
Produits en croix Classification des produits carnés
Classification des produits carnés Entretien du cadre de vie
Entretien du cadre de vie Produits laitiers maroc
Produits laitiers maroc