nergie Cintique chimique ractifs produits temps Chapitre 7








![Caractéristiques physico-chimiques de la flamme [ion positif] / cm 3 Échelle arbitraire énergie 1, Caractéristiques physico-chimiques de la flamme [ion positif] / cm 3 Échelle arbitraire énergie 1,](https://slidetodoc.com/presentation_image_h/3587ffe9a75ecc5a007c40d055360f1b/image-17.jpg)





- Slides: 24

énergie Cinétique chimique réactifs produits temps Chapitre 7 La chimie des flammes Guy COLLIN, 2014 -12 -29

LA CHIMIE DES FLAMMES énergie • Que se passe-t-il dans une flamme ? • Quelle est la cinétique chimique ? réactifs • Quelles sont les entités formées ? • Quels sont les éléments émetteurs de produits lumière ? temps 2014 -12 -29

Le mécanisme réactionnel • Amorçage : énergie – RH + O 2 R • + HO 2 • , DH = 190 -210 k. J/mol • Propagation linéaire de la chaîne : – réactifs – – produits – temps – R • + O 2 RO 2 • , EA 0 k. J/mol R • + O 2 oléfine + HO 2 • RO 2 • + RH ROOH + R • RO 2 • R’CHO + R"O • HO 2 • + RH H 2 O 2 + R • 2014 -12 -29

Le mécanisme réactionnel (suite) • Propagation ramifiante de la chaîne : – ROOH RO • + • OH, énergie – R’CHO + O 2 R’CO • + HO 2 • , DH = 134 -138 k. J/mol • Propagation linéaire : – OH + RH H 2 O + R • – R’CO • R’ + CO réactifs – R ’CO • + O 2 • R’C(=O) O O • • Rupture de chaîne : – R’CO • + R" • non porteur de chaîne ; produits – temps RO 2 • + parois non porteur de chaîne ; –. . . 2014 -12 -29

Le cas du méthane • Amorçage : – CH 4 + O 2 CH 3 • + HO 2 • , DH = 190 -210 k. J/mol énergie • Propagation linéaire et divergente : – CH 3 • + O 2 CH 3 O 2 • , EA 0 k. J/mol – CH 3 O 2 • HCHO + • OH réactifs – CH 4 + • OH CH 3 • + H 2 O – HCHO + O 2 HCO • + HO 2 • produits – CH 4 + HO 2 • H 2 O 2 + CH 3 • temps – HCHO + HO 2 • H 2 O 2 + HCO • 2014 -12 -29

Le cas du méthane (suite et fin) énergie • Rupture de chaîne : réactifs – • OH + parois non porteur de chaîne ; – HCHO + parois non porteur de chaîne. produits temps 2014 -12 -29

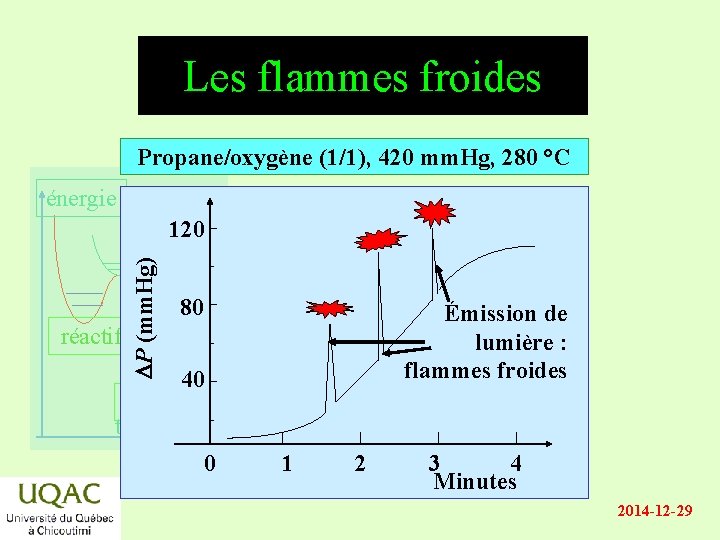
Les flammes froides Propane/oxygène (1/1), 420 mm. Hg, 280 °C énergie DP (mm. Hg) 120 80 Émission de lumière : flammes froides réactifs 40 produits temps 0 1 2 3 4 Minutes 2014 -12 -29

Le mécanisme de formation des flammes froides • Mécanisme suggéré par Semenov. énergie • Formation d’un intermédiaire peut réactif. • Cet intermédiaire est un hydroperoxyde à long temps de vie, gelant en quelque sorte l’explosion : réactifs produits temps On appelle ce mécanisme une ramification dégénérée. 2014 -12 -29

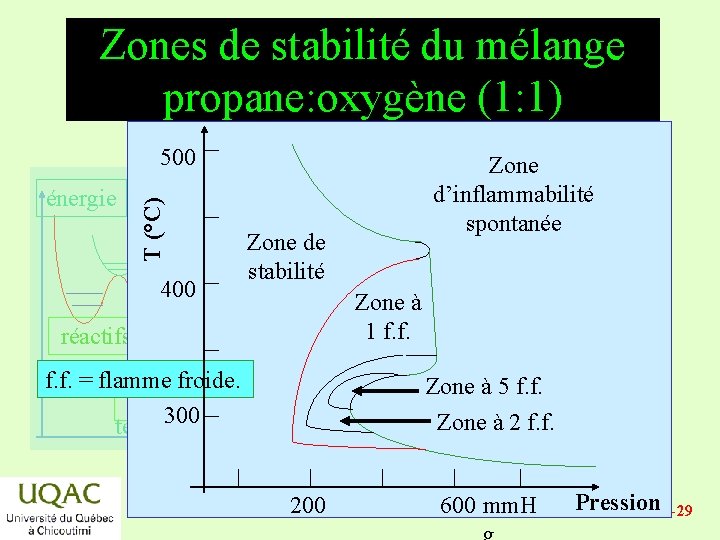
Zones de stabilité du mélange propane: oxygène (1: 1) énergie T (°C) 500 400 Zone d’inflammabilité spontanée Zone de stabilité Zone à 1 f. f. réactifs f. f. = flamme froide. produits temps 300 Zone à 5 f. f. Zone à 2 f. f. 200 600 mm. H Pression 2014 -12 -29

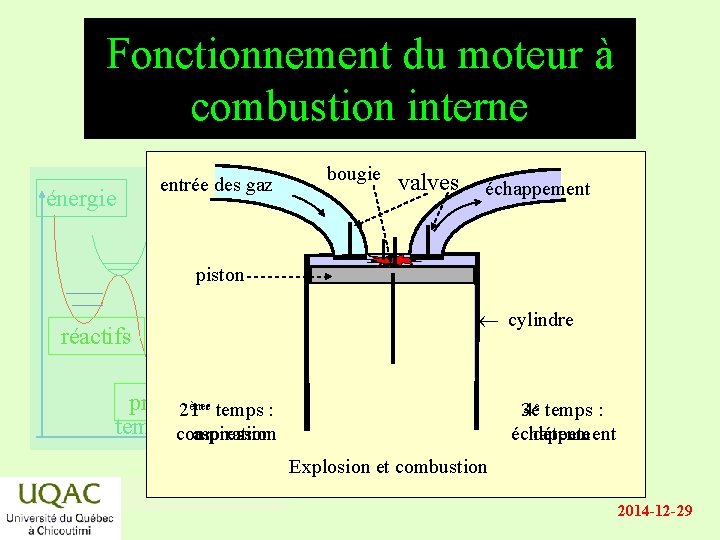
Fonctionnement du moteur à combustion interne énergie entrée des gaz bougie valves échappement piston réactifs cylindre produits 2ème 1 er temps : temps compression aspiration 3 e temps : 4 e temps : échappement détente Explosion et combustion 2014 -12 -29

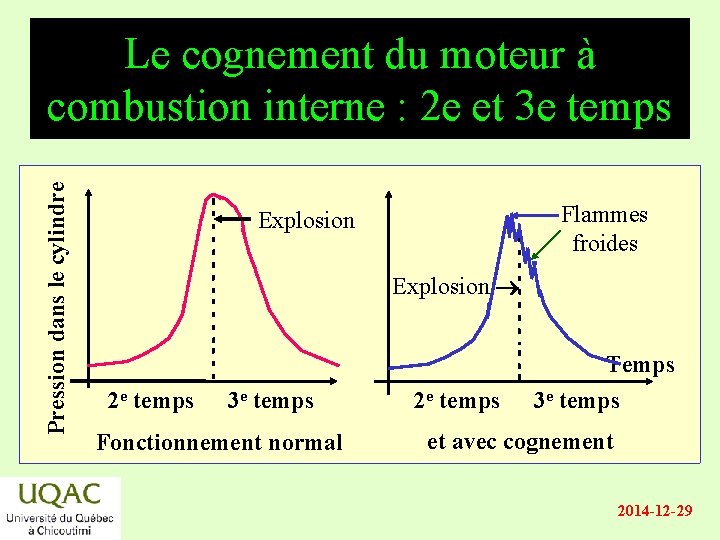
Pression dans le cylindre Le cognement du moteur à combustion interne : 2 e et 3 e temps énergie Flammes froides Explosion réactifs 2 e temps produits 3 e temps Fonctionnement normal 2 e temps Temps 3 e temps et avec cognement 2014 -12 -29

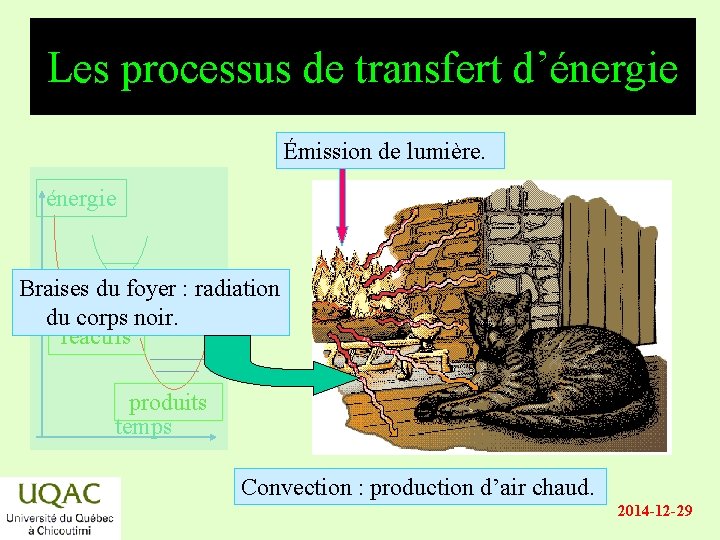
Les processus de transfert d’énergie Émission de lumière. énergie Braises du foyer : radiation du corps noir. réactifs produits temps Convection : production d’air chaud. 2014 -12 -29

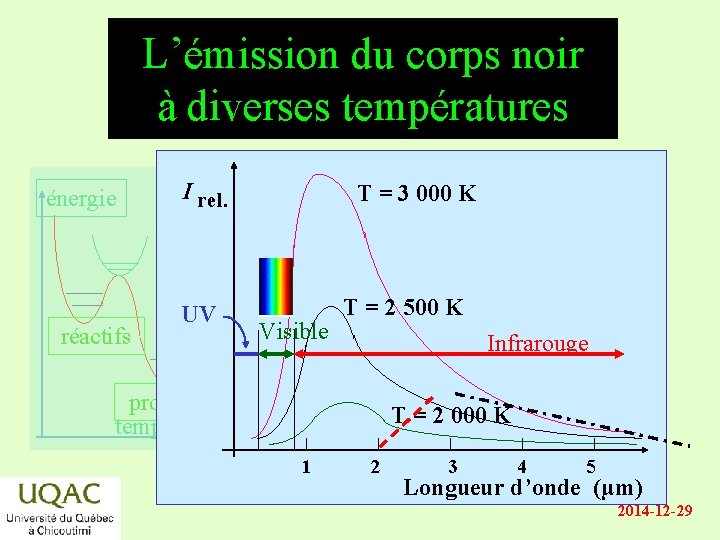
L’émission du corps noir à diverses températures énergie réactifs I rel. UV T = 3 000 K Visible T = 2 500 K Infrarouge produits temps T = 2 000 K 1 2 3 4 5 Longueur d’onde (µm) 2014 -12 -29

La chimiluminescence • Dans une flamme (foyer, par exemple) : – H • + H • + Na H 2 + Na* – H • + • OH + Na H 2 O+ Na* – Na* Na + hn, raies D énergie • Chalumeau oxyacétylénique : réactifs – CH • + O 2 • OH rot + CO, Trot = 5 400 K • Autres exemples : – C 2 + • OH CH* + CO produits + + e CH • + C * – H C C CH temps 2 3 2 – (CN) 2 + O 2 CN rot + ? , Trot = 4 800 K 2014 -12 -29

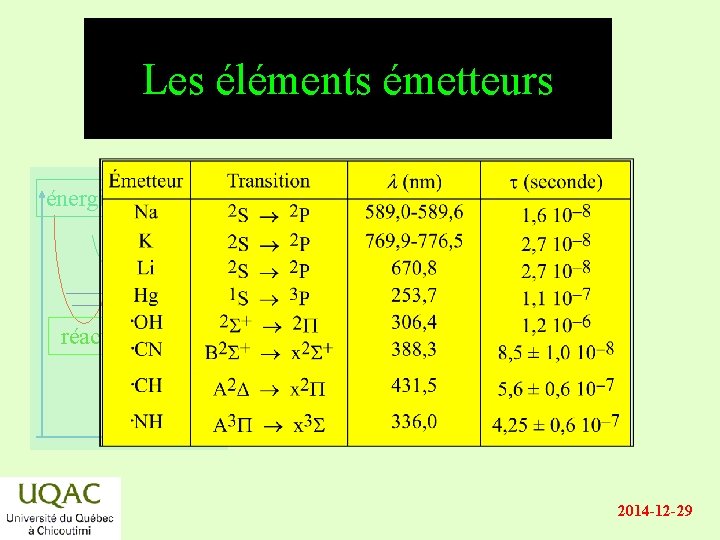
Les éléments émetteurs énergie réactifs produits temps 2014 -12 -29

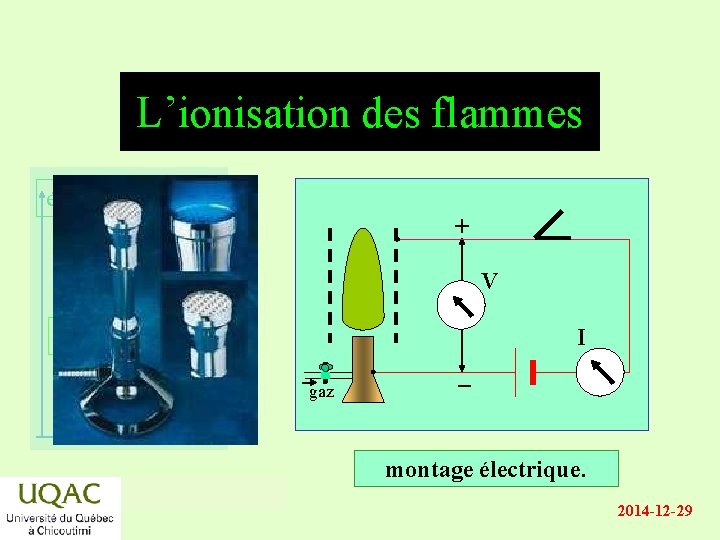
L’ionisation des flammes énergie + V réactifs produits temps I gaz montage électrique. 2014 -12 -29
![Caractéristiques physicochimiques de la flamme ion positif cm 3 Échelle arbitraire énergie 1 Caractéristiques physico-chimiques de la flamme [ion positif] / cm 3 Échelle arbitraire énergie 1,](https://slidetodoc.com/presentation_image_h/3587ffe9a75ecc5a007c40d055360f1b/image-17.jpg)
Caractéristiques physico-chimiques de la flamme [ion positif] / cm 3 Échelle arbitraire énergie 1, 0 réactifs 2 000 °C T de la flamme 1 000 0, 5 produits temps Zone lumineuse 2 0 2 mm Distance par rapport au brûleur 2014 -12 -29

L’ionisation des flammes : mécanismes • Réaction clé : – • CH(a 4 S) + • O (3 P) CHO+ + e DH = + 12 k. J/mol énergie • Rappels thermodynamiques : – • CH* + • O (3 P) CHO+ + e * = • CH(x 2 P), état fondamental, DH = + 83 k. J/mol * = • CH(A 2 D), état électronique excité, DH = 192 k. J/mol réactifs • Réactions de moindre probabilité : + + O + e DH = 188 k. J/mol – • CH* + O CHO 2 produits + + OH temps – • CH* + HO • CHO DH = 96 k. J/mol 2 – • CH* + HO • H + CHO + + e DH = + 8 k. J/mol 2 2 2014 -12 -29

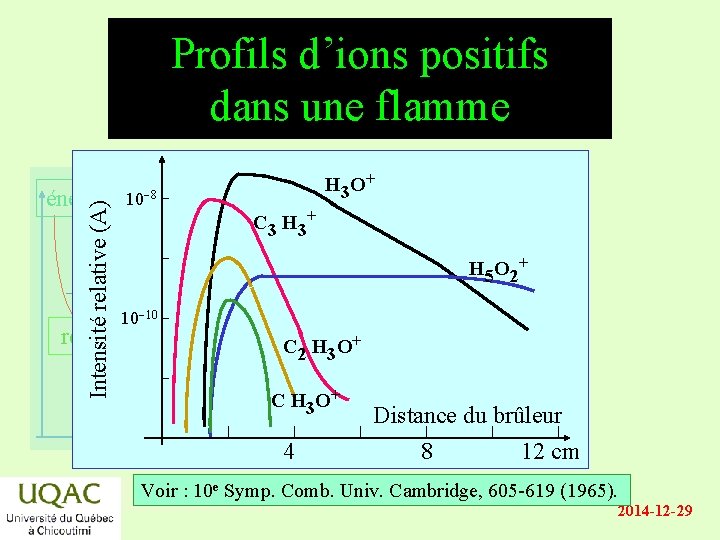
Profils d’ions positifs dans une flamme Intensité relative (A) énergie 10 8 H 3 O+ C 3 H 3+ H 5 O 2+ 10 10 réactifs C 2 H 3 O+ produits temps C H 3 O+ 4 Distance du brûleur 8 12 cm Voir : 10 e Symp. Comb. Univ. Cambridge, 605 -619 (1965). 2014 -12 -29

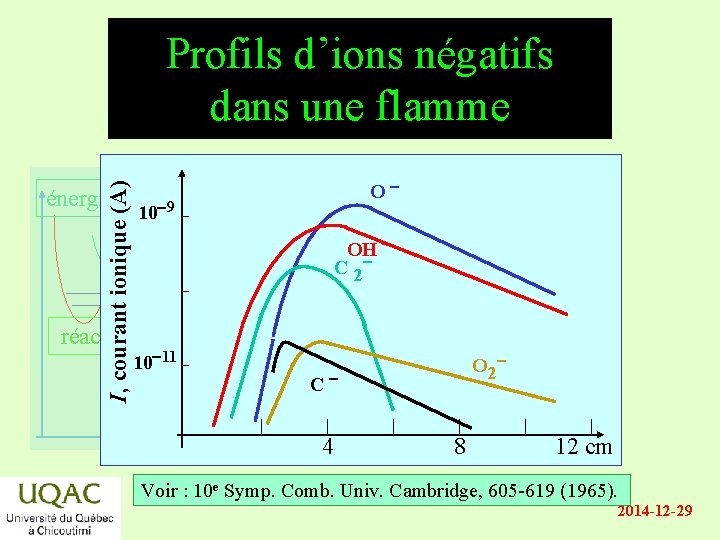
I, courant ionique (A) Profils d’ions négatifs dans une flamme énergie réactifs O 10 9 OH C 2 10 11 produits temps O 2 C 4 8 12 cm Voir : 10 e Symp. Comb. Univ. Cambridge, 605 -619 (1965). 2014 -12 -29

Les ions dans la flamme énergie • Concentrations relatives des ions positifs : – à faibles distances: [C 3 H 3+] > [C 2 H 3 O+] >> etc. – à longues distances: [H 3 O+] > [H 5 O 2+] > etc. • Concentrations relatives des ions négatifs : réactifs – [O ] [OH ] > [C 2 ] > etc. produits temps 2014 -12 -29

Utilisation de la chimionisation • En chromatographie, le détecteur à ionisation de flamme : énergie – très bonne sensibilité, stabilité et fiabilité de la réponse ; – la réponse du détecteur est proportionnelle à la concentration en carbone. • Optimisation du fonctionnement des fournaises industrielles réactifs : la formation d’ions est maximum lorsque le rapport combustible/comburant est optimum. produits temps 2014 -12 -29

Formation de la suie ou du noir de carbone • Cheminées, noir de carbone, combustion incomplète des énergie noyaux benzéniques , . . . réactifs produits temps – Voir aussi la formation de C 3 H 3+ 2014 -12 -29

Conclusion • La chimie des flammes est caractérisée par : énergie – de la chaleur provenant de la rupture ou de la formation de liaisons ; – des radicaux libres excités ou non ; – des ions positifs et négatifs (chimionisation) ; réactifs – de la lumière provenant d’espèces produits électroniquement excitées (fluorescence) ; temps – la formation de suie (combustion incomplète). 2014 -12 -29
 Nergie merci emi
Nergie merci emi Temps fort temps faible
Temps fort temps faible Le petit prince résumé chapitre par chapitre
Le petit prince résumé chapitre par chapitre Petit pays chapitre 1
Petit pays chapitre 1 Résumé du livre tirez pas sur le scarabée
Résumé du livre tirez pas sur le scarabée Le petit prince chapitre 5
Le petit prince chapitre 5 Risque chimique définition
Risque chimique définition Famille chimique
Famille chimique Flu produit chimique
Flu produit chimique Procédé chimique
Procédé chimique Procédé chimique
Procédé chimique Espèce chimique naturelle exemple
Espèce chimique naturelle exemple Traceur chimique
Traceur chimique Poisson composition
Poisson composition Déplacement chimique
Déplacement chimique Famille chimique
Famille chimique Basalte formule chimique
Basalte formule chimique L'affinité chimique
L'affinité chimique La digestion in vitro du pain par l amylase salivaire
La digestion in vitro du pain par l amylase salivaire Elmet berango
Elmet berango Systme digestif
Systme digestif Constante d'equilibre
Constante d'equilibre Formule chimique c
Formule chimique c équilibre chimique
équilibre chimique Produits laitiers maroc
Produits laitiers maroc