nergie Cintique chimique ractifs Chapitre 6 produits La





![Profils de T (°C) et de concentration ([M]) de la basse atmosphère - 80 Profils de T (°C) et de concentration ([M]) de la basse atmosphère - 80](https://slidetodoc.com/presentation_image_h/007db7a38ab385be8dfc787c011c67b0/image-9.jpg)










![énergie réactifs Altitude (km) Variations de la concentration d’ozone [O 3] mesurée le 71 énergie réactifs Altitude (km) Variations de la concentration d’ozone [O 3] mesurée le 71](https://slidetodoc.com/presentation_image_h/007db7a38ab385be8dfc787c011c67b0/image-29.jpg)




















- Slides: 68

énergie Cinétique chimique réactifs Chapitre 6 produits La photochimie atmosphérique temps Guy COLLIN, 2019 -03 -06

LA PHOTOCHIMIE ATMOSPHÉRIQUE énergie • À l’aide des lois de la photochimie entre autres, comment a évolué l’atmosphère au réactifs cours des âges ? • Maintenant ? produits temps • Que se passe-t-il sur les autres planètes ? 2019 -03 -06

La formation de l’atmosphère terrestre énergie • Comment était constitué notre atmosphère il y a 4 - 5 milliards d’années ? • Hypothèse généralement retenue : il n’y avait pas ou très peu d’oxygène. réactifs • La photolyse de l’eau et celle du gaz produits carbonique ont été à la source de l’oxygène. temps 2019 -03 -06

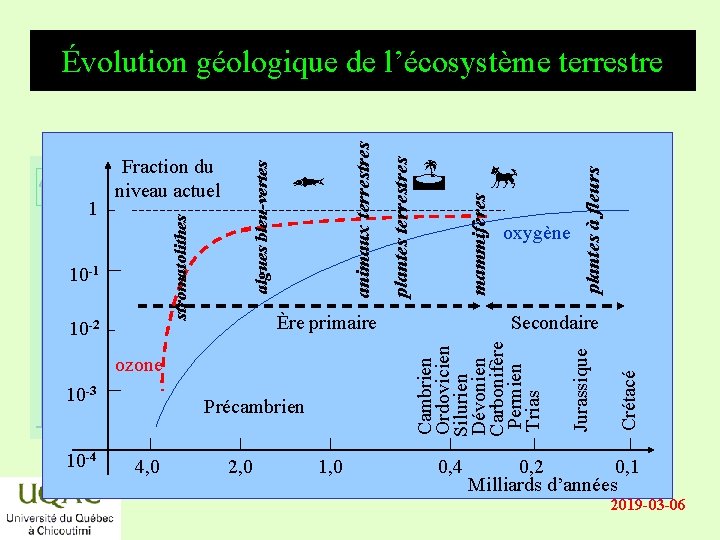
10 -4 2, 0 1, 0 plantes à fleurs oxygène 0, 4 Crétacé Secondaire Jurassique produits temps Précambrien 4, 0 mammifères Ère primaire ozone 10 -3 Cambrien Ordovicien Silurien Dévonien Carbonifère Permien Trias réactifs 10 -2 plantes terrestres 10 -1 animaux terrestres stromatolithes Fraction du énergieniveau actuel 1 algues bleu-vertes Évolution géologique de l’écosystème terrestre 0, 2 0, 1 Milliards d’années 2019 -03 -06

Le mécanisme de formation de O 2 énergie * H 2 O + hn • OH + • H, l < 240 nm * H 2 O + hn H 2 + • O * H 2 O + • O 2 • OH réactifs * CO 2 + hn CO + • O, l < 230 nm * • O + M O 2 + M produits * temps • O + • OH O 2 + • H, . . . 2019 -03 -06

Autres synthèses atmosphériques • Synthèse du méthane, oxydation du méthane (voir plus loin). • Formation de la formaldéhyde HCHO. • Formation de HC N. réactifs • Formation des sucres (synthèse chlorophyllienne). énergie produits temps 2019 -03 -06

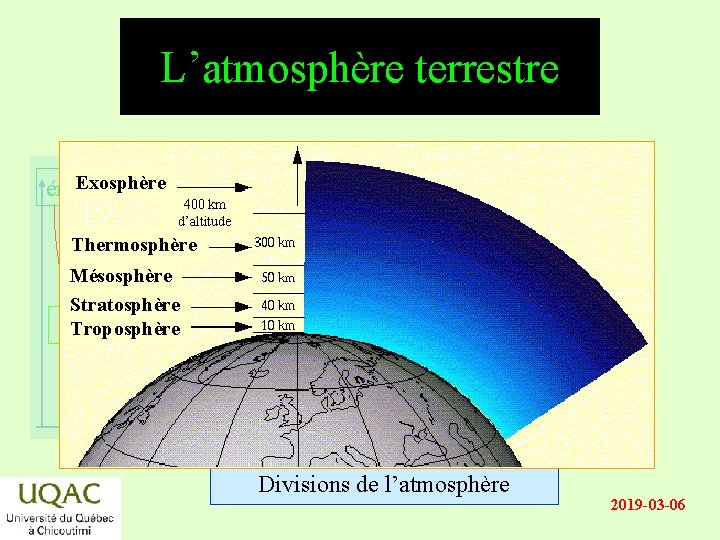
L’atmosphère terrestre Exosphère énergie 400 km d’altitude Thermosphère Mésosphère Stratosphère réactifs Troposphère produits temps Divisions de l’atmosphère 2019 -03 -06

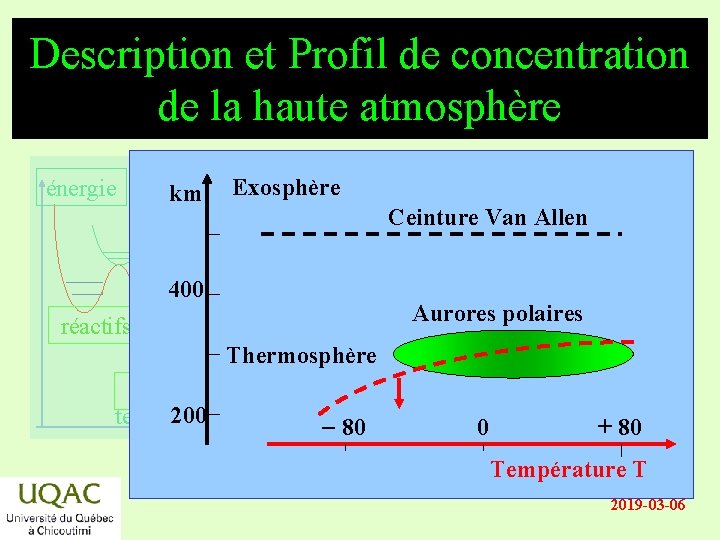
Description et Profil de concentration de la haute atmosphère énergie km Exosphère Ceinture Van Allen 400 Aurores polaires réactifs Thermosphère produits temps 200 - 80 0 + 80 Température T 2019 -03 -06
![Profils de T C et de concentration M de la basse atmosphère 80 Profils de T (°C) et de concentration ([M]) de la basse atmosphère - 80](https://slidetodoc.com/presentation_image_h/007db7a38ab385be8dfc787c011c67b0/image-9.jpg)
Profils de T (°C) et de concentration ([M]) de la basse atmosphère - 80 énergiekm Ionosphère 120 réactifs 0 + 80 Température (°C) T [M] Mésopose produits 40 temps. Stratosphère Mésosphère Couche d’ozone Troposphère 1010 molécules/cm 3 18 102019 -03 -06

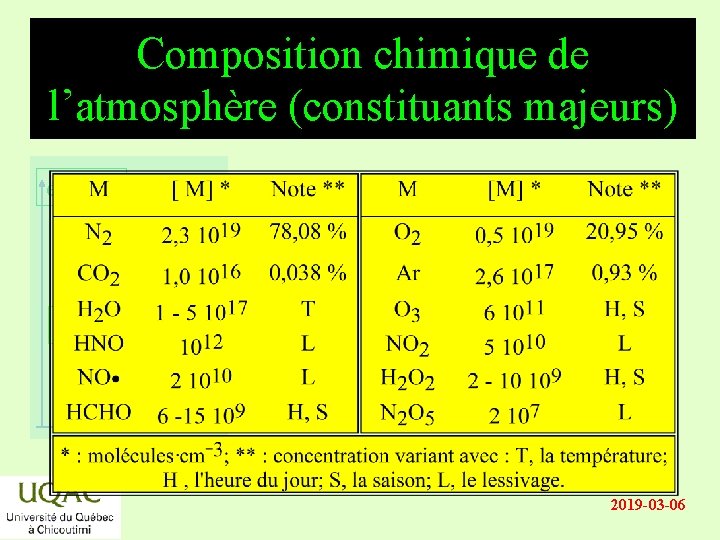
Composition chimique de l’atmosphère (constituants majeurs) énergie réactifs produits temps 2019 -03 -06

Composition chimique de l’atmosphère (constituants mineurs) énergie réactifs produits temps 2019 -03 -06

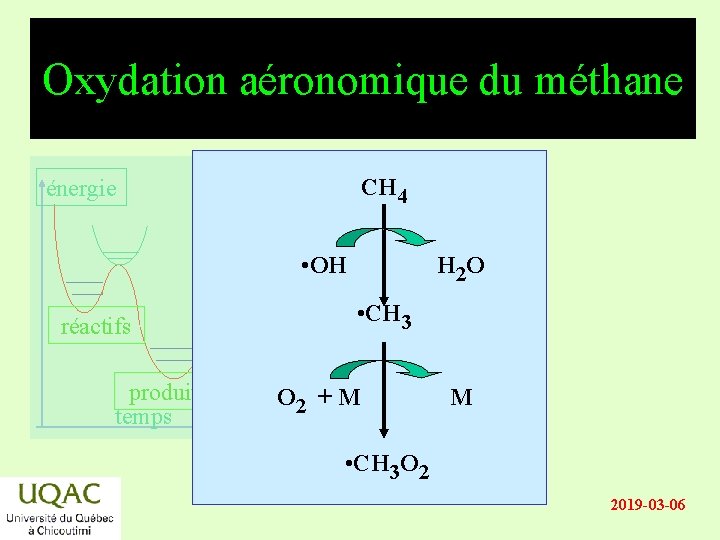
Oxydation aéronomique du méthane CH 4 énergie • OH réactifs produits temps H 2 O • CH 3 O 2 + M M • CH 3 O 2 2019 -03 -06

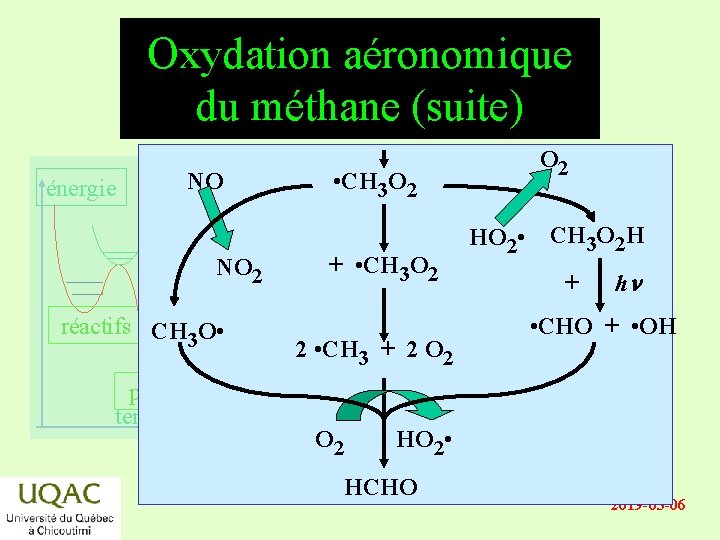
Oxydation aéronomique du méthane (suite) énergie NO NO 2 réactifs CH O • 3 produits temps O 2 • CH 3 O 2 + • CH 3 O 2 2 • CH 3 + 2 O 2 HO 2 • CH 3 O 2 H + hn • CHO + • OH O 2 HO 2 • HCHO 2019 -03 -06

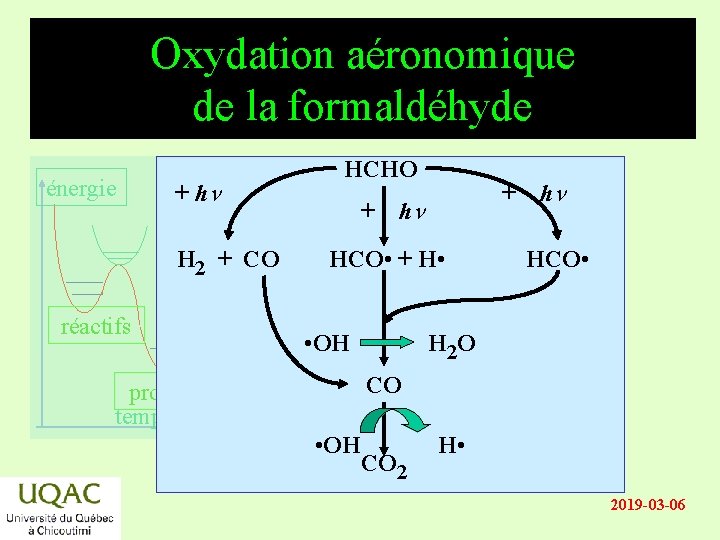
Oxydation aéronomique de la formaldéhyde énergie + hn H 2 + CO réactifs HCHO + + hn HCO • + H • • OH hn HCO • H 2 O CO produits temps • OH CO 2 H • 2019 -03 -06

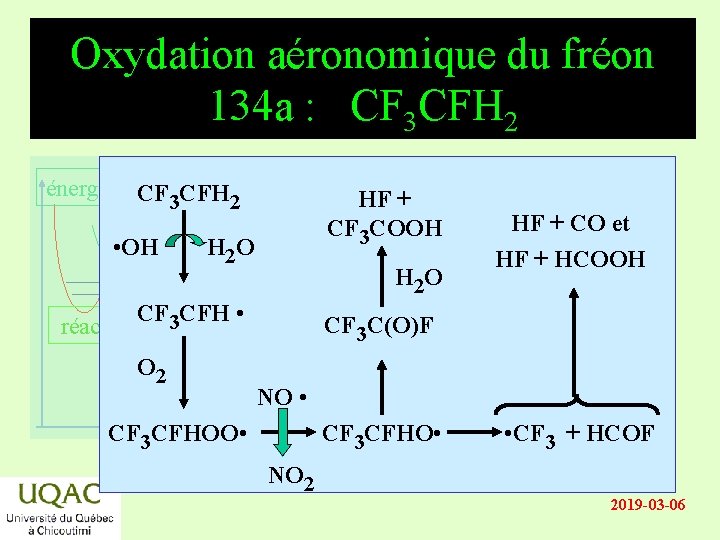
Oxydation aéronomique du fréon 134 a : CF 3 CFH 2 énergie CF CFH 3 2 • OH réactifs H 2 O CF 3 CFH • HF + CF 3 COOH H 2 O HF + CO et HF + HCOOH CF 3 C(O)F O 2 produits NO • temps CF 3 CFHOO • CF 3 CFHO • NO 2 • CF 3 + HCOF 2019 -03 -06

Principales réactions de consommation de monoterpènes • Les monoterpènes sont formés principalement par énergie les forêts de conifères. Terpènes k (O 3 )** k ( • OH)** % 10 48 10 > 90 d-limonène 3, 9 10 9, 0 10 produits temps ** : en litre/(mol s). > 80 réactifs 5 % a-pinène 1 - 2 10 b-pinène 2, 2 10 4 5 52 3, 5 10 4, 1 10 10 * Les forêts en émettent environ de 120 à 150 106 t/an ! 2019 -03 -06

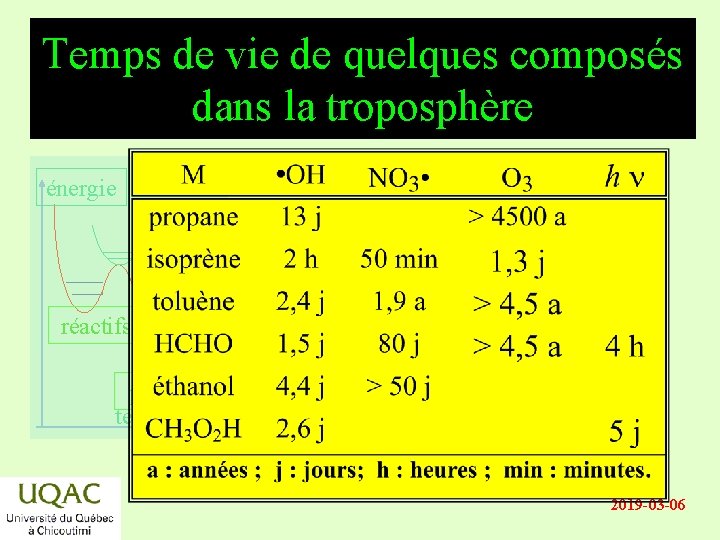
Temps de vie de quelques composés dans la troposphère énergie réactifs produits temps 2019 -03 -06

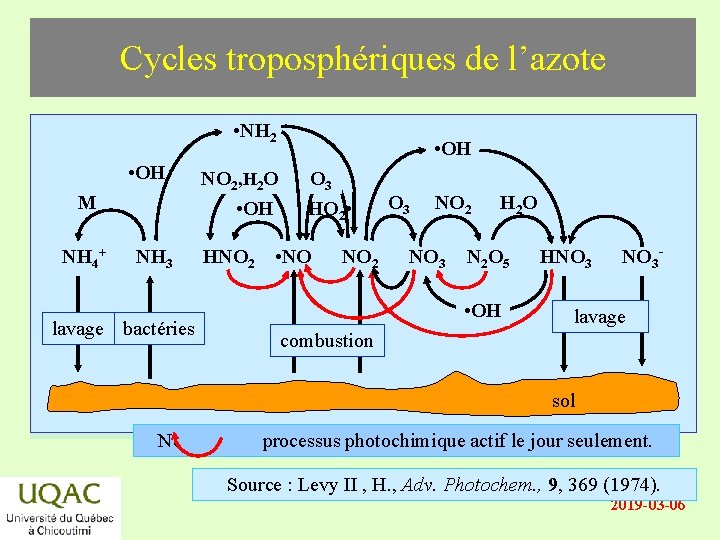
Cycles troposphériques de l’azote • NH 2 énergie • OH M NH 4+ NH 3 NO 2, H 2 O • OH HNO 2 réactifsbactéries lavage produits temps • OH O 3 HO 2 • • NO NO 2 O 3 NO 2 NO 3 H 2 O N 2 O 5 • OH HNO 3 - lavage combustion sol Note: processus photochimique actif le jour seulement. Source : Levy II , H. , Adv. Photochem. , 9, 369 (1974). 2019 -03 -06

Le cas de l’azote : l’ammoniac * NH 3 + • OH H 2 O + • NH 2 k = 1, 5 10 -13 molécules • cm-3 • s-1 * • NH 2 + NO • H 2 O + N 2 k = 2, 3 10 -11 molécules • cm-3 • s-1 réactifs * • NH 2 + NO 2 H 2 O + N 2 O k = 2, 3 10 -11 molécules • cm-3 • s-1 produits * • NH 2 + O 3 NOx + ? temps k = 6, 3 10 -14 molécules • cm-3 • s-1 énergie 2019 -03 -06

Les oxydes d’azote NOx énergie ¨ Ils jouent un rôle crucial dans les processus d’oxydo-réduction : ¨ R • + O 2 ROO • ¨ ROO • + NO • RO • + NO 2 réactifs ¨ NO 3 est photodécomposé le jour, il s’accumule pendant la nuit et réagit alors produits temps avec les hydrocarbures. 2019 -03 -06

Le cas du soufre : H 2 S * énergie H 2 S + • OH H 2 O + • SH k = 7, 5 10 -12 molécules • cm-3 • s-1 * • SH + HO 2 • HSO + • OH k = 1, 1 10 -11 molécules • cm-3 • s-1 réactifs 2 O 2 H 2 S + HO 2 • * • SH + H k = 5 10 -13 molécules • cm-3 • s-1 * • SH + Oproduits 3 HSO + O 2 temps k = 3, 5 10 -14 molécules • cm-3 • s-1 2019 -03 -06

Le cas du soufre: H 2 S (suite) énergie * • SH + CH 3 O 2 H H 2 S + CH 3 O 2 • k = 5 10 -13 molécules • cm-3 • s-1 * • SH + HO 2 • H 2 S + O 2 k = 3 10 -11 molécules • cm-3 • s-1 réactifs * • SH + HCHO H 2 S + HCO • k = 1 10 -12 molécules • cm-3 • s-1 produits - - , HSO * • OSH. . . SO 4 4 temps aérosols, pluies acides, . . . 2019 -03 -06

Le méthanethiol 3 S • énergie * CH 3 SH + • OH H 2 O + CH k = 3, 39 10 -11 molécules • cm-3 • s-1 * CH 3 S • + O 2 CH 3 S O 2 • k = 6 10 -16 molécules • cm-3 • s-1 3 SO • + NO 2 réactifs * CH 3 S O 2 + NO • CH k = 5 10 -13 molécules • cm-3 • s-1 - - , HSO * CH SO • + ? SO 3 4 4 produits aérosols, pluies acides, . . . temps 2019 -03 -06

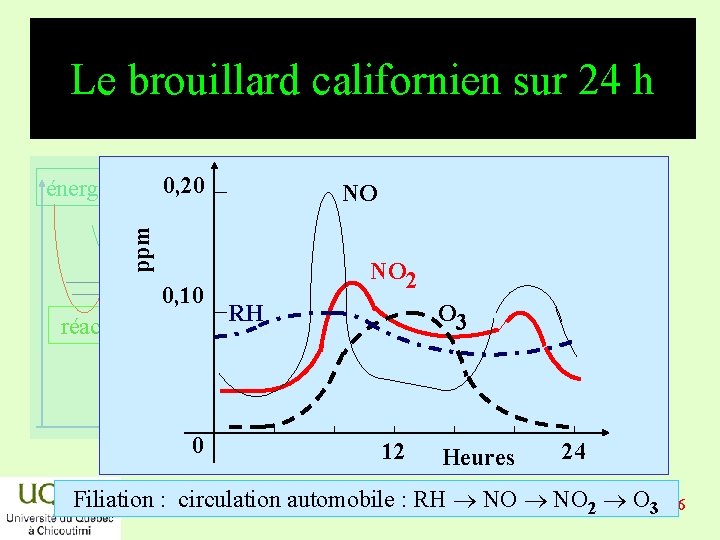
Le brouillard californien énergie réactifs * NO 2 + hn NO • + O • (3 P) * O • (3 P) + O 2 + M O 3 + M * O 3 + NO • NO 2 + O 2 • Formation d’ozone seulement le jour : – La concentration en ozone croît avec celle de produits temps la lumière ; – La réaction globale est nulle. 2019 -03 -06

Le brouillard californien sur 24 h 0, 20 NO ppm énergie 0, 10 réactifs produits temps 0 NO 2 RH O 3 12 Heures 24 Filiation : circulation automobile : RH NO 2 O 2019 -03 -06 3

Effets chimiques de l’ozone dans la troposphère énergie Ä O 3 + hn (l< 318 nm) O • (1 D) + O 2 (a 1 Dg) Ä O • (1 D) + H 2 O 2 • OH réactifs Ä O 2 (1 Dg) + alcènes a-peroxydes, dioxétanes produits irritants, cancérigènes, … produits temps Ä O 2 (1 Dg) + R 2 C=CR 2 RC(OOH)-C(CH 3)=CH 2 2019 -03 -06

La photochimie de la stratosphère : la formation de l’ozone énergie * Mécanisme en chaîne entretenu par la lumière ultraviolette. * Amorçage de la chaîne réactionnelle : 3 1 réactifs * O 2 + hn • O( P) + • O ( D) l < 176 nm produits * O 2 + hn • O(3 P) + • O (3 P) temps l < 242, 4 nm 2019 -03 -06

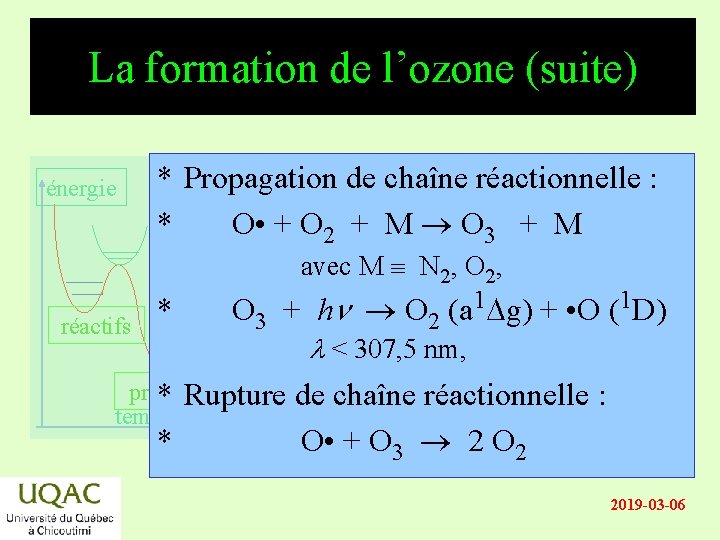
La formation de l’ozone (suite) énergie * Propagation de chaîne réactionnelle : * O • + O 2 + M O 3 + M avec M N 2, O 2, réactifs * O 3 + hn O 2 (a 1 Dg) + • O (1 D) l < 307, 5 nm, produits * Rupture de chaîne réactionnelle : temps * O • + O 3 2 O 2 2019 -03 -06
![énergie réactifs Altitude km Variations de la concentration dozone O 3 mesurée le 71 énergie réactifs Altitude (km) Variations de la concentration d’ozone [O 3] mesurée le 71](https://slidetodoc.com/presentation_image_h/007db7a38ab385be8dfc787c011c67b0/image-29.jpg)
énergie réactifs Altitude (km) Variations de la concentration d’ozone [O 3] mesurée le 71 -02 -04 40 20 produits temps 2 4 6 [O 3] 1012 molécules • cm-3 2019 -03 -06

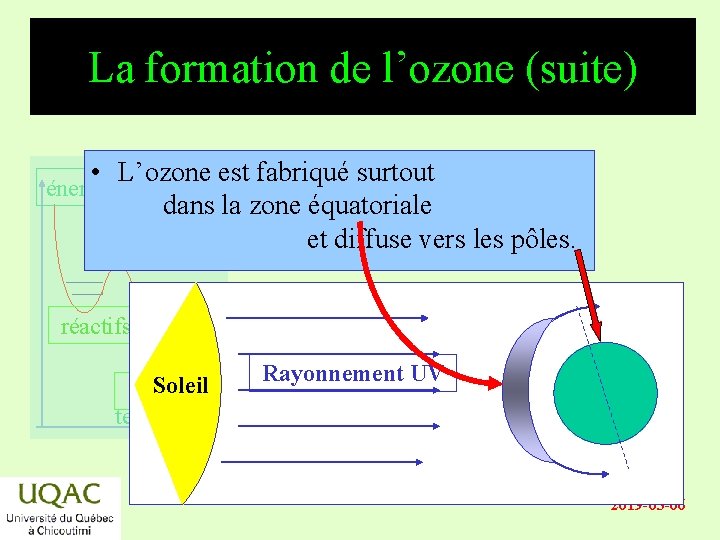
La formation de l’ozone (suite) • L’ozone est fabriqué surtout dans la zone équatoriale et diffuse vers les pôles. énergie réactifs Soleil produits temps Rayonnement UV 2019 -03 -06

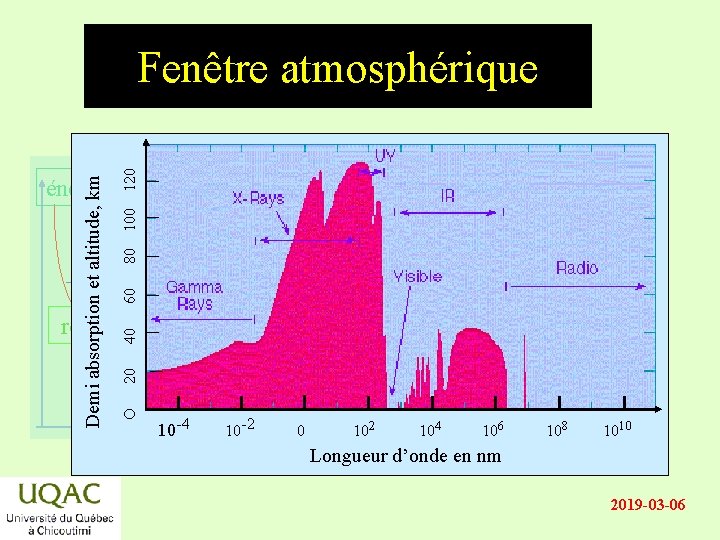
Demi absorption et altitude, km énergie O 20 40 60 80 100 120 Fenêtre atmosphérique réactifs produits temps -4 10 10 -2 0 102 104 106 108 1010 Longueur d’onde en nm 2019 -03 -06

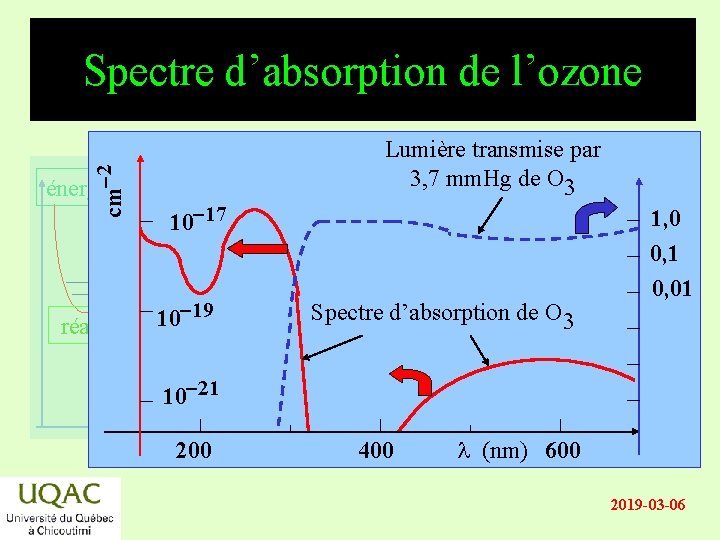
cm-2 Spectre d’absorption de l’ozone énergie réactifs 10 -17 10 -19 produits 10 -21 temps 200 Lumière transmise par 3, 7 mm. Hg de O 3 Spectre d’absorption de O 3 400 1, 0 0, 1 0, 01 l (nm) 600 2019 -03 -06

L’effet des Concordes énergie* * réactifs NO • + O 3 NO 2 + O 2 O • + NO 2 NO • + O 2 * Globalement : O • + O 3 2 O 2 * Les calculs montrent que 500 Concordes produits temps volant 7 h/j font baisser la concentration en ozone de 2 à 3 % ! 2019 -03 -06

L’effet des fréons énergie * CF 2 Cl 2 + hn • CF 2 Cl + Cl • * * Cl • + O 3 Cl. O • + O 2 O • + Cl. O • Cl • + O 2 réactifs * Globalement : produits O • + O 2 O 3 2 temps * Chaîne cinétique de grande efficacité. 2019 -03 -06

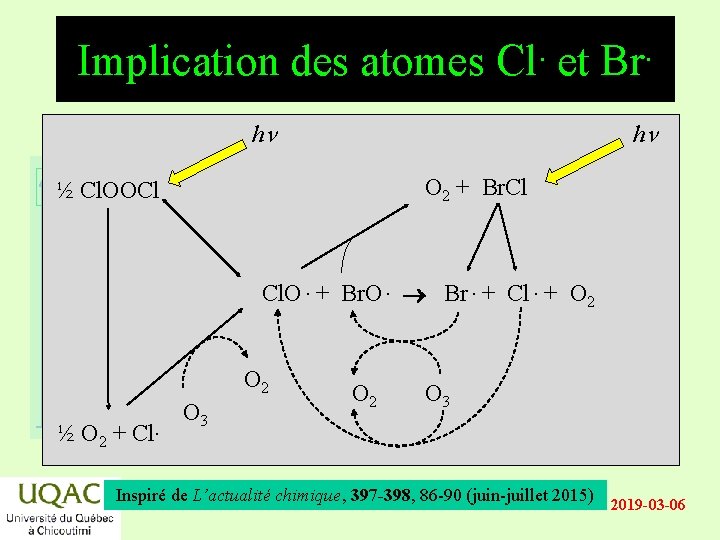
Implication des atomes Cl. et Br. hn hn O 2 + Br. Cl énergie ½ Cl. OOCl Cl. O. + Br. O. Br. + Cl. + O 2 réactifs produits O 3 temps. ½ O 2 + Cl O 2 O 3 Inspiré de L’actualité chimique, 397 -398, 86 -90 (juin-juillet 2015) 2019 -03 -06

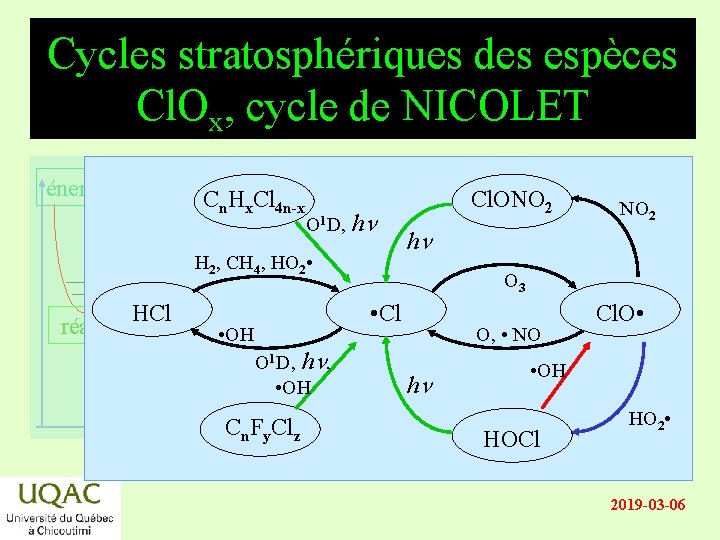
Cycles stratosphériques des espèces Cl. Ox, cycle de NICOLET énergie Cn. Hx. Cl 4 n-x O 1 D, hn H 2, CH 4, HO 2 • réactifs HCl • OH Cl. ONO 2 hn O 3 • Cl O 1 D, hn, • OH produits temps Cn. Fy. Clz NO 2 O, • NO hn Cl. O • • OH HOCl HO 2 • 2019 -03 -06

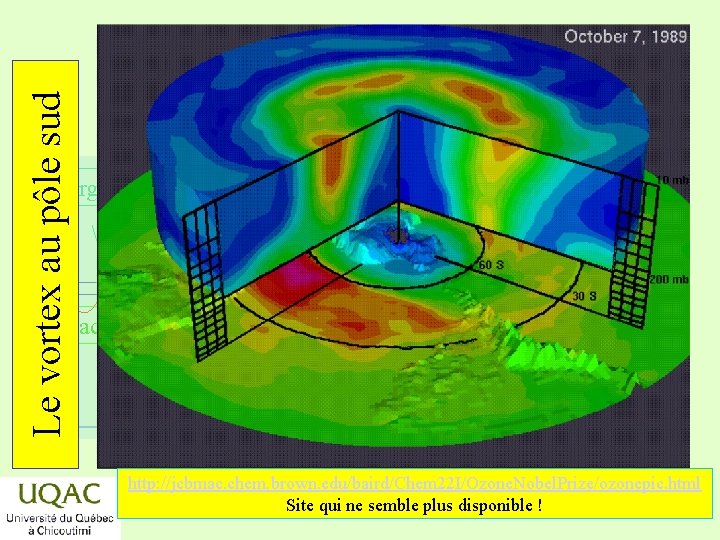
Le vortex au pôle sud énergie réactifs produits temps http: //jcbmac. chem. brown. edu/baird/Chem 22 I/Ozone. Nobel. Prize/ozonepic. html 2019 -03 -06 Site qui ne semble plus disponible !

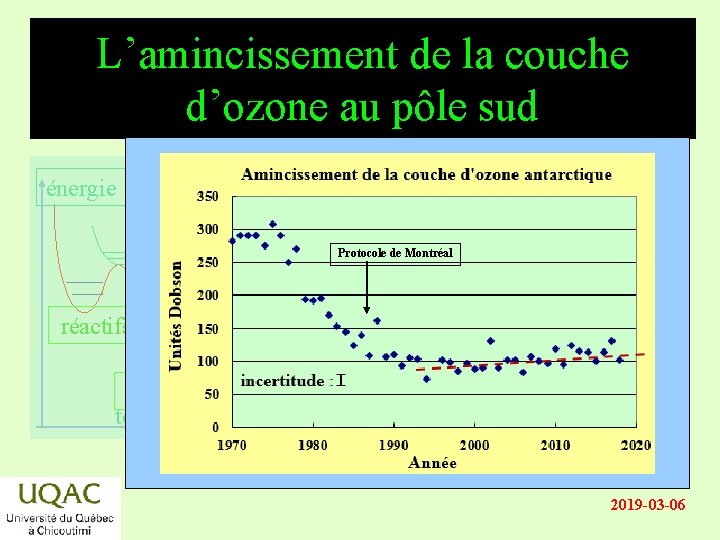
L’amincissement de la couche d’ozone au pôle sud énergie Protocole de Montréal réactifs produits temps 2019 -03 -06

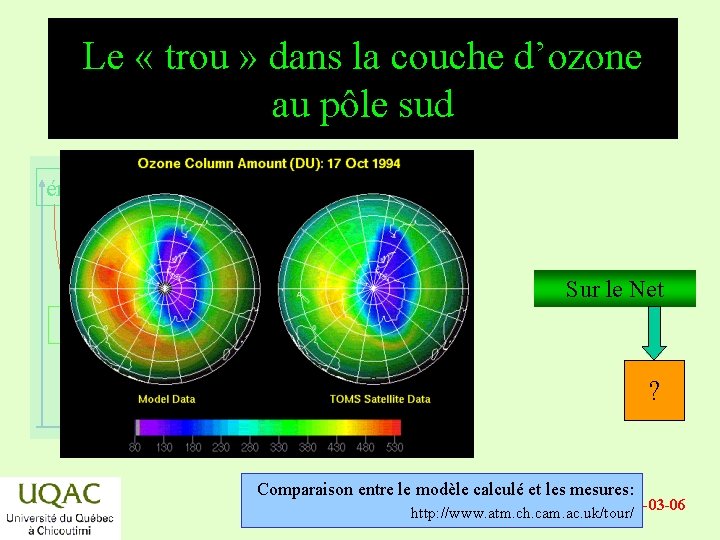
Le « trou » dans la couche d’ozone au pôle sud énergie Sur le Net réactifs ? produits temps Comparaison entre le modèle calculé et les mesures: 2019 -03 -06 http: //www. atm. ch. cam. ac. uk/tour/

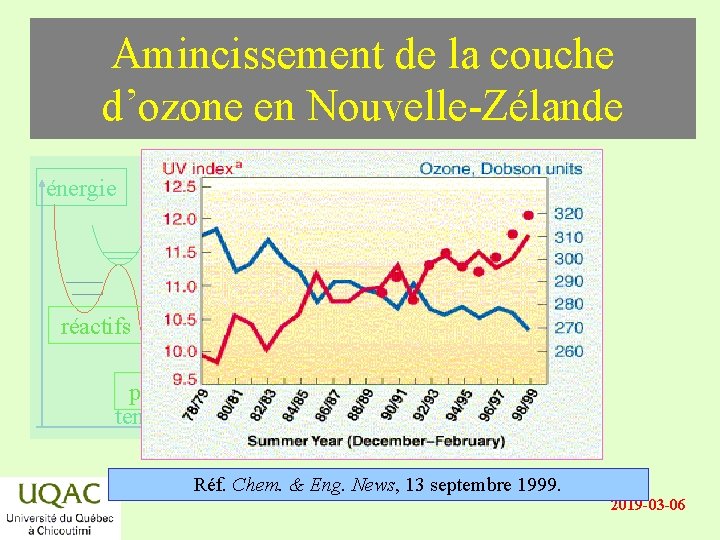
Amincissement de la couche d’ozone en Nouvelle-Zélande énergie réactifs produits temps Réf. Chem. & Eng. News, 13 septembre 1999. 2019 -03 -06

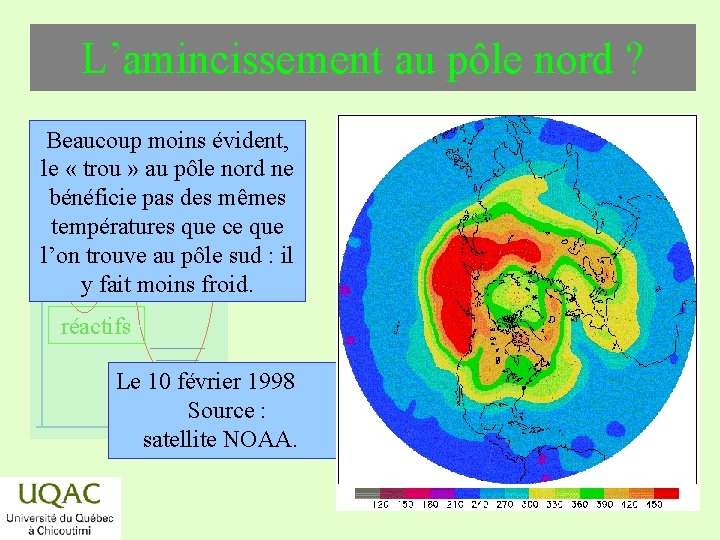
L’amincissement au pôle nord ? Beaucoup moins évident, le « trou » au pôle nord ne énergie bénéficie pas des mêmes températures que ce que l’on trouve au pôle sud : il y fait moins froid. réactifs Le 10 février 1998 produits temps Source : satellite NOAA. 2019 -03 -06

Le trou en mars 2011 ! énergie Sibérie Europe réactifs Canada produits • temps En 2010 et • en 2011 ! Source: Nature, 477, 257 -258 (2011) : Canadian ozone network faces axe. 2019 -03 -06

La vie d’un fréon • Fabrication au temps t = o. énergie • Inséré dans un réfrigérateur vendu au temps t = 1 an. • Temps de vie du réfrigérateur : 10 ans réactifs • Le fréon libéré dans l’air à t = 11 – 15 ans. • produits Diffusion du fréon vers la stratosphère : temps 10 à 12 ans (St = 21 à 27 ans). 2019 -03 -06

La photochimie de l’ionosphère * Couche située vers 90 - 250 km d’altitude (maximum vers 200 km). énergie * Concentration en ions : 105 - 106 ions/cm 3. * Les principales réactions sont : réactifs * O • + hn O+ + e- ou O • + O+ + e- * O + h n O 2 2 produits + + e- ou N • + N+ + etemps * N + h n N 2 2 2019 -03 -06

Photochimie de l’ionosphère (suite) * N • + NO • N 2 + O • énergie * N • + O 2 NO • + O • * O+ + N 2 NO+ + N • * O+ + e - O* • et O* • O • + hn réactifs * N 2 + e - N • + N* • N • + hn et N produits *temps NO+ + e - N • + O • , . . . 2019 -03 -06

Photochimie de l’ionosphère (suite) * N 2 + + O • NO+ + N • * N 2 + + O 2 N 2 + O 2+ * À haute altitude, il n’y a pas de réactifs réactions thermoléculaires. * Les réactions de recombinaison produits radicalaire sont rares. temps énergie 2019 -03 -06

Les aurores boréales * Le vent solaire concentré aux pôles par la magnétosphère. * Le courant ionique peut atteindre 107 A. * Une faible portion de l’énergie sert à exciter réactifs des atomes. * O • (1 S) O • (1 D) + 557, 7 nm; t = 0, 71 s produits 1 * O • ( D) O • (3 P) + 630, 0 nm; t = 150 s temps * Les atomes d’azote émettent dans le rose. énergie 2019 -03 -06

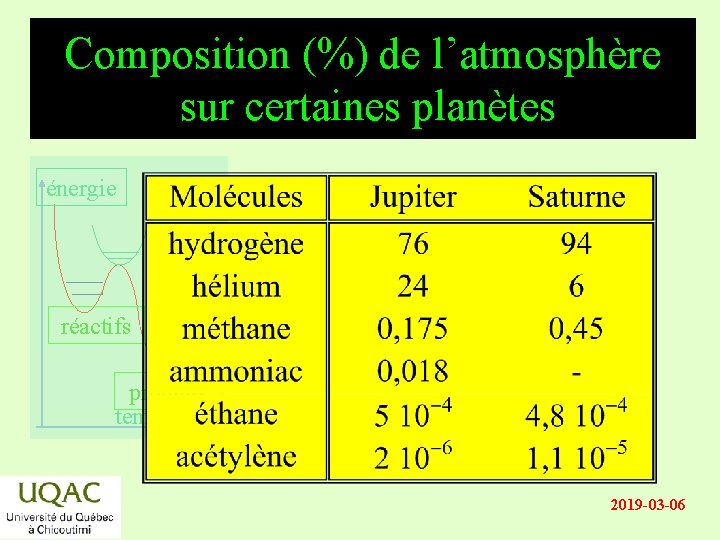
Composition (%) de l’atmosphère sur certaines planètes énergie réactifs produits temps 2019 -03 -06

Les planètes réductrices : les grosses planètes (cas de Saturne) énergie réactifs * La photochimie est principalement le fait du méthane : * CH 4 + hn • CH 3 + H • * CH 4 + hn : CH 2 + H 2 produits temps * CH 4 + hn • CH + H • + H 2 2019 -03 -06

Les planètes réductrices : les grosses planètes (Jupiter, Uranus, . . . ) énergie * Mécanisme secondaire : * : CH 2 + H 2 • CH 3 + H • * : CH 2 + CH 4 2 • CH 3 * • CH + CH 4 C 2 H 4 + H • * • CH + H 2 + M • CH 3 + M produits temps * • CH 3 + H • + M CH 4 + M * 2 • CH 3 + M C 2 H 6 + M réactifs 2019 -03 -06

L’atmosphère de Jupiter • Présence supplémentaire d’ammoniac : énergie • réactifs NH 3 + hn • NH 2 + H • • NH 2 + H 2 NH 3 + H • • H 2 + hn 2 H • produits • L’ammoniac joue le rôle d’un temps photosensibilisateur relativement à la photodécomposition de l’hydrogène. 2019 -03 -06

L’atmosphère de Jupiter (suite) énergie • 2 • NH 2 + M N 2 H 4 + M • N 2 H 4 + hn N 2 + 2 H 2 • H • + N 2 H 4 • N 2 H 3 + H 2 • H • + N 2 H 3 N 2 + 2 H 2 réactifs • • NH 2 + H 2 NH 3 + H • • • NH 2 + • CH 3 NH 2 produits temps • CH 3 NH 2 + hn produits, . . . 2019 -03 -06

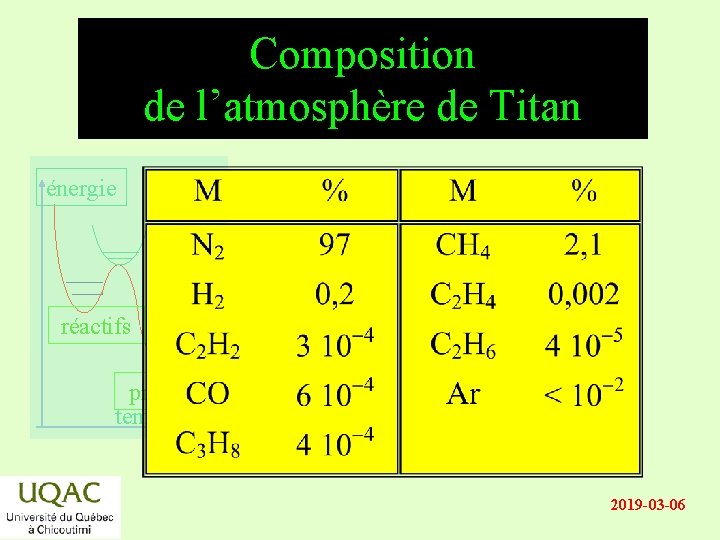
Composition de l’atmosphère de Titan énergie réactifs produits temps 2019 -03 -06

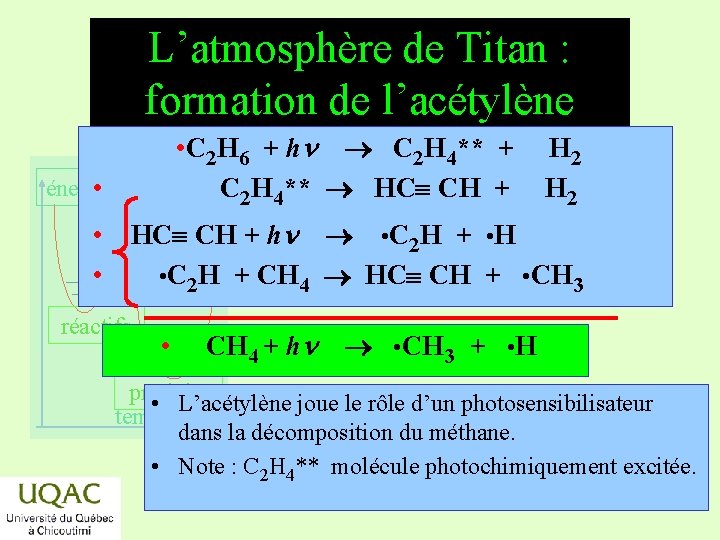
L’atmosphère de Titan : formation de l’acétylène • C 2 H 6 + hn C 2 H 4** + C 2 H 4** HC CH + énergie • H 2 • HC CH + hn • C 2 H + • H • • C 2 H + CH 4 HC CH + • CH 3 réactifs • CH 4 + hn • CH 3 + • H produits • L’acétylène joue le rôle d’un photosensibilisateur temps dans la décomposition du méthane. • Note : C 2 H 4** molécule photochimiquement excitée. 2019 -03 -06

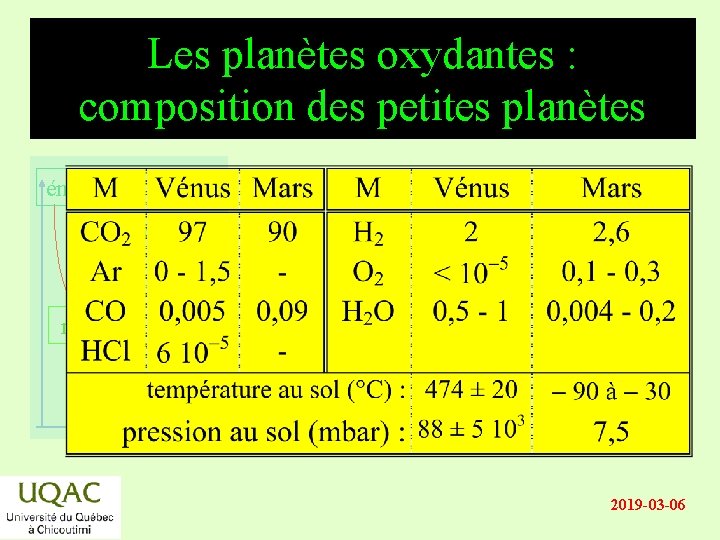
Les planètes oxydantes : composition des petites planètes énergie réactifs produits temps 2019 -03 -06

Photochimie sur les petites planètes * CO 2 + hn CO + O • énergie * H 2 O + hn H • + HO • * Ces réactions primaires sont suivies de : * 2 H • + 2 O 2 2 HO 2 • réactifs * HO 2 • + HO 2 • H 2 O 2 + O 2 * produits H 2 O 2 + hn 2 HO • temps * 2 CO + 2 HO • 2 CO 2 + 2 H • * 2 CO + O 2 2 CO 2 2019 -03 -06

Photochimie secondaire sur Vénus énergie • CO + Cl • Cl. CO • • Cl. CO • + O 2 Cl. CO 3 • Cl. CO 3 + O • Cl • + O 2 + CO 2 réactifs Au total • produits CO + O • CO 2 • temps Le système se réduit à l’oxydation du CO. 2019 -03 -06

Photochimie secondaire sur Mars énergie • CO + HO • CO 2 + H • • H • + O 2 HO 2 • • HO 2 • + O • HO • + Au total : réactifs • CO + O • CO 2 produits • temps Le système se réduit à l’oxydation du CO. 2019 -03 -06

L’atmosphère de Io • énergie • • • réactifs • Principalement constitué de SO 2 : SO 2 + hn SO + O • , l < 221 nm SO 2 + hn S + O 2 , l < 207 nm S + O 2 SO + O • , SO + SO SO 2 + S produits • Au total : temps SO 2 S + 2 O • 2019 -03 -06

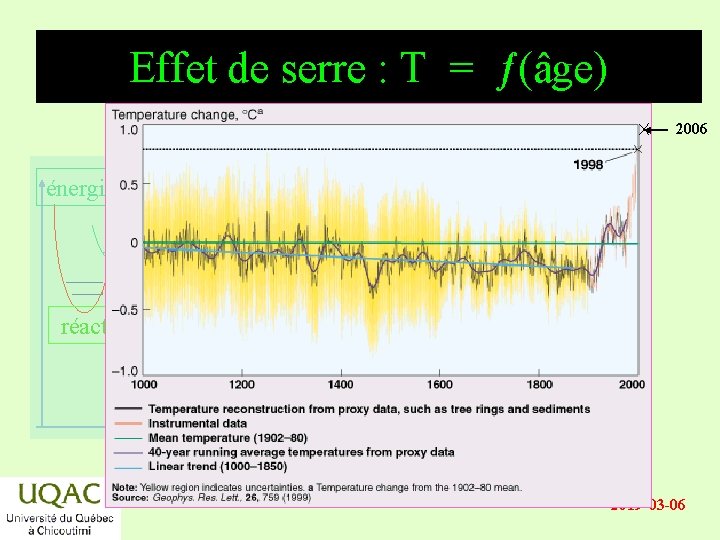
Effet de serre : T = ƒ(âge) 2006 énergie réactifs produits temps 2019 -03 -06

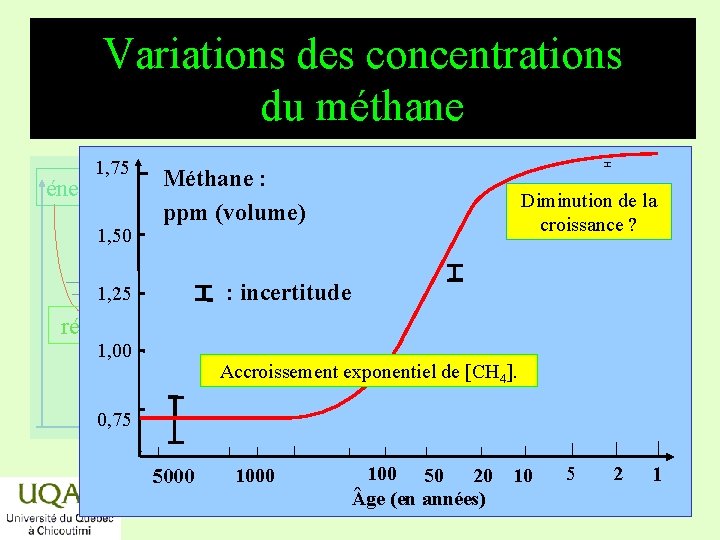
Variations des concentrations du méthane énergie 1, 50 H 1, 75 Méthane : ppm (volume) Diminution de la croissance ? : incertitude 1, 25 réactifs 1, 00 produits temps 0, 75 5000 Accroissement exponentiel de [CH 4]. 1000 100 50 20 10 ge (en années) 5 2 1 2019 -03 -06

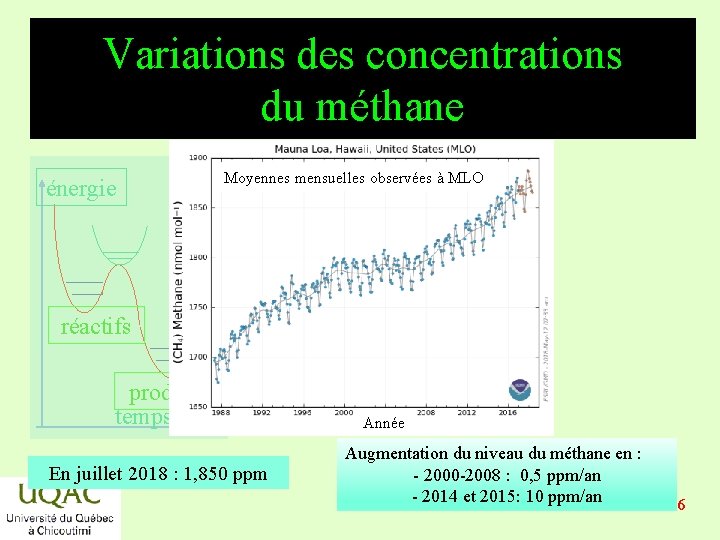
Variations des concentrations du méthane énergie Moyennes mensuelles observées à MLO réactifs produits temps En juillet 2018 : 1, 850 ppm Année Augmentation du niveau du méthane en : - 2000 -2008 : 0, 5 ppm/an - 2014 et 2015: 10 ppm/an 2019 -03 -06

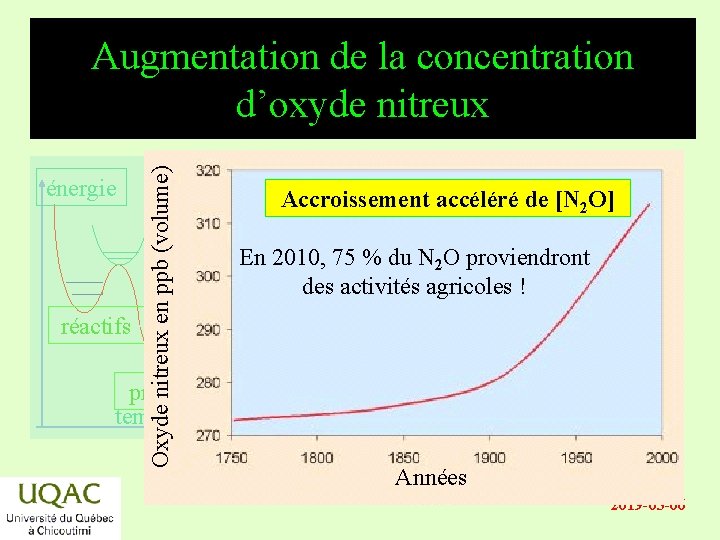
énergie réactifs Oxyde nitreux en ppb (volume) Augmentation de la concentration d’oxyde nitreux Accroissement accéléré de [N 2 O] En 2010, 75 % du N 2 O proviendront des activités agricoles ! produits temps Années 2019 -03 -06

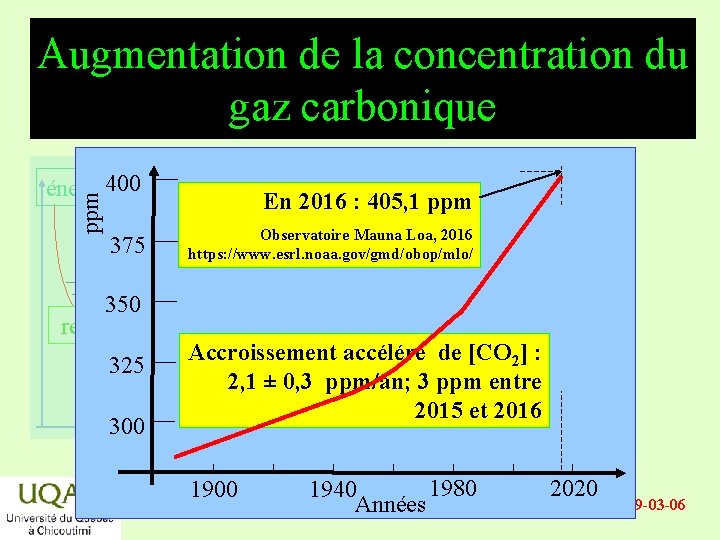
Augmentation de la concentration du gaz carbonique ppm énergie 400 375 En 2016 : 405, 1 ppm Observatoire Mauna Loa, 2016 https: //www. esrl. noaa. gov/gmd/obop/mlo/ 350 réactifs Accroissement accéléré de [CO 2] : 325 produits 2, 1 ± 0, 3 ppm/an; 3 ppm entre 2015 et 2016 temps 300 1980 1940 Années 2020 2019 -03 -06

Bilans du carbone terrestre • État du carbone Masse absolue* énergie Ca. CO 3: roches sédimentaires 35 000 Ca-Mg(CO 3) 2 roches sédimentaires 25 000 matières organiques sédimentaires 15 000 CO 3 - - et HCO 3 - dissous dans les océans 36 réactifs Carburants fossiles 4 Carbone mort (humus) 3 produits temps gaz carbonique de l’atmosphère 0, 7 *1012 tonnes; Scientific American, 74, mars 1989. 2019 -03 -06

Cycle schématique et géologique du carbone ++ + 2 HCO - • CO + H O + Ca. CO Ca 2 3 3 énergie 2 2 HCO 3 - + Ca++ Ca. CO 3 (s) + CO 2(g) + H 2 O • et 2 CO 2 + H 2 O + Ca. Si. O 3 réactifs Ca++ + 2 HCO 3 - + Si. O 2 2 HCO 3 - + Ca++ Ca. CO 3 (s) + CO 2(g) + H 2 O produits • Globalement: temps CO 2 + Ca. Si. O 3 Ca. CO 3 (s) + Si. O 2(s) 2019 -03 -06

Échange de carbone entre le sol et l’atmosphère • Processus d’échange sens 109 t/an • diffusion + 100 • diffusion - 104 • respiration du sol + 50 réactifs • photosynthèse - 100 • respiration végétale + 50 produits • déforestation + 2 temps • combustions fossiles + 5 énergie 2019 -03 -06

Conclusion • L’atmosphère terrestre n’a pas toujours été ce qu’il est aujourd’hui. énergie • Il est le résultat d’une dynamique continuellement en mouvement et en perpétuel évolution. • Les rejets industriels et domestiques participent à cet équilibre dynamique. • réactifs Avant de rejeter n’importe quoi dans l’atmosphère : nécessité du principe de précaution. produits • Les autres planètes ont aussi leur propre dynamique temps photochimique fortement déterminée par la présence de certains produits en faible concentration dans leur atmosphère. 2019 -03 -06
 Nergie merci emi
Nergie merci emi Tirez pas sur le scarabée résumé par chapitre
Tirez pas sur le scarabée résumé par chapitre Le petit prince chapitre 5
Le petit prince chapitre 5 Histoire le petit prince résumé
Histoire le petit prince résumé Petit pays chapitre 1
Petit pays chapitre 1 Formule plagioclase
Formule plagioclase Risque chimique définition
Risque chimique définition Apparail digestif
Apparail digestif Flu produit chimique
Flu produit chimique Procédé chimique
Procédé chimique équilibre chimique
équilibre chimique Systme digestif
Systme digestif Traceur chimique
Traceur chimique Formule cuivre
Formule cuivre Valence des corps chimiques
Valence des corps chimiques Famille chimique
Famille chimique L'affinité chimique
L'affinité chimique Procédé chimique
Procédé chimique Espèce chimique naturelle exemple
Espèce chimique naturelle exemple Elmet berango
Elmet berango Poisson composition
Poisson composition Constante dequilibre
Constante dequilibre Déplacement chimique
Déplacement chimique Aménagement durable des territoires et produits béton
Aménagement durable des territoires et produits béton Exacyl nedir
Exacyl nedir Produits dérivés du palmier à huile
Produits dérivés du palmier à huile Analyseur la texture des aliments
Analyseur la texture des aliments Differenciation verticale et horizontale des produits
Differenciation verticale et horizontale des produits Madame jc walker
Madame jc walker Liste des produits denk pharma
Liste des produits denk pharma Produits chimiques
Produits chimiques Liste des produits soumis au contrôle technique
Liste des produits soumis au contrôle technique Produits en croix
Produits en croix Classification des produits carnés
Classification des produits carnés Quizz bionettoyage
Quizz bionettoyage Produits laitiers maroc
Produits laitiers maroc Le petit prince et le businessman
Le petit prince et le businessman Jean chapitre 9
Jean chapitre 9 La prire
La prire Chapitre 7 vocabulaire 1 french 2
Chapitre 7 vocabulaire 1 french 2 Daniel 12 10
Daniel 12 10 Jean chapitre 6 verset 1 à 15
Jean chapitre 6 verset 1 à 15 Grammaire 1
Grammaire 1 Blanche canaby
Blanche canaby La fabrication des objets techniques chapitre 12
La fabrication des objets techniques chapitre 12 Le dernier jour d'un condamné chapitre 26
Le dernier jour d'un condamné chapitre 26 Chapitre 49 dernier jour d'un condamné
Chapitre 49 dernier jour d'un condamné Chapitre 7 observatoire
Chapitre 7 observatoire Mathieu chapitre 3
Mathieu chapitre 3 Chapitre 7 le petit prince
Chapitre 7 le petit prince Marc chapitre 14
Marc chapitre 14 Ainsi parle le saigneur characters
Ainsi parle le saigneur characters Jean chapitre 4
Jean chapitre 4 Tite 2 3-5
Tite 2 3-5 Allons en ville chapitre 9 vocabulaire 1
Allons en ville chapitre 9 vocabulaire 1 Chapitre 3 l'énergie et ses manifestations
Chapitre 3 l'énergie et ses manifestations Daniel chapitre 11
Daniel chapitre 11 La route de chlifa chapitre 1 résumé
La route de chlifa chapitre 1 résumé Daniel chapitre 5
Daniel chapitre 5 Chapitre 7 vocabulaire 1
Chapitre 7 vocabulaire 1 Chapitre 7 évaluer le risque client
Chapitre 7 évaluer le risque client L'histoire de friauche
L'histoire de friauche Bilan thermique du corps humain def
Bilan thermique du corps humain def Le faucon déniché chapitre 2
Le faucon déniché chapitre 2 Jean chapitre 8
Jean chapitre 8 Matthieu chapitre 1
Matthieu chapitre 1 Jean chapitre 7
Jean chapitre 7 Jean chapitre 11
Jean chapitre 11 Le petit prince chapitre 16
Le petit prince chapitre 16