Chap 15 Temps et volution chimique cintique et













- Slides: 21

Chap. 15 : Temps et évolution chimique : cinétique et catalyse.

1. Evolution temporelle d’un système chimique 1. 1. Réactions lentes et rapides Connaissez-vous des réactions lentes ? Formation de la rouille 4 Fe + 6 H 2 O + 3 O 2 2 Fe 2 O 3, 3 H 2 O Fermentation alcoolique (voir doc. 1) C 6 H 12 O 6 2 C 2 H 5 OH + 2 CO 2 Une réaction chimique est dite lente si. .

Connaissez-vous des réactions rapides ? Combustion CH 4 + 2 O 2 CO 2 + 2 H 2 O Dans le cas contraire. .

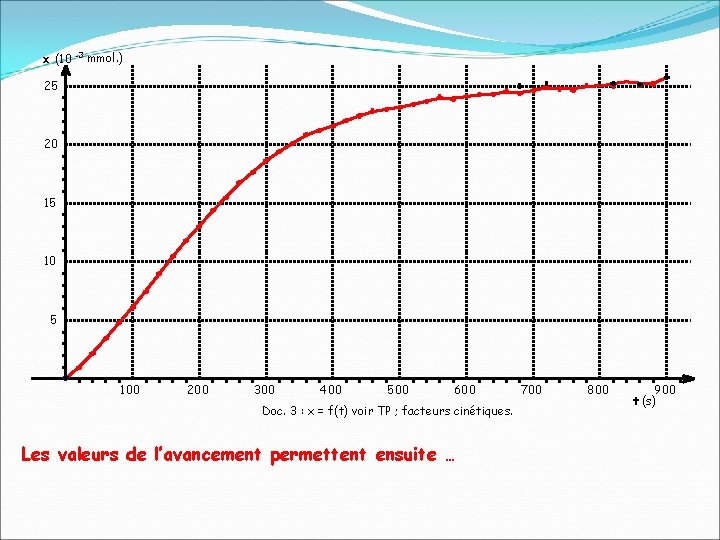
1. 2. Suivi temporel d’une réaction chimique La mesure de l’évolution d’un paramètre, pour une réaction lente, permet …

SOS Vidéo Quelle est l’équation de la réaction sachant qu’il se forme des ions Mg 2+ et du dihydrogène ? Sachant que DP est proportionnelle à n(H 2), comment obtient-on x = f(t) ?

x (10 -3 mmol. ) 25 20 15 100 200 300 400 500 600 Doc. 3 : x = f(t) voir TP ; facteurs cinétiques. Les valeurs de l’avancement permettent ensuite … 700 800 900 t (s)

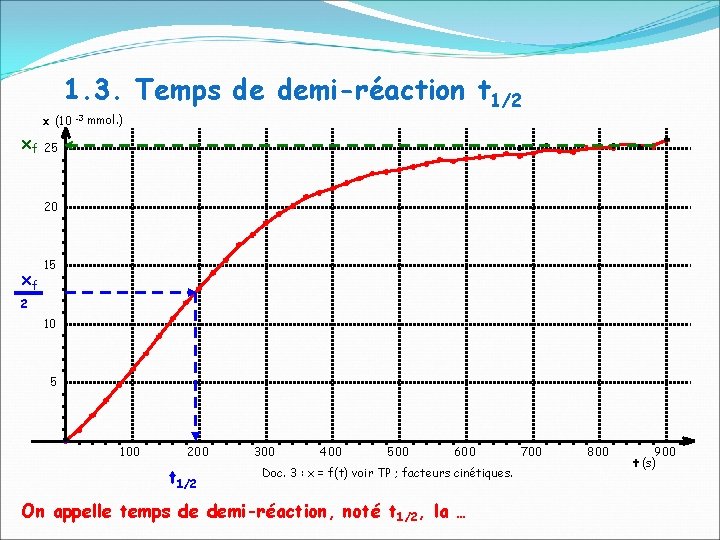
1. 3. Temps de demi-réaction t 1/2 x (10 xf -3 mmol. ) 25 20 xf 15 2 10 5 100 200 t 1/2 300 400 500 600 Doc. 3 : x = f(t) voir TP ; facteurs cinétiques. On appelle temps de demi-réaction, noté t 1/2, la … 700 800 900 t (s)

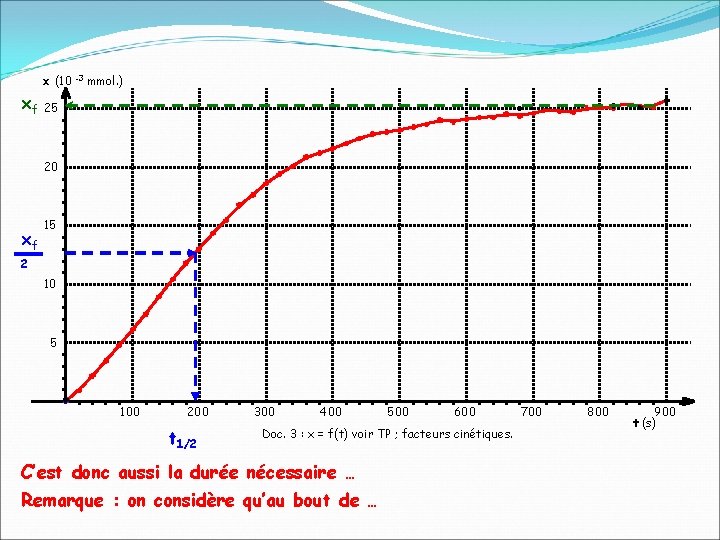
x (10 xf -3 mmol. ) 25 20 xf 15 2 10 5 100 200 t 1/2 300 400 500 600 Doc. 3 : x = f(t) voir TP ; facteurs cinétiques. C’est donc aussi la durée nécessaire … Remarque : on considère qu’au bout de … 700 800 900 t (s)

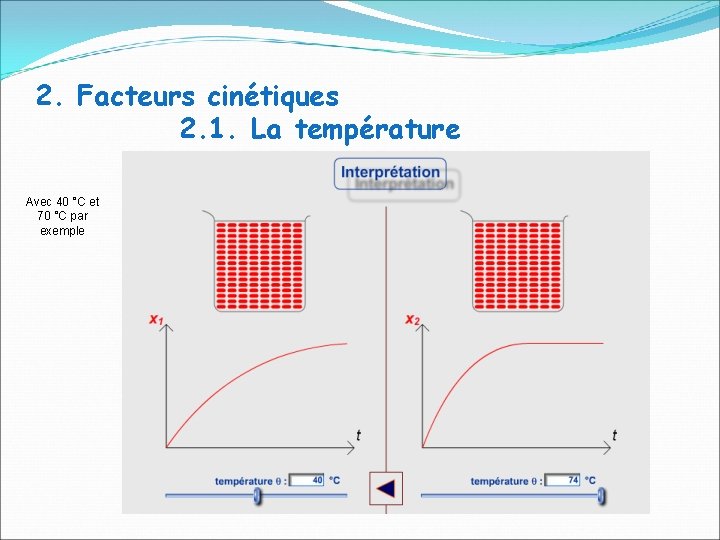
2. Facteurs cinétiques 2. 1. La température Avec 40 °C et 70 °C par exemple

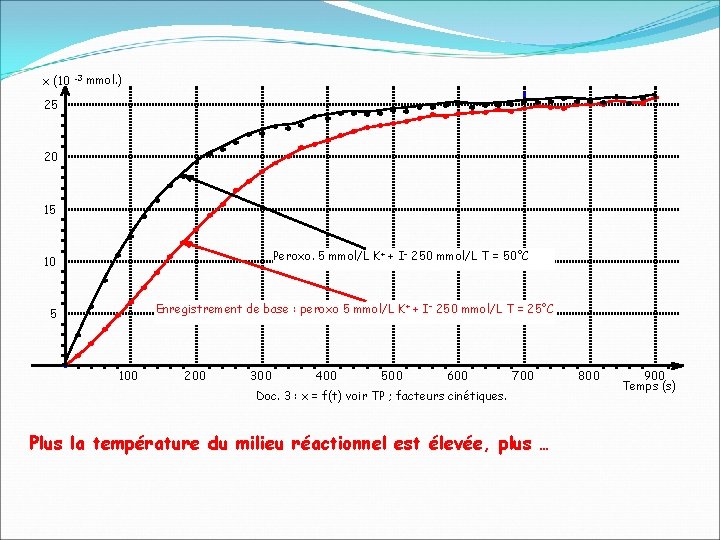
x (10 -3 mmol. ) 25 20 15 Peroxo. 5 mmol/L K+ + I– 250 mmol/L T = 50°C 10 Enregistrement de base : peroxo 5 mmol/L K+ + I– 250 mmol/L T = 25°C 5 100 200 300 400 500 600 700 Doc. 3 : x = f(t) voir TP ; facteurs cinétiques. Plus la température du milieu réactionnel est élevée, plus … 800 900 Temps (s)

Remarques : Cas où l’augmentation de la température est favorable Réacteur pour synthèse (ici l’ammoniac) Autocuiseur

Remarques : Cas où la baisse de la température est favorable Conservation de cellules biologiques Congélateur dans l’azote liquide La trempe : consiste en un refroidissement brutal du milieu réactionnel (par exemple avec de la glace). Elle fige le système dans l’état où il se trouve et permet d’analyser le système dans cet état.

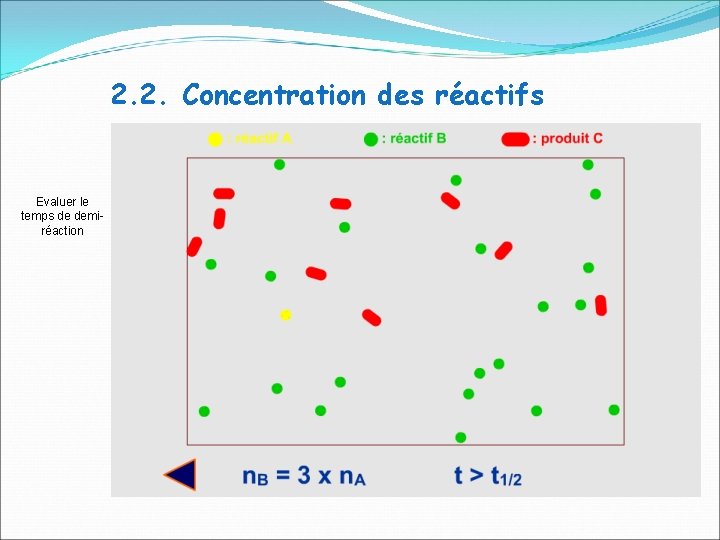
2. 2. Concentration des réactifs Evaluer le temps de demiréaction

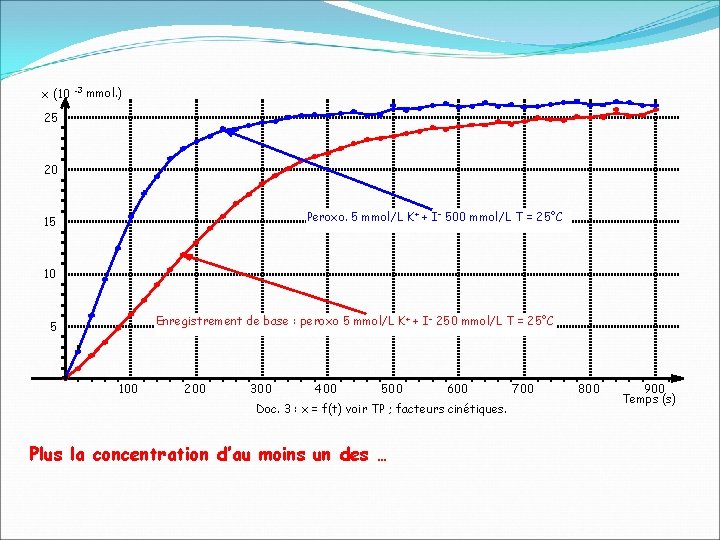
x (10 -3 mmol. ) 25 20 Peroxo. 5 mmol/L K+ + I– 500 mmol/L T = 25°C 15 10 Enregistrement de base : peroxo 5 mmol/L K+ + I– 250 mmol/L T = 25°C 5 100 200 300 400 500 600 Doc. 3 : x = f(t) voir TP ; facteurs cinétiques. Plus la concentration d’au moins un des … 700 800 900 Temps (s)

Remarques : Il existe d’autres facteurs cinétiques : SOS vidéo Pour les solides, leur état de …

Remarques : Il existe d’autres facteurs cinétiques : Le solvant (polaire, apolaire).

3. La catalyse 3. 1. Définition SOS vidéo Un catalyseur est … Un catalyseur n’apparaît pas …

3. 2. Différents types de catalyse La catalyse est homogène lorsque … La catalyse est hétérogène lorsque …

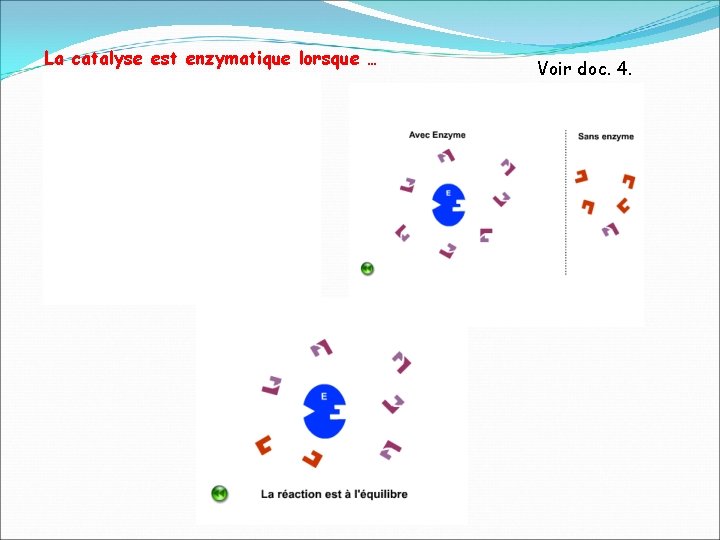
La catalyse est enzymatique lorsque … Voir doc. 4.

La catalyse est enzymatique lorsque …
