TS chimie chapitre 7 SUIVI CINTIQUE Suivi cintique













- Slides: 25

TS chimie chapitre 7 SUIVI CINÉTIQUE

Suivi cinétique https: //www. youtube. com/embed/55 p 4 A 1 IGGp. A



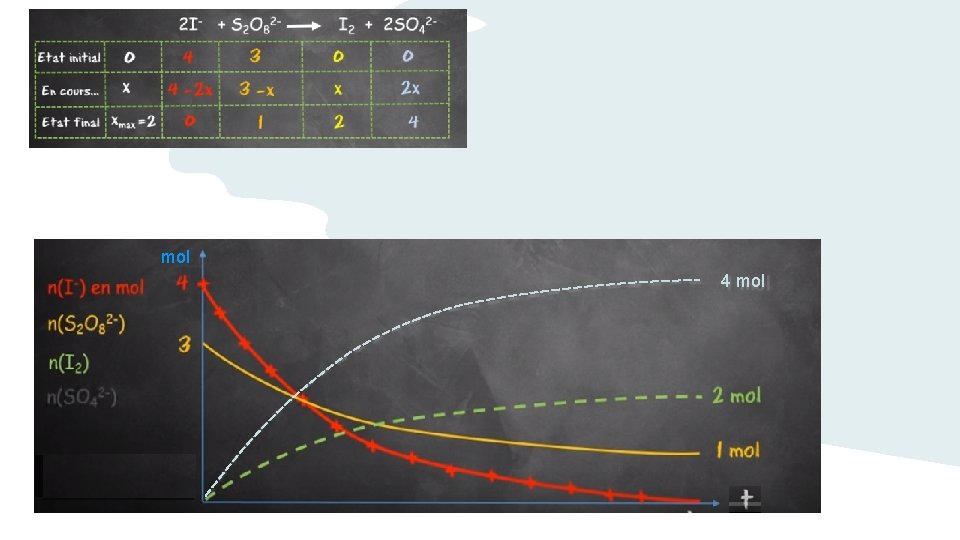
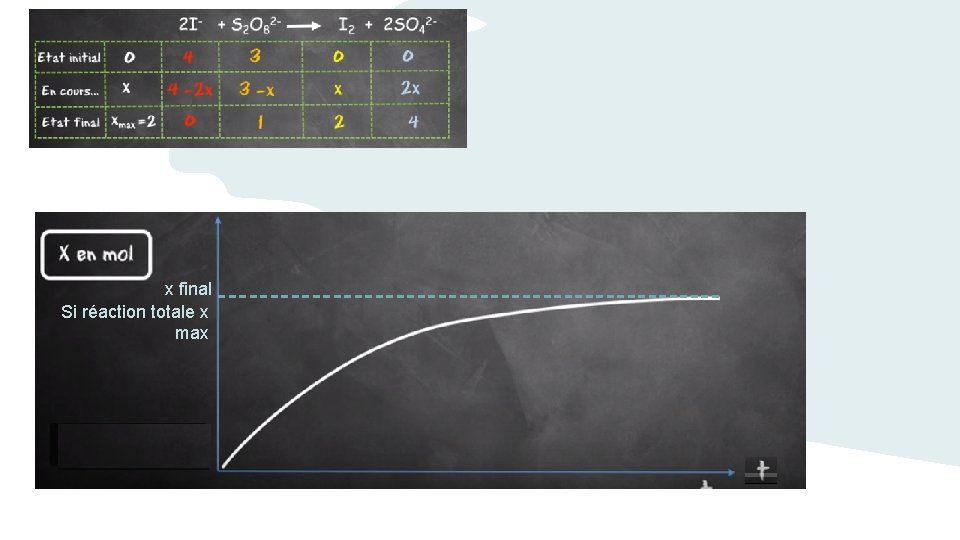
4 mol

mol 4 mol


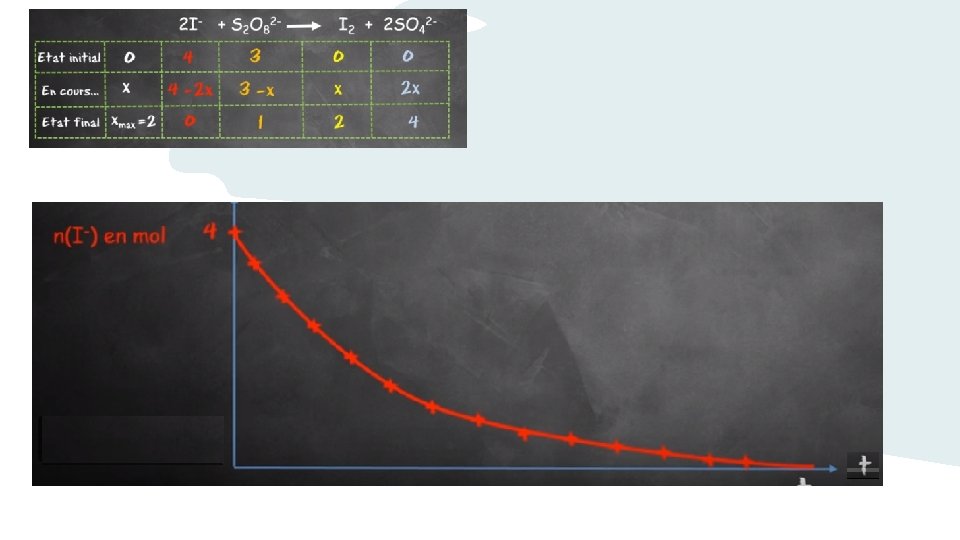
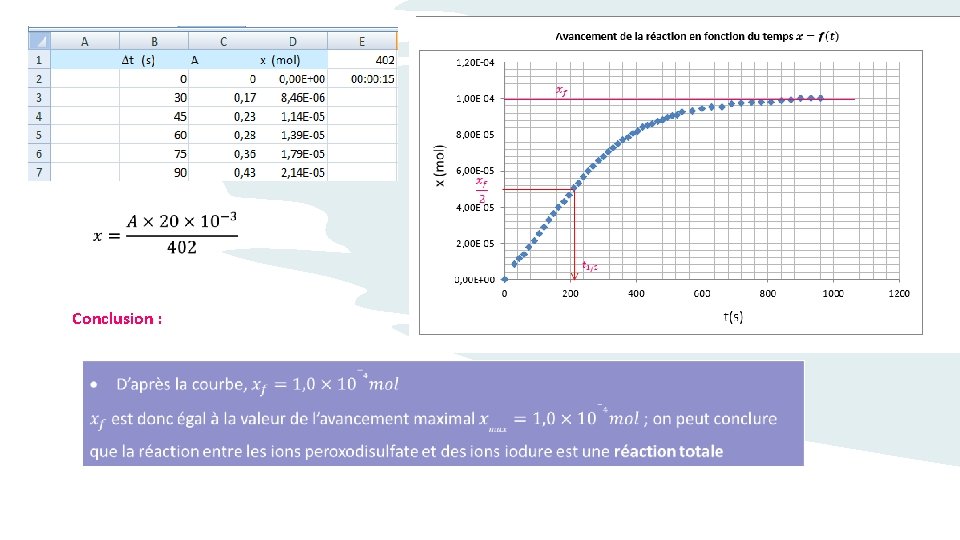
x final Si réaction totale x max

x final

Bilan : Facteurs cinétiques • Les paramètres contrôlables susceptibles de modifier la durée d’une transformation chimique sont appelés facteurs cinétiques • Parfois on cherche à diminuer la durée des transformations dans le cas par exemple de synthèse industrielle afin de réduire les coûts énergétiques. • Par contre on veut parfois augmenter la durée d’une transformation. Par exemple pour permettre une conservation plus longue des aliments, on veut augmenter la durée des réactions de dégradation. • Attention un facteur cinétique ne change pas l’état final de la réaction

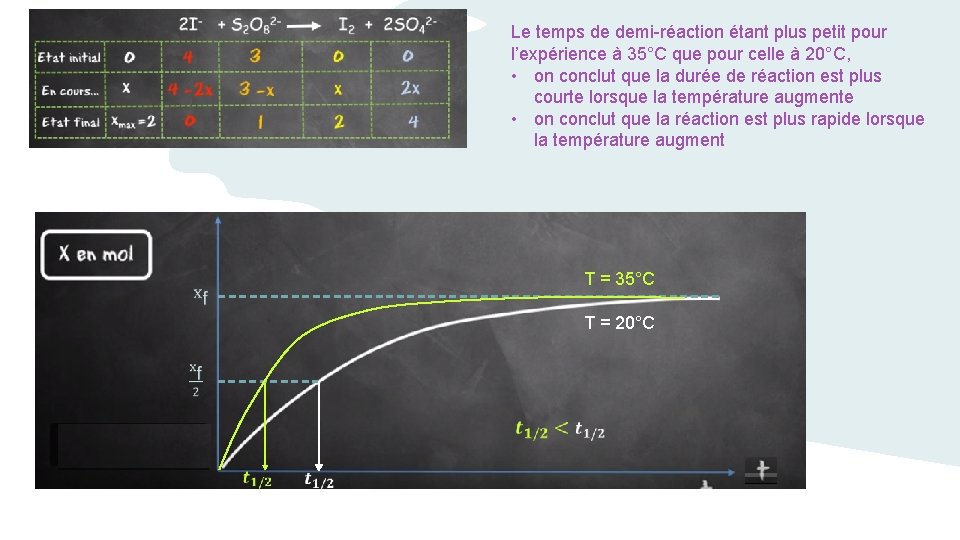
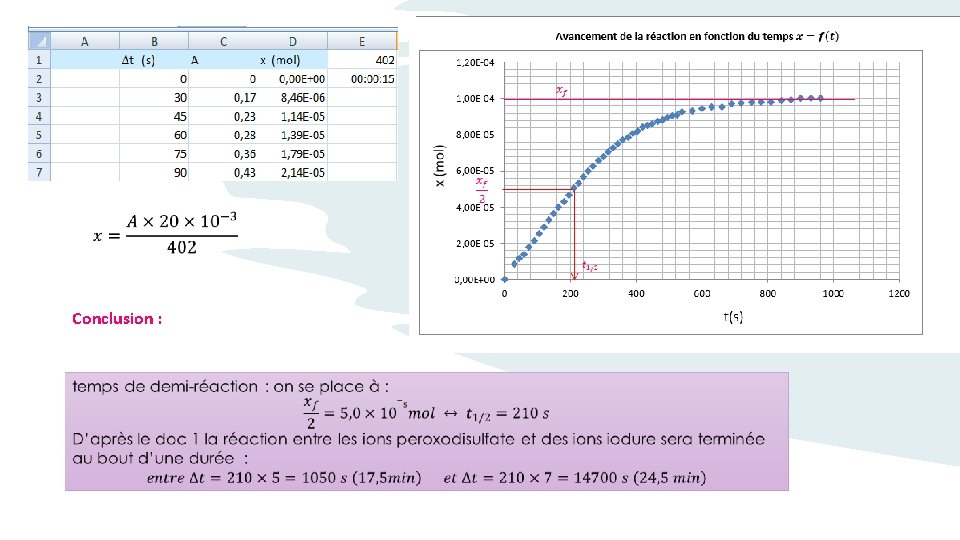
Le temps de demi-réaction étant plus petit pour l’expérience à 35°C que pour celle à 20°C, • on conclut que la durée de réaction est plus courte lorsque la température augmente • on conclut que la réaction est plus rapide lorsque la température augment T = 35°C T = 20°C

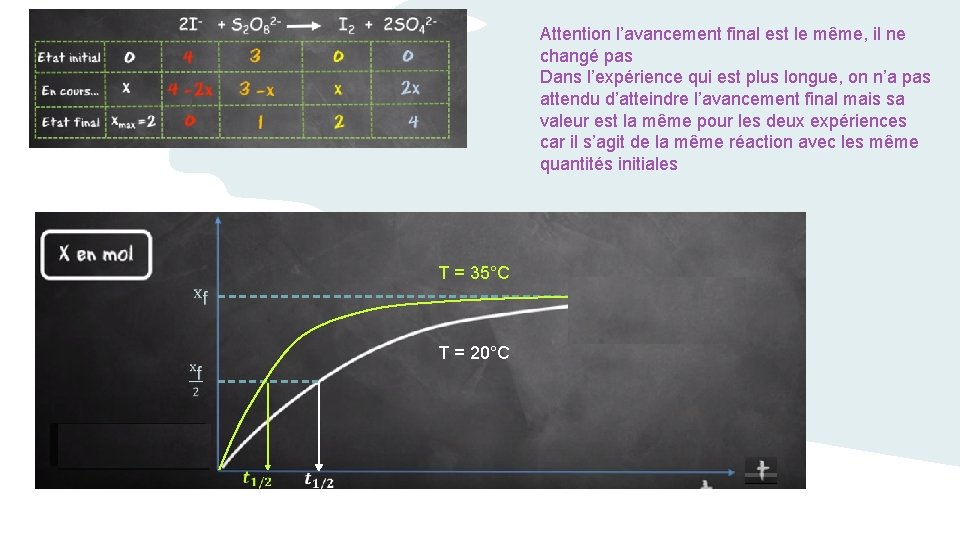
Attention l’avancement final est le même, il ne changé pas Dans l’expérience qui est plus longue, on n’a pas attendu d’atteindre l’avancement final mais sa valeur est la même pour les deux expériences car il s’agit de la même réaction avec les même quantités initiales T = 35°C T = 20°C

TP : On veut vérifier que la réaction est totale et On veut déterminer la durée totale de la réaction

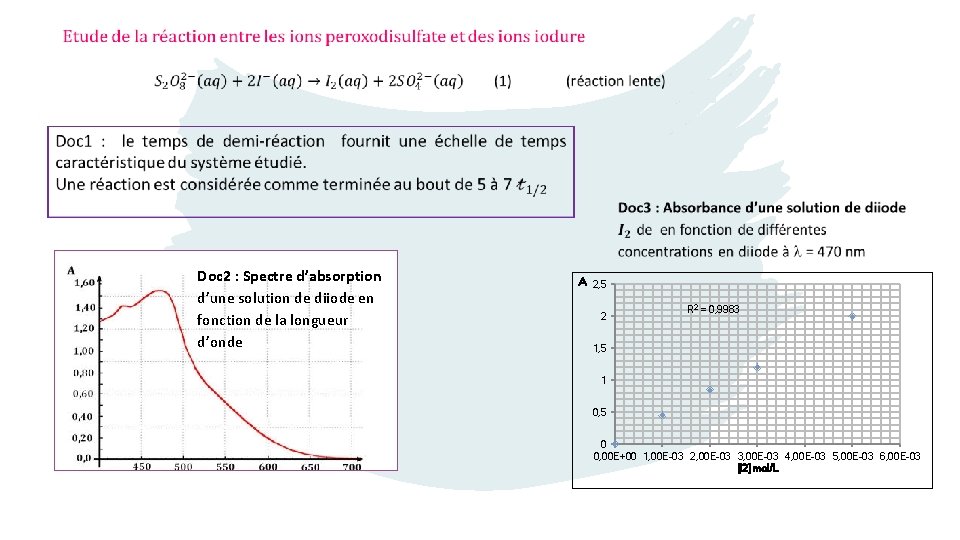
Doc 2 : Spectre d’absorption d’une solution de diiode en fonction de la longueur d’onde A 2, 5 2 R 2 = 0, 9983 1, 5 1 0, 5 0 0, 00 E+00 1, 00 E-03 2, 00 E-03 3, 00 E-03 4, 00 E-03 5, 00 E-03 6, 00 E-03 [I 2] mol/L

la réaction est totale si avancement final est égal à l’avancement maximum Calculer le xmax théorique et le comparer au xfinal Conditions initiales + tableau avancement



Équation de la réaction état initial 0 à t = 0 (mol) au cours de la transformation à une date t (mol) état final à t = (mol) Bilan état final 0 0

Conclusion :

Conclusion :

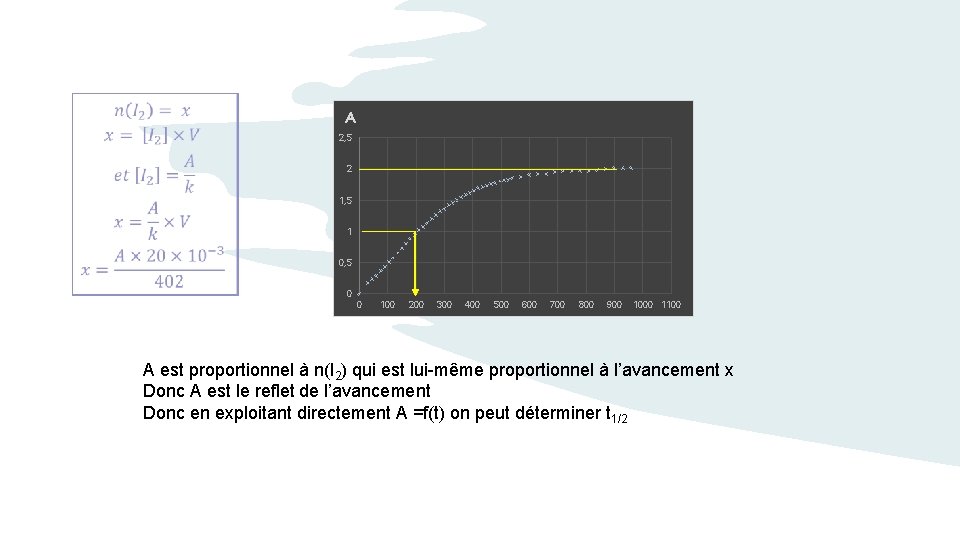
A 2, 5 2 1, 5 1 0, 5 0 0 100 200 300 400 500 600 700 800 900 1000 1100 A est proportionnel à n(I 2) qui est lui-même proportionnel à l’avancement x Donc A est le reflet de l’avancement Donc en exploitant directement A =f(t) on peut déterminer t 1/2

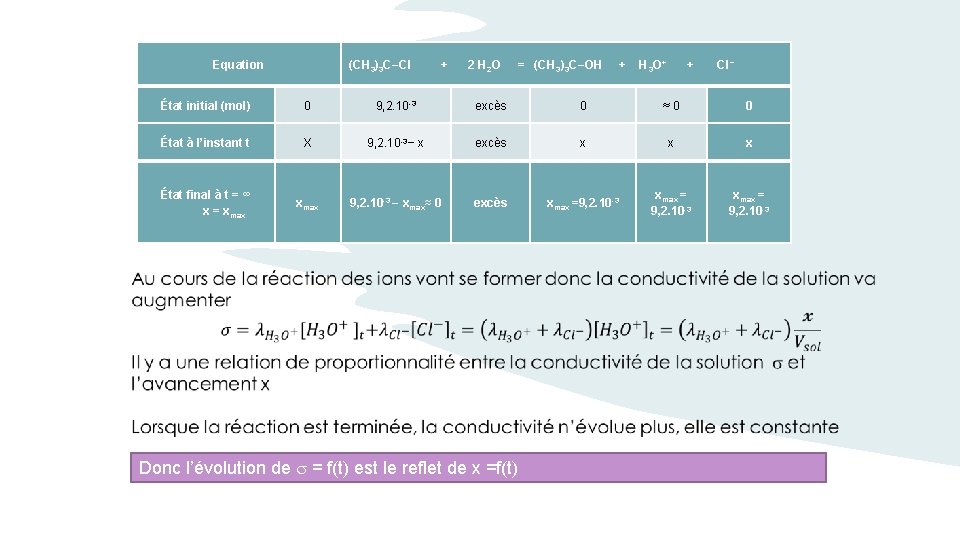
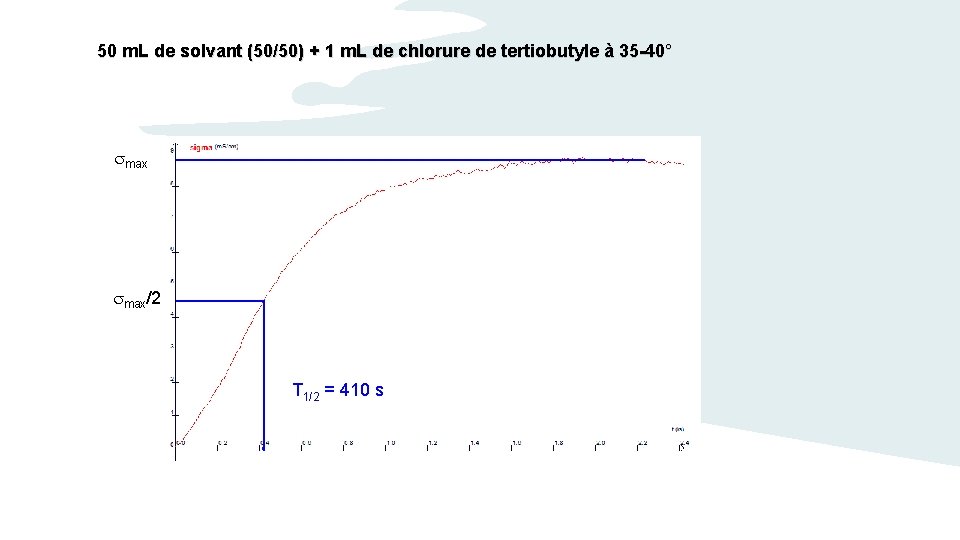
Quelle autre méthode pour suivre l’avancement d’une réaction ? • Suivi conductimétrique de l’hydrolyse du chlorure de tertiobutyle (CH 3)3 C−Cl + 2 H 2 O → (CH 3)3 C−OH + H 3 O+ + Cl−

Equation (CH 3)3 C−Cl + 2 H 2 O = (CH 3)3 C−OH + H 3 O+ + Cl − État initial (mol) 0 9, 2. 10 -3 excès 0 ≈0 0 État à l’instant t X 9, 2. 10 -3− x excès x x x État final à t = ∞ x = xmax 9, 2. 10 -3 − xmax≈ 0 excès xmax =9, 2. 10 -3 xmax = 9, 2. 10 -3 Donc l’évolution de = f(t) est le reflet de x =f(t)

50 m. L de solvant (50/50) + 1 m. L de chlorure de tertiobutyle à 35 -40° max/2 T 1/2 = 410 s

Quelle autre méthode pour suivre l’avancement d’une réaction ? • Suivi cinétique de la synthèse de l’acétate de benzyle.
 Tirez pas sur le scarabée résumé par chapitre
Tirez pas sur le scarabée résumé par chapitre Le petit prince résumé
Le petit prince résumé Resume du livre le petit prince
Resume du livre le petit prince Petit pays chapitre
Petit pays chapitre Kuehne nagel suivi
Kuehne nagel suivi Exemple de tableau de bord rh suivi de l absentéisme
Exemple de tableau de bord rh suivi de l absentéisme Application suivi diabete gestationnel
Application suivi diabete gestationnel Suivi de cohorte
Suivi de cohorte Suivi du contenu
Suivi du contenu Verbe jouer a l'imparfait
Verbe jouer a l'imparfait Suivi évaluation
Suivi évaluation Jai suivi
Jai suivi Racteur
Racteur Matrice de suivi-évaluation
Matrice de suivi-évaluation Fiche projet type
Fiche projet type Livret devoirs faits
Livret devoirs faits Carnet de suivi des apprentissages maternelle
Carnet de suivi des apprentissages maternelle Tableau de bord suivi et évaluation
Tableau de bord suivi et évaluation Registre des déchets excel
Registre des déchets excel Fiche suivi projet
Fiche suivi projet Projet suivi communautaire
Projet suivi communautaire Carnet de suivi des apprentissages cycle 1
Carnet de suivi des apprentissages cycle 1 Matrice de suivi-évaluation
Matrice de suivi-évaluation Suivi dicom
Suivi dicom Coloranti naturali wikipedia
Coloranti naturali wikipedia Spectroscopie d'absorption atomique
Spectroscopie d'absorption atomique