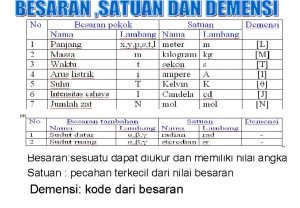
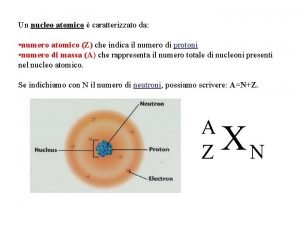
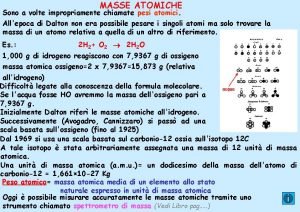
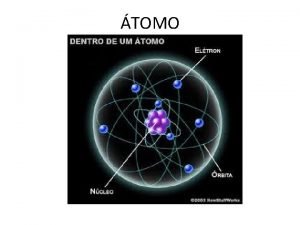
MATERI MATERI adalah segala sesuatu yang mempunyai massa

















































- Slides: 63

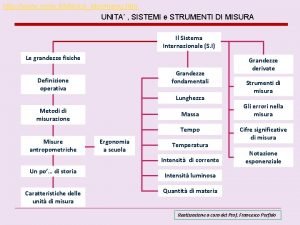
MATERI • MATERI adalah segala sesuatu yang mempunyai massa dan menempati ruang ( punya volume ) • Perubahan materi 1. perubahan fisis a) perubahan yang tidak menghasilkan zat baru b) perubahan bentuk dan wujud tanpa mengubah jenis zat. 2. perubahan kimia adalah perubahan yang menghasilkan zat baru. tanda-tanda perubahan kimia: a) terbentuk gas b) terbentuk endapan. c) perubahan warna d) perubahan suhu e) perubahan rasa

Wujud zat/ materi Padat solid (S) Cair liquid (L) Gas (g) Larutan berair agvous (ag)

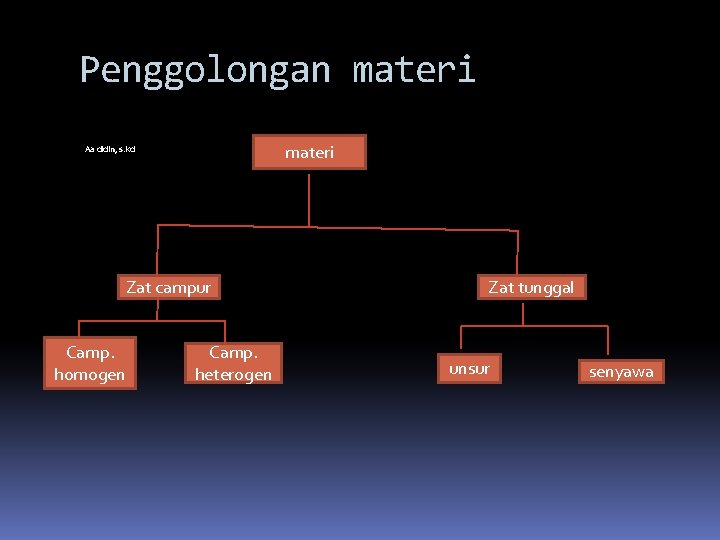
Penggolongan materi Aa didin, s. kd Zat campur Camp. homogen Camp. heterogen Zat tunggal unsur senyawa

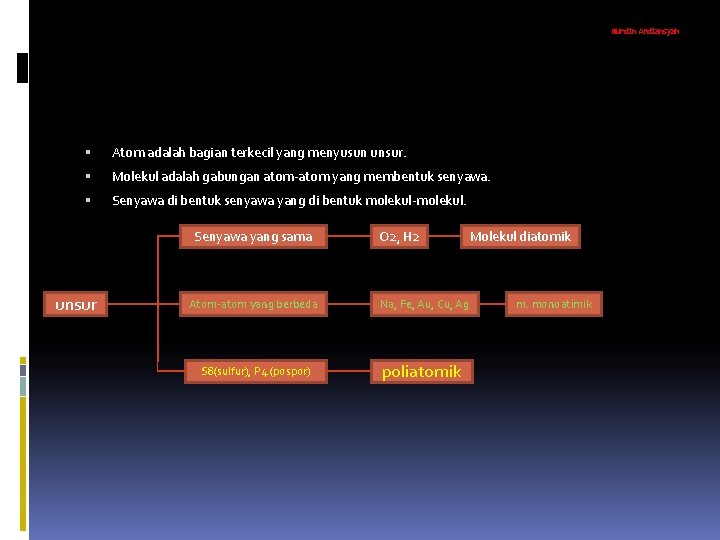
Nurdin Ardiansyah Atom adalah bagian terkecil yang menyusun unsur. Molekul adalah gabungan atom-atom yang membentuk senyawa. Senyawa di bentuk senyawa yang di bentuk molekul-molekul. Senyawa yang sama unsur O 2, H 2 Atom-atom yang berbeda Na, Fe, Au, Cu, Ag S 8(sulfur), P 4 (pospor) poliatomik Molekul diatomik m. monoatimik

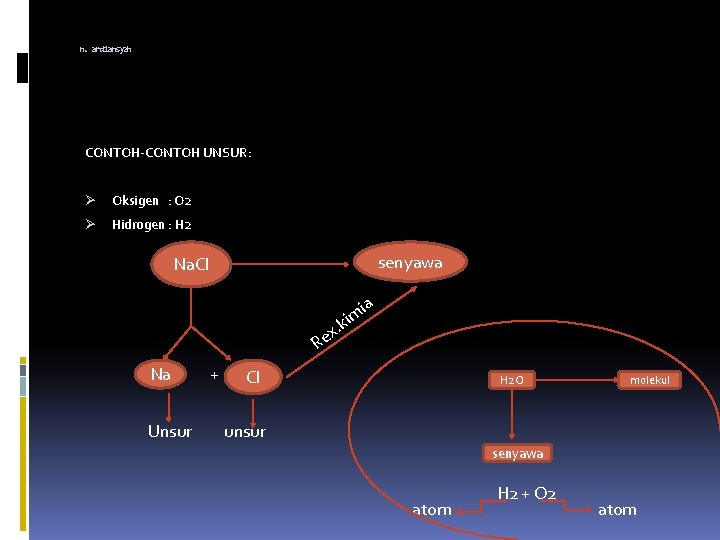
n. ardiansyah CONTOH-CONTOH UNSUR: Ø Oksigen : O 2 Ø Hidrogen : H 2 senyawa Na. Cl . x Re Na Unsur + ia kim Cl H 2 O molekul unsur senyawa atom H 2 + O 2 atom

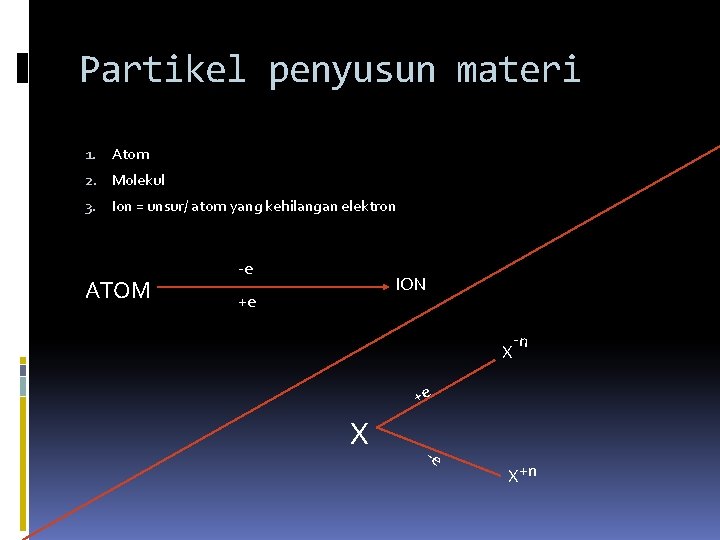
Partikel penyusun materi 1. Atom 2. Molekul 3. Ion = unsur/ atom yang kehilangan elektron ATOM -e ION +e X -n +e X -e X +n

STOIKIOMETRI adalah kajian tentang hubungan-hubungan kuantitatif dalam reaksi kimia. HUKUM KEKEKALAN ENERGI q Pada setiap rex kimia, massa zat” yang bereaksi adalah sama dengan massa produk q Materi tidak dapat di ciptakan atau dimusnahkan. q Versi modern: dalam setiap reaksi kimia tidak dapat di deteksi perubahan massa Magnesium + klorida 1, 0 g 2, 9 g pereaksi Magnesium klorida (3, 9 g) Hasil reaksi/produk

HUKUM PERBANDINGAN TETAP HUKUM SUSUNAN TETAP: Pada stiap rx kimia massa zatr yang beraksi dengan sjumlah zat tertentu zat lain selalu tetap. . atau suatu senyawa murni. . Ex: Oksigen = 16/16+2. 100% = 88, 9 % Hidrogen = 2/ 16+2. 100 % = 11, 1 % Jadi perbandingan O 2: H 2 = 8: 1

Analisa 2 sempel cuplikan garam dapur RUANG SEMPEL MASSA GARAM MASSA Na MASSA Cl 1. 0, 2925 g 0, 1150 g 0, 17750 g 2. 1, 755 g 0, 690 g 1, 065 g BUKTIKAN !!!!! 1. % Na = 0, 115/0, 2925 x 100% = 39, 3% % Cl = 0, 1775/ 0, 2925 x 100% = 60, 7% 2. % Na =0, 690/ 1, 775 x 100% = 39, 3% % Cl = 1, 065/ 1775 x 100% = 60, 7% sama

U/ senyawa dengan rumus Am Bn Massa A jumlah Ar. A m. Ar. A Massa B jumlah Ar. B n. Ar. B latihan perbandingan: A. Cu. SO 4 B. C 6 H 12 O 6

Hubungan massa senyawa dengan massa unsur penyusunnya Massa unsur dalam senyawa massa senyawa jumlah Ar unsur tsb Mr senyawa Latihan: Hitunglah massa masing-masing unsur yang terdapat daalam senyawa Mg. SO 4 ( Ar Mg = 24, S= 32, O= 16)

HUKIM BOYLE Bila suhu tetap, volume gas dalam ruang tertutup berbanding terbalik dengan tekanannya. P 1. V 1 = P 2. V 2 Ex: 1 mol gas CO 2 dengan volume 10 & tekanan 1, 5 atm, 1 Mol gas H dengan volume 30 pada temperatur yang sama dengan gas CO 2. berapa tekanannya? ? JAWAB: P 1 = 1, 5 atm V 1 = 10 V 2 = 30 P 2 = ? ? ? P 1. V 1 = P 2. V 2 1, 5. 10 = P 2. 30 15 = P 2. 30 P 2 = 15/30 P 2 = ½

HUKUM GAY LUSSAC “dalam suatu rx kimia gas yang di ukur pada P dan T yang sama volumenya berbanding lurus dengan koefisien reaksi atau mol dan berbanding lurus sebagai bilangan bulat & sederhana. V 1/V 2 = n 1/n 2 v: volume, n: mol Ex: massa 1 liter suatu gas adalah 2 gram. 10 liter NO pada T dan P yang sama massanya 7, 5 gr. Berapa massa molekul relatif gas tersebut? ? ? Jawab:

Hukum boyle lussac Bagi suatu kuantitas dan suatu gas ideal ( yakni kuantitas menurut beratnya ) hasil kali dari volume dan tekanannya di bagi dengan temperatur mutlaknya adalah konstanta. untuk n 1 = n 2 p 1. v 1/t 1 = p 2. v 2/t 2

Hukum gas ideal Pv =n. Rt Keterangan: P = tekanan V = volume R = konstanta ( 0, 082) N = mol T = temperatur ( temperatur standar nol derajat celcius )

Contoh: Hitunglah volume 1 mol gas pada tekanan standar ( 0 c = 273 k ) pada tekanan 1 atm Jawab : pv =n. Rt 1. v = 1. O, 082. 273 v = 22, 4 l

Teori atom dalton 1. Materi terdiri dari partikel yang tidak dapat di bagi. 2. Atom adalah sama dalam semua hal atom insur lain berbeda dari atom unsur lain. 3. Jika atom-atom bergabung membentuk senyawa, perbandingan atom-atom ini merupakan bilangan yang bulat dan sederhana.

Massa atom relatif Def lama : massa satu atom unsur massa 1 atom hidrogen Def baru : massa 1 atom relatif 1/12 massa atom c-12

Suatu massa dinyatakan dalam satuan massa atom ( SMA ) atau Atomic mass unit ( AMU ) Massa atom relatif : H = 1, 0079 SMA C = 12, 011 SMA O = 15, 999 SMA

Massa molekul relatif (Mr) massa 1 molekul unsur / senyawa relatif 1/12 massa satuan atom C – 12 Harga Mr suatu senyawa merupakan jumlah total dari Ar unsur-unsur penyusun senyawa tersebut. Ex: Hitung massa molekul relatif H 2 SO 4 ( Ar H= 1 , S= 32, O = 16 ) Mr H 2 SO 4 = ( 2. 1) + ( 1. 32) + ( 4. 16) = 98

example: diketahui massa atom (Ar) unsur-unsur: H=1 Na = 23 Mg= 24 C = 12 Cl = 35, 5 N =14 Ca = 40 O = 16 S = 32

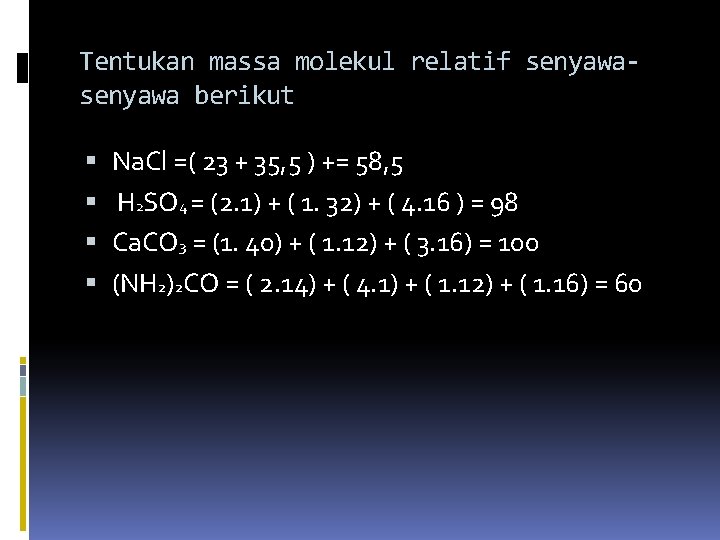
Tentukan massa molekul relatif senyawa berikut Na. Cl =( 23 + 35, 5 ) += 58, 5 H 2 SO 4 = (2. 1) + ( 1. 32) + ( 4. 16 ) = 98 Ca. CO 3 = (1. 40) + ( 1. 12) + ( 3. 16) = 100 (NH 2)2 CO = ( 2. 14) + ( 4. 1) + ( 1. 12) + ( 1. 16) = 60

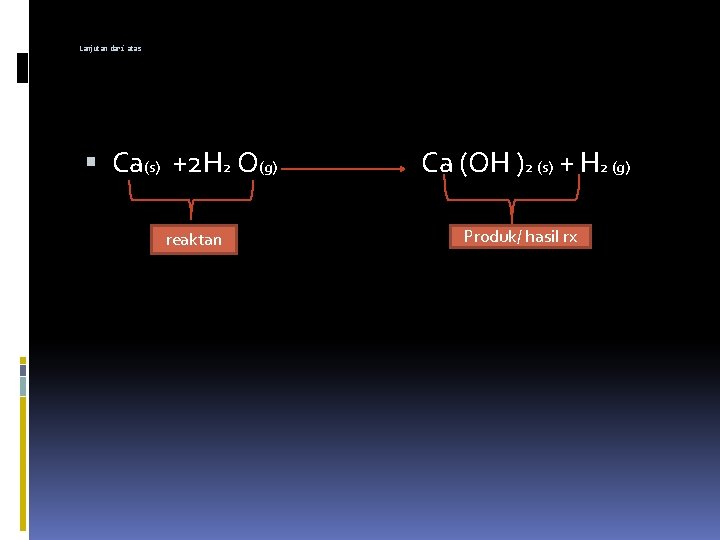
PERSAMAAN REAKSI Persamaan kimia = persamaan yang di gunakan untuk menjabarkan suatu reaksi kima. Ex: logam kalsium akan bereaksi dengan cairan air membentuk padatan kalsium hidrosida dan gas hidrogen. . . lanjut cuyyy

Lanjutan dari atas Ca(s) +2 H 2 O(g) reaktan Ca (OH )2 (s) + H 2 (g) Produk/ hasil rx

Bentuk fasa pada persamaan rx solid/ padat = (S) Liquid/ cair = (I) Gas= (G) Aqveous solution/ larutan berair= (aq)

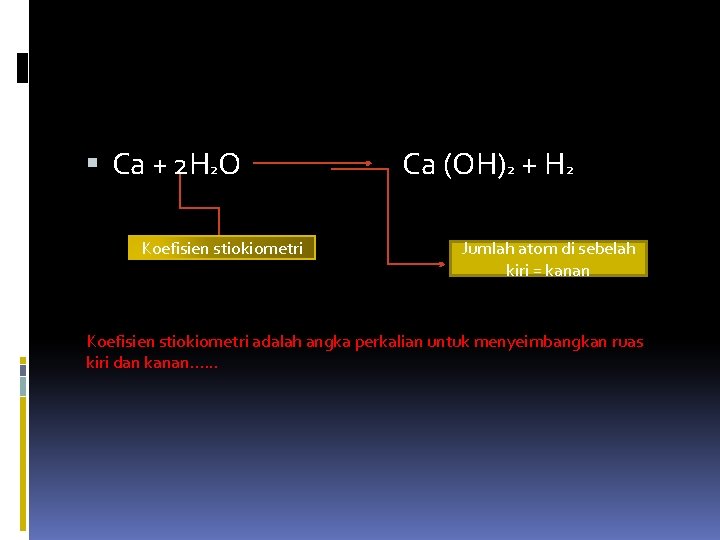
Ca + 2 H 2 O Koefisien stiokiometri Ca (OH)2 + H 2 Jumlah atom di sebelah kiri = kanan Koefisien stiokiometri adalah angka perkalian untuk menyeimbangkan ruas kiri dan kanan. . .

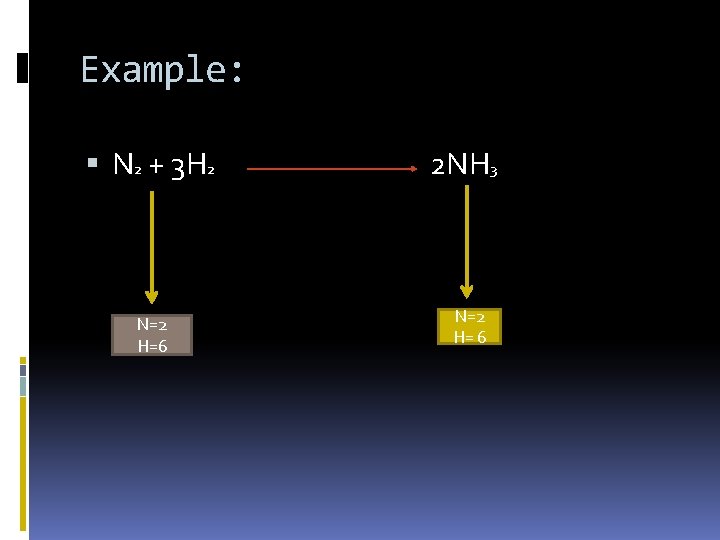
Example: N 2 + 3 H 2 N=2 H=6 2 NH 3 N=2 H= 6

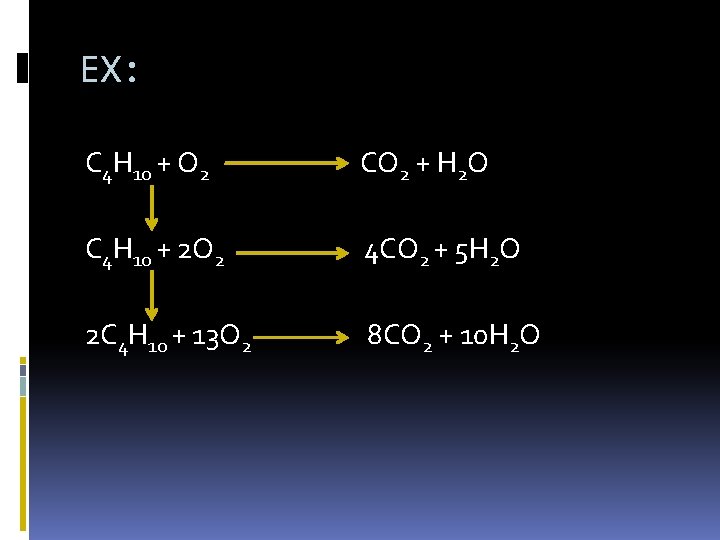
EX: C 4 H 10 + O 2 CO 2 + H 2 O C 4 H 10 + 2 O 2 4 CO 2 + 5 H 2 O 2 C 4 H 10 + 13 O 2 8 CO 2 + 10 H 2 O

Aa didin DALAM PERSAMAAN REAKSI Koefisien = : mol = : volume N 2(g) + 3 H 2(g) 2 NH 3 (g) V 0 lume: 1 : 3 : 2 VH 2 = 3/1. 1 L = 3 L VNH 3 = 2/1. 1 L = 2 L # Ca + 2 H 2 O Ca ( 0 H )2 + H 2 Andai 10 ? ? v. H 2 = ½. 10 L= 5 L

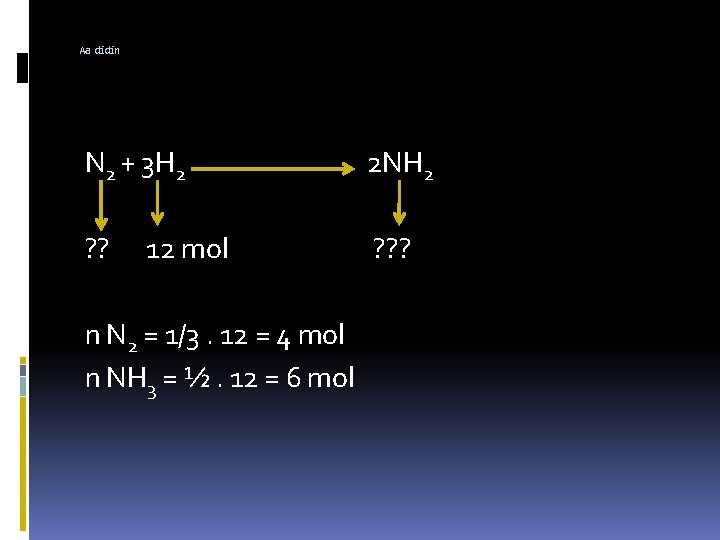
Aa didin N 2 + 3 H 2 2 NH 2 ? ? ? 12 mol n N 2 = 1/3. 12 = 4 mol n NH 3 = ½. 12 = 6 mol

MOL: Satu mol zat adalah banyak zat tersebut yang mengandung 6, 02 x 1023 (L) butir partikel ( atom/molekul/ion dll )

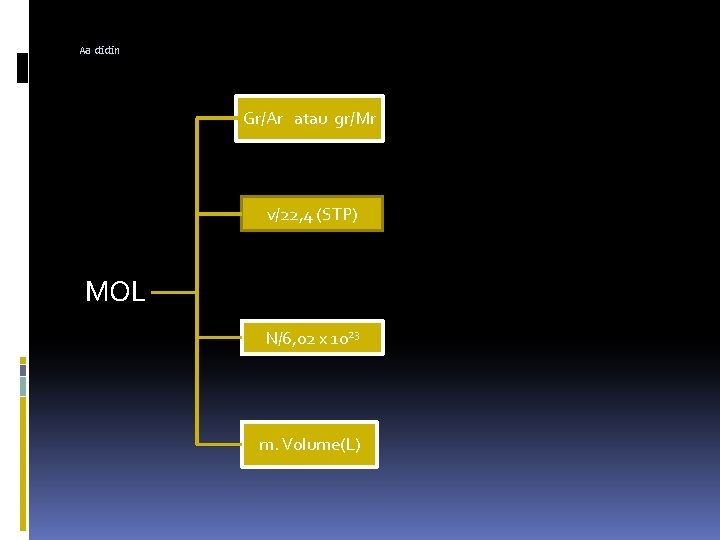
Aa didin Gr/Ar atau gr/Mr v/22, 4 (STP) MOL N/6, 02 x 1023 m. Volume(L)

Hubungan mol dengan jumlah partikel N molekul = mol. L. Jlh atom N ion = mol. L. jlh ion * Jumlah partikel ( N ) 1 mol H 2 O = 6, 02 x 1023 molekul 0, 5 mol H 2 O = 0, 5 x 6, 02 x 1023 molekul = 3, 01 x 1023 molekul

Ex: H 2 O H O molekul N molekul = mol. L = 1 x 6, 02 x 1023 Atom N atom O = mol. L. jlh atom = 1 x 6, 02 x 1023 x 1 N atom H = mol. L. jlh atom = 1 x 6, 02 x 1023 x 2

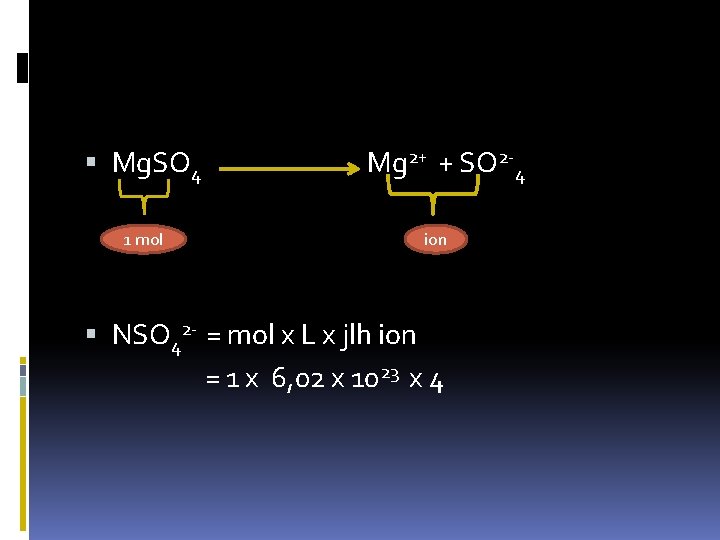
Mg. SO 4 1 mol Mg 2+ + SO 2 -4 ion NSO 42 - = mol x L x jlh ion = 1 x 6, 02 x 1023 x 4

Hubungan mol dengan massa M 1 mol zat = m molekul relatifnya ( Mr )/massa atomnya ( Ar ) dinamakan massa molar. 1 mol zat karbon = 12 SMA shingga massa zat tersebut juga 12 gram. Untuk itu 1 mol zat dapat di buat dalam bentuk persamaan: 1 mol unsur = ( 1 x Ar unsur ) gram 1 mol senyawa = ( 1 x Mr senyawa ) gram Mol (n) = massa (gr) / Mr = massa (gr) / Ar

Ex: = berapa jumlah mol dari 2, 4 gr Mg ? ? ( Ar Mg = 24 ) Jawab: Massa/ Ar = 2, 4/24 = 0, 1 mol = berapa jumlah mol dari 1, 2 gr Mg. SO 4 ? ? ? ( Ar Mg = 24; S = 32; O = 16 ) Jawab: 1, 2/ (1. 24)+(1. 32)+(4. 16) = 1, 2/120 = 0, 01 mol

Soal: A. Suatu gas sebanyak 11, 9 gr menempati wadah 5, 60 L Pada STP. Hitunglah massa atom molarnya!!!!! B. Dalam 245 gr H 3 PO 4, hitunglah: a) jumlah mol H 3 PO 4 ? Mr = 98 b) jumlah atom setiap unsur!! C. hitunglah berapa garam H 2 SO 4, yang dalam 0, 250 L; H 2 SO 4; 0, 50 M !! terdapat

pv = n. Rt 1. 5, 60 = n. 0, 082. 273 5, 60 = n. 22, 386 n = 5, 60 N = 5, 60/22, 386 N = 0, 25 mol N = v/22, 4 N =gr/ stp N = gr/Mr Mr = gr/n Mr = 11, 0/0, 25 Mr = 44 Ja w a b : A.

Aa didin 2. a) mol = massa/Mr = 245/98 = 2, 5 mol b) H 3 PO 4 n H = mol. L. jlh ion = 2, 5. 6, 02. 1023. 3 = 45, 15 x 1023 n P = 2, 5. 6, 02. 1023. 1 = 15, 05 x 1023 n O = 2, 5. 6, 02. 1023. 4 = 60, 2 x 1023

Aa didin 3. diketahui: V = 0, 250 M = 0, 50 m Mr H 2 SO 4 = 98 Di tanya= massa H 2 SO 4 Jawab : N = m x volume = 0, 50 x 0, 250 = 0, 125 mol N = massa/Mr Massa = n x Mr = 0, 125 x 98 `= 12, 25 gr

PERSEN KOMPOSISI Persen komposisi ( menurut massa ) adalah persentase setiap unsur dalam senyawa. % unsur = Ar. ( i )Jlh atom / Mr x 100 Keterangan : v. Ar = massa atom relatif v. Mr = massa molekul relatif v. I = jumlah atom

Contoh: 1. Hitunglah % Na, S, dan O dalam natrium sulfat ( Na. SO 4) : jawab: Na = 2. 23 = 46 S = 1. 32 = 32 O = 4. 16 = 64 % Na = 46/ 142. 100 % = 32, 4 % % S = 32 /142. 100 % = 22, 5 % % O = 64 / 142. 100 % = 45 , 1 %

Aa didin 2. hitunglah persen air dalam Na 2 SO 4. 10 H 2 O. Dan berapa banyak air dalam garam seberat 2 kg ? Jawab: Na = 2. 23 = 46 S = 1. 32 = 32 O = 4. 16 = 64 H = 2. 1 = 2 O = 1. 16 = 16 X 10 = 180 Seluruhnya di jumlahkan sehingga menjadi = 322 Jadi % H 2 O = 180 / 322 x 100 % = 55, 9 % Dalam 2 kg = 2000 gr = 55, 9/ 100 x 2000 = 11, 8 gr

Rumus senyawa ( empiris & molekul) Rumus empiris ü Rumus paling sederhana ü Perbandingan atom-atom dari berbagai unsur dalam senyawa. ü Rumus empiris dapat di tentukan dari data: 1. massa unsur dan senyawa. 2. persen komposisi unsur. 3. Ar unsur- unsur.

Cara menentukan rumus empiris 1. Tentukan massa tiap unsur atau % massa unsur dalam senyawa. 2. Bagi massa tiap unsur dengan Ar nya. ( berarti mol ) perbandingan mol tiap unsur perbandingan atom. 3. Mengubah perbandingan pada point 2 menjadi bilangan sederhana dengan cara membagi dengan bilangan bulat terkecil.

Ex: Suatu senyawa sebanyak 10, 0 gr Mengandung : Seng = 5, 20 gr Karbon = 0, 96 gr Oksigen = 3, 84 gr Tentukan rumus empiris senyawa tersebut!!! Macam unsur Seng Karbon Oksigen Kode unsur Zn C O 2 Ar 65 12 16 Perbandingan mol perbandingan 5, 20/ 65 = 0, 08 1 Jadi rumus empirisnya adalah : Zn. CO 3 0, 96/ 12 = 0, 08 1 3, 84/ 16 = 0, 24 3

Rumus molekul ü ü ü � � Rumus molekul menunjukkan jumlah mol ( bukan perbandingan ) setiap jenis atom dalam satu molekul senyawa. Menyatakan jumlah atom yang sebenarnya dari masing- masing unsur dalam molekul senyawa. Data yang di perlukan : 1. rumus empiris 2. massa molekul relat if ( Mr )

Ex: � � Tentukan rumus molekul suatu senyawa dengan rumus empiris C 2 H 4 O dan massa molekul relatif 88. Jawab: massa RE relatif (2. 12)+(4. 1)+(1. 16)= 44 Mr = 88 =2 x massa RE relatif rumus molekul = 2. RE = (C 2 H 4 O )2 rumus molekul = C 4 H 8 O 2

! ! ! y u c s a g Tu 1. 2. 3. Senyawa gas mulia pertama di temukan pada tahun 1962 terdiri dari 30% , Xe, 40% Pt, dan 26 % F. Hitung rumus empirisnya!!!! Jika 63, 5 gr tembaga bereaksi dengan oksigen membentuk 71, 5 gr tembaga oksida. Hitunglah rumus empiris tembaga oksida tersebut! Tentukan rumus molekul & rumus empiris suatu senyawa dengan persen komposisi H = 2, 36% ; C = 42, 17%; N = 16, 67%; O = 38, 10%, , bila di ketahui Mr= 168

PEREAKASI PEMBATAS Pada persamaan rx yang sudah setara dapat di hitunh banyaknya pereaksi dalam pembatas Tidak semua pereaks dapat bereaksi, salah satu pereaksi habis sedangkan yang lain berlebih. Pereaksi yang habis bereaksi di sebut PEREAKSI PEMBATAS.

Pereaksi pembatas 2 mol C 2 H 5 OH di reaksikan dengan 2 mol O 2. Berapa mol CO 2 yang di hasilkan? ?

TERMODINAMIKA KIMIA Ilmu yang mempelajari perubahan’’ energi dalam suatu sistem yang menyertai reaksi kimia dan hubungan antara berbagai bentuk enargi. Ø Sistem = bagian dari alam yang sedang di pelajari. ( menjadi pusat perhtian) Ø Lingkungan = segala sesuatu yagn di luar sistem yang mempengaruhi atau membatasi sistem secara langsung.

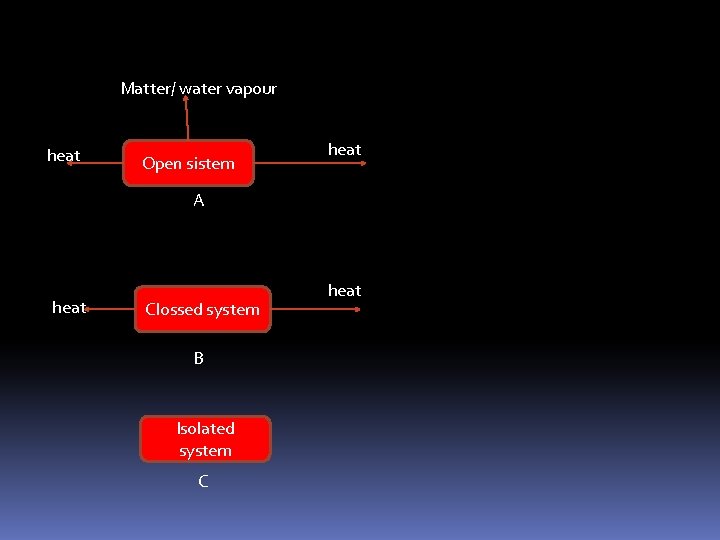
ardyenginering@yahoo. co. id Sistem terbuka= terjadi pertukaran massa dan energi. Sistem tertutup = terjadi peretukaran energi Sistem terisolasi= tidak terjadi pertukaran massa dan energi.

Matter/ water vapour heat Open sistem heat A heat Clossed system B Isolated system C heat

Unit of energi Calorie = 1 heat requered to raise temp. 1000 call = 1 kilocalorie = 1 kcall But we use the unit called the Joule 1 call = 4, 184 Joule.

kalor Bentuk energi yg mengalir dari suatu sistem ke sistem lain karena perbedaan suhu. -q SISTEM LINGKUNGAN +q

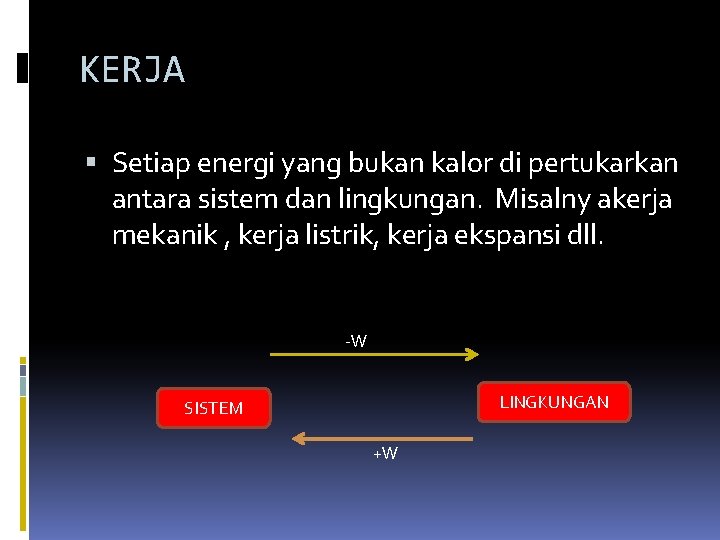
KERJA Setiap energi yang bukan kalor di pertukarkan antara sistem dan lingkungan. Misalny akerja mekanik , kerja listrik, kerja ekspansi dll. -W LINGKUNGAN SISTEM +W

FUNGSI KEADAAN yang d. Sifat-sifat tentukan oleh keadaan sistem yaitu keadaan awal dan keadaan akhir , tidak tergantung pada proses yang di tempuh. ~ energi dalam (U) ~ entalpi ( H) ~ entrapi (S) ~ energi bebas (G)

Energi dalam (U) Yaitu energi total sistem zat” kimia Δϵ =E 2 – E 1 Δϵ = perubahan energi dalam E 1 = energi dalam awal E 2 = enegi dalam akhir

eltalpi Dalam reaksi perubahan entalpi (Δ H) di sebut sebagai kalor reaksi yaitu kalor yang di ukur dengan tekanan tetap ( Qp)


Bentuk” perubahan eltalpi Perubahan entalpi pembentukan perubahan entalpi pembentukan 1 mol senyawa dari unsur-unsurnya dalam keadaa bebas
 Materi adalah segala sesuatu yang
Materi adalah segala sesuatu yang Sesuatu yang menempati ruang dan mempunyai masa disebut
Sesuatu yang menempati ruang dan mempunyai masa disebut Segala sesuatu yang dapat mengalir adalah pengertian dari ?
Segala sesuatu yang dapat mengalir adalah pengertian dari ? Zat adalah segala sesuatu yang memiliki
Zat adalah segala sesuatu yang memiliki Mili mikro nano piko
Mili mikro nano piko Kebutuhan adalah segala sesuatu yang
Kebutuhan adalah segala sesuatu yang Segala sesuatu
Segala sesuatu Segala sesuatu yang merupakan
Segala sesuatu yang merupakan Numero di massa
Numero di massa Molarità
Molarità Come si calcola massa molecolare
Come si calcola massa molecolare Massa molar
Massa molar Mol e massa molar
Mol e massa molar Sifat integral lipat dua
Sifat integral lipat dua Solu.zone chimica molecole in movimento
Solu.zone chimica molecole in movimento Scheda misure antropometriche
Scheda misure antropometriche Aumento ponderale
Aumento ponderale Rapporto massa grassa massa magra
Rapporto massa grassa massa magra Sebuah peluru mempunyai massa 10 gram
Sebuah peluru mempunyai massa 10 gram Tekanan zat padat
Tekanan zat padat Rumus empiris vanilin
Rumus empiris vanilin Sebatang logam mempunyai massa 200 gram
Sebatang logam mempunyai massa 200 gram Ukuran mudah sukarnya suatu benda untuk berputar disebut
Ukuran mudah sukarnya suatu benda untuk berputar disebut Segala tulisan yang diilhamkan allah
Segala tulisan yang diilhamkan allah Latar adalah
Latar adalah Segala tindakan yang
Segala tindakan yang Segala tindakan yang
Segala tindakan yang Memo is short for
Memo is short for Sesuatu yang memiliki nilai
Sesuatu yang memiliki nilai Jenis tari dibedakan menjadi dua yaitu
Jenis tari dibedakan menjadi dua yaitu Menghayal sesuatu yang dapat menimbulkan syahwat
Menghayal sesuatu yang dapat menimbulkan syahwat Orang yang mempunyai daya guna yang tinggi akan
Orang yang mempunyai daya guna yang tinggi akan Gradien garis yang memiliki persamaan y = 3x + 2 adalah
Gradien garis yang memiliki persamaan y = 3x + 2 adalah Kuantisasi digitalisasi grayscale berjumlah
Kuantisasi digitalisasi grayscale berjumlah Gradien garis yang memiliki persamaan y = 13x + 3 adalah
Gradien garis yang memiliki persamaan y = 13x + 3 adalah Akar persamaan kuadrat
Akar persamaan kuadrat Node editor adalah jenis editor yang mempunyai fungsi
Node editor adalah jenis editor yang mempunyai fungsi Kepala sari
Kepala sari Bahan alam dalam berkarya
Bahan alam dalam berkarya Konfigurasi elektron dari unsur 31p15 dengan notasi adalah
Konfigurasi elektron dari unsur 31p15 dengan notasi adalah Manfaat ikan dan daging produk setengah jadi adalah
Manfaat ikan dan daging produk setengah jadi adalah Jenis usaha bersama yang mempunyai asaz kekeluargaan adalah
Jenis usaha bersama yang mempunyai asaz kekeluargaan adalah Gambar bidang
Gambar bidang Magnet berasal dari kata magnesia
Magnet berasal dari kata magnesia Segala puji milik allah
Segala puji milik allah Segala perubahan
Segala perubahan Segala perubahan
Segala perubahan Maksud pujian hanya kepada allah
Maksud pujian hanya kepada allah Pujian hanya kepada allah
Pujian hanya kepada allah Segala macam bentuk
Segala macam bentuk Menahan diri dari makanan dan minuman
Menahan diri dari makanan dan minuman Usaha manusia dalam memenuhi kebutuhan
Usaha manusia dalam memenuhi kebutuhan Pujian hanya kepada allah
Pujian hanya kepada allah Perubahan kimia
Perubahan kimia Perubahan kimia tidak disertai perubahan .... *
Perubahan kimia tidak disertai perubahan .... * Beban 75 gram yang digantung
Beban 75 gram yang digantung Peta konsep tekanan zat padat
Peta konsep tekanan zat padat Bola dengan massa 0 440 kg yang bergerak ke timur
Bola dengan massa 0 440 kg yang bergerak ke timur Faktor-faktor yang mempengaruhi efek komunikasi massa
Faktor-faktor yang mempengaruhi efek komunikasi massa Adi menarik mobil-mobilannya yang memiliki massa
Adi menarik mobil-mobilannya yang memiliki massa Jumlah mol dari 3,01 x 1022 atom besi adalah
Jumlah mol dari 3,01 x 1022 atom besi adalah Media management theory
Media management theory Pada pengaratan 5 milyar atom besi
Pada pengaratan 5 milyar atom besi Hukum proust
Hukum proust