STRUKTUR ATOM SISTEM PERIODIK UNSUR Zat Kimia Zat













- Slides: 19

STRUKTUR ATOM & SISTEM PERIODIK UNSUR

Zat Kimia Zat Tunggal Unsur Senyawa Campuran

Mengapa barang-barang di toko buku dan pasar swalayan tersusun dengan rapi …? ? ? Apakah dasar penyusunannya?

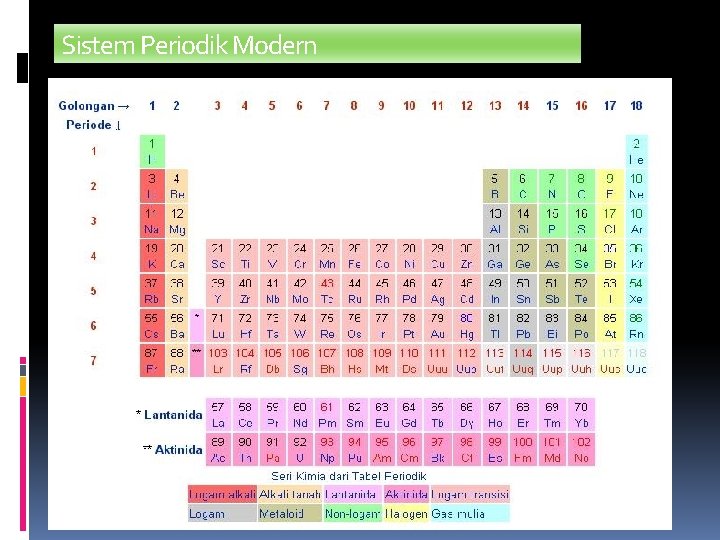
Sistem Periodik Unsur Untuk mempermudah mempelajari sifat suatu unsur, para ilmuwan mengembangkan sistem periodik :

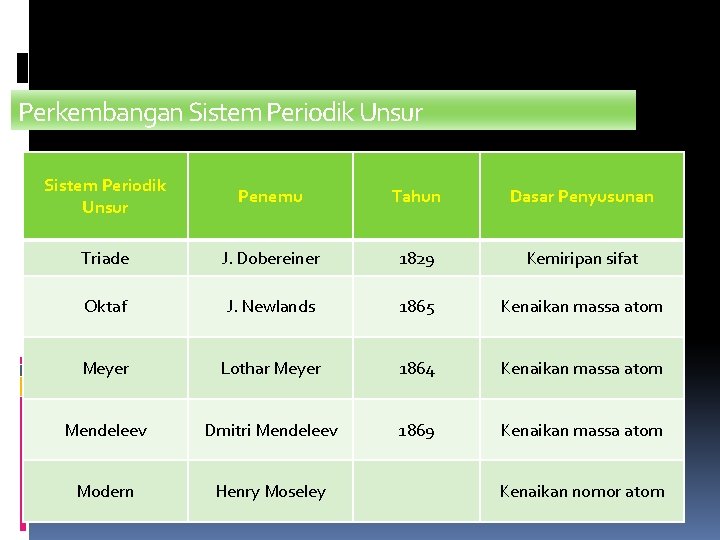
Perkembangan Sistem Periodik Unsur Penemu Tahun Dasar Penyusunan Triade J. Dobereiner 1829 Kemiripan sifat Oktaf J. Newlands 1865 Kenaikan massa atom Meyer Lothar Meyer 1864 Kenaikan massa atom Mendeleev Dmitri Mendeleev 1869 Kenaikan massa atom Modern Henry Moseley Kenaikan nomor atom

Sistem Periodik Modern

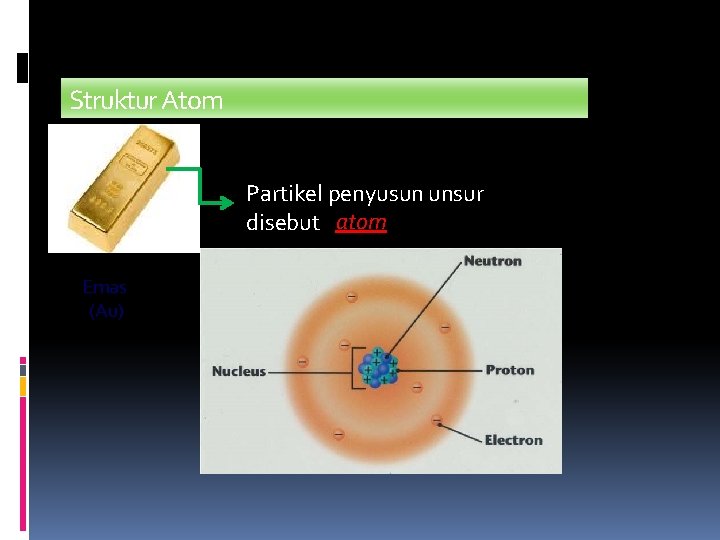
Struktur Atom Partikel penyusun unsur disebut atom Emas (Au)

Notasi Atom Jumlah proton, elektron, dan neutron dapat ditentukan dengan cara : Nomor Massa A Nomor Atom Z X Lambang Unsur Menunjukkan jumlah proton dan juga jumlah elektron Jumlah neutron diperoleh dengan : A - Z

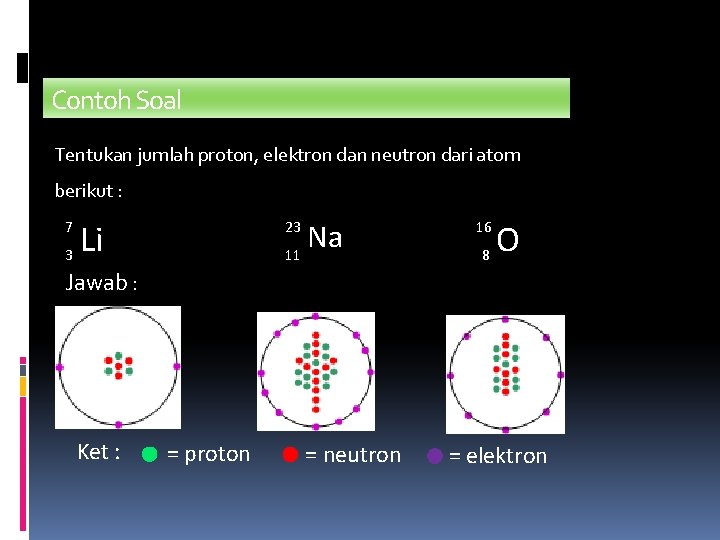
Contoh Soal Tentukan jumlah proton, elektron dan neutron dari atom berikut : 7 3 Li Na 11 23 16 8 O Jawab : Ket : = proton = neutron = elektron

Notasi Ion adalah partikel yang bermuatan Kation (+) Jika jumlah proton > jumlah elektron karena terjadi pelepasan elektron Contoh : K+ , Ca 2+ , Fe 3+ Anion (-) Jika jumlah elektron > jumlah proton karena terjadi penerimaan elektron Contoh : Cl- , O 2 -

Contoh Atom Al 3+ S proton = 13 S elektron = 10 S neutron = 14

Ion positif melepas elektron, jml elektron berkurang 23 p 11 n = 12 e = 10 Na+ Ion negatif 17 2 8 O _ = 11 menangkap elektron, jml elektron bertambah p = 8 n = 9 e = 10

ISOTOP Atom-atom yang mempunyai nomor atom sama, tetapi mempunyai nomor massa berbeda 35 Cl 17 37 Cl 17 p = 17 n = 18 p = 17 n = 20 e = 17

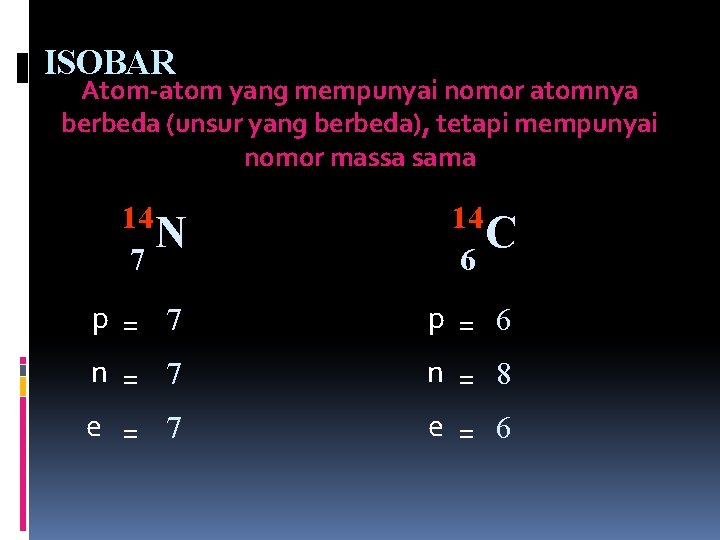
ISOBAR Atom-atom yang mempunyai nomor atomnya berbeda (unsur yang berbeda), tetapi mempunyai nomor massa sama 14 N 7 14 C 6 p = 7 n = 7 p = 6 n = 8 e = 7 e = 6

ISOTON Atom-atom dari unsur yang berbeda nomor, tetapi jumlah neutronnya sama 31 P 15 32 S 16 p = 15 n = 16 p = 16 n = 16 e = 15 e = 16

ISOELEKTRON Atom-atom yang mempunyai jumlah elektron sama 31 P 15 32 + S 16 p = 15 n = 16 p = 16 n = 16 e = 15

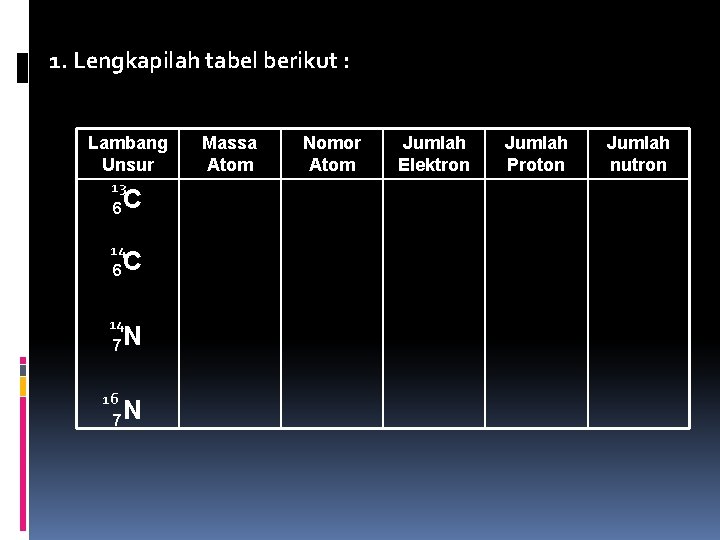
1. Lengkapilah tabel berikut : Lambang Unsur 13 6 C 14 7 N 16 7 N Massa Atom Nomor Atom Jumlah Elektron Jumlah Proton Jumlah nutron

Latihan

Lambang Unsur Massa Atom Nomor Atom Jumlah Elektron Jumlah Proton Jumlah nutron 16 8 O 17 8 O 19 9 F 20 10 Ne 2. Dari data di atas tentukan pasangan unsur-unsur yang termasuk isotop, isobar dan isoton !
 Mengapa susunan unsur unsur diberi sisipan kata periodik
Mengapa susunan unsur unsur diberi sisipan kata periodik Ppt perkembangan sistem periodik unsur
Ppt perkembangan sistem periodik unsur Hukum oktaf dikemukakan oleh . . . . *
Hukum oktaf dikemukakan oleh . . . . * Jari jari atom
Jari jari atom Sistem informasi akuntansi lanjutan
Sistem informasi akuntansi lanjutan Unsur unsur pendidikan
Unsur unsur pendidikan Contoh jurnal khusus retur pembelian
Contoh jurnal khusus retur pembelian Antoine lavoiseir
Antoine lavoiseir Unsur kimia kayu
Unsur kimia kayu Bab 3 kimia unsur
Bab 3 kimia unsur Ada 6 jenis zat kimia yang perlu disimpan di gudang
Ada 6 jenis zat kimia yang perlu disimpan di gudang Caco3
Caco3 Apa itu wawasan nusantara
Apa itu wawasan nusantara Unsur negara secara klasik
Unsur negara secara klasik Unsur nada akor f adalah
Unsur nada akor f adalah Unsur penunjang pak guru
Unsur penunjang pak guru Unsur unsur logam
Unsur unsur logam Kang ora kelebu dasanamane tembung pranatacara yaiku
Kang ora kelebu dasanamane tembung pranatacara yaiku Tingkatan manajemen adalah
Tingkatan manajemen adalah Setiap kelompok atau tim
Setiap kelompok atau tim