Mendiskripsikan struktur atom sifatsifat periodik unsur dan ikatan




























- Slides: 34


Mendiskripsikan struktur atom, sifat-sifat periodik unsur dan ikatan kimia serta struktur molekul dan sifat-sifatnya

Mengidentifikasi atom, struktur atom, sifat-sifat unsur, massa atom relatif dan sifat-sifat periodik dari tabel periodik

INDIKATOR Menentukan partikel dasar (proton, elektron dan netron) Menentukan konfigurasi elektron dan elektron valensi Menentukan massa atom relatif berdasarkan tabel periodik Mengklasifikasikan unsur ke dalam isotop, isobar dan isoton) Mengklasifikasikan unsur ke dalam logam, non logam dan metaloid.

Salah satu konsep ilmiah tertua adalah bahwa semua materi dapat dipecah menjadi zarah (partikel) terkecil, dimana partikel-partikel itu tidak bisa dibagi lebih lanjut. A : Tidak, Tomos : memotong. Dinamakan atom karena dianggap tidak dapat dipecah lagi


MICHAEL FARADAY ( 1791 – 1867 ) MENEMUKAN SINAR KATODA DENGAN MELEWATKAN LISTRIK DI DALAM TABUNG GELAS YANG DIVAKUMKAN

SIFAT – SIFAT SINAR KATODA 1. Sinar katoda dipancarkan oleh katoda dalam sebuah tabung hampa bila dilewati arus listrik (aliran listrik adalah penting) 2. Sinar katoda berjalan dalam garis lurus 3. Sinar tersebut bila membentur gelas atau benda tertentu lainnya akan menyebabkan terjadinya fluoresensi (mengeluarkan cahaya). Dari fluoresensi inilah kita bisa melihat sinar, sinar katoda sendiri tidak tampak. 4. Sinar katoda dibelokkan oleh medan listrik dan magnit; sehubungan dengan hal itu diperkirakan partikelnya bermuatan negatif 5. Sifat-sifat dari sinar katoda tidak tergantung dari bahan elektrodanya (besi, platina dsb. )

Mengamati pembelokan sinar katoda Sinar katoda tidak tampak, hanya melalui pengaruh fluoresensi dari bahan sinar ini dapat dilacak. Berkas sinar katoda dibelokkan oleh medan magnit. Pembelokkan ini menunjukkan bahwa sinar katoda bermuatan negatif.

Thomson juga berhasil menetapkan perbandingan harga muatan negatif elektron terhadap massanya, yaitu : e/m = - 1, 76 x 10 8 Coulomb / gram. e = muatan elektron dalam satuan Coloumb m = massa elektron dalam satuan gram Nilai ini sekitar 2000 kali lebih besar dari e/m yang dihitung dari hidrogen yang dilepas dari elektrolisis air (Thomson menganggap sinar katoda mempunyai muatan listrik yang sama seperti atom hidrogen dalam elektrolisis air).

Partikel sinar katoda bermuatan negatif dan merupakan partikel dasar suatu benda yang harus ada pada setiap atom. Pada tahun 1874 Stoney mengusulkan istilah elektron.

Berhasil menemukan muatan elektron melalui eksperimen “Tetesan Minyak” Percikan tetes minyak dihasilkan oleh penyemprot (A). Tetes ini masuk kedalam alat melalui lubang kecil pada lempeng atas sebuah kondensor listrik. Pergerakan tetes diamati dengan teleskop yang dilengkapi alat micrometer eyepiece (D). Ion-ion dihasilkan oleh radiasi pengionan seperti sinar x dari sebuah sumber (E). Sebagian dari tetes minyak memperoleh muatan listrik dengan menyerap (mengadsorbsi) ion-ion.

Tetes diantara B dan C hanya melayang, tergantung dari tanda (+ atau -) dan besarnya muatan listrik pada tetes. Dengan menganalisis data dari jumlah tetes, Milikan dapat menghitung besarnya muatan q, bahwa tetes selalu merupakan integral berganda dari muatan listrik elektron e yaitu q = n. e (dimana n = 1, 2, 3. . . ) Millikan menyimpulkan besarnya muatan elektron e = - 1, 6 x 10 -19 coloumb

Menurut Thomson dan Millikan e/m = - 1, 76 x 108 Coulomb / gram e = - 1, 6 x 10 -19 Coloumb m= - 1, 76 x 108 Coloumb/gram = 9, 11 x 10 -28 gram Jadi elektron merupakan partikel sub atom dengan massa 9, 11 x 10 -28 gram dan bermuatan - 1, 6 x 10 -19 Coloumb

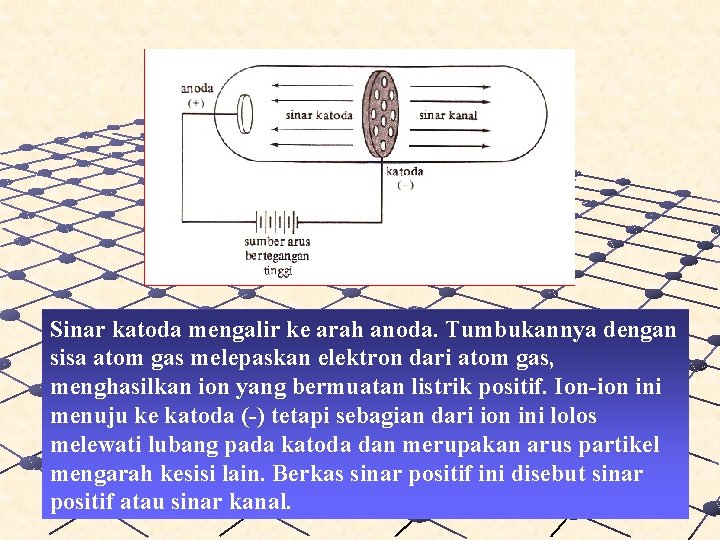
Dalam tahun 1886 Eugen Goldstein melakukan serangkaian percobaan dan ia menemukan partikel jenis baru yang disebut sinar kanal (canal rays) atau sinar positif.

Sinar katoda mengalir ke arah anoda. Tumbukannya dengan sisa atom gas melepaskan elektron dari atom gas, menghasilkan ion yang bermuatan listrik positif. Ion-ion ini menuju ke katoda (-) tetapi sebagian dari ion ini lolos melewati lubang pada katoda dan merupakan arus partikel mengarah kesisi lain. Berkas sinar positif ini disebut sinar positif atau sinar kanal.

Melakukan percobaan hamburan sinar alpha pada lempengan logam emas Sinar alpha Massa = 4 sma (700 x massa elektron) Muatan = + 3, 2 x 10 -19 coloumb (-2 x muatan elektron)

James Chadwick melakukan percobaan penembakan atom berilium dengan sinar alpha dan menemukan partikel yang tidak bermuatan (netral) yang disebut neutron Massa neutron hampir sama dengan massa proton, yaitu 1. 836 x massa elektron Massa neutron = 1. 836 x 9, 11 x 10 -28 gram = 1, 67 x 10 -24 gram = 1 sma

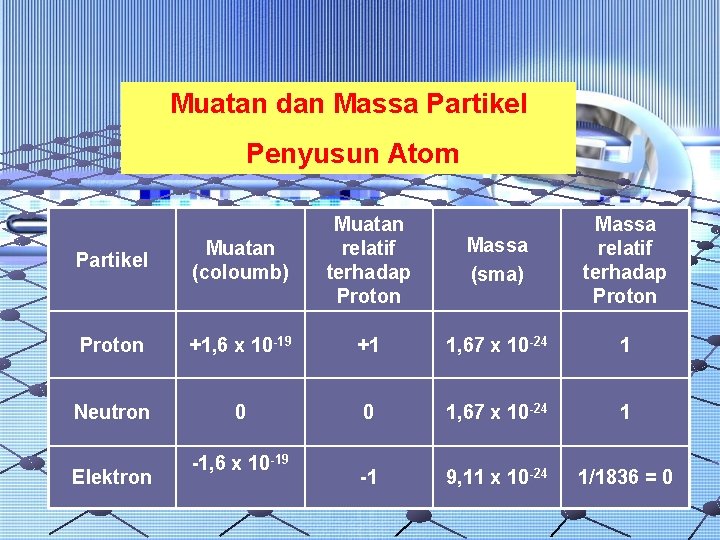
Muatan dan Massa Partikel Penyusun Atom Partikel Muatan (coloumb) Muatan relatif terhadap Proton +1, 6 x 10 -19 +1 1, 67 x 10 -24 1 Neutron 0 0 1, 67 x 10 -24 1 -1 9, 11 x 10 -24 1/1836 = 0 Elektron -1, 6 x 10 -19 Massa (sma) Massa relatif terhadap Proton

NOMOR ATOM DAN NOMOR MASSA Nomor Atom ( Z ) = Jumlah Proton Pada Atom netral, Jumlah Proton = Jumlah elektron Sehingga Z = Jumlah Proton (p) = Jumlah Elektron (e) Nomor Massa (A) = Jumlah Proton + Jumlah Neutron = p+n

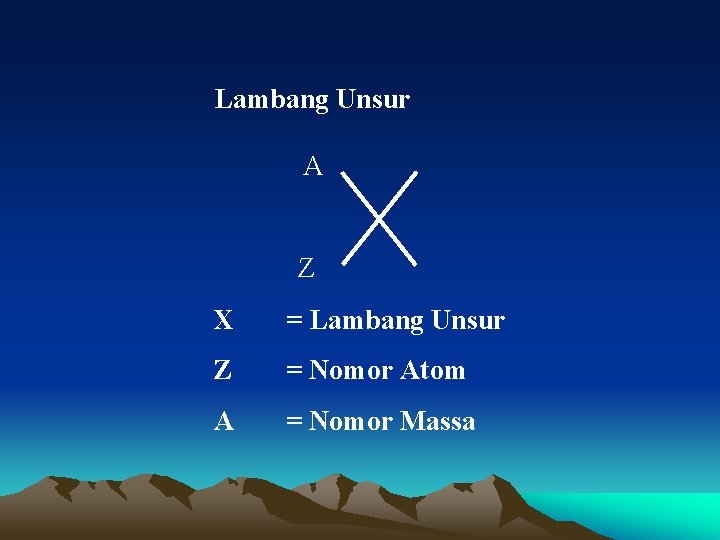
Lambang Unsur A Z X = Lambang Unsur Z = Nomor Atom A = Nomor Massa

ISOTOP, ISOTON DAN ISOBAR ISOTOP = Z sama, A berbeda ISOBAR = Z berbeda, A sama ISOTON = Z dan A berbeda, tetapi A – Z sama = p berbeda, n sama

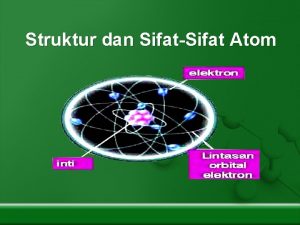
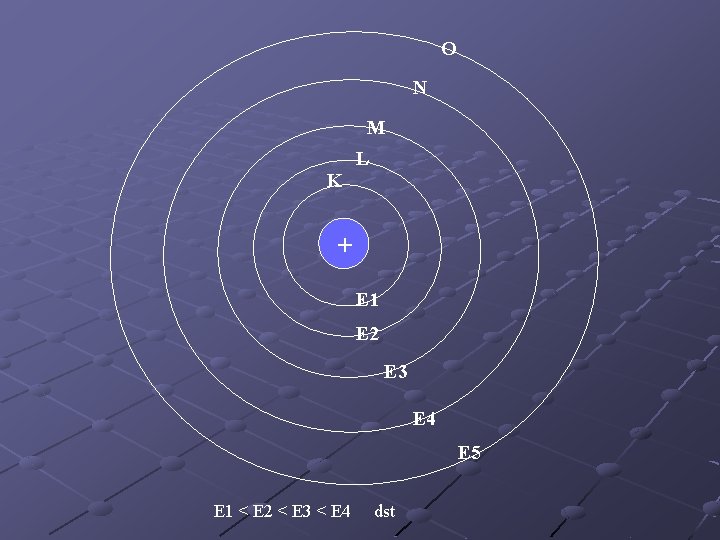
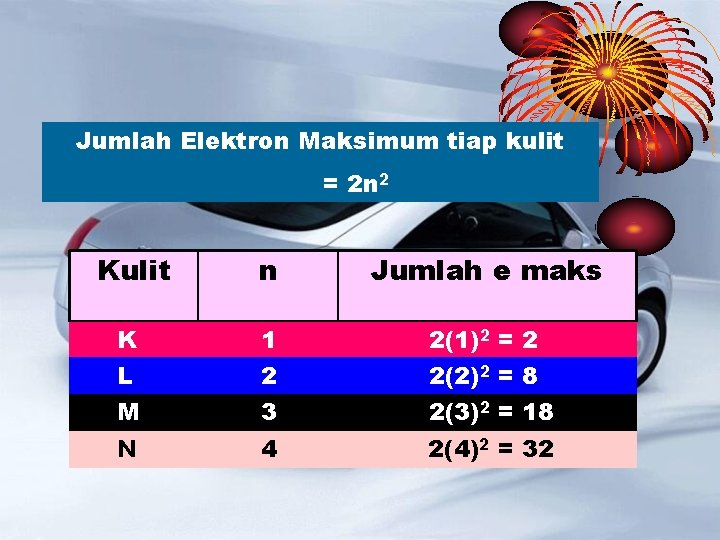
KONFIGURASI ELEKTRON Adalah penyusunan elektron dalam atom Elektron dalam atom tersusun pada kulit atom berdasarkan tingkat energinya Kulit ke-1 (n=1) disebut kulit K Kulit ke-2 (n=2) disebut kulit L Kulit ke-3 (n=3) disebut kulit M Kulit ke-4 (n=4) disebut kulit N Dan seterusnya sampai kulit ke-7

O N M L K + E 1 E 2 E 3 E 4 E 5 E 1 < E 2 < E 3 < E 4 dst

Jumlah Elektron Maksimum tiap kulit = 2 n 2 Kulit n Jumlah e maks K L 1 2 2(1)2 = 2 2(2)2 = 8 M 3 2(3)2 = 18 N 4 2(4)2 = 32

Pengisian Elektron Dari kulit K kemudian L, M, N dan seterusnya Atom Kulit K Kulit L Kulit M Kulit N n = 1 n = 2 n = 3 n = 4 1 H 1 3 Li 6 C 2 2 1 4 12 Mg 2 8 2 19 K 2 8 8 1

Elektron Valensi • Elektron yang ada pada kulit terluar 1 H 1 3 Li 2 1

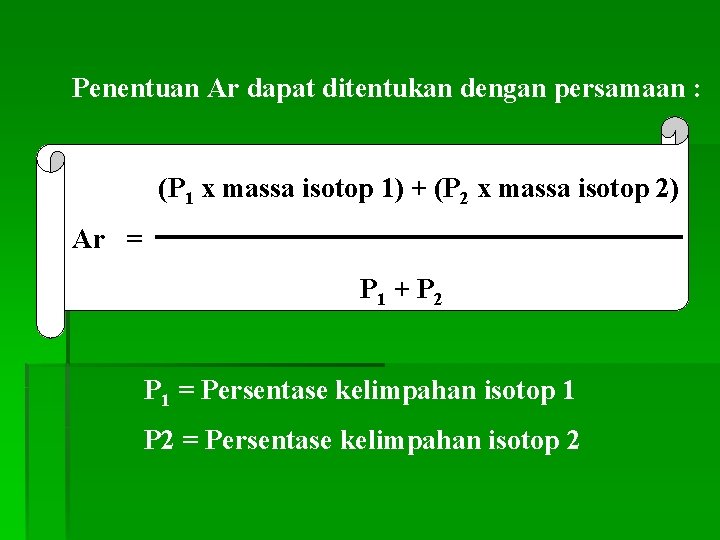
Massa rata-rata 1 atom X Ar X = 1/12 x Massa 1 atom 12 C

Penentuan Ar dapat ditentukan dengan persamaan : (P 1 x massa isotop 1) + (P 2 x massa isotop 2) Ar = P 1 + P 2 P 1 = Persentase kelimpahan isotop 1 P 2 = Persentase kelimpahan isotop 2

UNSUR LOGAM DAN NON LOGAM Sifat logam dan non logam dipengaruhi oleh elektron valensi Unsur Logam mampu melepas elektron menjadi bermuatan positif Unsur non logam mampu menerima elektron menjadi bermuatan negatif

Diskusi kelompok untuk memahamim partikel dasar penyusun atom 1. Siapa penemu elektron, proton dan neutron ? 2. Jelaskan penemuan elektron dengan penemuan sinar katoda ! 3. Jelaskan penemuan inti atom, proton dan neutron ! 4. Bagaimana percobaan tetesan minyak yang dilakukan oleh Millikan ?

1. Lengkapilah tabel berikut : Lambang Unsur 13 6 C 14 7 N 16 7 N Massa Atom Nomor Atom Jumlah Elektron Jumlah Proton Jumlah nutron

Lambang Unsur Massa Atom Nomor Atom Jumlah Elektron Jumlah Proton Jumlah nutron 16 8 O 17 8 O 19 9 F 20 10 Ne 2. Dari data di atas tentukan pasangan unsur-unsur yang termasuk isotop, isobar dan isoton !

3. Tentukan konfigurasi elektron dan elektron valensi dari : 16 a. 8 A b. 35 17 X _ 4. Atom C mempunyai 3 isotop, yaitu C-12, C-13 dan C-14. Jumlah masing isotop di alam adalah 80 %, 10 %. Tentukan Ar C !
 Mengapa susunan unsur unsur diberi sisipan kata periodik
Mengapa susunan unsur unsur diberi sisipan kata periodik Materi sistem periodik unsur ppt
Materi sistem periodik unsur ppt Hukum oktaf dikemukakan oleh . . . . *
Hukum oktaf dikemukakan oleh . . . . * Jari jari atom
Jari jari atom Angka kredit pengawas ujian
Angka kredit pengawas ujian Sisi pada balok dibatasi oleh
Sisi pada balok dibatasi oleh Identifikasi ciri-ciri pertanian rakyat
Identifikasi ciri-ciri pertanian rakyat Unsur-unsur bangun ruang kubus balok dan prisma segitiga
Unsur-unsur bangun ruang kubus balok dan prisma segitiga Garis oq dan os pada gambar dinamakan
Garis oq dan os pada gambar dinamakan Suatu unsur netral mempunyai 2 elektron dalam kulit pertama
Suatu unsur netral mempunyai 2 elektron dalam kulit pertama Molekul senyawa
Molekul senyawa Jelaskan arti wawasan nusantara
Jelaskan arti wawasan nusantara Unsur unsur negara secara klasik
Unsur unsur negara secara klasik Unsur nada akor f adalah
Unsur nada akor f adalah Unsur unsur logam
Unsur unsur logam Bedane teks pranatacara karo pamedhar sabda ing perangan
Bedane teks pranatacara karo pamedhar sabda ing perangan Tingkatan manajemen adalah
Tingkatan manajemen adalah Manfaat membangun tim yang dinamis
Manfaat membangun tim yang dinamis Saluran kepemimpinan
Saluran kepemimpinan Hubungan antar unsur lingkaran
Hubungan antar unsur lingkaran Body diagonal of a cube
Body diagonal of a cube Manajemen keperawatan adalah
Manajemen keperawatan adalah Berikut yang merupakan indikator sistem demokrasi adalah
Berikut yang merupakan indikator sistem demokrasi adalah Luas selimut kerucut = 2 ∏ r t
Luas selimut kerucut = 2 ∏ r t Unsur pembantu pimpinan muhammadiyah
Unsur pembantu pimpinan muhammadiyah Unsur pembentuk prosa fiksi
Unsur pembentuk prosa fiksi Unsur karangan ilmiah
Unsur karangan ilmiah Unsur-unsur perencanaan pembelajaran
Unsur-unsur perencanaan pembelajaran Unsur terbentuknya bangsa
Unsur terbentuknya bangsa Bangun ruang yang dibatasi oleh
Bangun ruang yang dibatasi oleh Unsur unsur pendidikan kesehatan
Unsur unsur pendidikan kesehatan Unsur unsur kerucut
Unsur unsur kerucut Unsur-unsur
Unsur-unsur Unsur-unsur balok
Unsur-unsur balok Elemen yang merupakan ide pokok lakon drama adalah
Elemen yang merupakan ide pokok lakon drama adalah