STRUKTUR ATOM SISTEM PERIODIK 1 2 TEORI ATOM
















![IONISASI UNSUR-UNSUR Na [Ne]3 s 1 Mg [Ne]3 s 2 Al [Ne]3 s 23 IONISASI UNSUR-UNSUR Na [Ne]3 s 1 Mg [Ne]3 s 2 Al [Ne]3 s 23](https://slidetodoc.com/presentation_image_h/2cdc426ed4f248a6f18de47faf9e63c3/image-21.jpg)

- Slides: 24

STRUKTUR ATOM & SISTEM PERIODIK 1

2 TEORI ATOM DALTON • Atom adalah partikel terkecil penyusun materi yang tidak dapat terbagi dan dihancurkan • Seluruh atom suatu unsur identik, baik masa maupun sifatnya • Senyawa akan terbentuk bila atom-atom dari unsur yang berbeda bergabung dalam bilangan bulat sederhana • Perubahan/reaksi kimia terjadi apabila terdapat penyusunan kembali atom-atom suatu senyawa membentuk senyawa yang baru. 2

8 FAKTA-FAKTA YANG MELEMAHKAN MODEL ATOM DALTON • Atom dapat berubah menjadi atom lain: peluruhan radioaktif • Atom memiliki sub-partikel, diantaranya bermuatan listrik : gaya-gaya Coulumb antar materi 3

Spektrum Garis dari Atom • Kontribusi Bohr : model atom sederhana. • Dasar model : Spektrum garis yang tajam dari atom tereksitasi Niels Bohr (1885 -1962) (Nobel, 1922) 4

Spektrum Garis dari Atom-atom Tereksitasi • Atom-atom tereksitasi akan memancarkan radiasi pada panjang gelombang tertentu • Panjang gelombang radiasi tergantung pada jenis unsur. H Hg Ne 5

Spektra atom dan model Bohr Model atom awal abad 20: suatu elektron mengelilingi inti dalam suatu orbit 1. 2. Karena orbit yang mungkin tidak terhingga, energi elektron juga tidak terhingga: tidak mungkin Pergerakan partikel dalam medan listrik akan memancarkan energi. Elektron akan terus menerus kehilangan energi: Akhir pergerakan elektron, kehancuran atom! Niels Bohr (1885 -1962) (Nobel, 1922) 6

Spektra atom dan model Bohr (2) • Bohr mengatakan bahwa teori klasik adalah salah. • Teori baru: QUANTUM atau WAVE MECHANICS. • e- hanya dapat berada pada orbit-orbit yang diskrit — disebut sebagai keadaan stasioner. • e- dipisahkan oleh keadaan-keadaan yang energinya terkuantisasi. 7

Dari Model Bohr ke Mekanika Kuantum • Bohr mengubah secara radikal pandangan kita terhadap materi • Problema teori model Bohr – tidak berhasil untuk atom berelektron banyak. – ide-ide kuantum diperkenalkan secara “paksa”. • Perbaikan model Bohr: KUANTUM atau MEKANIKA GELOMBANG 8

Mekanika Kuantum atau Gelombang • Cahaya: partikel dan gelombang • Usulan de Broglie (1924): Setiap materi bergerak memiliki sifat gelombang • Untuk cahaya: E = hn = hc / l • Untuk partikel: E = mc 2 (Einstein) L. de Broglie (1892 -1987) maka, mc = h / l untuk partikel mv=h/l l untuk partikel disebut panjang gelombang de Broglie 9

Mekanika Kuantum atau Gelombang E. Schrodinger 1887 -1961 • Schrodinger : elektron yang bergerak mengelilingi inti juga berperilaku seperti gelombang • Penyelesaian PERSAMAAN GELOMBANG menghasilkan sederet rumus matematik yang disebut Fungsi gelombang, Y • Setiap fungsi gelombang menggambarkan energi yang diperbolehkan untuk sebuah elektron • Kuantisasi akan terjadi dengan sendirinya. 10

FUNGSI GELOMBANG, Y • Y adalah fungsi jarak dan sudut. • Untuk satu elektron, Y menyangkut sebuah ORBITAL — daerah dalam ruang tempat ditemukannya sebuah elektron • Y tidak menggambarkan kedudukan elektron dengan tepat • Harga Y 2 menunjukkan probabilitas menemukan sebuah elektron pada titik tertentu 11

Azas ketidakpastian W. Heisenberg 1901 -1976 • Hakekat elektron dalam atom: teori W. Heisenberg. • Posisi dan momentum (p = mv) sebuah elektron tidak dapat ditentukan secara tepat sekaligus. Kesalahan posisi dan momentum ditunjukkan dengan hubungan Dx. Dp = h • Posisi dan kecepatan sebuah elektron dapat digambarkan dengan : DISTRIBUSI PROBABILITAS (Y 2) 12

Fungsi gelombang (3) Y 2 setara dengan probabilitas menemukan elektron dalam satu titik tertentu 13

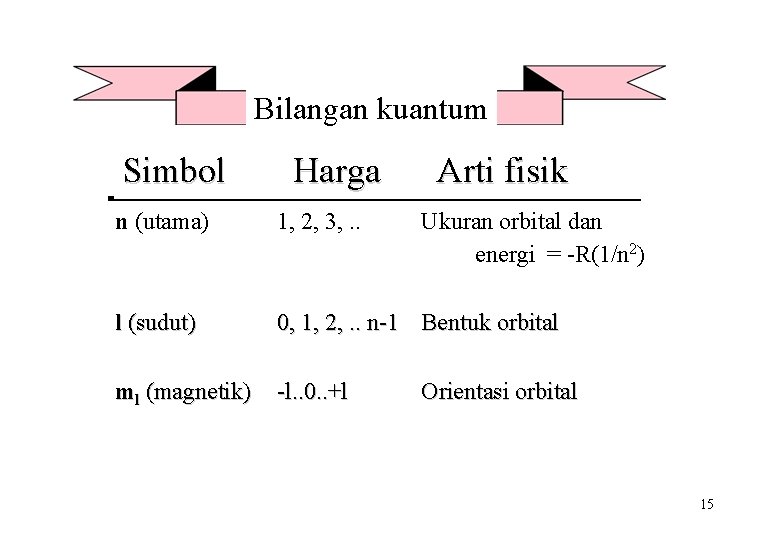
Bilangan kuantum orbital • Suatu orbital atom didefenisikan oleh 3 bilangan kuantum : n bilangan kuantum utama l bilangan kuantum angular ml bilangan kuantum magnetik 14

Bilangan kuantum Simbol Harga Arti fisik n (utama) 1, 2, 3, . . Ukuran orbital dan energi = -R(1/n 2) l (sudut) 0, 1, 2, . . n-1 Bentuk orbital ml (magnetik) -l. . 0. . +l Orientasi orbital 15

Urutan Pengisian Orbital 16

Konfigurasi Elektron dan Sistem Berkala 17

SISTEM BERKALA UNSUR-UNSUR 18

JARI-JARI ATOM 19

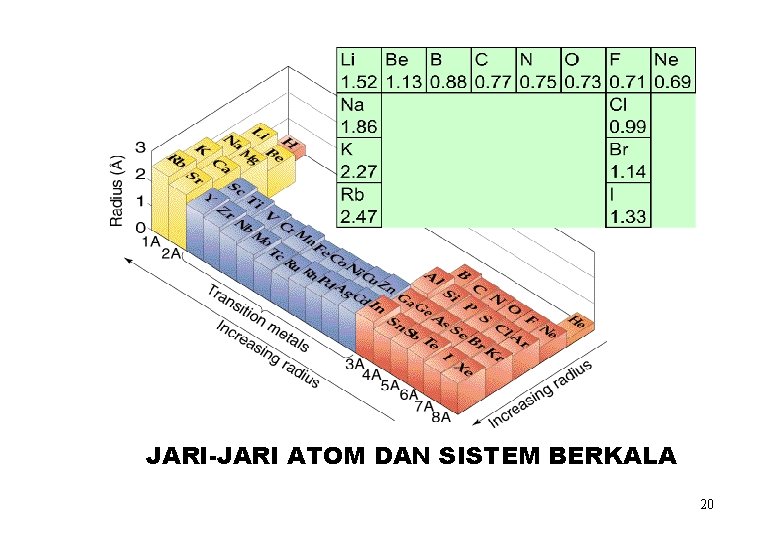
JARI-JARI ATOM DAN SISTEM BERKALA 20
![IONISASI UNSURUNSUR Na Ne3 s 1 Mg Ne3 s 2 Al Ne3 s 23 IONISASI UNSUR-UNSUR Na [Ne]3 s 1 Mg [Ne]3 s 2 Al [Ne]3 s 23](https://slidetodoc.com/presentation_image_h/2cdc426ed4f248a6f18de47faf9e63c3/image-21.jpg)
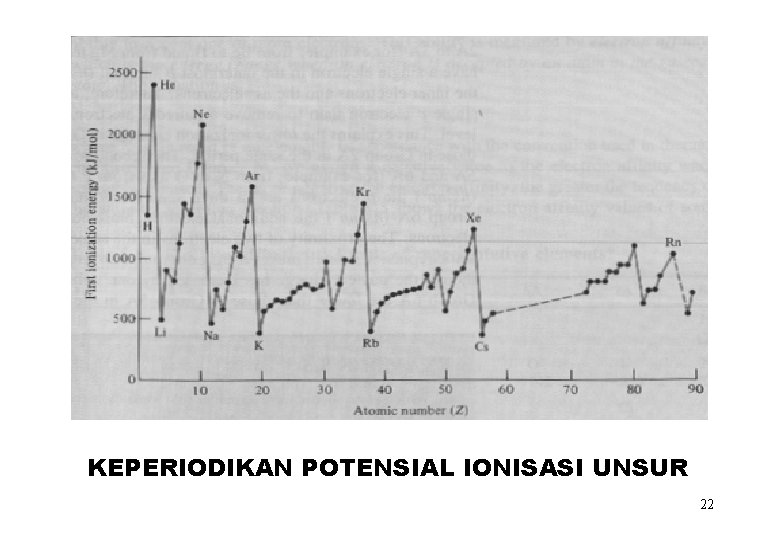
IONISASI UNSUR-UNSUR Na [Ne]3 s 1 Mg [Ne]3 s 2 Al [Ne]3 s 23 p 1 Si [Ne]3 s 23 p 2 P [Ne]3 s 23 p 3 S [Ne]3 s 23 p 4 Cl [Ne]3 s 23 p 5 Ar [Ne]3 s 23 p 6 = [Ar] 1) Semakin kecil atom, semakin sulit untuk melepaskan elektron 2) I 1 < I 2 < I 3 < I 4 Ionisasi pertama adalah yang paling mudah 3) Elektron dalam tidak dapat diionisasi 21

KEPERIODIKAN POTENSIAL IONISASI UNSUR 22

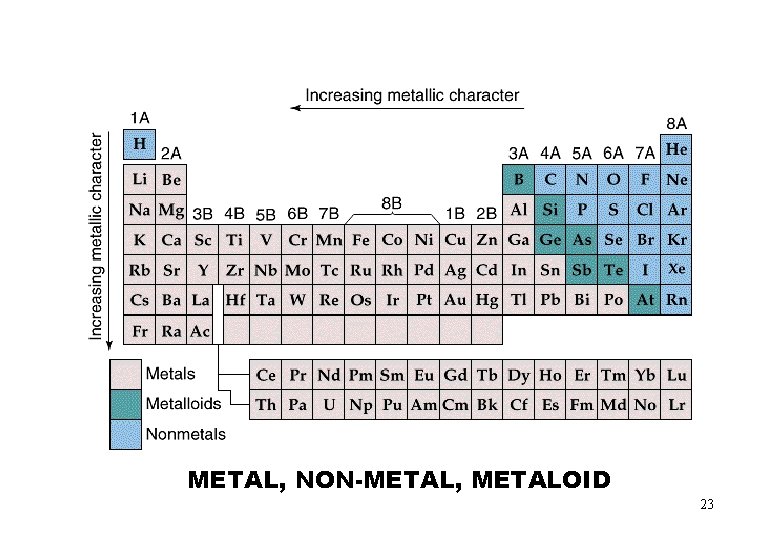
METAL, NON-METAL, METALOID 23

24
 Jari jari atom
Jari jari atom Ppt sifat keperiodikan unsur
Ppt sifat keperiodikan unsur Contoh jurnal khusus retur pembelian
Contoh jurnal khusus retur pembelian Jelaskan sistem periodik menurut oktaf new zealand
Jelaskan sistem periodik menurut oktaf new zealand Sifat reduktor dalam satu periode
Sifat reduktor dalam satu periode Periode tabel periodik
Periode tabel periodik Sinyal periodik
Sinyal periodik Sistemi periodik i elementeve
Sistemi periodik i elementeve Frequency of a cos function
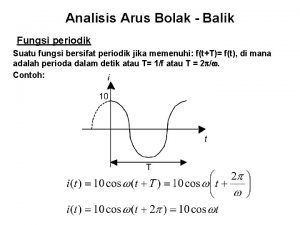
Frequency of a cos function Fungsi periodik
Fungsi periodik Kmsh kontabilitet
Kmsh kontabilitet Tabel periodik
Tabel periodik Contoh soal sinyal periodik dan aperiodik
Contoh soal sinyal periodik dan aperiodik Contoh soal sinyal periodik dan aperiodik
Contoh soal sinyal periodik dan aperiodik Mengapa susunan unsur unsur diberi sisipan kata periodik
Mengapa susunan unsur unsur diberi sisipan kata periodik Biaya periodik (period cost)
Biaya periodik (period cost) Zirkadiane periodik
Zirkadiane periodik Diketahui tabel unsur p q dan r sebagai berikut
Diketahui tabel unsur p q dan r sebagai berikut Contoh soal persediaan metode periodik
Contoh soal persediaan metode periodik Materi deret fourier
Materi deret fourier Fungsi periodik
Fungsi periodik Contoh teori great man dan big bang
Contoh teori great man dan big bang Teori umum dan teori khusus
Teori umum dan teori khusus Teori kesediaan
Teori kesediaan Model tradisional dalam motivasi
Model tradisional dalam motivasi