KIMIA DASAR SISTEM PERIODIK UNSUR TIM DOSEN KIMIA





















- Slides: 25

KIMIA DASAR : SISTEM PERIODIK UNSUR (TIM DOSEN KIMIA DASAR FTP UB) ANGGA DHETA S. A. , SSi. MSi.

Perkembangan teori atom Partikel Sub atom � Neutron � Proton � Elektron

Bilangan Kuantum � Bilangan Kuantum Utama (n) � Menyatakan ukuran dan tingkat energi orbital � Memiliki nilai bilangan bulat positif (1, 2, 3, …dst) � Smkn besar nilai n, semakin besar ukuran orbital (smkn besar jarak rata 2 elektron dlm orbital dari inti atom) � Nilai n menunjukkan kulit atom

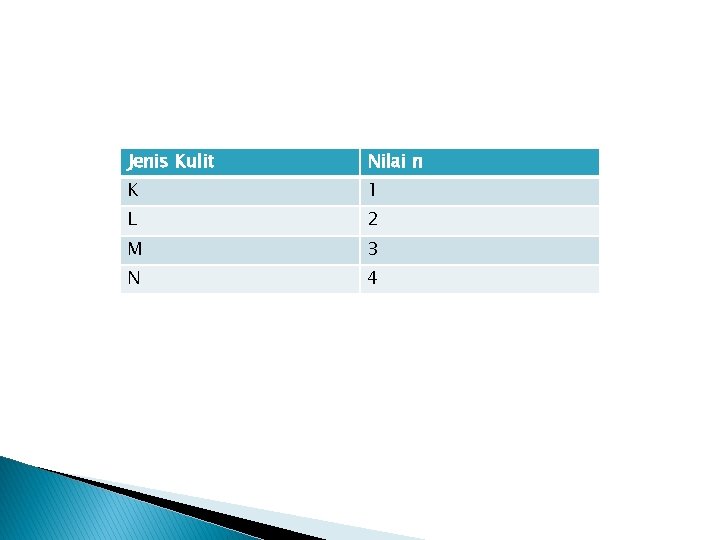
Bilangan kuantum utama (n) � Jenis kulit-kulit dalam konfigurasi elektron dilambagkan dengan huruf K, L, M, N, dst. Kulit yang paling dekat dengan inti adalah kulit K dan bilangan kuantum kulit ini = 1. � Kulit berikutnya adalah L yang mempunyai bilangan kuantum utama = 2 dan demikian seterusnya untuk kulit-kulit berikutnya

Jenis Kulit Nilai n K 1 L 2 M 3 N 4

Bilangan Kuantum Azimut (l) � Menyatakan subkulit tempat elektron berada dan bentuk orbital serta menentukan besarnya momentum sudut elektron terhadap inti. � Nilai bilangan kuantum azimut yg diijinkan yaitu semua bilangan bulat mulai dr 0 smp n-1 � Contoh : � Nilai n=1 maka nilai yg mungkin adalah 0 � Nilai n=2 maka nilai yg mungkin adalah 0 dan 1 � Nilai n=3 maka nilai yg mgkn adalah 0, 1 dan 2 dst

� Bentuk orbital biasanya dinyatakan dgn s, p, d, f, g, dst. . � Kulit M, maka nilai n = 3 dan l = 0, 1, dan 2 karena mempunyai subkulit s, p, dan d. � Kulit N, maka nilai n = 4 dan l = 0, 1, 2, dan 3 karena mempunyai subkulit s, p, d, dan f. � Jadi nilai bilangan kuantum azimut tidak mungkin sama atau lebih besar dari bilangan kuantum utamanya. Maksimal nilai l = n – 1

Bilangan Kuantum Magnetik (m) � mewujudkan adanya satu atau beberapa tingkatan energi di dalam satu sub kulit. Bilangan kuantum magnetik (m) mempunyai harga (-l) dan harga (+l) Untuk: l = 0 (sub kulit s), harga m = 0 (mempunyai 1 orbital) l = 1 (sub kulit p), harga m = -1, O, +1 (mempunyai 3 orbital) l = 2 (sub kulit d), harga m = -2, -1, O, +1, +2 (mempunyai 5 orbital) l = 3 (sub kwit f) , harga m = -3, -2, O, +1, +2, +3 (mempunyai 7 orbital)

Bilangan Kuantum Spin (s) � menunjukkan arah perputaran elektron pada sumbunya � arah rotasi : searah jarum jam (nilai s = + ½ dan dalam orbital dituliskan dengan tanda panah ke atas). � berlawanan arah jarum jam (nilai s = - ½ dan dalam orbital dituliskan dengan tanda panah ke bawah)

CONTOH � Pertanyaan: � Bagaimana menyatakan keempat bilangan kuantum dari elektron 3 s 1 ? � Jawab: � Keempat bilangan kuantum dari kedudukan elektron 3 s 1 dapat dinyatakan sebagai, n= 3 ; l = 0 ; m = 0 ; s = +1/2 ; atau -1/2

Bentuk Orbital s berbentuk bola, artinya: elektron yang ada pada orbital s berada sama jauh dan � orbital segala arah terhadap inti atom

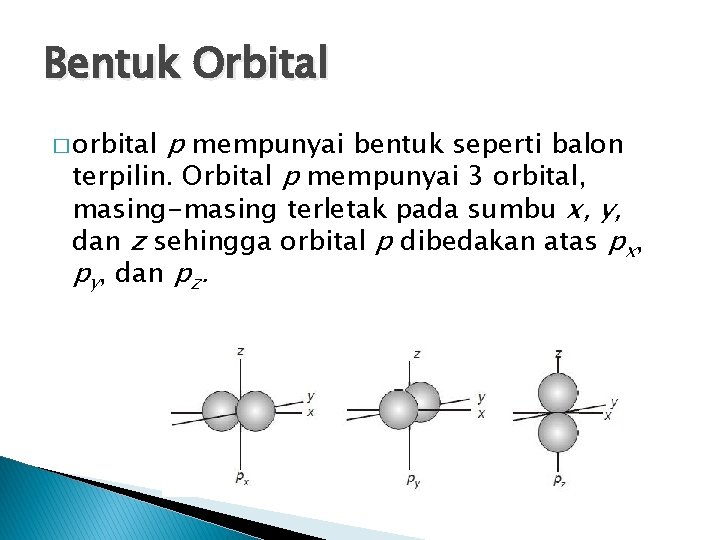
Bentuk Orbital p mempunyai bentuk seperti balon terpilin. Orbital p mempunyai 3 orbital, masing-masing terletak pada sumbu x, y, dan z sehingga orbital p dibedakan atas px, py, dan pz. � orbital

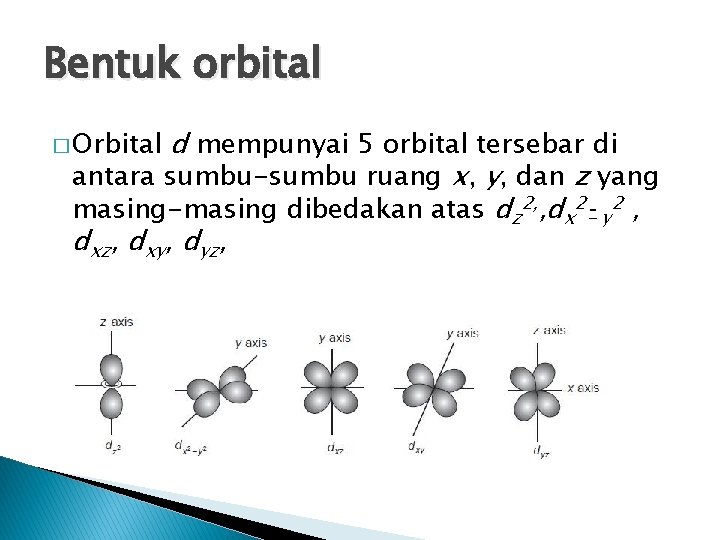
Bentuk orbital d mempunyai 5 orbital tersebar di antara sumbu-sumbu ruang x, y, dan z yang masing-masing dibedakan atas dz 2, , dx 2 - y 2 , dxz, dxy, dyz, � Orbital

KONFIGURASI ELEKTRON � Konfigurasi elektron menggambarkan lokasi semua elektron menurut orbital-orbital yang ditempati � Prinsip Aufbau: Elektron akan mengisi orbital atom yang tingkat energi relatifnya lebih rendah dahulu baru orbital atom yang tingkat energi relatifnya lebih tinggi. Urutan tingkat energi : 1 s 2 s 2 p 3 s 3 p 4 s 3 d


� Azas Larangan Pauli : “Tidak boleh ada dua elektron dalam satu atom yang memiliki ke empat bilangan kuantum yang sama”. � Aturan Hund : elektron-elektron dalam orbital -orbital suatu subkulit cenderung untuk tidak berpasangan”.

Susunan Periodik Unsur

Klasifikasi SPU � Periode disusun menurut nomor atom � Golongan disusun menurut kemiripan sifat � Golongan dibagi atas: � Golongan A disebut Golongan Utama � Golongan B disebut golongan transisi/peralihan

� Golongan VIII A (Gas Mulia) gas yang sangat stabil (inert), sangat sukar bereaksi dengan unsur lain. Sifat yang paling istimewa: ketidakreaktifannya. � Golongan VII A (Halogen) unsur non-logam yang sangat reaktif. Oleh karena bersifat radioaktif, sifat kimia-nya tidak banyakdiketahui, maka disebut Halogen (pembentuk garam). � Golongan I A (Logam Alkali)Unsur-unsur golongan I A, kecuali Hidrogen, disebut logam alkali karena unsur tersebut membentuk basa yang larutdalam air. � Golongan II A (Logam Alkali Tanah)Disebut logam alkali tanah karena membentuk basa, tetapi senyawa-senyawanya kurang larut dalam air

SIFAT PERIODIK UNSUR

Jari-jari atom � jarak dari inti atom sampai kulit terluar � 1) Dalam satu golongan, jari-jari atom bertambah besar dari atas kebawah. 2) Dalam satu periode, jari-jari atom makin kecil dari kiri ke kanan.

Energi Ionisasi � energi yang diperlukan untuk melepaskan elektron terluar suatu atom (dinyatakan dalam satuan k. J mol – 1) � Unsur-unsur yang segolongan, energi ionisasinya makin ke bawah semakin kecil � Sedangkan unsur-unsur yang seperiode, gaya tarik inti makin ke kanan makin kuat, sehingga energi ionisasi pada umumnya makin ke kanan makin besar. � Ada beberapa perkecualian yang perlu diperhatikan. Golongan IIA, VA, dan VIIIA ternyata mempunyai energi ionisasi yang sangat besar, bahkan lebih besar daripada energi ionisasi unsur di sebelah kanannya, yaitu IIIA dan VIA. Hal ini terjadi karena unsur-unsur golongan IIA, VA, dan VIIIA

Elektronegativitas � kemampuan suatu atom untuk menarik elektron dari atom lain. Faktor yang mempengaruhi keelektronegatifan adalah gaya tarik dari inti terhadap elektron dan jari-jari atom. � Unsur-unsur yang segolongan : keelektronegatifan makin ke bawah makin kecil, � Unsur-unsur yang seperiode : keelektronegatifan makin kekanan makin besar. keelektronegatifan terbesar pada setiap periode dimiliki oleh golongan VII A (unsur-unsur halogen). Harga kelektronegatifan terbesar terdapat pada flour (F) yakni 4, 0, dan harga terkecil terdapat pada fransium (Fr) yakni 0, 7.

Afinitas Elektron � energi yang dibebaskan atau yang diserap apabila suatu atom menerima elektron. � Dalam satu periode dari kiri ke kanan, jari-jari semkain kecil dan gaya tarik inti terhadap elektron semakin besar, maka atom semakin mudah menarik elektron dari luar sehingga afinitas elektron semakin besar. � Pada satu golongan dari atas ke bawah, jari-jari atom makin besar, sehingga gaya tarik inti terhadap elektron makin kecil, maka atom semakin sulit menarik elektron dari luar, sehingga afinitas elektron semakin kecil.

� Terimakasih…. Selamat belajar.
 Mengapa susunan unsur unsur diberi sisipan kata periodik
Mengapa susunan unsur unsur diberi sisipan kata periodik Ppt sifat keperiodikan unsur
Ppt sifat keperiodikan unsur Dalam sistem periodik unsur periode menyatakan banyaknya
Dalam sistem periodik unsur periode menyatakan banyaknya Mahasiswa takut pada dosen
Mahasiswa takut pada dosen Unsur-unsur yang ada dalam tim yang dinamis
Unsur-unsur yang ada dalam tim yang dinamis Sisi sisi balok dibatasi oleh
Sisi sisi balok dibatasi oleh Definisi sistem informasi akuntansi
Definisi sistem informasi akuntansi Unsur-unsur sistem pendidikan
Unsur-unsur sistem pendidikan Diketahui tabel unsur p q dan r sebagai berikut
Diketahui tabel unsur p q dan r sebagai berikut Sistem keperiodikan unsur
Sistem keperiodikan unsur Contoh retur pembelian
Contoh retur pembelian Jelaskan sistem periodik menurut oktaf new zealand
Jelaskan sistem periodik menurut oktaf new zealand Apakah pengertian wawasan nusantara
Apakah pengertian wawasan nusantara Unsur unsur negara secara klasik
Unsur unsur negara secara klasik Unsur-unsur nada akor
Unsur-unsur nada akor Contoh kegiatan penunjang
Contoh kegiatan penunjang Unsur unsur logam
Unsur unsur logam Pambiwara tegese
Pambiwara tegese Tingkatan manajemen adalah
Tingkatan manajemen adalah Saluran kepemimpinan
Saluran kepemimpinan Hubungan antar unsur lingkaran
Hubungan antar unsur lingkaran Sisi frontal balok
Sisi frontal balok Komponen manajemen keperawatan
Komponen manajemen keperawatan Berikut unsur-unsur demokrasi menurut affan gaffar kecuali
Berikut unsur-unsur demokrasi menurut affan gaffar kecuali Unsur unsur tabung
Unsur unsur tabung Unsur pembantu pimpinan
Unsur pembantu pimpinan