Sifat Periodik Unsur 1122020 Kimia Dasar EvaYasserZulfah 1


















- Slides: 20

Sifat Periodik Unsur 11/2/2020 Kimia Dasar (Eva/Yasser/Zulfah) 1

Tujuan n n Memahami perubahan sifat-sifat unsur seiring dengan letaknya dalam tabel periodik Mengetahui cara menentukan radius atom dalam suatu molekul Memahami konsep energi ionisasi dan afinitas elektron serta hubungannya. Dapat membedakan antara unsur logam, non logam, dan metaloid 11/2/2020 Kimia Dasar (Eva/Yasser/Zulfah) 2

Soal n n Jarak antar inti atom I pada I 2 adalah 2, 66 Å, dan jarak antar inti atom H pada H 2 adalah 0, 74 Å. Berapakah jarak antar atom H dan I pada molekul HI? Urutkan unsur berikut berdasarkan kenaikan radius atomnya: Al, F, S, Rb! Dari unsur-unsur berikut, yang manakah yang memiliki energi ionisasi terendah: B, Al, C, Si? Mengapa? Perkirakan senyawa yang terjadi antara unsur: Rb dan Se! 11/2/2020 Kimia Dasar (Eva/Yasser/Zulfah) 3

Perkembangan Tabel Periodik n Ø Ø Usaha untuk menggolongkan unsur-unsur yang mirip dilakukan oleh: Johann Dobereiner (1817 -1830) Triade Dobereiner Dmitri Mendeleev & Lothar Meyer (1969) sifat kimia dan sifat fisika yang serupa akan berulang jika unsur-unsur disusun menurut kenaikan berat atomnya Ø Henry Moseley (1913) memperkenalkan konsep nomor atom yang dijadikan dasar penyusunan unsur dalam tabel periodik modern 11/2/2020 Kimia Dasar (Eva/Yasser/Zulfah) 4

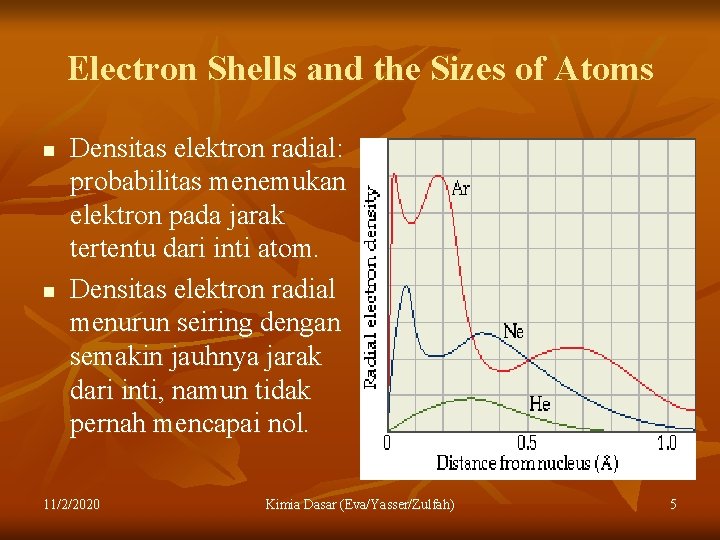
Electron Shells and the Sizes of Atoms n n Densitas elektron radial: probabilitas menemukan elektron pada jarak tertentu dari inti atom. Densitas elektron radial menurun seiring dengan semakin jauhnya jarak dari inti, namun tidak pernah mencapai nol. 11/2/2020 n Kimia Dasar (Eva/Yasser/Zulfah) 5

n n n Dalam menentukan radius atom, dapat dilakukan dengan cara menentukan panjang ikatan antar atom dalam molekul. Radius atom bertambah dari atas ke bawah dalam 1 golongan. Mengapa? Radius atom berkurang dari kiri ke kanan dalam 1 periode. Mengapa? 11/2/2020 Kimia Dasar (Eva/Yasser/Zulfah) 6

Energi Ionisasi n n n Energi ionisasi: energi minimum yang diperlukan untuk memindahkan sebuah elektron dari keadaan dasar atom dalam kondisi gas atau ion. Energi ionisasi pertama (I 1): energi yang diperlukan untuk memindahkan sebuah elektron dari atom netral, contoh: Na (g) Na+ (g) + e. Semakin besar energi ionisasi, semakin sukar untuk memindahkan sebuah elektron. 11/2/2020 Kimia Dasar (Eva/Yasser/Zulfah) 7

Kecenderungan periodik energi ionisasi: & Dalam satu periode, I 1 pada umumnya meningkat seiring dengan meningkatnya nomor atom. Mengapa? & Dalam satu golongan, energi ionisasi menurun seiring dengan meningkatnya nomor atom. Mengapa? & Unsur-unsur representatif menunjukkan rentang yang besar untuk I 1 dibandingkan dengan unsur-unsur transisi. Secara umum, energi ionisasi unsur transisi meningkat dari kiri ke kanan dalam satu periode. n 11/2/2020 Kimia Dasar (Eva/Yasser/Zulfah) 8

Afinitas Elektron n n Afinitas elektron: energi yang diperlukan untuk menambah sebuah elektron dalam keadaan gas. Contoh: Cl (g) + e- Cl- (g) E = -349 k. J/mol Semakin negatif nilai E, afinitas elektron semakin meningkat. Afinitas elektron cenderung meningkat (semakin negatif) dari kiri ke kanan dalam tabel periodik. Mengapa? Afinitas elektron cenderung tetap dari atas ke bawah dalam satu golongan. 11/2/2020 Kimia Dasar (Eva/Yasser/Zulfah) 9

Afinitas Elektron 11/2/2020 Kimia Dasar (Eva/Yasser/Zulfah) 10

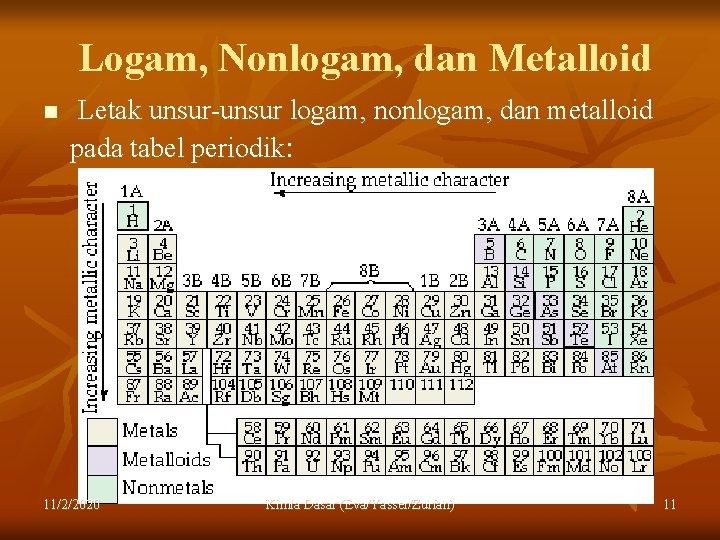
Logam, Nonlogam, dan Metalloid n Letak unsur-unsur logam, nonlogam, dan metalloid pada tabel periodik: 11/2/2020 Kimia Dasar (Eva/Yasser/Zulfah) 11

n Perbedaan sifat antara logam dan nonlogam: 11/2/2020 Kimia Dasar (Eva/Yasser/Zulfah) 12

Oksida logam merupakan oksida basa, larut dalam air membentuk logam hidroksida: LO (s) + H 2 O (l) LOH (aq) Cth: Na 2 O (s) + H 2 O (l) 2 Na. OH (aq) n Oksida logam bereaksi dengan asam membentuk garam dan air: LO (s) + HA (aq) LA (aq) + H 2 O (l) Cth: Mg. O (s) + 2 HCl (aq) Mg. Cl 2 (aq) + H 2 O (l) n 11/2/2020 Kimia Dasar (Eva/Yasser/Zulfah) 13

n n Nonlogam, bereaksi dengan logam, cenderung menerima elektron dan membentuk anion. Logam + Nonlogam Garam 2 Al (s) + 3 Br 2 (l) 2 Al. Br 3 (s) Oksida nonlogam adalah oksida asam: Oksida nonlogam + air asam CO 2 (g) + H 2 O (l) H 2 CO 3 (aq) Oksida nonlogam bereaksi dengan basa membentuk garam dan air: oksida nonlogam + basa garam + air CO 2 (g) + 2 Na. OH (aq) Na 2 CO 3 (aq) + H 2 O (l) Metalloid memiliki sifat-sifat di antara sifat logam dan sifat nonlogam. 11/2/2020 Kimia Dasar (Eva/Yasser/Zulfah) 14

Group Trends for Active Metals n Logam alkali sangat reaktif, kehilangan 1 elektron untuk membentuk ion bermuatan +1: M M+ + e Logam alkali bereaksi dengan hidrogen membentuk hidrida, sulfur membentuk sulfida, dan klorin membentuk klorida. 11/2/2020 Kimia Dasar (Eva/Yasser/Zulfah) 15

n n Logam alkali bereaksi hebat dengan air, menghasilkan gas hidrogen dan alkali hidroksida. 2 M (s) + 2 H 2 O (l) 2 MOH (aq) + H 2 (g) Litium bereaksi dengan gas oksigen membentuk litium oksida. Kalium bereaksi dengan gas oksigen membentuk kalium superoksida. Natrium bereaksi dengan gas oksigen membentuk natrium peroksida. 11/2/2020 Kimia Dasar (Eva/Yasser/Zulfah) 16

n n Logam alkali tanah melepas 2 elektron untuk membentuk ion dengan muatan +2. M M 2+ + 2 e. Logam alkali tanah memiliki sifat-sifat fisika dan kimia yang serupa dengan logam alkali. 11/2/2020 Kimia Dasar (Eva/Yasser/Zulfah) 17

Group Trends for Selected Nonmetals Hidrogen bereaksi dengan halogen membentuk senyawa biner. Hidrogen bereaksi juga dengan logam alkali aktif membentuk logam hidrida padat. n Golongan 6 A: Golongan Oksigen z Oksigen memiliki kecenderungan untuk menarik elektron dari unsur lain (mengoksidasi). Dalam kombinasinya dengan logam, oksigen pada umumnya membentuk ion oksida, O 2 -, yang menyerupai konfigurasi gas mulia. z Sulfur berada dalam beberapa bentuk struktur, yang paling stabil adalah S 8, padatan berwarna kuning. Sulfur juga membentuk ion S 2 -. Di alam, sulfur pada umumnya bereaksi dengan logam membentuk sulfida 11/2/2020 Kimia Dasar (Eva/Yasser/Zulfah) 18 logam n

Golongan 7 A: Halogen halos & gennao (Yunani), berarti pembentuk garam. | Titik didih dan titik leleh unsur-unsur halogen semakin meningkat dengan bertambahnya nomor atom. | Halogen memiliki afinitas elektron yang sangat besar, sehingga: X 2 + 2 e- 2 X| Halogen bereaksi dengan hidrogen membentuk hidrogen halida yang sangat larut dalam air: H + X 2 HX 2 (g) 11/2/2020 Kimia Dasar (Eva/Yasser/Zulfah) 19 n

n | | Golongan 8 A: Gas Mulia Semua unsur gas mulia merupakan gas monoatomik. Semua unsur gas mulia memiliki energi ionisasi pertama yang besar, energi ionisasinya semakin kecil dengan bertambahnya nomor atom. Mengapa? 11/2/2020 Kimia Dasar (Eva/Yasser/Zulfah) 20
 Mengapa susunan unsur unsur diberi sisipan kata periodik
Mengapa susunan unsur unsur diberi sisipan kata periodik Materi sistem periodik unsur ppt
Materi sistem periodik unsur ppt The winner's choice
The winner's choice 1122020
1122020 Sisi sisi pada balok dibatasi oleh
Sisi sisi pada balok dibatasi oleh Sifat sifat unsur dan senyawa periode 3
Sifat sifat unsur dan senyawa periode 3 Dalam sistem periodik unsur periode menyatakan banyaknya
Dalam sistem periodik unsur periode menyatakan banyaknya Jaiz bagi allah ada
Jaiz bagi allah ada Sifat - sifat -sifat pemerintah reformasi di indonesia
Sifat - sifat -sifat pemerintah reformasi di indonesia Sifat bahan yang tepat untuk membuat jas hujan adalah
Sifat bahan yang tepat untuk membuat jas hujan adalah Diketahui tabel unsur p q dan r sebagai berikut
Diketahui tabel unsur p q dan r sebagai berikut Bab 3 kimia unsur
Bab 3 kimia unsur Unsur kimia kayu
Unsur kimia kayu Types of interventional studies
Types of interventional studies Unsur-unsur prisma segi enam
Unsur-unsur prisma segi enam Unsur trapesium
Unsur trapesium Unsur unsur pendidikan kesehatan
Unsur unsur pendidikan kesehatan Unsur unsur leasing
Unsur unsur leasing Manajemen keperawatan adalah
Manajemen keperawatan adalah Unsur unsur logam
Unsur unsur logam Cpotb adalah
Cpotb adalah