Sifat Keperiodikan Unsur SISTEM PERIODIK II KIMIA KELAS














- Slides: 18

Sifat Keperiodikan Unsur SISTEM PERIODIK II KIMIA KELAS X SMA MUHAMMADIYAH 3 BATU

Sifat keperiodikan unsur-unsur Jari-jari atom Energi ionisasi Afinitas elektron Keelektroegatifan

Jari-jari atom adalah jarak dari inti atom ke elektron di kulit paling luar. Perhatikan ilustrasi perbandingan jari-jari atom unsur-unsur golongan utama berikut.

Jari-jari atom unsur segolongan dari atas ke bawah adalah semakin besar hal ini disebabkan semakin ke bawah jumlah kulit atom semakin banyak. Contoh: manakah yang lebih besar jari-jari atom dari 11 Na atau 19 K? Cara menganalisis besar jari-jari atom: (1)menuliskan konfigurasi elektronnya, (2) menentukan jumlah kulit, jika sama (3) menentukan muatan inti, jika sama (4) menentukan jumlah elektron • • 11 Na 19 K : 1 s 2 2 p 6 3 s 1 : 1 s 2 2 p 6 3 s 2 3 p 6 4 s 1 terdiri dari 3 kulit terdiri dari 4 kulit jari-jari lebih kecil jari-jari lebh besar Karena K mempunyai jumlah kulit yang lebih banyak dari Na maka K jari-jarinya lebih besar.

Jari-jari atom unsur seperiode Jari-jari atom unsur sepriode dari kiri ke kanan adalah semakin kecil hal ini disebabkan semakin ke kanan muatan inti (jumlah proton) semakin banyak meskipun jumlah kulitnya sama. Contoh: manakah yang lebih besar jari-jari atom dari 15 P atau 17 Cl? Cara menganalisis besar jari-jari atom: (1)menuliskan konfigurasi elektronnya, (2) menentukan jumlah kulit, jika sama (3) menentukan muatan inti, jika sama (4) menentukan jumlah elektron • • 15 P 17 Cl : 1 s 2 2 p 6 3 s 2 3 p 3 : 1 s 2 2 p 6 3 s 2 3 p 5 terdiri dari 3 kulit muatan inti = 15 muatan inti = 17 jari-jari lebih besar jari-jari lebih kecill Karena P mempunyai muatan inti yang lebih sedikit dari Cl maka P jari-jarinya lebih besar.

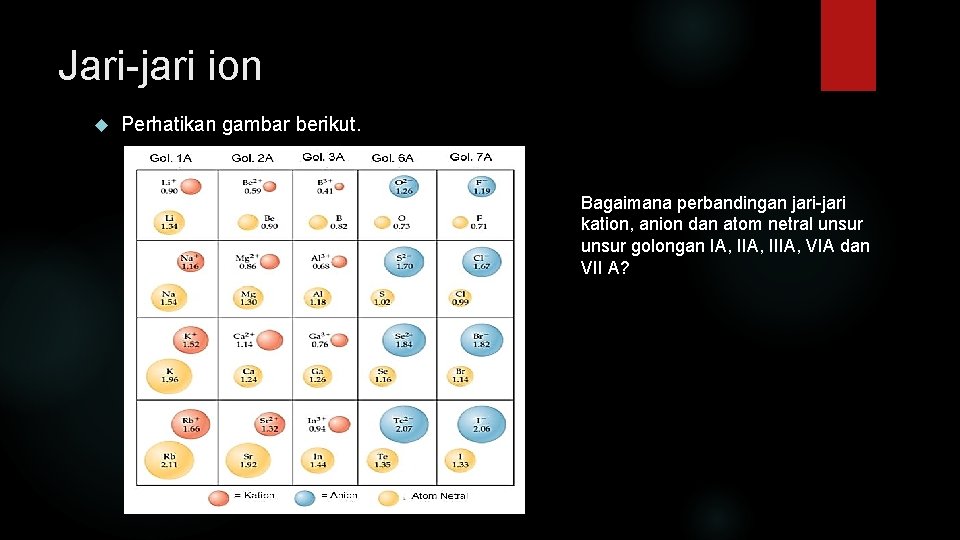
Jari-jari ion Perhatikan gambar berikut. Bagaimana perbandingan jari-jari kation, anion dan atom netral unsur golongan IA, IIIA, VIA dan VII A?

Jari-jari ion Ion positif (kation)adalah atom yang kehilangan elektron. • Jari-jari kation lebih kecil dari jari-jari atom netralnya. Ion negatif (anion)adalah atom yang ketambahan elektron • Jari-jari anion lebih besar dari jari-jari atom netralnya. Bagaimana analisisnya?

Membandingkan kation dengan ion netralnya. Manakah yang lebih besar jari-jarinya, ion 11 Na+ atau atom 11 Na Cara menganalisis besar jari-jari atom/ion: (1)menuliskan konfigurasi elektronnya, (2) menentukan jumlah kulit, jika sama (3) menentukan muatan inti, jika sama (4) menentukan jumlah elektron • 11 Na : 1 s 2 2 p 6 3 s 1 terdiri dari 3 kulit jari-jari lebih besar +: 1 s 2 2 p 6 terdiri dari 2 kulit jari-jari lebh kecil

Membandingkan anion dengan ion netralnya. Manakah yang lebih besar jari-jarinya, ion 11 Na+ atau atom 11 Na Cara menganalisis besar jari-jari atom/ion: (1)menuliskan konfigurasi elektronnya, (2) menentukan jumlah kulit, jika sama (3) menentukan muatan inti, jika sama (4) menentukan jumlah elektron • 17 Cl − : 1 s 2 2 p 6 3 s 2 3 p 5 terdiri dari 3 kulit muatan inti 17 jumlah elektron 17 jari-jari kecil : 1 s 2 2 p 6 3 s 2 3 p 6 terdiri dari 3 kulit muatan inti 17 jumlah elektron 18 jari-jari besar Semakin banyak elektron yang harus ditarik oleh muatan inti yang sama, menyebabkan jari-jarinya menjadi semakin besar.

Energi ionisasi adalah energi minimal yang diperlukan suatu atom netral dalam wujud gas untuk melepaskan satu elektron yang berada di kulit paling luar membentuk ion bermuatan +1 M Harga energi ionisasi dipengaruhi oleh nomor atom dan panjangnya jari– jari atom. Makin panjang jari–jari atom makin lemah gaya tarik inti terhadap elektron sehingga elektron mudah lepas, energi yang diperlukan untuk melepas elektron makin kecil. M+ + 1 e

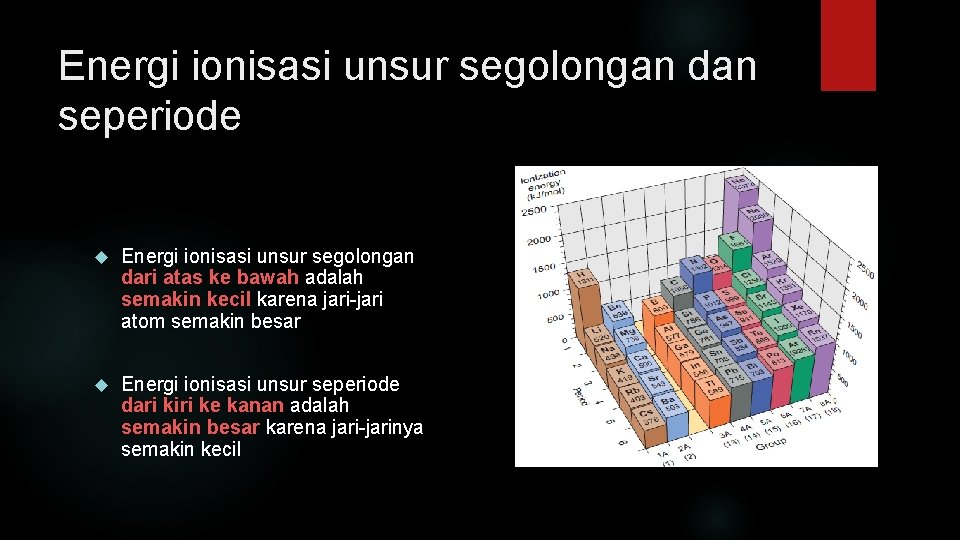
Energi ionisasi unsur segolongan dan seperiode Energi ionisasi unsur segolongan dari atas ke bawah adalah semakin kecil karena jari-jari atom semakin besar Energi ionisasi unsur seperiode dari kiri ke kanan adalah semakin besar karena jari-jarinya semakin kecil

• Berdasarkan tabel berikut: Urutan unsur-unsur tersebut dalam suatu perioda dari kiri ke kanan adalah. . . . Menganalisis data energi ionisasi Perhatikan data energi ionisasi beberapa unsur seperiode berikut. Unsur Energy Ionisasi (k. J/mol) P 1251 Q 1012 R 786 S 1521 T 738 Urutan unsur-unsur tersebut dalam suatu periode dari kiri ke kanan adalah. . . . Analisis: dari kiri ke kanan dalam 1 periode, jari-jari atom semakin kecil, hal ini menyebabkan semakin ke kanan elektron semakin sulit untuk dilepaskan sehingga menyebabkan energi ionisasi semakin besar. Jawabannya: urut dari kecil ke besar. T-R-Q-P-S

AFINITAS ELEKTRON Afinitas elektron adalah energi yang menyertai penambahan 1 elektron pada suatu atom netral dalam wujud gas membentuk ion bermuatan -1. Jumlah elektron yang dapat diterima oleh suatu atom bisa lebih dari satu. Oleh karena itu, kita mengenal istilah afinitas elektron pertama (AE 1), kedua (AE 2) dan seterusnya. Contoh:

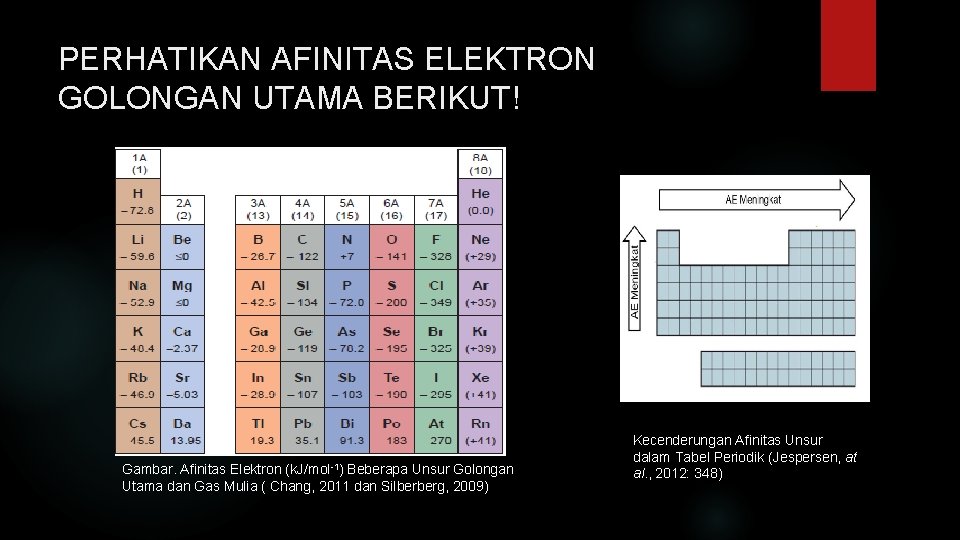
PERHATIKAN AFINITAS ELEKTRON GOLONGAN UTAMA BERIKUT! Gambar. Afinitas Elektron (k. J/mol-1) Beberapa Unsur Golongan Utama dan Gas Mulia ( Chang, 2011 dan Silberberg, 2009) Kecenderungan Afinitas Unsur dalam Tabel Periodik (Jespersen, at al. , 2012: 348)

Ketentuan dalam afinitas elektron Afinitas elektron bertanda negatif: Penyerapan elektron disertai pelepasan energi. Mempunyai daya tarik elektron lebih kuat dari yang lebih positif. Ion negatif lebih stabil dari atom netralnya. Afinitas elektron bertana positif: Penyerapan elektron disertai penyerapan energi. Daya tarik elektron lebih lemah dari yang lebih negatif. Atom netral lebih stabil dari pada ion negatifnya.

Kecenderungan periodik afinitas elektron. Dalam 1 golongan dari atas ke bawah, afinitas elektron semakin kecil Dalam 1 periode dari kiri ke kanan, afinitas elektron semakin besar.

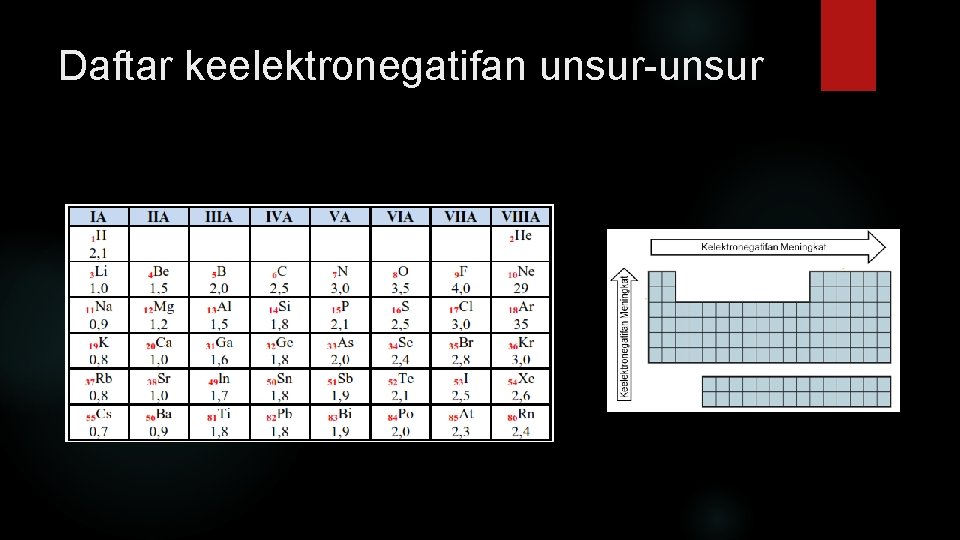
Keelektronegatifan adalah suatu bilangan yang menggambarkan kecenderungan relatif suatu unsur menarik elektron ke pihaknya dalam suatu ikatan kimia. Dalam satu golongan, dari atas ke bawah, keelektronegatifan semakin berkurang Dalam satu periode, dari kiri ke kanan keelektronegatifan semakin bertambah.

Daftar keelektronegatifan unsur-unsur