HUKUM DASAR KIMIA DAN PERHITUNGAN KIMIA Hukum Lavoisier












- Slides: 15

HUKUM DASAR KIMIA DAN PERHITUNGAN KIMIA

Hukum Lavoisier (Hukum Kekekalan Massa) Dalam reaksi kimia, massa zat sebelum reaksi (reaktan) dan sesudah reaksi (produk) adalah sama Contoh: Bagaimana dengan karat pada besi? Apakah berat awal besi sama dengan berat besi berkarat? Bagaimana dengan pembakaran kertas? Apakah berat kertas sama dengan berat hasil pembakaran?

Hukum Proust (Hukum Perbandingan Tetap) Perbandingan massa unsur-unsur penyusun suatu senyawa adalah tertentu dan tetap

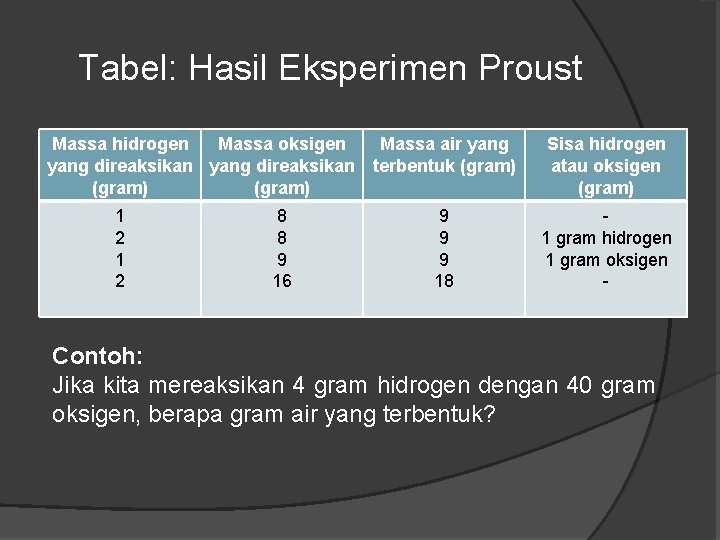
Tabel: Hasil Eksperimen Proust Massa hidrogen Massa oksigen Massa air yang direaksikan terbentuk (gram) 1 2 8 8 9 16 9 9 9 18 Sisa hidrogen atau oksigen (gram) 1 gram hidrogen 1 gram oksigen - Contoh: Jika kita mereaksikan 4 gram hidrogen dengan 40 gram oksigen, berapa gram air yang terbentuk?

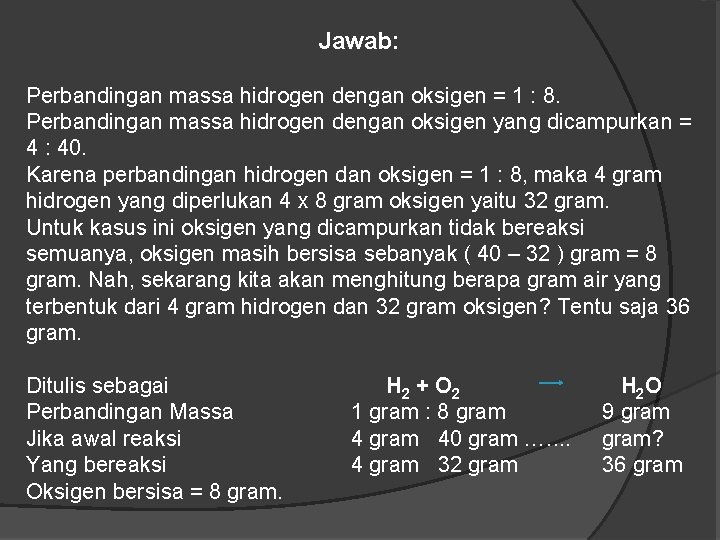
Jawab: Perbandingan massa hidrogen dengan oksigen = 1 : 8. Perbandingan massa hidrogen dengan oksigen yang dicampurkan = 4 : 40. Karena perbandingan hidrogen dan oksigen = 1 : 8, maka 4 gram hidrogen yang diperlukan 4 x 8 gram oksigen yaitu 32 gram. Untuk kasus ini oksigen yang dicampurkan tidak bereaksi semuanya, oksigen masih bersisa sebanyak ( 40 – 32 ) gram = 8 gram. Nah, sekarang kita akan menghitung berapa gram air yang terbentuk dari 4 gram hidrogen dan 32 gram oksigen? Tentu saja 36 gram. Ditulis sebagai Perbandingan Massa Jika awal reaksi Yang bereaksi Oksigen bersisa = 8 gram. H 2 + O 2 1 gram : 8 gram 40 gram …. . 4 gram 32 gram H 2 O 9 gram? 36 gram

Latihan 1. Dalam senyawa AB diketahui perbandingan massa A : massa B = 2 : 1. Jika terdapat 60 gram senyawa AB, tentukan massa masing unsur dalam senyawa tersebut! 2. Perbandingan massa Fe : massa S = 7 : 4, untuk membentuk senyawa besi sulfida. Bila 30 gram besi (Fe) dan 4 gram belerang (S) dibentuk menjadi senyawa besi sulfida, berapa gram massa besi sulfida (Fe. S) yang dapat terjadi?

Hukum Dalton (Hukum Perbandingan Berganda) Bila dua unsur dapat membentuk dua jenis atau lebih dari satu senyawa, dimana massa salah satu unsur tersebut tetap (sama), maka perbandingan massa unsur yang lain dalam senyawa-senyawa tersebut merupakan bilangan bulat dan sederhana

Contoh: Nitrogen dan oksigen dapat membentuk senyawa N 2 O, N 2 O 3, dan N 2 O 4 dengan komposisi massa terlihat pada tabel berikut. Tabel: Perbandingan nitrogen dan oksigen dalam senyawanya. Senyawa Massa nitrogen (gram) Massa oksigen (gram) Perbandingan N 2 O NO N 2 O 3 N 2 O 4 28 14 28 28 16 16 48 64 7: 8 7 : 12 7 : 16 Dari tabel tersebut, terlihat bahwa bila massa N dibuat tetap (sama), sebanyak 7 gram, maka perbandingan massa oksigen dalam: N 2 O 3 : N 2 O 4 = 4 : 8 : 12 : 16 atau 1 : 2 : 3 : 4

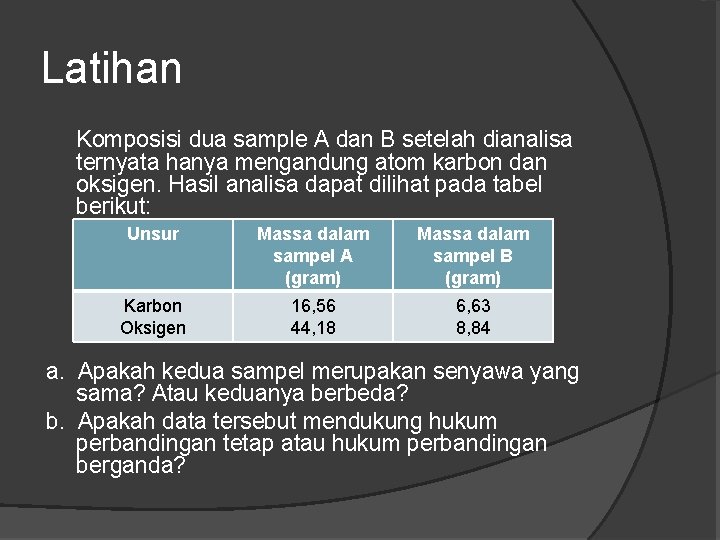
Latihan Komposisi dua sample A dan B setelah dianalisa ternyata hanya mengandung atom karbon dan oksigen. Hasil analisa dapat dilihat pada tabel berikut: Unsur Massa dalam sampel A (gram) Massa dalam sampel B (gram) Karbon Oksigen 16, 56 44, 18 6, 63 8, 84 a. Apakah kedua sampel merupakan senyawa yang sama? Atau keduanya berbeda? b. Apakah data tersebut mendukung hukum perbandingan tetap atau hukum perbandingan berganda?

Hukum Gay Lusssac (Hukum Perbandingan Volume) Pada suhu dan tekanan yang sama perbandingan volume gas-gas yang bereaksi dan hasil reaksi berbanding sebagai bilangan bulat

Contoh No. 1. 2. 3. 4. Volume gas yang bereaksi Hidrogen + Oksigen 1 L + 0, 5 L Nitrogen + Hidrogen 2 L + 6 L Hidrogen + Klor 1 L + 1 L Etilena + Hidrogen 1 L + 1 L Hasil reaksi Perbandingan volume Uap air 1 L Amonia 4 L Hidrogen klorida 2 L Etana 1 L 2: 1: 2 1: 3: 2 1: 1: 1

Hipotesis Avogadro (Penentuan Volume Gas Pereaksi dan Hasil Reaksi) � Pada suhu dan tekanan sama, semua gas bervolum sama dan mengandung jumlah molekul yang sama pula � Perbandingan volum gas-gas yang bereaksi sama dengan koefisien reaksinya

Contohnya Pada reaksi pembentukkan uap air. 2 H 2 (g) + O 2 (g) 2 H 2 O (g) Jika volume gas H 2 yang diukur pada suhu 25 o C dan tekanan 1 atm adalah 10 liter, maka volume gas O 2 dan H 2 O pada tekanan dan suhu yang sama dapat ditentukan dengan cara sebagai berikut : Volume H 2 : Volume O 2 = Koefisien H 2 : Koefisien O 2 Volume O 2 = 0, 5 x 10 L = 5 Liter Coba Anda tentukan volume H 2 O! Jawab : Volume H 2 O = 2/2 x 10 L = 10 Liter

Latihan 1. Tuliskan persamaan reaksi yang menunjukkan bahwa perbandingan volume gas Nitrogen (N 2), gas Hidrogen (H 2) yang bereaksi dengan Amonia (NH 3) yang dihasilkan adalah : 1 : 3 : 2 2. Gas Metana (CH 4) terbakar di udara menurut reaksi : CH 4 (g) + 2 O 2 (g) CO 2 (g) + 2 H 2 O (g) Jika gas Metana yang terbakar (pada suhu dan tekanan yang sama) sebanyakm 1 liter : a. Berapa liter O 2 yang diperlukan? b. Berapa liter uap air dan gas CO 2 yang dihasilkan?

Terima Kasih GBU
 Peta konsep hukum dasar kimia
Peta konsep hukum dasar kimia Lapisan ilmu hukum adalah
Lapisan ilmu hukum adalah Termokimia adalah cabang ilmu kimia yang mempelajari…
Termokimia adalah cabang ilmu kimia yang mempelajari… Hukum kekekalan massa
Hukum kekekalan massa Menggabungka
Menggabungka Hukum lavoisier
Hukum lavoisier Laporan praktikum dasar pengukuran dan ketidakpastian
Laporan praktikum dasar pengukuran dan ketidakpastian Dasar-dasar dan perlakuan adil di tempat kerja
Dasar-dasar dan perlakuan adil di tempat kerja Konsep dasar unit pemrosesan dan dasar datapath
Konsep dasar unit pemrosesan dan dasar datapath Antarmuka memori utama
Antarmuka memori utama Hakikat dan dasar berlakunya hukum internasional
Hakikat dan dasar berlakunya hukum internasional Komponen dan hukum dasar rangkaian listrik
Komponen dan hukum dasar rangkaian listrik Dasar teori hukum pascal
Dasar teori hukum pascal Peta konsep hukum kepler
Peta konsep hukum kepler Ohm coulomb
Ohm coulomb Hukum taklifi dan hukum wad'i
Hukum taklifi dan hukum wad'i





























