Unit 10 HukumHukum Dasar dan Perhitungan Kimia A



























- Slides: 37

Unit 10 Hukum-Hukum Dasar dan Perhitungan Kimia A. Hukum–Hukum Dasar Kimia B. Konsep Mol C. Penentuan Rumus Empiris, Rumus Molekul, Senyawa Hidrat, dan Kadar Zat dalam Senyawa D. Penentuan Pereaksi Pembatas Kimia untuk Kelas X SMA

Diskusi Perhatikan gambar berikut. Bagaimana cara menghitung jumlah abu yang dihasilkan dari pembakaran tersebut? Hal apa saja yang mendasari perhitungannya? Sebelum Anda mempelajari unit ini, lakukan beberapa percobaan berikut. Siswa dibagi ke dalam tiga kelompok. Berikut ini adalah pembagian percobaan yang akan dilakukan oleh setiap kelompok. q Kelompok 1: Aktivitas Ilmiah 6. 1 q Kelompok 2: Aktivitas Ilmiah 6. 2 q Kelompok 3: Aktivitas Ilmiah 6. 3 Diskusikan perolehan data hasil percobaan secara berkelompok. Bangkit Karakter Taatilah prosedur kerja laboratorium, bertanggung jawab pada alat dan bahan yang digunakan, serta kembalikan alat kerja dalam keadaan bersih dan kering.

A. Hukum-Hukum Dasar Kimia 1. Hukum Kekekalan Massa (Hukum Lavoisier) Antoine Laurent Lavoisier menemukan fakta bahwa pada reaksi kimia tidak terjadi perubahan massa zat. Massa zat sebelum dan sesudah reaksi adalah sama Kegiatan Kelompok 1 mempresentasikan hasil diskusi dari percobaan Aktivitas Ilmiah 6. 1 di depan kelas untuk menginformasikan pembuktian berlakunya Hukum Kekekalan Massa.

Contoh Soal Sebanyak 23 gram logam natrium direaksikan dengan gas klorin menghasilkan 58, 5 gram natrium klorida. Berapa massa gas klorin yang bereaksi? Penyelesaian: natrium(s) + klorin(g) 23 gram x natrium klorida(s) 58, 5 gram Berdasarkan Hukum Kekekalan Massa maka Massa Natrium + Massa Klorin = Massa Natrium Klorida 23 gram + x = 58, 5 gram – 23 gram = 35, 5 gram Jadi, massa yang bereaksi adalah 35, 5 gram.

2. Hukum Perbandingan Tetap (Hukum Proust) Joseph Louis Proust menyatakan: Perbandingan massa unsur–unsur dalam setiap senyawa selalu tetap. Massa Zat yang Bereaksi (g) Kegiatan Massa H 2(g) Massa O 2(g) Massa H 2 O(g) 1, 0 8 9, 0 1, 5 12 13, 5 2, 0 16 18, 0 2, 5 20 22, 5 Kelompok 2 mempresentasikan hasil diskusi dari percobaan Aktivitas Ilmiah 6. 2 di depan kelas untuk menginformasikan pembuktian berlakunya Hukum Perbandingan Tetap.

Contoh Soal Perbandingan massa karbon dan massa oksigen dalam senyawa karbon dioksida (CO 2) adalah 3 : 8. 1. Berapa gram karbon yang dapat bereaksi dengan 24 gram O 2? 2. Berapa persen massa karbon dan oksigen dalam senyawa? Penyelesaian: 1. Massa C : Massa O = 3 : 8, dapat ditulis 2. Massa C : Massa O = 3 : 8 maka total perbandingan = 3 + 8 = 11

3. Hukum Perbandingan Berganda (Hukum Dalton) John Dalton menyatakan: Jika dua unsur membentuk dua macam senyawa atau lebih, untuk massa salah satu unsur yang sama banyaknya, massa unsur kedua dalam senyawa–senyawa itu akan berbanding sebagai bilangan bulat dan sederhana. Senyawa Perbandingan Massa Unsur–Unsur Perbandingan Massa Unsur yang Berbeda I. Karbon monoksida 12 g karbon 16 g oksigen II. Karbon dioksida 12 g karbon 32 g oksigen Massa yang berbeda adalah oksigen OI : OII = 16 : 32 = 1 : 2

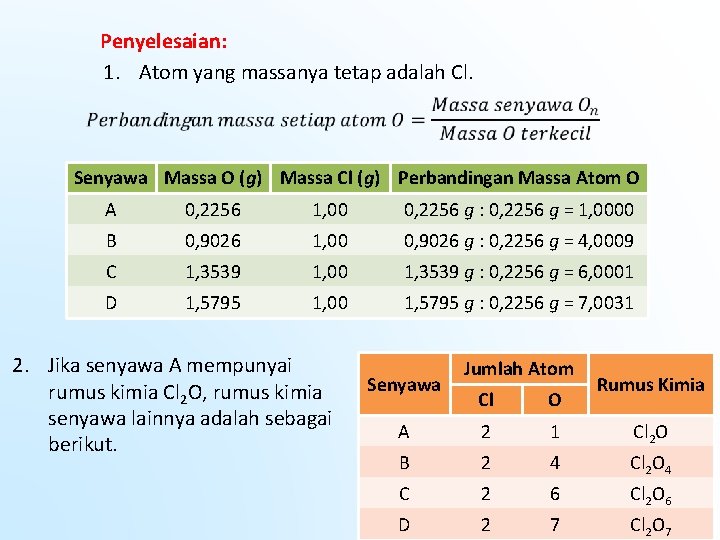
Contoh Soal Gas klorin (Cl 2) dan gas oksigen (O 2) dapat membentuk empat senyawa biner yang berbeda. Berikut komposisi massa O dan massa Cl dalam setiap senyawa yang terbentuk. Senyawa Massa O (g) Massa Cl (g) A 0, 2256 1, 00 B 0, 9026 1, 00 C 1, 3539 1, 00 D 1, 5795 1, 00 1. Tunjukkan bahwa Hukum Perbandingan Berganda berlaku untuk semua senyawa tersebut. 2. Jika rumus senyawa A adalah Cl 2 O maka tentukanlah rumus senyawa B, C, dan D.

Penyelesaian: 1. Atom yang massanya tetap adalah Cl. Senyawa Massa O (g) Massa Cl (g) Perbandingan Massa Atom O A 0, 2256 1, 00 0, 2256 g : 0, 2256 g = 1, 0000 B 0, 9026 1, 00 0, 9026 g : 0, 2256 g = 4, 0009 C 1, 3539 1, 00 1, 3539 g : 0, 2256 g = 6, 0001 D 1, 5795 1, 00 1, 5795 g : 0, 2256 g = 7, 0031 2. Jika senyawa A mempunyai rumus kimia Cl 2 O, rumus kimia senyawa lainnya adalah sebagai berikut. Senyawa Jumlah Atom Rumus Kimia Cl O A 2 1 Cl 2 O B 2 4 Cl 2 O 4 C 2 6 Cl 2 O 6 D 2 7 Cl 2 O 7

4. Hukum Perbandingan Volume (Hukum Gay–Lussac) Volume gas–gas yang bereaksi dan volume gas hasil reaksi, jika diukur pada suhu dan tekanan yang sama, berbanding lurus sebagai bilangan– bilangan bulat dan sederhana. Perbandingan volume gas sesuai dengan perbandingan koefisien reaksinya. Dasar pembuatan rumusan penentuan volume gas dalam suatu reaksi kimia.

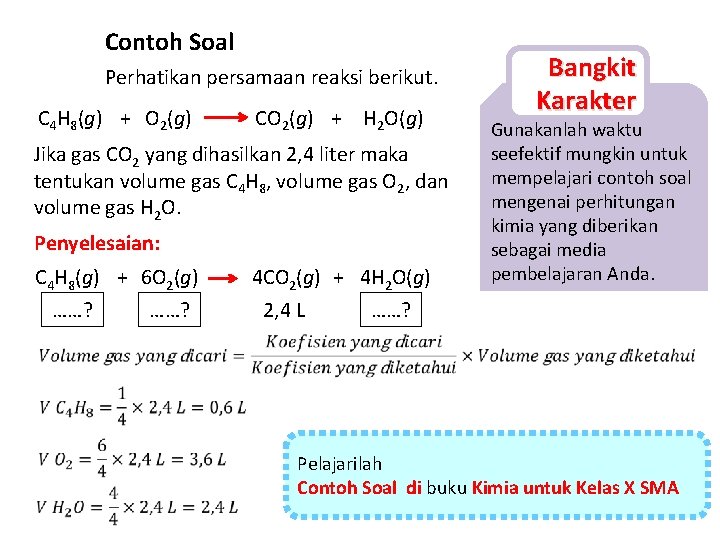
Contoh Soal Perhatikan persamaan reaksi berikut. C 4 H 8(g) + O 2(g) CO 2(g) + H 2 O(g) Jika gas CO 2 yang dihasilkan 2, 4 liter maka tentukan volume gas C 4 H 8, volume gas O 2, dan volume gas H 2 O. Penyelesaian: C 4 H 8(g) + 6 O 2(g) ……? 4 CO 2(g) + 4 H 2 O(g) 2, 4 L ……? Bangkit Karakter Gunakanlah waktu seefektif mungkin untuk mempelajari contoh soal mengenai perhitungan kimia yang diberikan sebagai media pembelajaran Anda. Pelajarilah Contoh Soal di buku Kimia untuk Kelas X SMA

5. Hukum Avogadro menyatakan: Pada suhu dan tekanan yang sama, perbandingan volume gas sesuai dengan perbandingan jumlah molekulnya. Hukum Avogadro dapat dirumuskan dengan persamaan sebagai berikut.

Contoh Soal Penyelesaian: 1. 2. Pelajarilah Contoh Soal halaman 166 – 168, buku Kimia untuk Kelas X SMA

Hukum–hukum dasar kimia yang dikemukakan oleh para ilmuwan untuk mendasari setiap perhitungan kimia yang digunakan dalam berbagai aplikasi sangat bermanfaat dalam kehidupan sehari–hari. Sesungguhnya hal ini adalah bentuk kekuasaan Tuhan yang telah memberikan kecerdasan kepada para ilmuwan untuk menghasilkan teori–teori yang bermanfaat bagi kehidupan manusia.

Latihan Soal 1. Jika 50 m. L gas Cx. Hy dibakar dengan 250 m. L oksigen, dihasilkan 150 m. L karbon dioksida dan sejumlah uap air. Semua gas diukur pada suhu dan tekanan yang sama. Tentukan rumus Cx. Hy. 2. Pada pengaratan 5 milyar atom besi dengan oksigen terbentuk molekul karat Fe 2 O 3. Tentukan: a. persamaan reaksinya; b. jumlah molekul gas oksigen yang diperlukan; dan c. jumlah molekul karat yang terbentuk. Kerjakan Uji Materi di Buku Kimia untuk Kelas X SMA

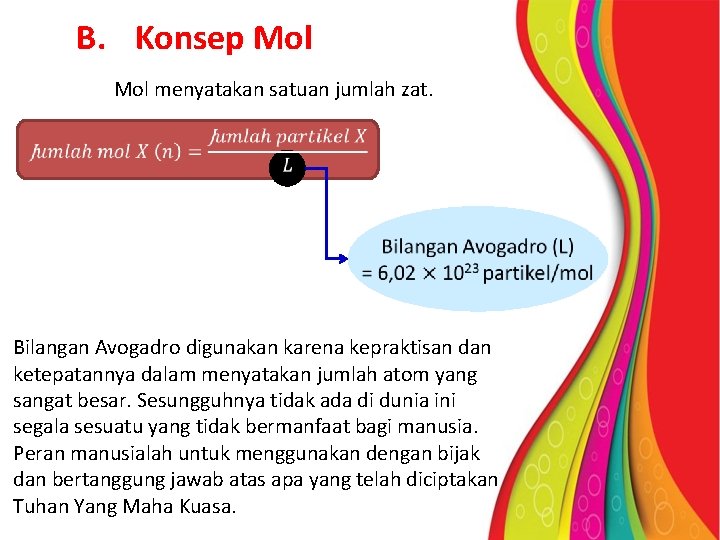
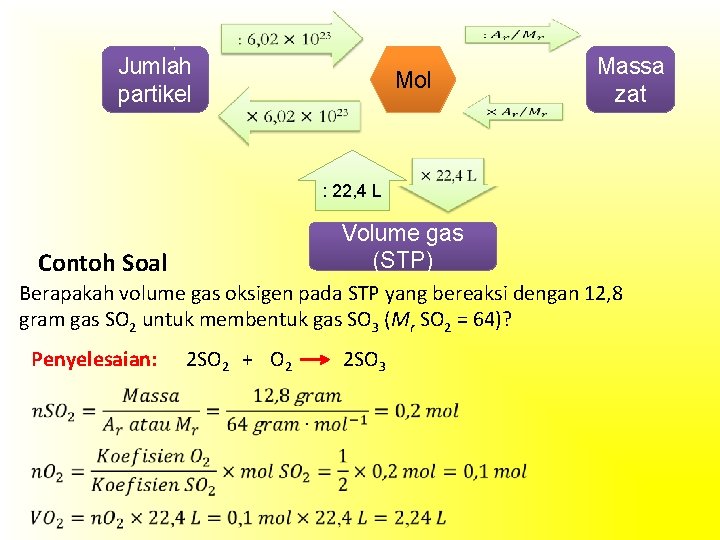
B. Konsep Mol menyatakan satuan jumlah zat. Bilangan Avogadro digunakan karena kepraktisan dan ketepatannya dalam menyatakan jumlah atom yang sangat besar. Sesungguhnya tidak ada di dunia ini segala sesuatu yang tidak bermanfaat bagi manusia. Peran manusialah untuk menggunakan dengan bijak dan bertanggung jawab atas apa yang telah diciptakan Tuhan Yang Maha Kuasa.

1. Massa Molar Massa satu mol zat disebut massa molar (Mm) dengan satuan g. mol– 1. Contoh Soal Tentukan jumlah mol 20 gram senyawa Ca. CO 3. (Ar: C = 12, O = 16, dan Ca = 40) Penyelesaian: Pelajarilah Contoh Soal halaman 173 – 174, buku Kimia untuk Kelas X SMA atau

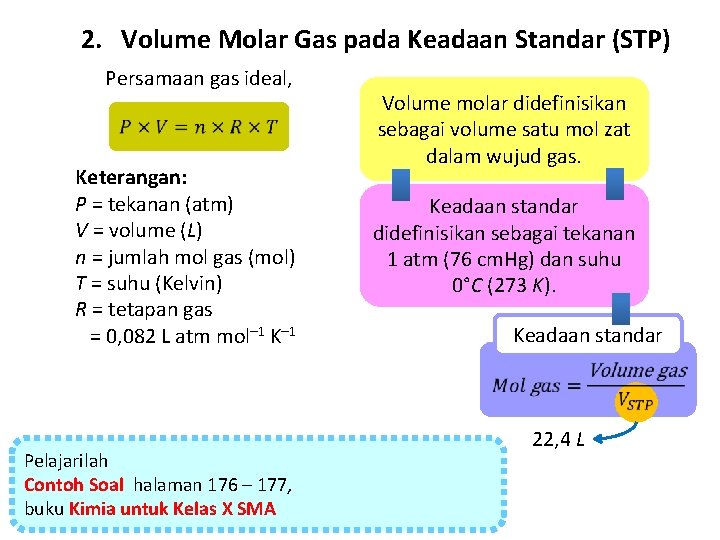
2. Volume Molar Gas pada Keadaan Standar (STP) Persamaan gas ideal, Keterangan: P = tekanan (atm) V = volume (L) n = jumlah mol gas (mol) T = suhu (Kelvin) R = tetapan gas = 0, 082 L atm mol– 1 K– 1 Volume molar didefinisikan sebagai volume satu mol zat dalam wujud gas. Keadaan standar didefinisikan sebagai tekanan 1 atm (76 cm. Hg) dan suhu 0°C (273 K). Keadaan standar Pelajarilah Contoh Soal halaman 176 – 177, buku Kimia untuk Kelas X SMA 22, 4 L

3. Hubungan Jumlah Mol dan Keadaan Standar Koefisien Reaksi 4. Hubungan Hukum Gay–Lussac dan Jumlah Mol Pada suhu dan tekanan yang sama, perbandingan volume gas–gas sesuai dengan perbandingan jumlah molnya sehingga berlaku hubungan: Pelajarilah Contoh Soal 6. 16 – Contoh Soal 6. 17 halaman 178 – 179, buku Kimia untuk Kelas X SMA

Jumlah partikel Mol : 22, 4 L Massa zat Volume gas (STP) Contoh Soal Berapakah volume gas oksigen pada STP yang bereaksi dengan 12, 8 gram gas SO 2 untuk membentuk gas SO 3 (Mr SO 2 = 64)? Penyelesaian: 2 SO 2 + O 2 2 SO 3

Latihan Soal 1. Berapa gramkah massa zat berikut ini. a. 5 mol emas (Ar: Au = 197) b. 7 mol gula (C 12 H 22 O 11) dengan Ar: C = 12, H = 1, dan O = 16 2. Berapakah jumlah mol 700 gram batu kapur (Ca. CO 3) jika diketahui Ar: Ca = 40, C = 12, dan O = 16? 3. Berapa gramkah massa 5 L gas amonia (NH 3) yang diukur pada suhu 27°C dan tekanan 120 cm. Hg? 4. Jika 8, 1 gram logam aluminium direaksikan dengan larutan H 2 SO 4 menghasilkan garam Al 2(SO 4)3 dan gas hidrogen. Tentukan: a. Massa garam Al 2(SO 4)3 yang terbentuk b. Volume gas hidrogen pada keadaan STP Kerjakan Uji Materi 6. 2 halaman 179 – 180, buku Kimia untuk Kelas X SMA

C. Penentuan Rumus Empiris, Rumus Molekul, Senyawa Hidrat, dan Kadar Zat dalam Senyawa 1. Penentuan Rumus Empiris dan Rumus Molekul Penentuan Rumus Empiris Massa unsur atau persen unsur penyusun senyawa Pembagian massa atau persen unsur dengan Ar masing–masing Penentuan Rumus Molekul Tentukan rumus empiris Hitung Mr senyawa Perbandingan mol terkecil Tentukan kelipatannya (n)

Contoh Soal Suatu senyawa hidrokarbon mengandung 85, 7% massa karbon dan sisanya massa hidrogen. Jika ditentukan Ar: H = 1, C = 12, dan massa molekul relatif senyawa hidrokarbon 56. Tentukan rumus empiris dan rumus molekul senyawa tersebut. Penyelesaian: Rumus Empiris Perbandingan jumlah mol Jadi, rumus empiris senyawa tersebut = (CH 2)n Rumus Molekul Jadi, rumus molekulnya = (CH 2)4 atau C 4 H 8

Kegiatan Kelompok 3 mempresentasikan hasil diskusi dari percobaan Aktivitas Ilmiah 6. 3 di depan kelas untuk menginformasikan penentuan rumus empiris magnesium oksida. 2. Penentuan Senyawa Hidrat Persamaan reaksi Massa unsur Jumlah mol Perbandingan jumlah mol dengan koefisien Jumlah molekul hidrat Contoh Soal Pemanasan 31, 2 gram garam magnesium sulfat hidrat menghasilkan 24 gram magnesium anhidrat. Jika diketahui Mr Mg. SO 4 = 120 dan Mr H 2 O = 18, tentukan jumlah air kristal yang terikat dan rumus senyawa terhidratnya.

Penyelesaian: Mg. SO 4. x. H 2 O Mg. SO 4 + x. H 2 O Massa H 2 O = Massa Mg. SO 4. x. H 2 O – Massa Mg. SO 4 = 31, 2 gram – 24 gram = 7, 2 gram Mol Mg. SO 4 : Mol H 2 O = Koefisien Mg. SO 4 : Koefisien H 2 O 0, 2 : 0, 4 = 1 : x 0, 2 x = 0, 4 x =2 Jumlah air kristal = 2 Jadi, rumus senyawa tersebut adalah Mg. SO 4. 2 H 2 O

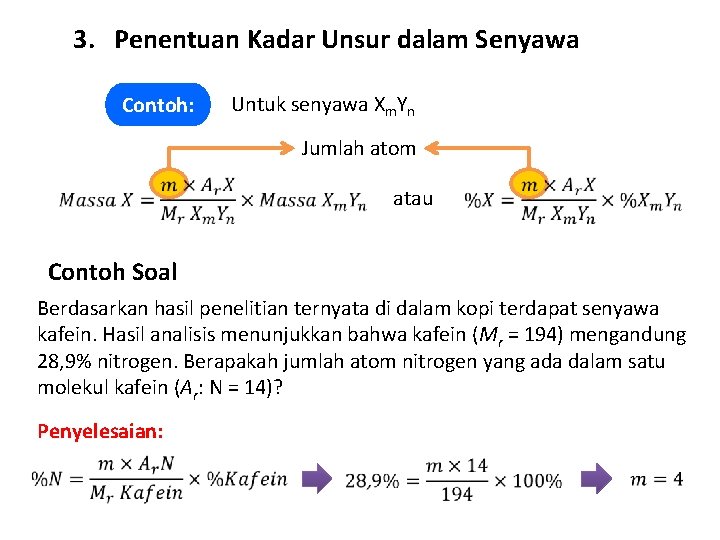
3. Penentuan Kadar Unsur dalam Senyawa Contoh: Untuk senyawa Xm. Yn Jumlah atom atau Contoh Soal Berdasarkan hasil penelitian ternyata di dalam kopi terdapat senyawa kafein. Hasil analisis menunjukkan bahwa kafein (Mr = 194) mengandung 28, 9% nitrogen. Berapakah jumlah atom nitrogen yang ada dalam satu molekul kafein (Ar: N = 14)? Penyelesaian:

Latihan Soal 1. Senyawa oksida fosfor mengandung unsur fosfor sebesar 49, 2%. Jika diketahui Ar: P = 31, O = 16, dan Mr oksida fosfor = 120, tentukan rumus empiris dan rumus molekul senyawa tersebut. 2. Terdapat 50 gram senyawa Ca. CO 3 yang dilarutkan dalam air untuk mengapur pagar dan dinding. Jika diketahui Ar: Ca = 40, C = 12, dan O = 16, tentukan massa Ca, massa C, dan massa O dalam senyawa tersebut. 3. Kadar molekul hidrat dalam senyawa hidrat VOSO 4. n. H 2 O 35, 57%. Jika diketahui Mr VOSO 4 = 163 dan Mr H 2 O = 18, tentukan harga n. 4. Pemanasan 25 gram garam tembaga sulfat hidrat menghasilkan tembaga sulfat anhidrat. Jika diketahui Mr Cu. SO 4 = 160 dan Mr H 2 O = 18, tentukan rumus molekul senyawa hidrat tersebut. Kerjakan Uji Materi buku Kimia untuk Kelas X SMA

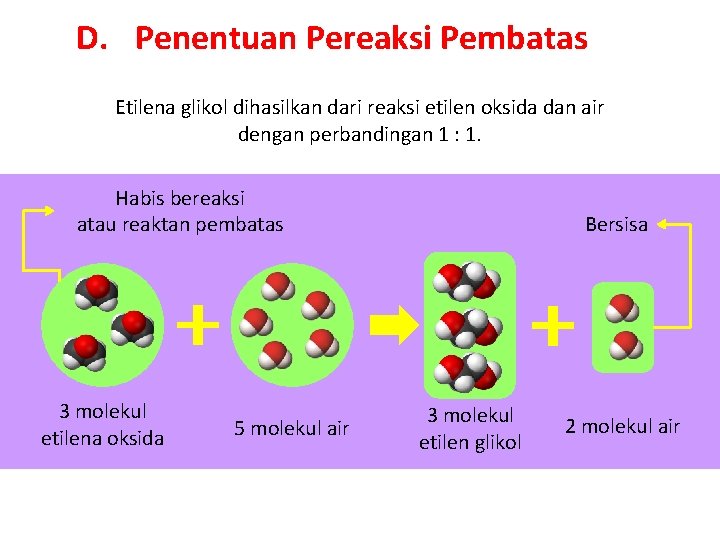
D. Penentuan Pereaksi Pembatas Etilena glikol dihasilkan dari reaksi etilen oksida dan air dengan perbandingan 1 : 1. Habis bereaksi atau reaktan pembatas 3 molekul etilena oksida 5 molekul air Bersisa 3 molekul etilen glikol 2 molekul air

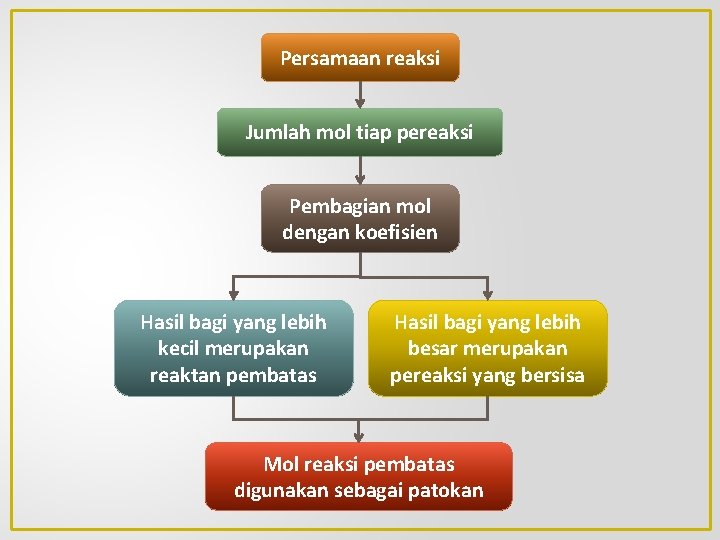
Persamaan reaksi Jumlah mol tiap pereaksi Pembagian mol dengan koefisien Hasil bagi yang lebih kecil merupakan reaktan pembatas Hasil bagi yang lebih besar merupakan pereaksi yang bersisa Mol reaksi pembatas digunakan sebagai patokan

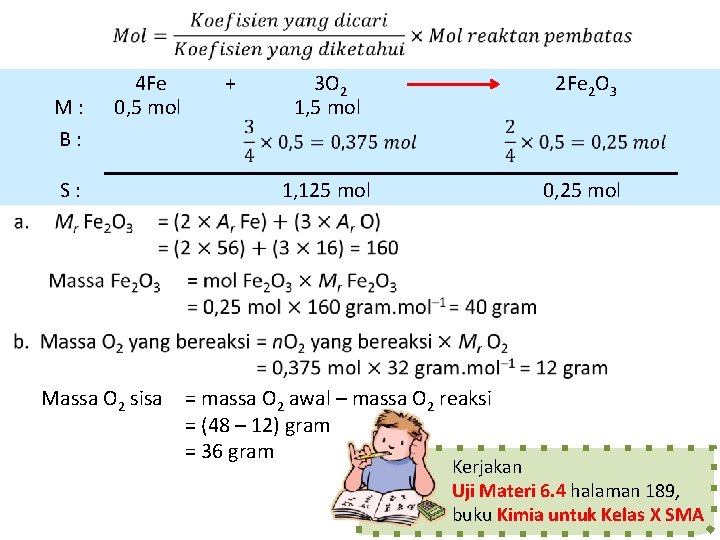
Contoh Soal Sebanyak 28 gram logam besi direaksikan dengan 48 gram gas oksigen menghasilkan Fe 2 O 3 (Diketahui Ar: Fe = 56 dan O = 16). 1. Tentukan massa Fe 2 O 3 2. Tentukan massa zat pereaksi yang tersisa Penyelesaian: Persamaan reaksi 4 Fe Jumlah mol zat + 0, 5 mol 3 O 2 1, 5 mol Lebih kecil = reaksi pembatas 2 Fe 2 O 3

M: B: 4 Fe 0, 5 mol S: + 3 O 2 1, 5 mol 2 Fe 2 O 3 1, 125 mol 0, 25 mol Massa O 2 sisa = massa O 2 awal – massa O 2 reaksi = (48 – 12) gram = 36 gram Kerjakan Uji Materi 6. 4 halaman 189, buku Kimia untuk Kelas X SMA

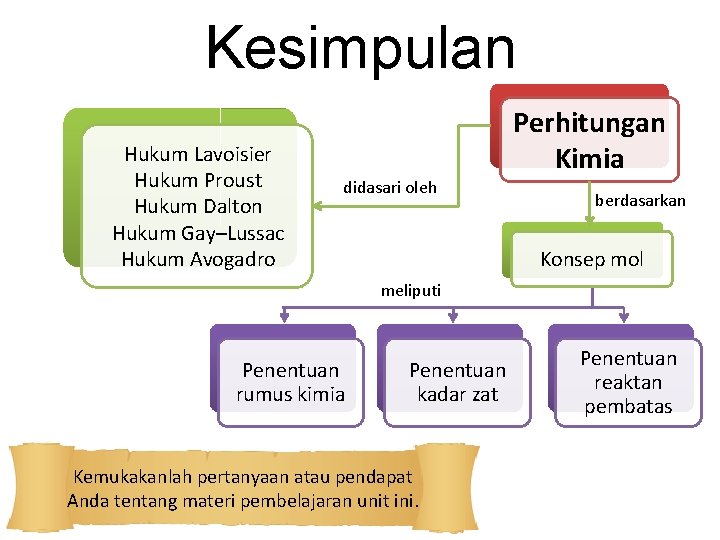
Kesimpulan Hukum Lavoisier Hukum Proust Hukum Dalton Hukum Gay–Lussac Hukum Avogadro Perhitungan Kimia didasari oleh berdasarkan Konsep mol meliputi Penentuan rumus kimia Penentuan kadar zat Kemukakanlah pertanyaan atau pendapat Anda tentang materi pembelajaran unit ini. Penentuan reaktan pembatas

Kuis 1. Perbandingan massa karbon dan oksigen dalam karbon dioksida adalah 3 : 8. Jika 3 gram karbon direaksikan dengan 16 gram oksigen, tentukan karbon dioksida yang terbentuk. 2. Suatu campuran gas terdiri atas 2 mol N 2 O 3 dan 4 mol NO. Jika campuran ini diuraikan dengan sempurna menjadi gas–gas nitrogen dan oksigen, tentukan perbandingan gas nitrogen dan oksigen. 3. Jika KCl. O 3 dipanaskan akan terurai menjadi KCl dan O 2. Berapa gram gas oksigen yang dihasilkan jika 245 gram KCl. O 3 (Mr = 122, 5) dipanaskan? 4. Serbuk besi sejumlah 28 gram (Ar Fe = 56) direaksikan dengan 20 gram belerang (Ar = 32) sesuai dengan persamaan reaksi: Fe + S → Fe. S, tentukan zat yang tersisa sesudah reaksi.

5. Pemanasan Hg. O akan terurai menurut reaksi: 2 Hg. O → 2 Hg + O 2 Pada pemanasan 108 gram Hg. O tersebut akan terbentuk 4, 8 gram O 2. Berapa persen Hg. O yang terurai? 6. Reaksi dehidrasi natrium sulfat terhidrasi: Na 2 SO 4. x. H 2 O → Na 2 SO 4 + x. H 2 O Bila 11, 6 gram Na 2 SO 4. x. H 2 O dipanaskan akan terbentuk Na 2 SO 4 anhidrat sebanyak 7, 1 gram. Tentukan jumlah x. Kerjakan Uji Kompetensi Unit 6 halaman 191 – 202, buku Kimia untuk Kelas X SMA

Terima Kasih Berusahalah untuk tidak menjadi manusia yang berhasil, tetapi berusahalah menjadi manusia yang berguna. Einstein

Referensi www. redorbit. com www. zastavki. com www. glogster. com wiki. blender. org www. idesktopbackground. com www. evroberts. com www. eastpennsd. org wiki. blender. org www. theritzsalonandspa. com www. idesktopbackground. com www. evroberts. com wiki. blender. org eastgwillimburywow. com en. wikipedia. org www. apartmenttherapy. commons. wikimedia. org fineartamerica. com www. webdesignhot. com www. duniainter. net gadeual-quran. blogspot. com www. youtube. com

Created By: Astri Putri Perdana