Curso de Tcnicas Electroqumicas Cronoamperometra Ignacio Gonzlez Martnez










![Fe 2+ Fe 3+ 0. 771 E(ENH) v Zona de activación [CFe(III) (x=0) CFe(III)*] Fe 2+ Fe 3+ 0. 771 E(ENH) v Zona de activación [CFe(III) (x=0) CFe(III)*]](https://slidetodoc.com/presentation_image/337374220df017096570170ae75ac899/image-22.jpg)


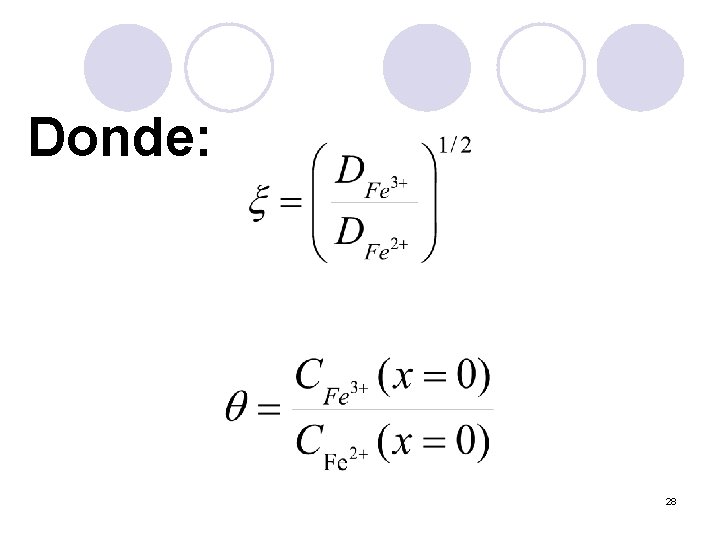





![EJEMPLO No. 1 [01] Electrochimica Acta 48 (2003) 3593 -3598 36 EJEMPLO No. 1 [01] Electrochimica Acta 48 (2003) 3593 -3598 36](https://slidetodoc.com/presentation_image/337374220df017096570170ae75ac899/image-36.jpg)
![Quinonas Actividad biológica Generadores de EOR (OH*) + e- • – = [] [] Quinonas Actividad biológica Generadores de EOR (OH*) + e- • – = [] []](https://slidetodoc.com/presentation_image/337374220df017096570170ae75ac899/image-37.jpg)
![Factores de estabilidad • – [] • Efectos electrónicos (inducción o atracción de carga) Factores de estabilidad • – [] • Efectos electrónicos (inducción o atracción de carga)](https://slidetodoc.com/presentation_image/337374220df017096570170ae75ac899/image-39.jpg)
![IP DP 0 q 2 q t [01] Electrochim. Acta 48 (2003) 3593 45 IP DP 0 q 2 q t [01] Electrochim. Acta 48 (2003) 3593 45](https://slidetodoc.com/presentation_image/337374220df017096570170ae75ac899/image-45.jpg)
![EJEMPLO No. 2 [03] J. Electroanal. Chem. 579(2005)103 -111 47 EJEMPLO No. 2 [03] J. Electroanal. Chem. 579(2005)103 -111 47](https://slidetodoc.com/presentation_image/337374220df017096570170ae75ac899/image-47.jpg)


![Ecuación de Cottrell [03] J Electroanalytical Chem 579(2005)103 -111 55 Ecuación de Cottrell [03] J Electroanalytical Chem 579(2005)103 -111 55](https://slidetodoc.com/presentation_image/337374220df017096570170ae75ac899/image-55.jpg)
![EJEMPLO No. 3 [02] J. Phys. Chem. B 105 (2001) 4214 -4223 59 EJEMPLO No. 3 [02] J. Phys. Chem. B 105 (2001) 4214 -4223 59](https://slidetodoc.com/presentation_image/337374220df017096570170ae75ac899/image-59.jpg)

![EJEMPLO No. 4 [04] J. Electroanal. Chem. 310 (1991) 293 -303 64 EJEMPLO No. 4 [04] J. Electroanal. Chem. 310 (1991) 293 -303 64](https://slidetodoc.com/presentation_image/337374220df017096570170ae75ac899/image-64.jpg)



- Slides: 72

Curso de Técnicas Electroquímicas (Cronoamperometría) Ignacio González Martínez Carlos Eduardo Frontana Vázquez Víctor Manuel Ugalde Saldívar 1

Fundamentos de electroquímica • Reacciones en disolución (reacciones redox) • Celda electroquímica • Reacción electroquímica • Potenciometría de corriente nula • Electrodo Normal de Hidrógeno y sistemas de referencia • Potenciostato (instrumentación) • Factores que alteran la velocidad del proceso: • Transferencia de carga (BV) • Transferencia de masa (Nernst-Planck) • Leyes de Fick 2

Cronoamperometría • Repaso de conceptos • Potenciostatos de tres electrodos • Micro y macro electrólisis • Parámetros de control (perturbación – respuesta) • Factores que afectan la velocidad del proceso • Aproximación a la resolución del problema (E constante) • Perfiles de concentración • Ecuación de Cottrell • Ejemplos 3

Cronoamperometría • Repaso de conceptos • Potenciostatos de tres electrodos • Micro y macro electrólisis • Parámetros de control (perturbación – respuesta) • Factores que afectan la velocidad del proceso • Aproximación a la resolución del problema (E constante) • Perfiles de concentración • Ecuación de Cottrell • Ejemplos 4

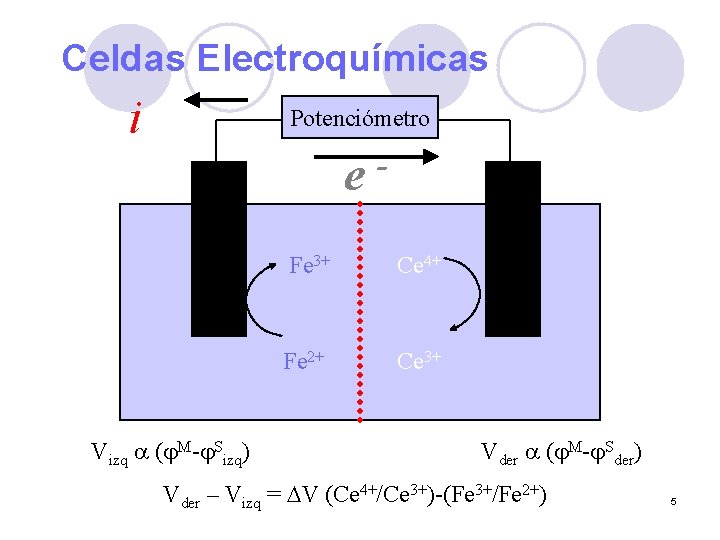
Celdas Electroquímicas i Potenciómetro e Vizq ( M- Sizq) - Fe 3+ Ce 4+ Fe 2+ Ce 3+ Vder ( M- Sder) Vder – Vizq = DV (Ce 4+/Ce 3+)-(Fe 3+/Fe 2+) 5

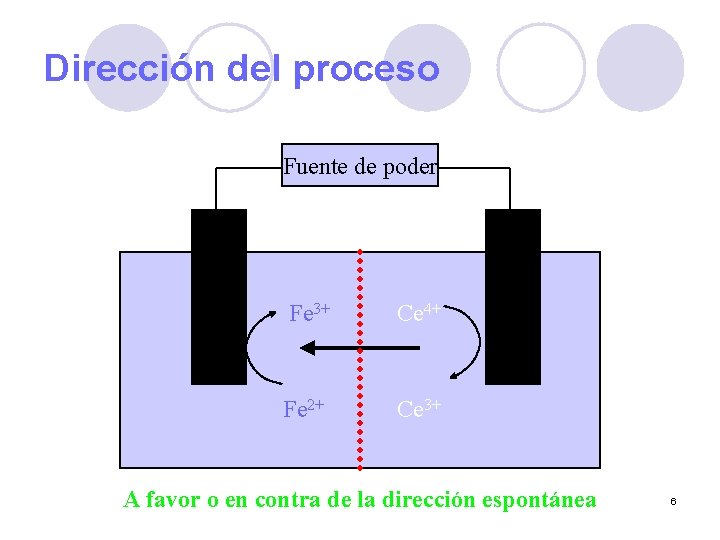
Dirección del proceso Fuente de poder Fe 3+ Ce 4+ Fe 2+ Ce 3+ A favor o en contra de la dirección espontánea 6

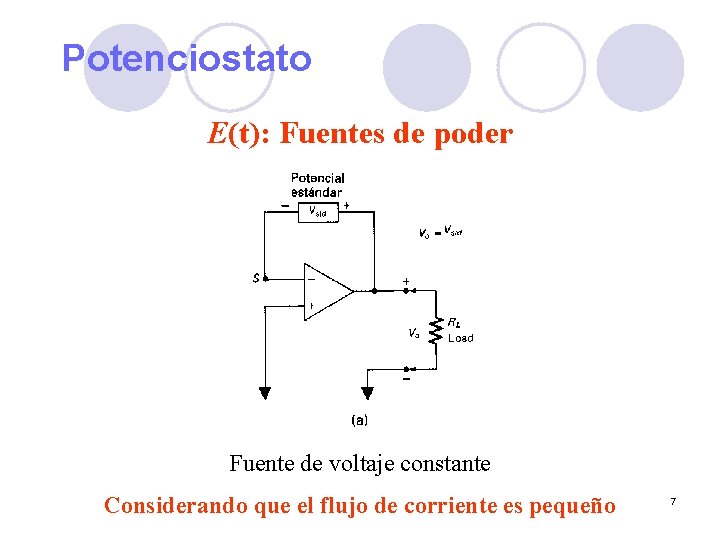
Potenciostato E(t): Fuentes de poder Fuente de voltaje constante Considerando que el flujo de corriente es pequeño 7

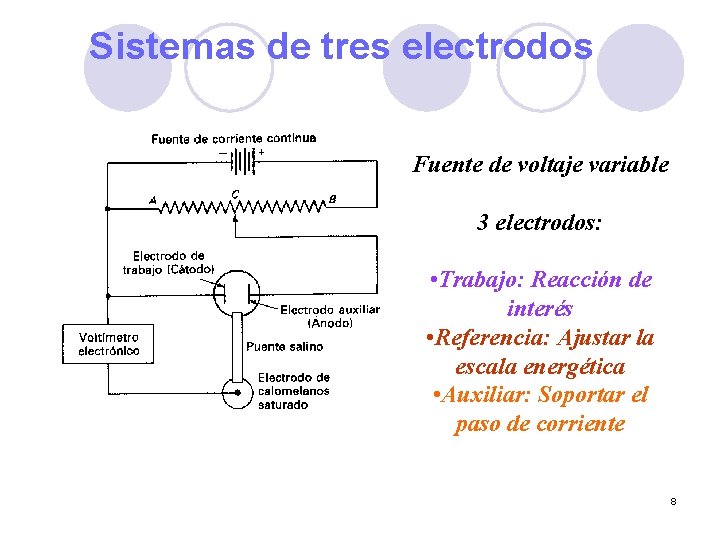
Sistemas de tres electrodos Fuente de voltaje variable 3 electrodos: • Trabajo: Reacción de interés • Referencia: Ajustar la escala energética • Auxiliar: Soportar el paso de corriente 8

Micro y macroelectrólisis Relaciones Área vs Volumen, Área vs Concentración A/V o A/C bajo Poca electrólisis total (microelectrólisis) (cantidad transformada=2%Co*) A/V o A/C alto Consumo alto de sustancia (macroelectrólisis) (transformación total) Selección del método = f (Eficiencia de transferencia de masa) 9

Celda de microelectrólisis Celda de macroelectrólisis l Electrodos (cm 2) l Microelectrodos (mm 2) l Ultramicroelectrodos (mm 2) 10

Cronoamperometría • Repaso de conceptos • Potenciostatos de tres electrodos • Micro y macro electrólisis • Parámetros de control (perturbación – respuesta) • Factores que afectan la velocidad del proceso • Aproximación a la resolución del problema (E constante) • Perfiles de concentración • Ecuación de Cottrell • Ejemplos 11

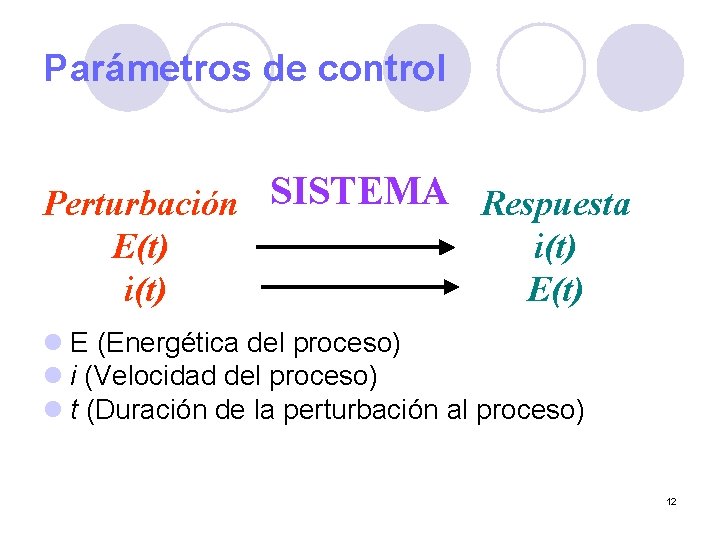
Parámetros de control Perturbación SISTEMA Respuesta E(t) i(t) E(t) l E (Energética del proceso) l i (Velocidad del proceso) l t (Duración de la perturbación al proceso) 12

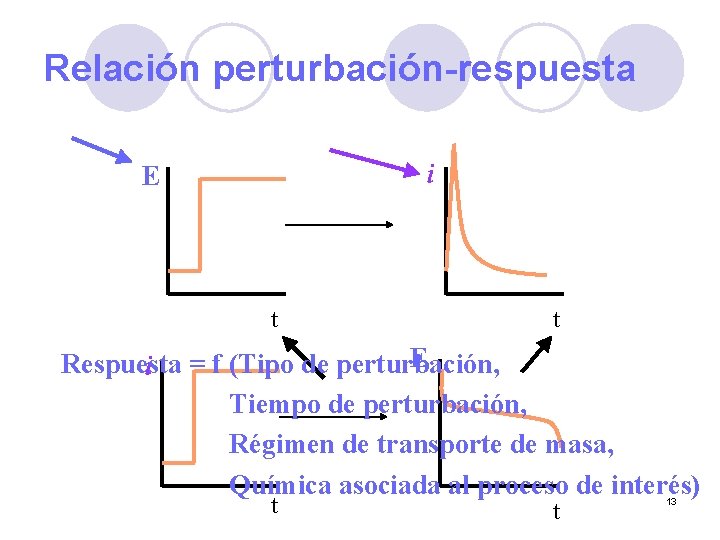
Relación perturbación-respuesta i E t t E Respuesta i = f (Tipo de perturbación, Tiempo de perturbación, Régimen de transporte de masa, Química asociada al proceso de interés) t t 13

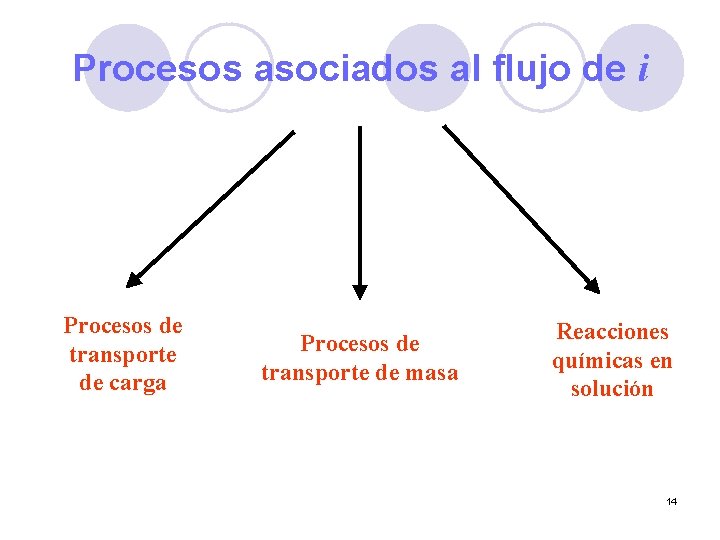
Procesos asociados al flujo de i Procesos de transporte de carga Procesos de transporte de masa Reacciones químicas en solución 14

Técnicas en régimen de difusión no estacionario l Transporte de masa siempre gobernado por difusión [v(x) = 0 (sin convección mecánica), tj 0 (Electrolito soporte en exceso)] l Zonas de diferente tipo de transporte limitante (transferencia de carga, difusión) 15

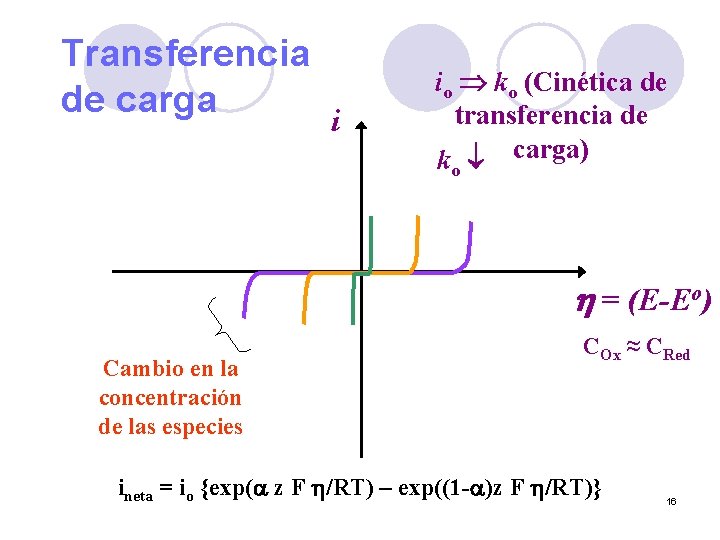
Transferencia de carga i io ko (Cinética de transferencia de k carga) o h = (E-Eo) Cambio en la concentración de las especies COx ≈ CRed ineta = io {exp(a z F h/RT) – exp((1 -a)z F h/RT)} 16

Difusión en una sola dimensión = 0 Flujo constante (Estado estacionario) 0 Flujo variable (Estado no estacionario, “transient techniques”) 17

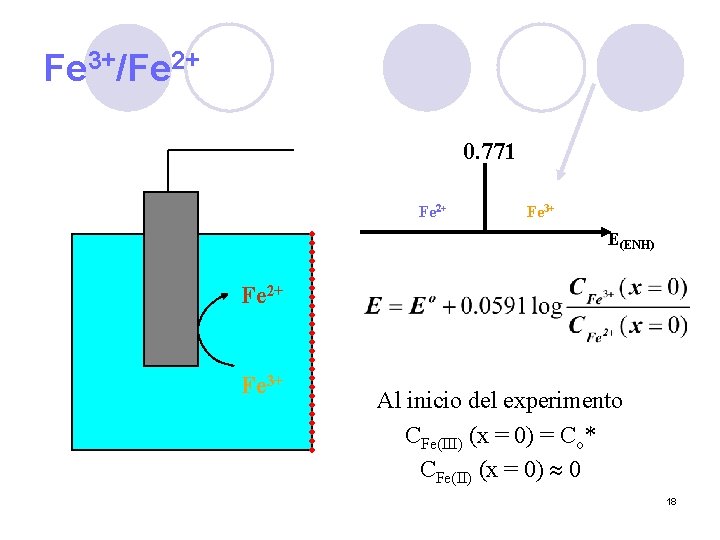
Fe 3+/Fe 2+ 0. 771 Fe 2+ Fe 3+ E(ENH) Fe 2+ Fe 3+ Al inicio del experimento CFe(III) (x = 0) = Co* CFe(II) (x = 0) 0 18

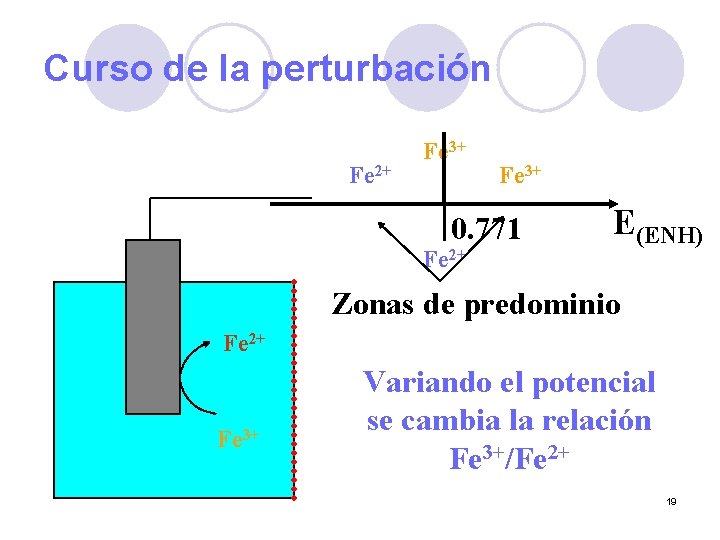
Curso de la perturbación Fe 2+ Fe 3+ 0. 771 Fe 2+ E(ENH) Zonas de predominio Fe 2+ Fe 3+ Variando el potencial se cambia la relación Fe 3+/Fe 2+ 19

Cronoamperometría • Repaso de conceptos • Potenciostatos de tres electrodos • Micro y macro electrólisis • Parámetros de control (perturbación – respuesta) • Factores que afectan la velocidad del proceso • Aproximación a la resolución del problema (E constante) • Perfiles de concentración • Ecuación de Cottrell • Ejemplos 20

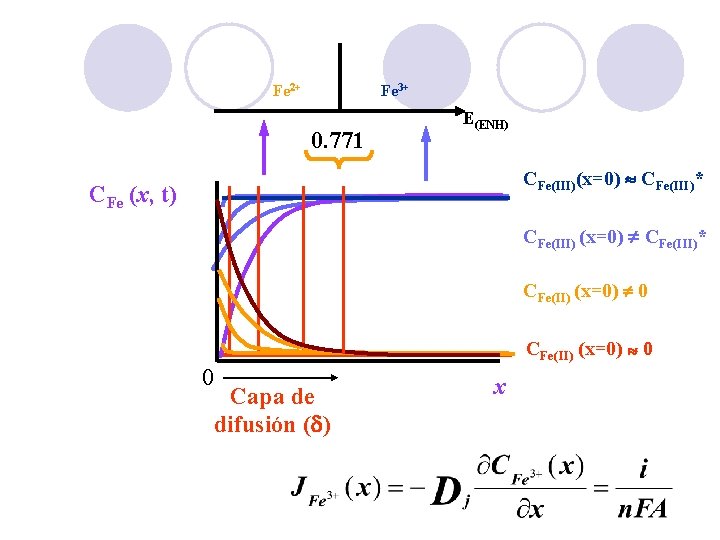
Fe 2+ Fe 3+ 0. 771 E(ENH) CFe(III)(x=0) CFe(III)* CFe (x, t) CFe(III) (x=0) CFe(III)* CFe(II) (x=0) 0 0 Capa de difusión (d) x 21
![Fe 2 Fe 3 0 771 EENH v Zona de activación CFeIII x0 CFeIII Fe 2+ Fe 3+ 0. 771 E(ENH) v Zona de activación [CFe(III) (x=0) CFe(III)*]](https://slidetodoc.com/presentation_image/337374220df017096570170ae75ac899/image-22.jpg)
Fe 2+ Fe 3+ 0. 771 E(ENH) v Zona de activación [CFe(III) (x=0) CFe(III)*] 0. 771 E aplicado < > activación (idifusión masa 0)*] Zona de control por transporte de C * (x (x = = 0) 0) = = 0 v. CCFe(III) Zona de control por difusión [C (x=0) C o Fe(III) CFe(II) (x =(x 0)= 0)0 0 Co* v Zona límite de difusión [CFe(III) (x=0) = 0] difusionalde carga Límite difusional Cinética. Control de transferencia (Butler-Volmer) Condiciones de frontera 22

Perfiles de concentración 23

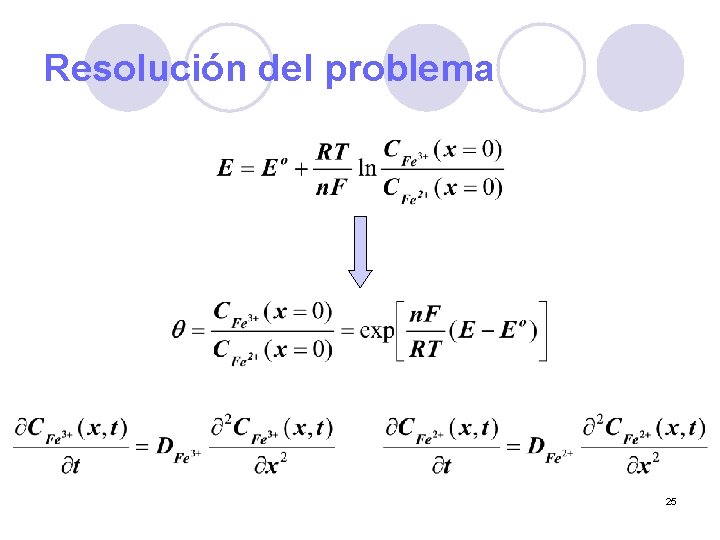
Resolución del problema l Considerar condiciones iniciales l Considerar condiciones de frontera para el potencial seleccionado l Dimensiones consideradas como un límite 24

Resolución del problema 25

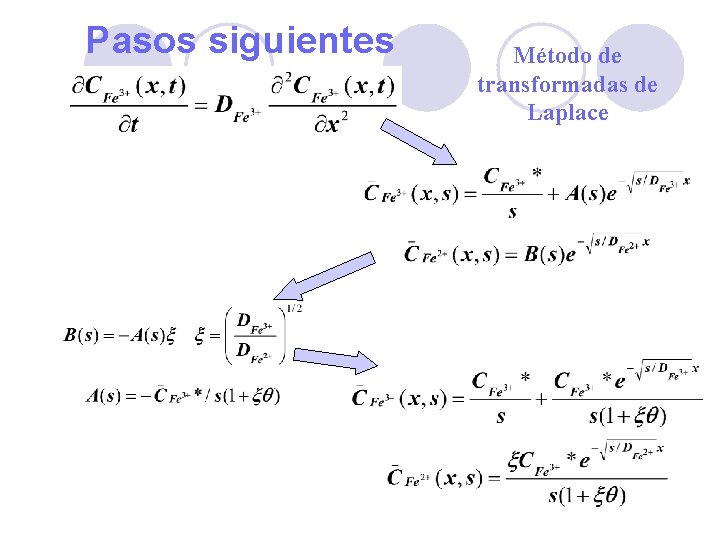
Pasos siguientes Método de transformadas de Laplace 26

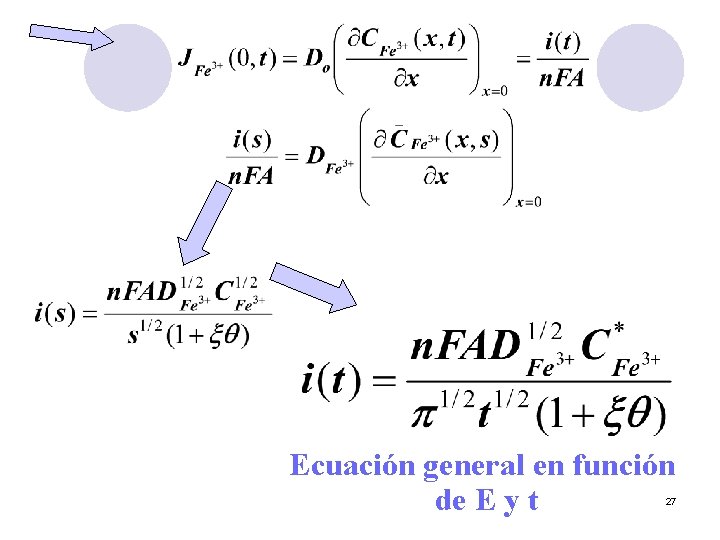
Ecuación general en función de E y t 27
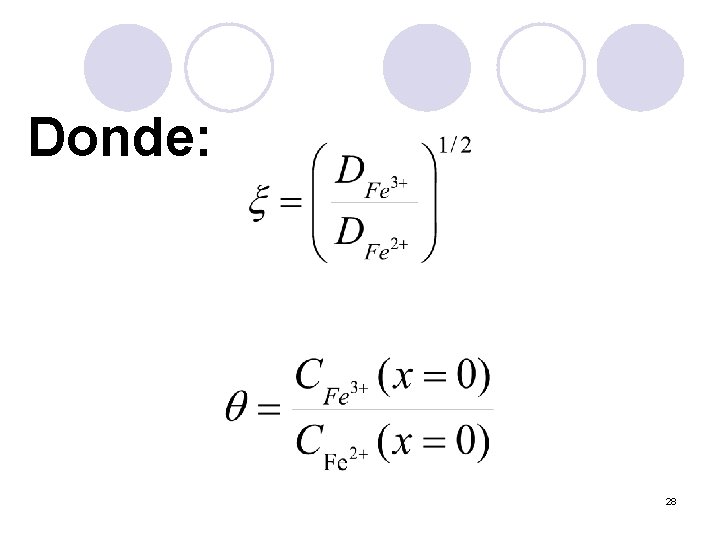
Donde: 28

29

30

Ecuación de Cottrell E en la zona de potencial de límite de difusión 31

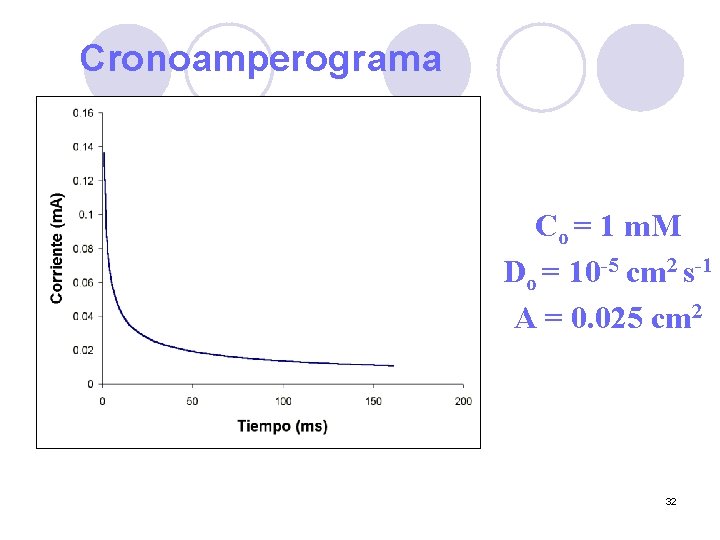
Cronoamperograma Co = 1 m. M Do = 10 -5 cm 2 s-1 A = 0. 025 cm 2 32

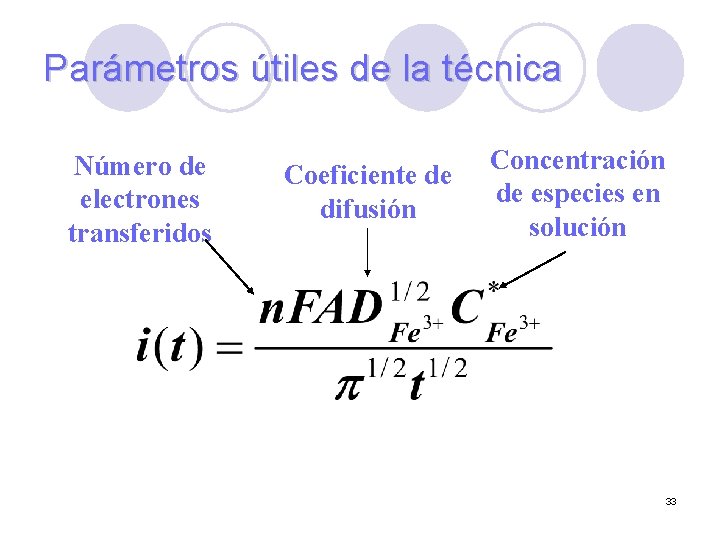
Parámetros útiles de la técnica Número de electrones transferidos Coeficiente de difusión Concentración de especies en solución 33

El “Tiempo-ventana” • Parámetro experimental • Depende de las condiciones experimentales (DCE, Área, etc. ) • Útil en el discernimiento de k • Límite mínimo: Carga de la doble capa, respuesta del aparato • Límite máximo: Fenómenos de convección térmica, cambios en la interfase Técnica Respuesta Parámetro experimental de tiempo Función característica 34

Cronoamperometría • Repaso de conceptos • Potenciostatos de tres electrodos • Micro y macro electrólisis • Parámetros de control (perturbación – respuesta) • Factores que afectan la velocidad del proceso • Aproximación a la resolución del problema (E constante) • Perfiles de concentración • Ecuación de Cottrell • Ejemplos 35
![EJEMPLO No 1 01 Electrochimica Acta 48 2003 3593 3598 36 EJEMPLO No. 1 [01] Electrochimica Acta 48 (2003) 3593 -3598 36](https://slidetodoc.com/presentation_image/337374220df017096570170ae75ac899/image-36.jpg)
EJEMPLO No. 1 [01] Electrochimica Acta 48 (2003) 3593 -3598 36
![Quinonas Actividad biológica Generadores de EOR OH e Quinonas Actividad biológica Generadores de EOR (OH*) + e- • – = [] []](https://slidetodoc.com/presentation_image/337374220df017096570170ae75ac899/image-37.jpg)
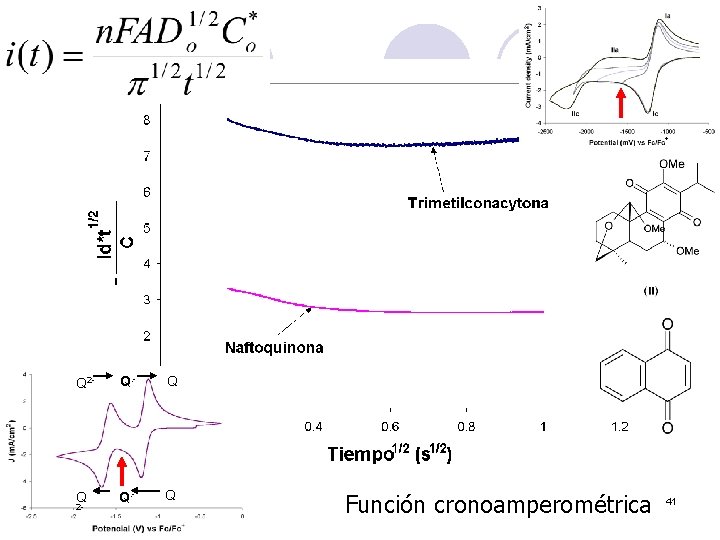
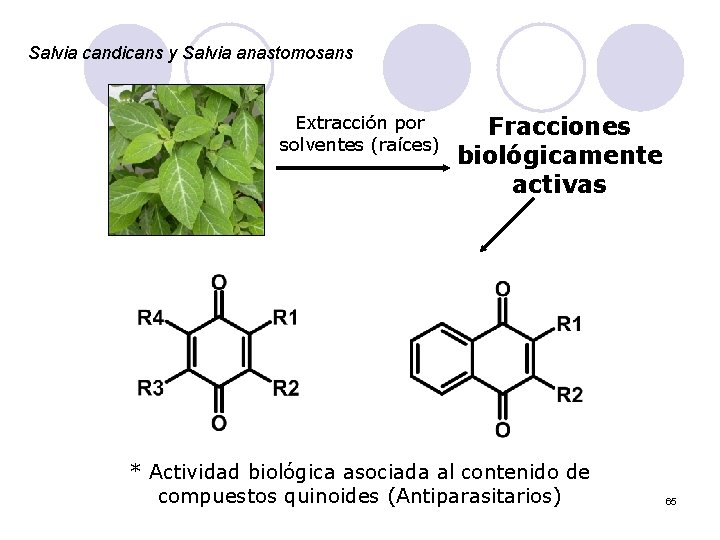
Quinonas Actividad biológica Generadores de EOR (OH*) + e- • – = [] [] Algunas ligadas a la cadena del transporte de electrones + e- Semiquinona/Dianión (Espectroscopía / Electroquímica) 37

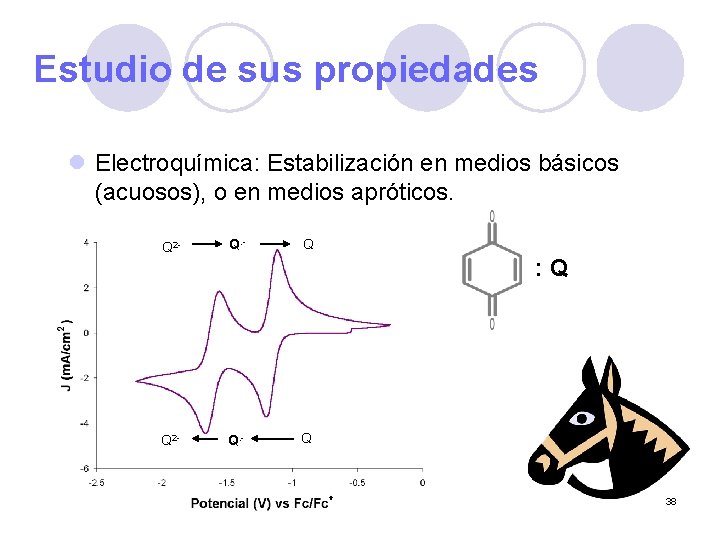
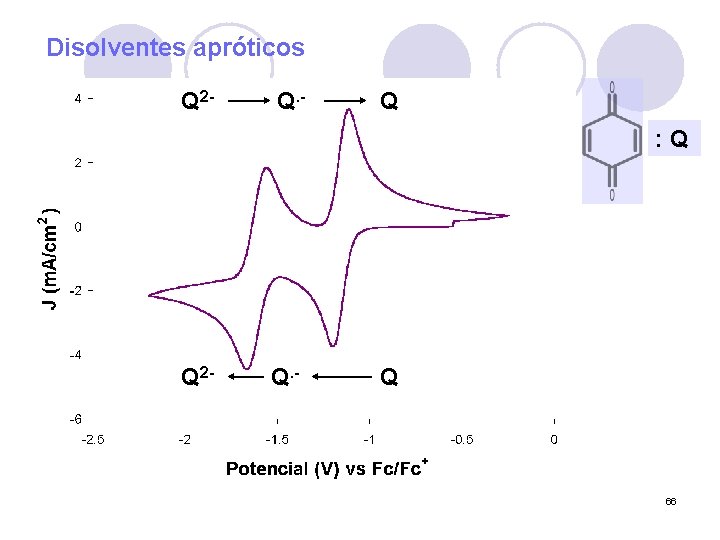
Estudio de sus propiedades l Electroquímica: Estabilización en medios básicos (acuosos), o en medios apróticos. Q 2 - Q. - Q : Q Q 38
![Factores de estabilidad Efectos electrónicos inducción o atracción de carga Factores de estabilidad • – [] • Efectos electrónicos (inducción o atracción de carga)](https://slidetodoc.com/presentation_image/337374220df017096570170ae75ac899/image-39.jpg)
Factores de estabilidad • – [] • Efectos electrónicos (inducción o atracción de carga) • Efectos de solvatación (polaridad del solvente, e) • Química de la especie (reacciones subsecuentes: protonación, dismutación, etc. ) 39

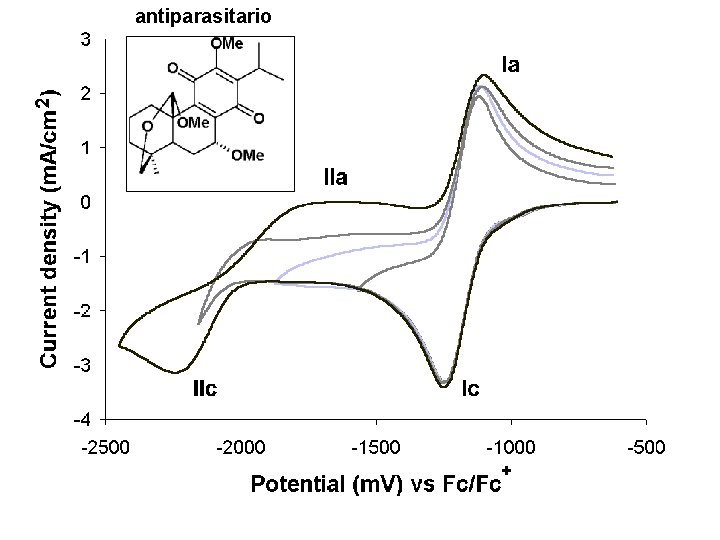
antiparasitario 40

Q 2 - Q. - Q Q Q. - Q 2 - Función cronoamperométrica 41

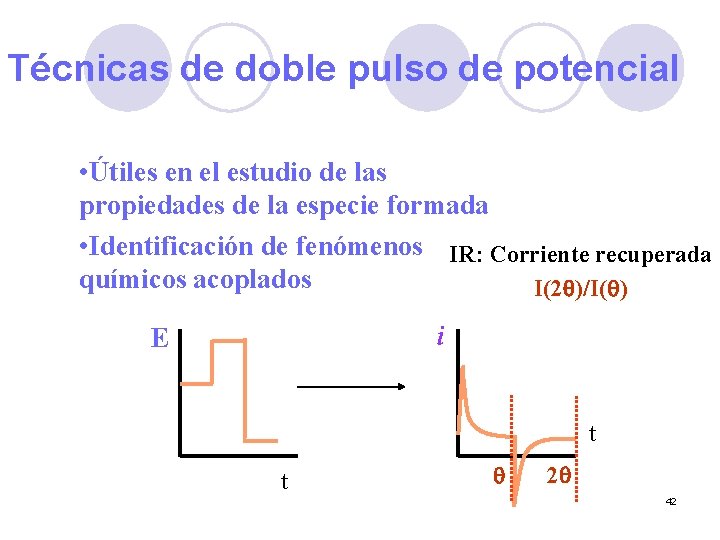
Técnicas de doble pulso de potencial • Útiles en el estudio de las propiedades de la especie formada • Identificación de fenómenos IR: Corriente recuperada químicos acoplados I(2 q)/I(q) i E t t q 2 q 42

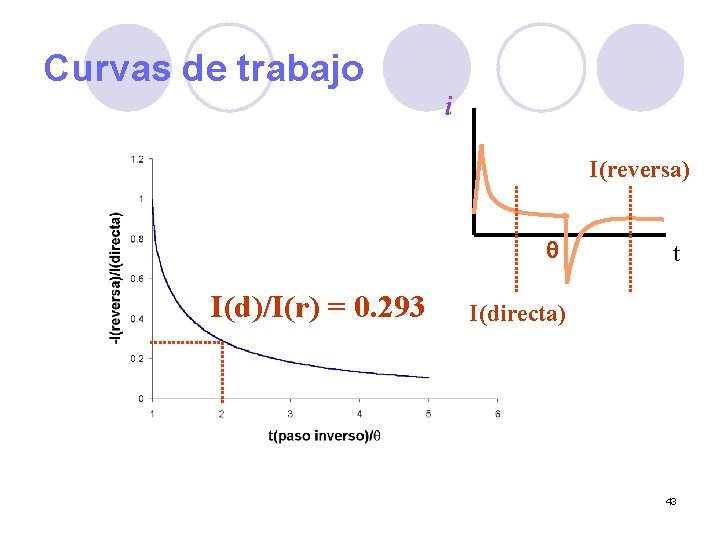
Curvas de trabajo i I(reversa) q I(d)/I(r) = 0. 293 t I(directa) 43

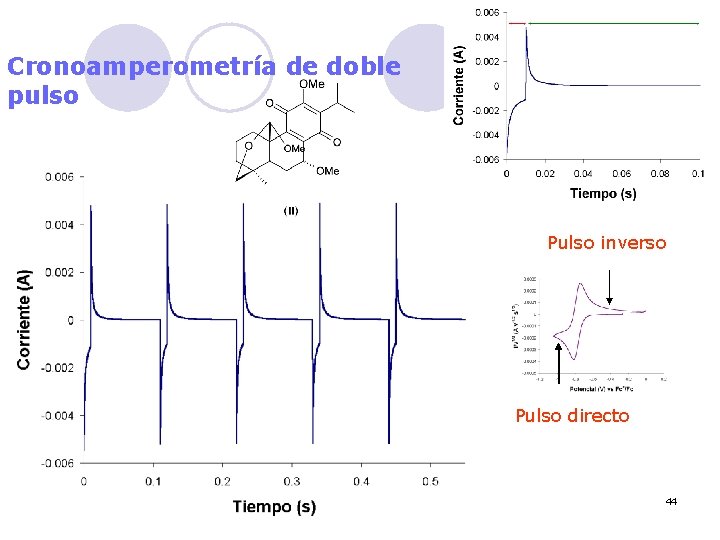
Cronoamperometría de doble pulso Pulso inverso Pulso directo 44
![IP DP 0 q 2 q t 01 Electrochim Acta 48 2003 3593 45 IP DP 0 q 2 q t [01] Electrochim. Acta 48 (2003) 3593 45](https://slidetodoc.com/presentation_image/337374220df017096570170ae75ac899/image-45.jpg)
IP DP 0 q 2 q t [01] Electrochim. Acta 48 (2003) 3593 45

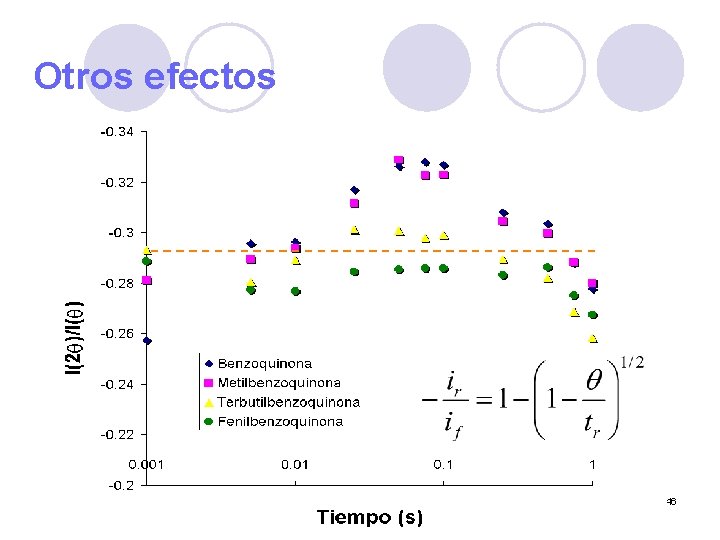
Otros efectos 46
![EJEMPLO No 2 03 J Electroanal Chem 5792005103 111 47 EJEMPLO No. 2 [03] J. Electroanal. Chem. 579(2005)103 -111 47](https://slidetodoc.com/presentation_image/337374220df017096570170ae75ac899/image-47.jpg)
EJEMPLO No. 2 [03] J. Electroanal. Chem. 579(2005)103 -111 47

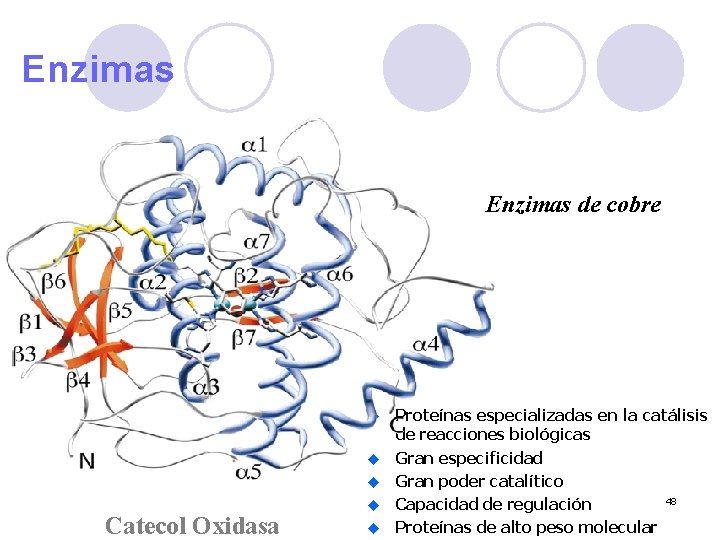
Enzimas de cobre u u u Catecol Oxidasa u u Proteínas especializadas en la catálisis de reacciones biológicas Gran especificidad Gran poder catalítico 48 Capacidad de regulación Proteínas de alto peso molecular

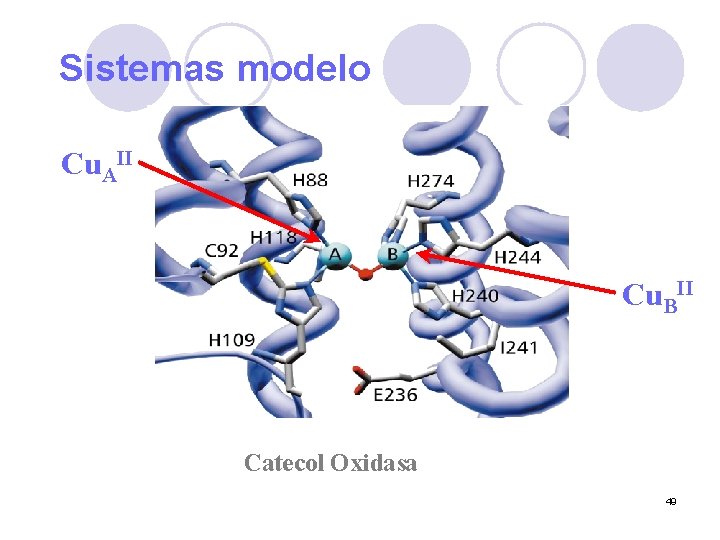
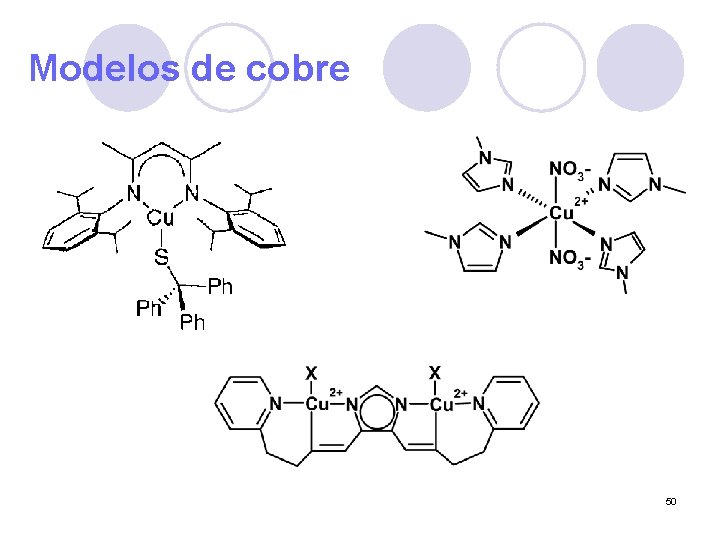
Sistemas modelo Cu. AII Cu. BII Catecol Oxidasa 49

Modelos de cobre 50

Posibles formas de coordinación B A 51

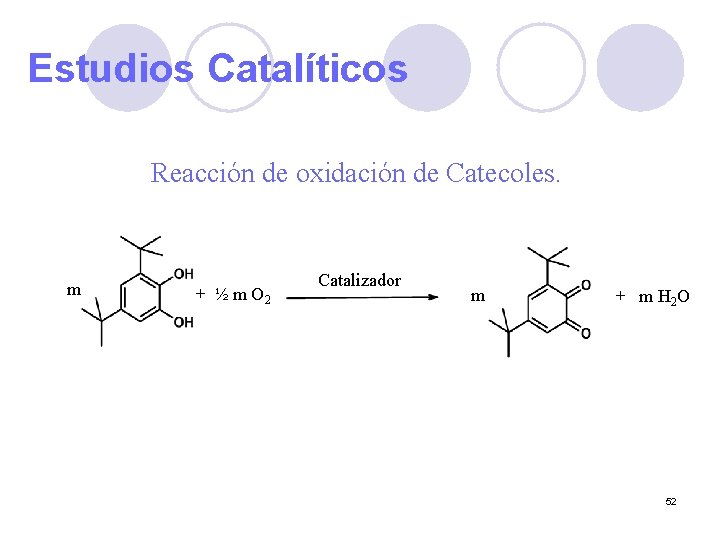
Estudios Catalíticos Reacción de oxidación de Catecoles. m + ½ m O 2 Catalizador m + m H 2 O 52

Estudio de potencial de inversión catódico variable 53 E( vs Ag/Ag. Cl)

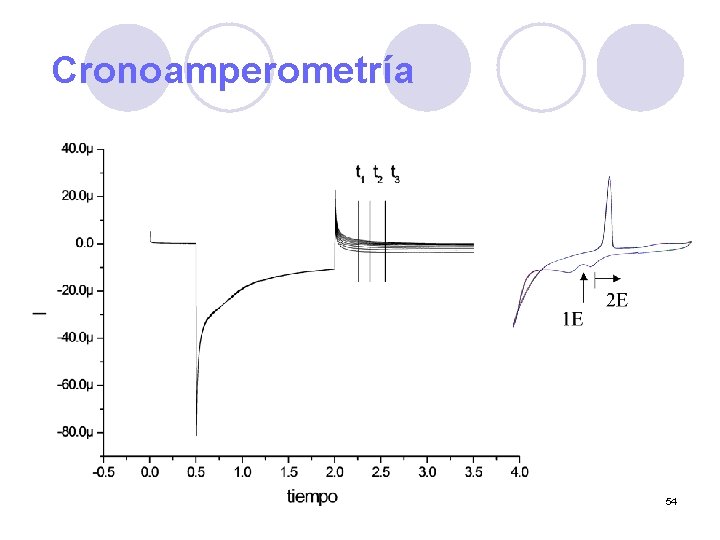
Cronoamperometría 54
![Ecuación de Cottrell 03 J Electroanalytical Chem 5792005103 111 55 Ecuación de Cottrell [03] J Electroanalytical Chem 579(2005)103 -111 55](https://slidetodoc.com/presentation_image/337374220df017096570170ae75ac899/image-55.jpg)
Ecuación de Cottrell [03] J Electroanalytical Chem 579(2005)103 -111 55

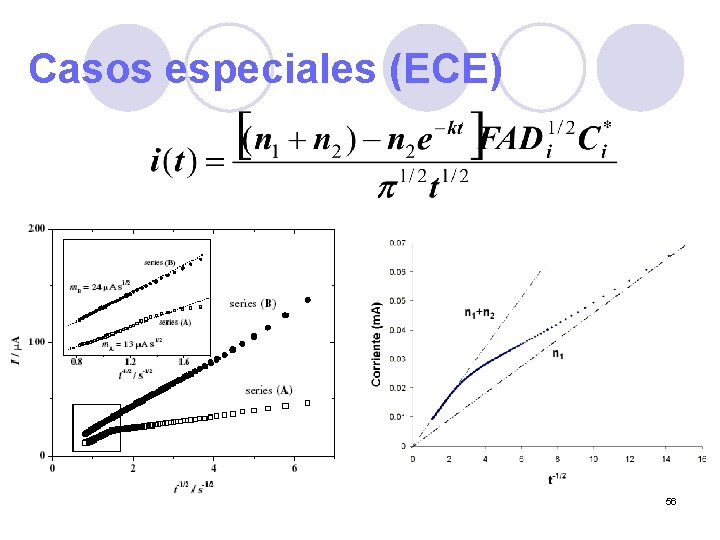
Casos especiales (ECE) 56

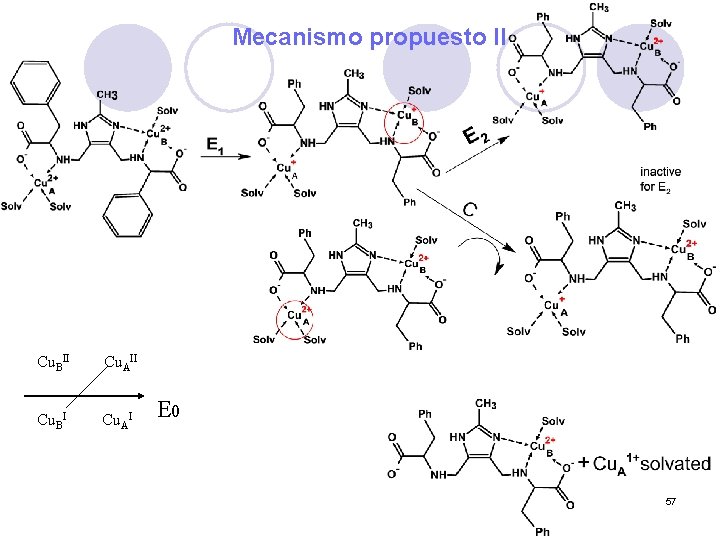
Mecanismo propuesto II Cu. BII Cu. AII Cu. BI Cu. AI E 0 57

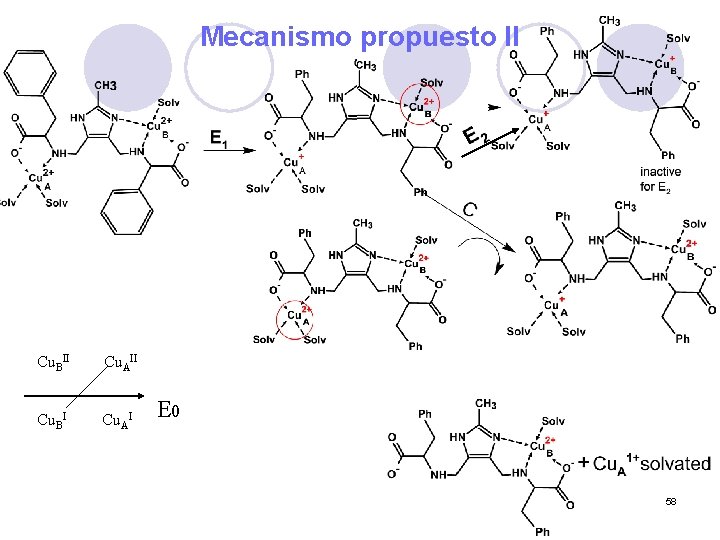
Mecanismo propuesto II Cu. BII Cu. AII Cu. BI Cu. AI E 0 58
![EJEMPLO No 3 02 J Phys Chem B 105 2001 4214 4223 59 EJEMPLO No. 3 [02] J. Phys. Chem. B 105 (2001) 4214 -4223 59](https://slidetodoc.com/presentation_image/337374220df017096570170ae75ac899/image-59.jpg)
EJEMPLO No. 3 [02] J. Phys. Chem. B 105 (2001) 4214 -4223 59

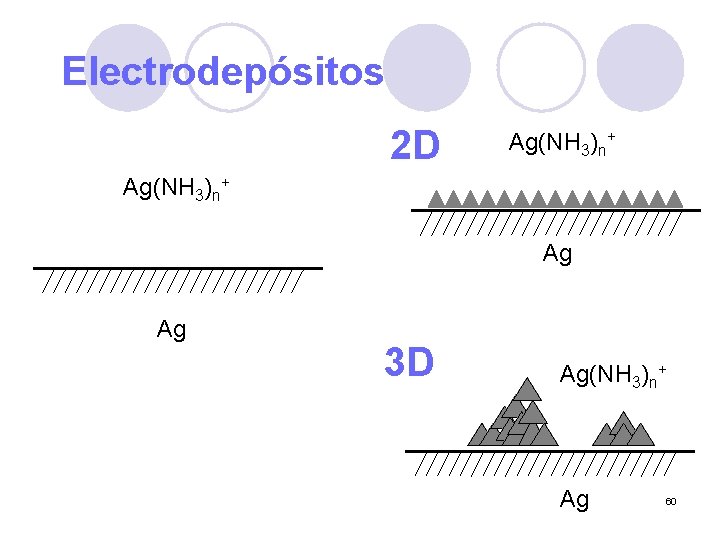
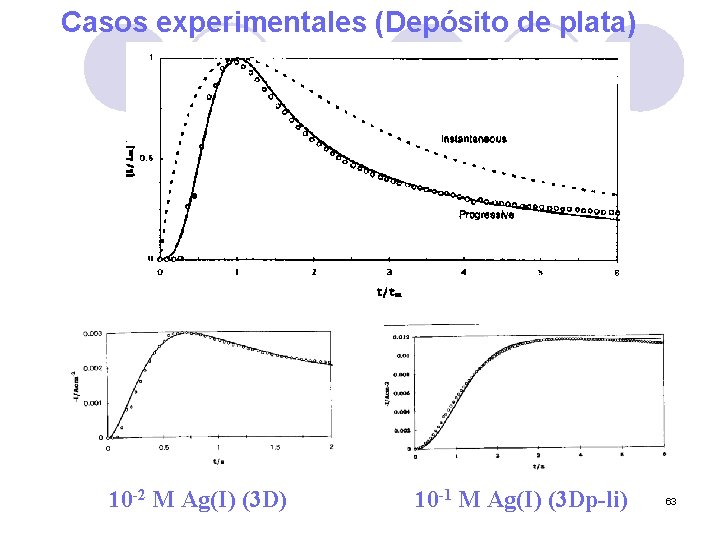
Electrodepósitos 2 D Ag(NH 3)n+ Ag Ag 3 D Ag(NH 3)n+ Ag 60

Electrodepósitos Modelo de nucleación (2 D limitada) 61

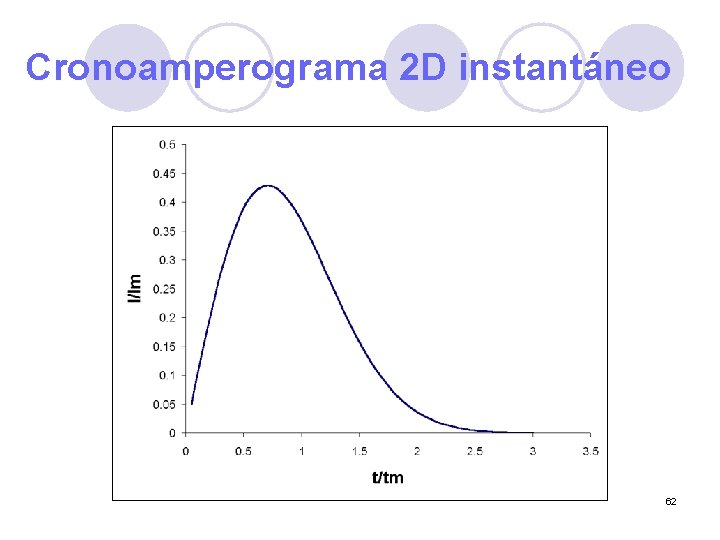
Cronoamperograma 2 D instantáneo 62

Casos experimentales (Depósito de plata) 10 -2 M Ag(I) (3 D) 10 -1 M Ag(I) (3 Dp-li) 63
![EJEMPLO No 4 04 J Electroanal Chem 310 1991 293 303 64 EJEMPLO No. 4 [04] J. Electroanal. Chem. 310 (1991) 293 -303 64](https://slidetodoc.com/presentation_image/337374220df017096570170ae75ac899/image-64.jpg)
EJEMPLO No. 4 [04] J. Electroanal. Chem. 310 (1991) 293 -303 64

Salvia candicans y Salvia anastomosans Extracción por solventes (raíces) Fracciones biológicamente activas * Actividad biológica asociada al contenido de compuestos quinoides (Antiparasitarios) 65

Disolventes apróticos Q 2 - Q. - Q : Q Q 2 - Q. - Q 66

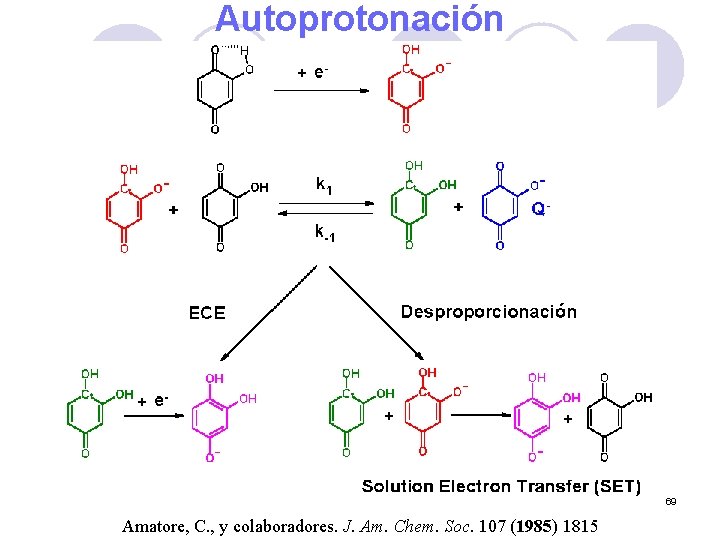
Electroquímica de a-Hidroxiquinonas 3 m. M, 100 m. V s-1 ET: Pt QH 3 Q*= QH Q- Fenómenos de autoprotonación González, F. J. Electroanalysis, 10 (1998) 638. 67

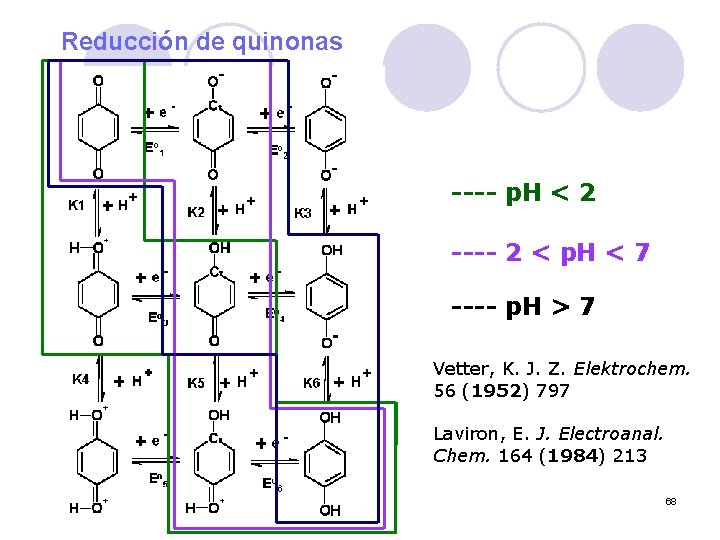
Reducción de quinonas ---- p. H < 2 ---- 2 < p. H < 7 ---- p. H > 7 Vetter, K. J. Z. Elektrochem. 56 (1952) 797 Laviron, E. J. Electroanal. Chem. 164 (1984) 213 68

Autoprotonación 69 Amatore, C. , y colaboradores. J. Am. Chem. Soc. 107 (1985) 1815

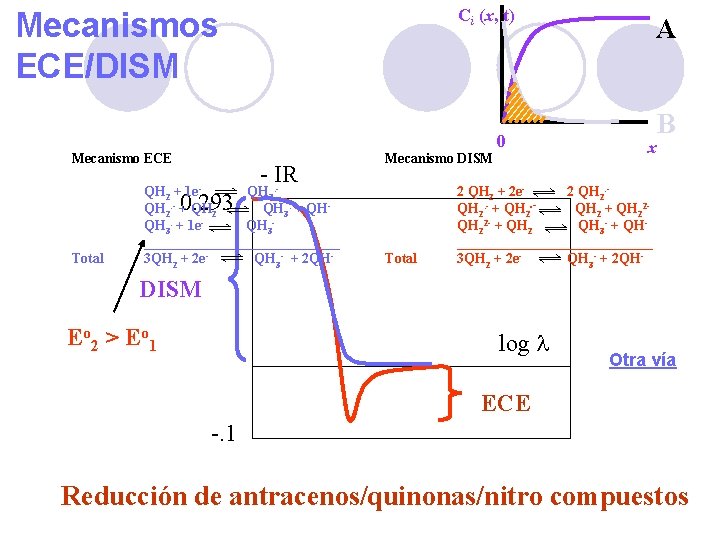
“Capa de reacción” Ci (x, t) A Zona donde coexisten A y B B 0 x A + e- B B+A C C + e- D (E) (C) (E) 70

Ci (x, t) Mecanismos ECE/DISM Mecanismo ECE - IR 1 e- QH 2 + QH 2. - + QH 2 QH 3. + QHQH 3. + 1 e. QH 3______________ 3 QH 2 + 2 e. QH 3 - + 2 QH- Mecanismo DISM 0. 293 Total 0 A B x 2 QH 2 + 2 e 2 QH 2. - + QH 22 - + QH 2 QH 3 - + QH______________ 3 QH 2 + 2 e. QH 3 - + 2 QH- DISM Eo 2 > Eo 1 log l Otra vía ECE -. 1 Reducción de antracenos/quinonas/nitro compuestos 71

Casos reales Reducción de 1. 07 m. M perezona en medio PTEA/HBz 0. 01 M/CH 3 CN Reducción de 1 m. M antraceno en medio 0. 1 M NBu 4 BF 4/DMF Mecanismos DISM [04] J Electroanal Chem 310 (1991) 293 72
 Gustavo martnez
Gustavo martnez Roberto martnez
Roberto martnez Que significa lser
Que significa lser Tcnicas
Tcnicas Tcnicas de estudio
Tcnicas de estudio Tcnicas de estudio
Tcnicas de estudio Tcnicas de estudio
Tcnicas de estudio Gonzlez
Gonzlez Vfetch
Vfetch Ignacio bossi
Ignacio bossi Herrera esquivel juan ignacio
Herrera esquivel juan ignacio Amar y servir san ignacio
Amar y servir san ignacio Primer rayo notable
Primer rayo notable Plantel ignacio ramírez calzada logo
Plantel ignacio ramírez calzada logo Macrfagos
Macrfagos Ignacio barcenas
Ignacio barcenas Orden religiosa fundada por san ignacio de loyola
Orden religiosa fundada por san ignacio de loyola Juan ignacio villela
Juan ignacio villela Ignacio negueruela
Ignacio negueruela Ignacio manuel altamirano romanticismo
Ignacio manuel altamirano romanticismo Clemencia ignacio manuel altamirano
Clemencia ignacio manuel altamirano Jorge ignacio celis mejia
Jorge ignacio celis mejia Iglesia san ignacio de loyola
Iglesia san ignacio de loyola 22dpr
22dpr Facultad de ciencias médicas y biológicas umsnh
Facultad de ciencias médicas y biológicas umsnh Ignacio taboada
Ignacio taboada Ignacio grossmann
Ignacio grossmann Juan ignacio fraschini
Juan ignacio fraschini Ignacio harrouch
Ignacio harrouch Soy ignacio me gusta mucho tocar la guitarra in english
Soy ignacio me gusta mucho tocar la guitarra in english Ignacio mora gonzalez
Ignacio mora gonzalez Ignacio hernandez medrano edad
Ignacio hernandez medrano edad Si no te saluda no le importas
Si no te saluda no le importas Colegio ignacio carrera pinto lo prado
Colegio ignacio carrera pinto lo prado Ignacio luzan
Ignacio luzan Juanito belmonte
Juanito belmonte Pintor peruano la jarana
Pintor peruano la jarana Tenia andres cierta ilusion por el nuevo curso
Tenia andres cierta ilusion por el nuevo curso Oración inicio de curso 2020 21
Oración inicio de curso 2020 21 Curso dns básico
Curso dns básico Elkar backup
Elkar backup Curso tecnico em agroecologia
Curso tecnico em agroecologia Curso derecho registral
Curso derecho registral Diploma fin de curso primaria
Diploma fin de curso primaria Caracteristicas de la vision de una empresa
Caracteristicas de la vision de una empresa Curso de circuito fechado de tv
Curso de circuito fechado de tv Desde o inicio de seu curso o jovem gerente tinha aprendido
Desde o inicio de seu curso o jovem gerente tinha aprendido Curso patrón de lancha deportiva de bahía
Curso patrón de lancha deportiva de bahía Linx microvix
Linx microvix Curso de evangelismo
Curso de evangelismo Cumaps
Cumaps Viaje paris fin de curso
Viaje paris fin de curso Bpl oms
Bpl oms E.p.t curso
E.p.t curso Curso de magnetismo espiritual
Curso de magnetismo espiritual Curso variadores de frecuencia
Curso variadores de frecuencia Que es sav
Que es sav Fatfa curso auxiliar de farmacia
Fatfa curso auxiliar de farmacia El curso favorito de los alumnos de una escuela.
El curso favorito de los alumnos de una escuela. Slide to doc.com
Slide to doc.com Diploma fin curso
Diploma fin curso Curso para ser alfabetizador
Curso para ser alfabetizador Curso desenho instrucional
Curso desenho instrucional Curso word 2007
Curso word 2007 Fisioterapia veterinaria curso
Fisioterapia veterinaria curso Curso siltra
Curso siltra Curso de compiladores
Curso de compiladores Ingenieria en computacion
Ingenieria en computacion Curso mmog
Curso mmog Curso de profeta
Curso de profeta Curso aislamiento hospitalario
Curso aislamiento hospitalario Duplicacao
Duplicacao Curso apoyo psicosocial
Curso apoyo psicosocial