Curso de Tcnicas Electroqumicas Fundamentos Ignacio Gonzlez Martnez


























- Slides: 46

Curso de Técnicas Electroquímicas (Fundamentos) Ignacio González Martínez Carlos Eduardo Frontana Vázquez Víctor Manuel Ugalde Saldívar 1

Q. Carlos Eduardo Frontana Vázquez Dr. Víctor Manuel Ugalde Saldívar Universidad Autónoma Metropolitana Unidad Iztapalapa Universidad Nacional Autónoma de México ultrabuho@yahoo. com. mx Universidad Metropolitana Unidad Iztapalapa Electroquímica molecular (Química Orgánica) vmus@xanum. uam. mx vmus@servidor. unam. mx Electroquímica molecular (Química Inorgánica) 2

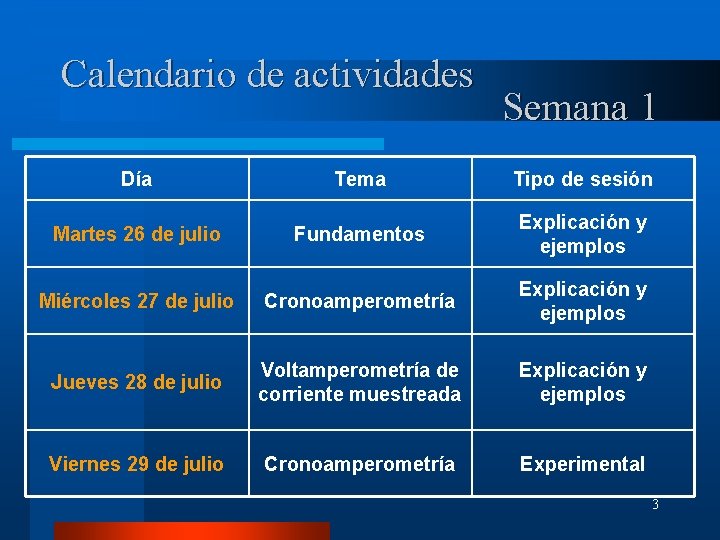
Calendario de actividades Semana 1 Día Tema Tipo de sesión Martes 26 de julio Fundamentos Explicación y ejemplos Miércoles 27 de julio Cronoamperometría Explicación y ejemplos Jueves 28 de julio Voltamperometría de corriente muestreada Explicación y ejemplos Viernes 29 de julio Cronoamperometría Experimental 3

Calendario de actividades Semana 2 Día Tema Tipo de sesión Lunes 1 de agosto Voltamperometría de barrido lineal Explicación y ejemplos Miércoles 3 de agosto Casos experimentales Explicación y ejemplos Jueves 4 de agosto Voltamperometría de barrido lineal Experimental Viernes 5 de agosto Espectroelectroquímica Explicación y ejemplos 4

Fundamentos de electroquímica • Reacciones en disolución (reacciones redox) • Celda electroquímica • Reacción electroquímica • Potenciometría de corriente nula • Electrodo Normal de Hidrógeno y sistemas de referencia • Potenciostato (instrumentación) • Factores que alteran la velocidad del proceso: • Transferencia de carga (BV) • Transferencia de masa (Nernst-Planck) • Leyes de Fick 5

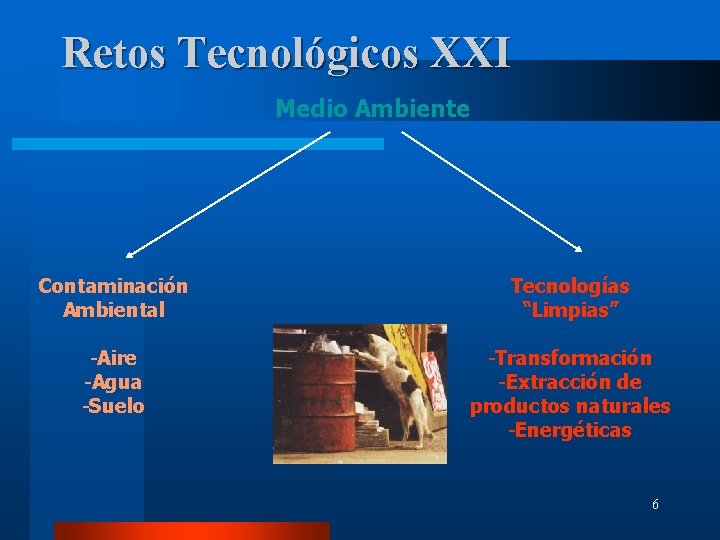
Retos Tecnológicos XXI Medio Ambiente Contaminación Ambiental Tecnologías “Limpias” -Aire -Agua -Suelo -Transformación -Extracción de productos naturales -Energéticas 6

Retos Tecnológicos XXI Industrial Innovación Tecnologías “Limpias” Disminución de costos 7

Retos Tecnológicos XXI Ciencia Básica Desarrollo de Teorías Relaciones estructura-actividad Mayor implicación en el proceso productivo 8

Fundamentos de electroquímica • Reacciones en disolución (reacciones redox) • Celda electroquímica • Reacción electroquímica • Potenciometría de corriente nula • Electrodo Normal de Hidrógeno y sistemas de referencia • Potenciostato (instrumentación) • Factores que alteran la velocidad del proceso: • Transferencia de carga (BV) • Transferencia de masa (Nernst-Planck) • Leyes de Fick 9

Reacciones “redox” Red 1 + Ox 1 Ox 2 + Red 2 Fe 2+ + Ce 4+ Fe 3+ + Ce 3+ Fe 2+ + Fe 3+ + Ce 4+ Ce 3+ DGrxn = G mezcla final – G mezcla inicial Mezcla final= [j] después del avance de un coeficiente estequiométrico 10

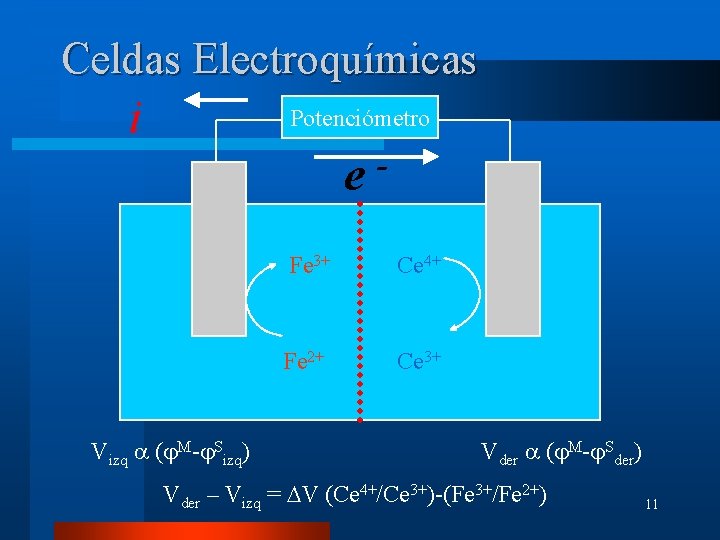
Celdas Electroquímicas i Potenciómetro e Vizq ( M- Sizq) - Fe 3+ Ce 4+ Fe 2+ Ce 3+ Vder ( M- Sder) Vder – Vizq = DV (Ce 4+/Ce 3+)-(Fe 3+/Fe 2+) 11

Reacciones electroquímicas Toda reacción que involucra transferencia de carga A TRAVÉS de la interfase y, por lo tanto, un FLUJO DE CORRIENTE (J), se llama REACCIÓN ELECTROQUÍMICA De transferencia iónica: Ag+ (soln) + e- (metal) Ag (metal) H 3 O+ (soln) + e-(metal) Had + H 2 O 2 Had H 2 (g) A+ (ac) A+ (org) De transferencia electrónica Fe 3+ (soln) + e- (metal) Fe 2+ (soln) 12

Introducción • Electroquímica: Inicio formal a partir de los trabajos de Volta y Galvani (celdas de energía y fenómenos biológicos). • Estudio de estructuras y procesos en la interfase formada por un conductor electrónico y un conductor iónico (o entre dos conductores iónicos) 13

Propiedades de la reacción electroquímica v J, si sólo ocurre una reacción química en el sistema l Sensible al estado de la superficie. l Modifica el término DG por valores zi eo Df l Al variar Df, es posible controlar la velocidad de reacción e incluso revertir su dirección 14

Fundamentos de electroquímica • Reacciones en disolución (reacciones redox) • Celda electroquímica • Reacción electroquímica • Potenciometría de corriente nula • Electrodo Normal de Hidrógeno y sistemas de referencia • Ley de Nernst • Potenciostato (instrumentación) • Factores que alteran la velocidad del proceso: • Transferencia de carga (BV) • Transferencia de masa (Nernst-Planck) • Leyes de Fick 15

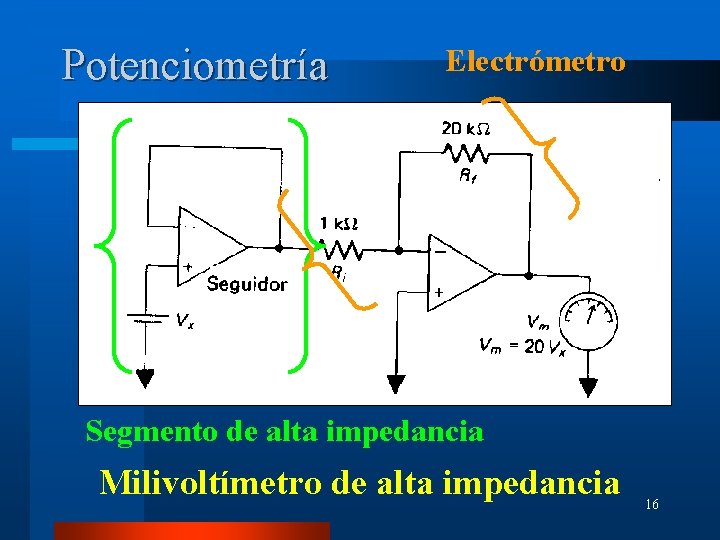
Potenciometría Electrómetro Segmento de alta impedancia Milivoltímetro de alta impedancia 16

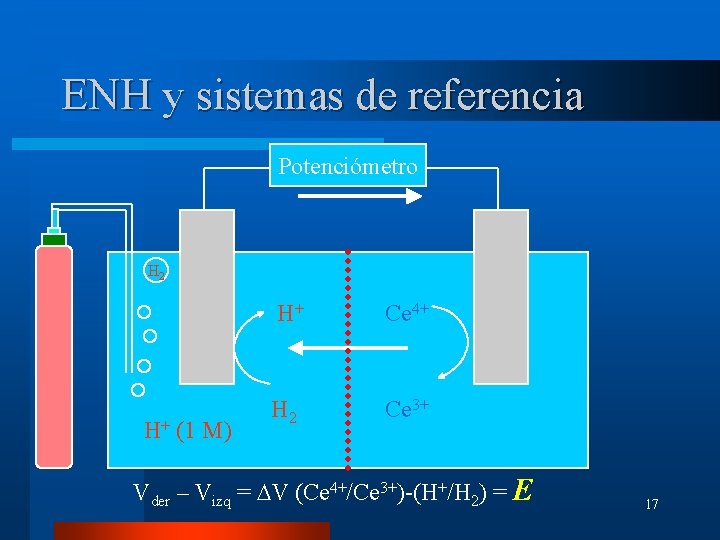
ENH y sistemas de referencia Potenciómetro H 2 H+ (1 M) H+ Ce 4+ H 2 Ce 3+ Vder – Vizq = DV (Ce 4+/Ce 3+)-(H+/H 2) = E 17

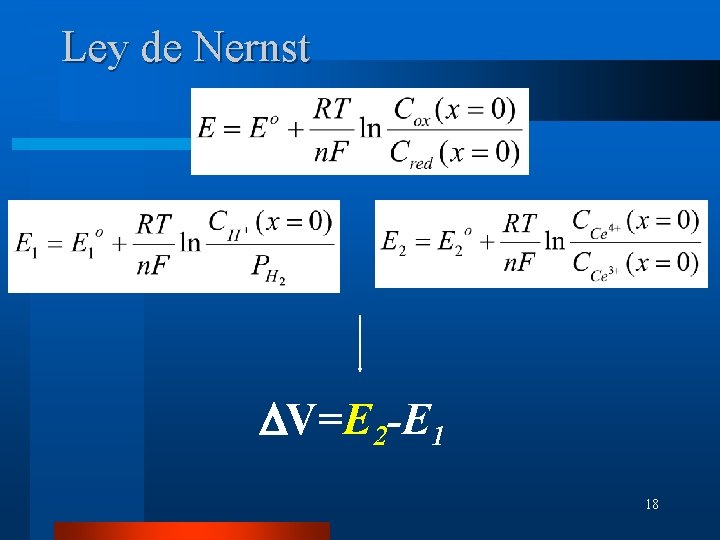
Ley de Nernst DV=E 2 -E 1 18

Condiciones de aplicabilidad de E DV = E 2, sí y sólo sí • Vizq = ENH (Sistema de referencia) • [Ox]x=0=[Ox]* • [Red]x=0=[Red]* (no hay reacción química) • icelda 0 [A] = [A] después de la llamada doble capa(“Energía”) eléctrica E es lax=0 condición termodinámica de mi sistema 19

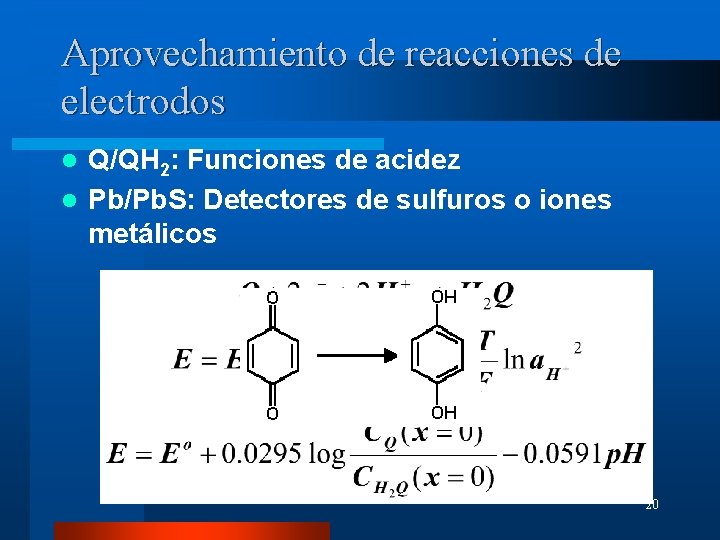
Aprovechamiento de reacciones de electrodos Q/QH 2: Funciones de acidez l Pb/Pb. S: Detectores de sulfuros o iones metálicos l 20

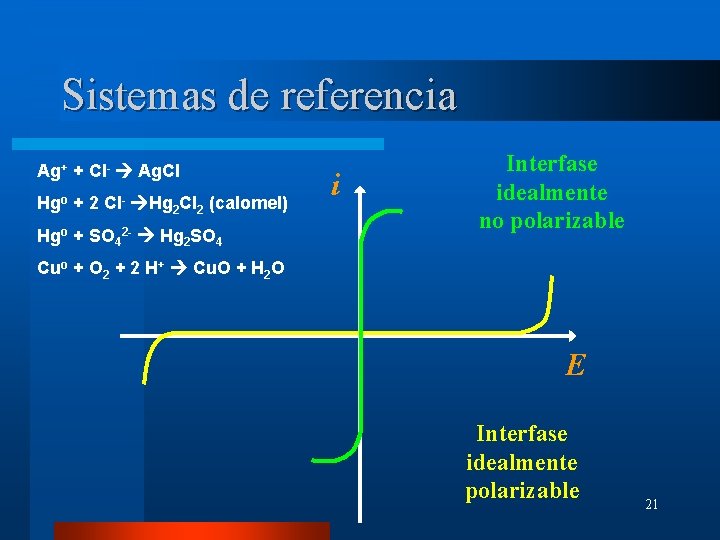
Sistemas de referencia Ag+ + Cl- Ag. Cl Hgo +2 Cl- Hg 2 Cl 2 (calomel) Hgo + SO 42 - Hg 2 SO 4 i Interfase idealmente no polarizable Cuo + O 2 + 2 H+ Cu. O + H 2 O E Interfase idealmente polarizable 21

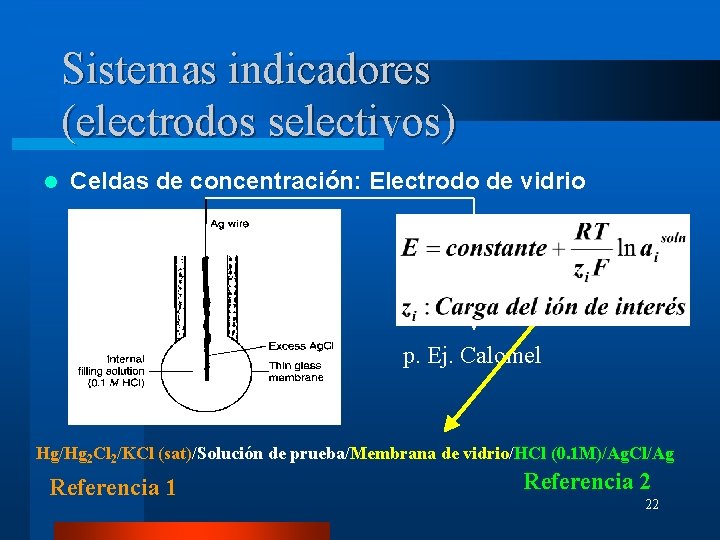
Sistemas indicadores (electrodos selectivos) l Celdas de concentración: Electrodo de vidrio p. Ej. Calomel Hg/Hg 2 Cl 2/KCl (sat)/Solución de prueba/Membrana de vidrio/HCl (0. 1 M)/Ag. Cl/Ag Referencia 1 Referencia 2 22

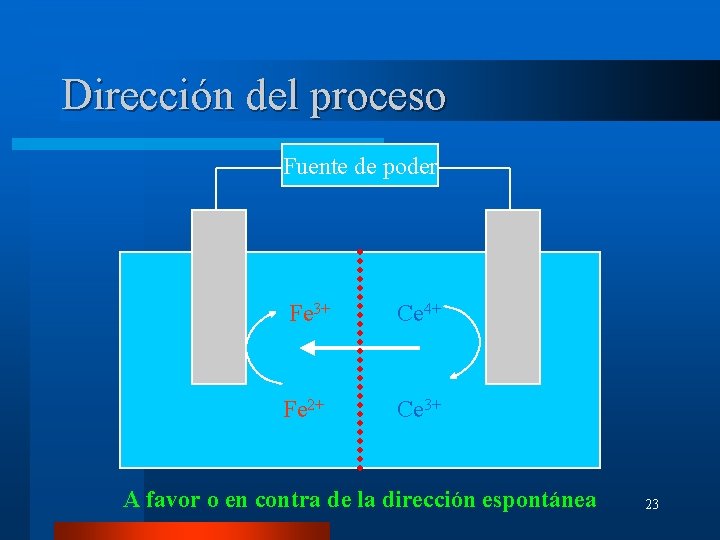
Dirección del proceso Fuente de poder Fe 3+ Ce 4+ Fe 2+ Ce 3+ A favor o en contra de la dirección espontánea 23

Fundamentos de electroquímica • Reacciones en disolución (reacciones redox) • Celda electroquímica • Reacción electroquímica • Potenciometria de corriente nula • Electrodo Normal de Hidrogeno y sistemas de referencia • Ley de Nernst • Potenciostato (instrumentación) • Factores que alteran la velocidad del proceso: • Transferencia de carga (BV) • Transferencia de masa (Nernst-Planck) • Leyes de Fick 24

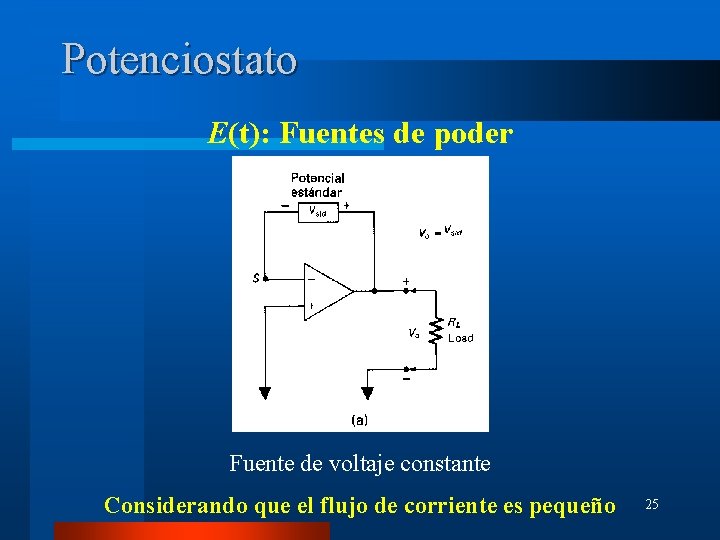
Potenciostato E(t): Fuentes de poder Fuente de voltaje constante Considerando que el flujo de corriente es pequeño 25

Fundamentos de electroquímica • Reacciones en disolución (reacciones redox) • Celda electroquímica • Reacción electroquímica • Potenciometria de corriente nula • Electrodo Normal de Hidrogeno y sistemas de referencia • Potenciostato (instrumentación) • Factores que alteran la velocidad del proceso • Transferencia de carga (BV) • Transferencia de masa (Nernst-Planck) • Leyes de Fick 26

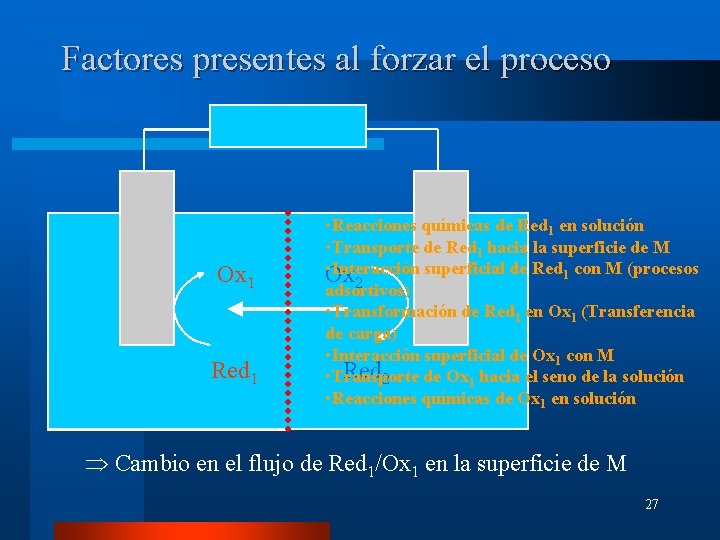
Factores presentes al forzar el proceso Ox 1 Red 1 • Reacciones químicas de Red 1 en solución • Transporte de Red 1 hacia la superficie de M • Interacción superficial de Red 1 con M (procesos Ox 2 adsortivos) • Transformación de Red 1 en Ox 1 (Transferencia de carga) • Interacción superficial de Ox 1 con M Red 2 de Ox 1 hacia el seno de la solución • Transporte • Reacciones químicas de Ox 1 en solución Cambio en el flujo de Red 1/Ox 1 en la superficie de M 27

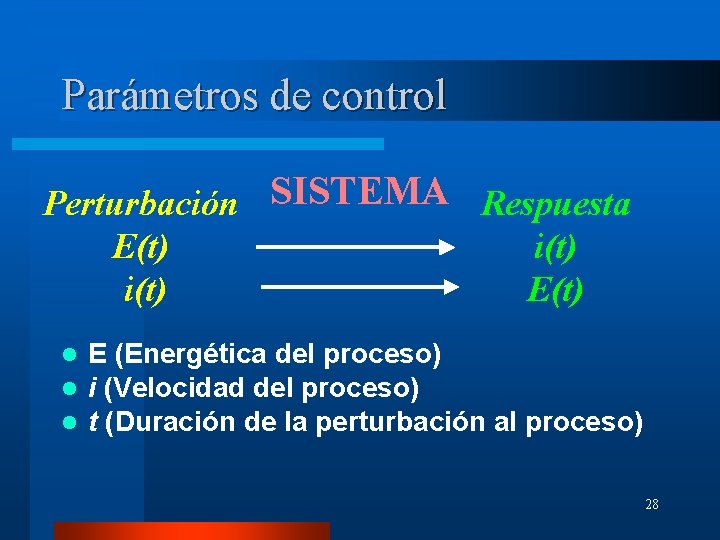
Parámetros de control Perturbación SISTEMA Respuesta E(t) i(t) E(t) l l l E (Energética del proceso) i (Velocidad del proceso) t (Duración de la perturbación al proceso) 28

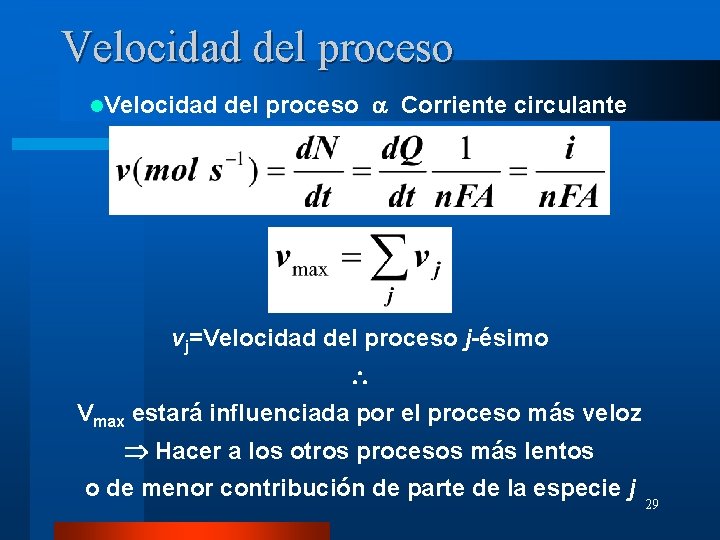
Velocidad del proceso l. Velocidad del proceso Corriente circulante vj=Velocidad del proceso j-ésimo Vmax estará influenciada por el proceso más veloz Hacer a los otros procesos más lentos o de menor contribución de parte de la especie j 29

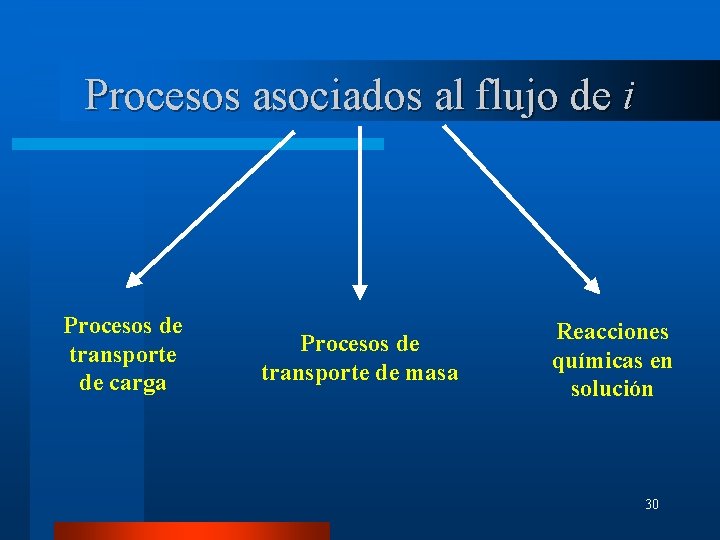
Procesos asociados al flujo de i Procesos de transporte de carga Procesos de transporte de masa Reacciones químicas en solución 30

Selección de condiciones experimentales Vproceso = vtransferencia de carga + vtransporte de masa + vreacciones químicas Transferencia de carga TM y Rxns Q Rápidas Transporte de masa TC y Rxns Q Rápidas Reacciones químicas TC y TM Rápidadas 31

Fundamentos de electroquímica • Reacciones en disolución (reacciones redox) • Celda electroquímica • Reacción electroquímica • Potenciometria de corriente nula • Electrodo Normal de Hidrogeno y sistemas de referencia • Potenciostato (instrumentación) • Factores que alteran la velocidad del proceso • Transferencia de carga (BV) • Transferencia de masa (Nernst-Planck) • Leyes de Fick 32

Transferencia de carga Ecuación de Butler-Volmer ineta = io {exp( a z F h/RT) – exp(- c z F h/RT)} Ecuación de Wagner-Traud icorrosión = ioa {exp( aa F [f*- foa]/RT) -exp(- ac F [f*- foa]/RT) } = - ioc {exp( ca F [f*- foc]/RT) - exp(- cc F [f*- foc]/RT) } 33

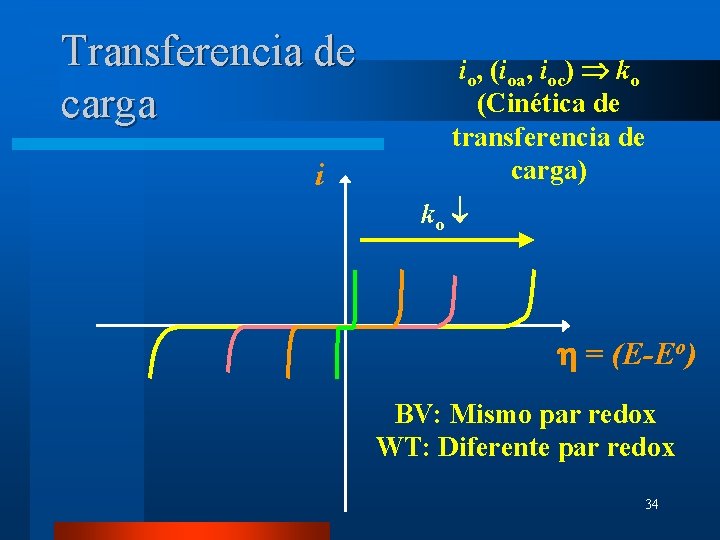
Transferencia de carga i io, (ioa, ioc) ko (Cinética de transferencia de carga) ko h = (E-Eo) BV: Mismo par redox WT: Diferente par redox 34

Cantidad a electrolizar Relaciones Área vs Volumen, Área vs Concentración A/V o A/C bajo Poca electrólisis total (microelectrólisis) A/V o A/C alto Consumo alto de sustancia (macroelectrólisis) Selección del método = f (Eficiencia de transferencia de masa) 35

Fundamentos de electroquímica • Reacciones en disolución (reacciones redox) • Celda electroquímica • Reacción electroquímica • Potenciometria de corriente nula • Electrodo Normal de Hidrogeno y sistemas de referencia • Potenciostato (instrumentación) • Factores que alteran la velocidad del proceso: • Transferencia de carga (BV) • Transferencia de masa (Nernst-Planck) • Leyes de Fick 36

Transporte de masa Difusión Migración Convección Otros factores influirán en J(x) total (Rxns químicas, adsorción, presencia de nuevas fases, etc. ) Ecuación de Nernst-Planck 37

Leyes de Fick Condiciones de distribución espacial de concentración Condiciones de distribución temporal de concentración xk: k-ésima coordenada espacial de distribución 38

Difusión en una sola dimensión = 0 No hay transformación (i=0) 0 Hay transformación (i 0) = 0 Flujo constante (Estado estacionario) 0 Flujo variable (Estado no estacionario, “transient techniques”) 39

Fundamentos de electroquímica • Reacciones en disolución (reacciones redox) • Celda electroquímica • Reacción electroquímica • Potenciometría de corriente nula • Electrodo Normal de Hidrógeno y sistemas de referencia • Potenciostato (instrumentación) • Factores que alteran la velocidad del proceso: • Transferencia de carga (BV) • Transferencia de masa (Nernst-Planck) • Leyes de Fick 40

41

42

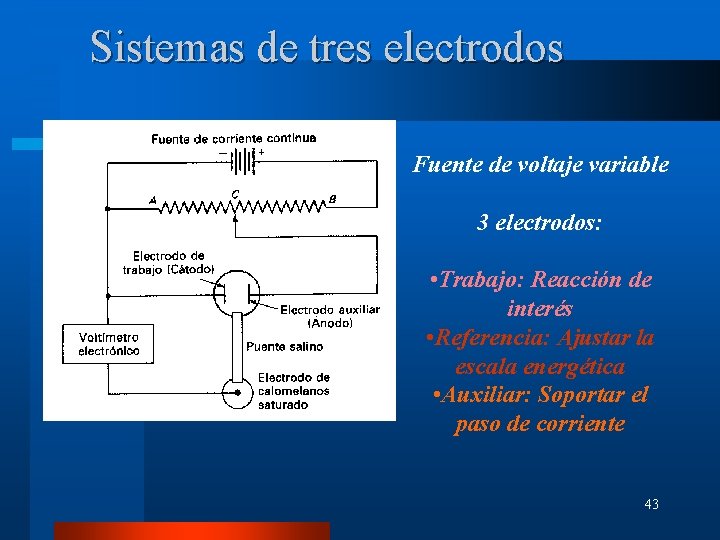
Sistemas de tres electrodos Fuente de voltaje variable 3 electrodos: • Trabajo: Reacción de interés • Referencia: Ajustar la escala energética • Auxiliar: Soportar el paso de corriente 43

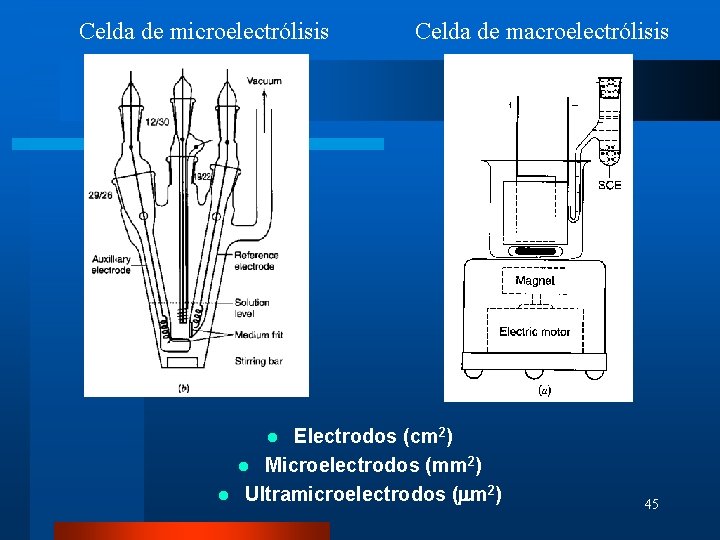
Micro y macroelectrólisis Relaciones Área vs Volumen, Área vs Concentración A/V o A/C bajo Poca electrólisis total (microelectrólisis) (cantidad transformada=2%Co*) A/V o A/C alto Consumo alto de sustancia (macroelectrólisis) (transformación total) Selección del método = f (Eficiencia de transferencia de masa) 44

Celda de microelectrólisis Celda de macroelectrólisis Electrodos (cm 2) l Microelectrodos (mm 2) l Ultramicroelectrodos (mm 2) l 45

Condiciones de validez l No hay transferencia de masa l Conducción iónica Fuente de voltaje variable 3 electrodos: • Trabajo: Reacción de interés • Referencia: Ajustar la escala energética • Auxiliar: Soportar el paso de corriente 46
 Gustavo martnez
Gustavo martnez Laxo areolar
Laxo areolar Tcnicas
Tcnicas Esquema de llaves
Esquema de llaves Tcnicas de estudio
Tcnicas de estudio Tcnicas de estudio
Tcnicas de estudio Metodo de estudio lser caracteristicas
Metodo de estudio lser caracteristicas Gonzlez
Gonzlez Ushader
Ushader Ignacio mora gonzalez
Ignacio mora gonzalez Ignacio hernandez medrano edad
Ignacio hernandez medrano edad Ignacio manuel altamirano romanticismo
Ignacio manuel altamirano romanticismo Colegio ignacio carrera pinto lo prado
Colegio ignacio carrera pinto lo prado Ignacio luzan
Ignacio luzan Llanto por ignacio sanchez mejia
Llanto por ignacio sanchez mejia Pintor peruano el bufon
Pintor peruano el bufon Facultad de ciencias médicas y biológicas umsnh
Facultad de ciencias médicas y biológicas umsnh Ignacio bossi
Ignacio bossi Jose de jesus herrera esquivel
Jose de jesus herrera esquivel Ignacio harrouch
Ignacio harrouch Ley snell
Ley snell Area y perimetro de figuras irregulares
Area y perimetro de figuras irregulares Ignacio saldana
Ignacio saldana Ignacio barcenas
Ignacio barcenas Que todas mis intenciones acciones y operaciones
Que todas mis intenciones acciones y operaciones Juan ignacio villela
Juan ignacio villela 't zand
't zand Clemencia reseña
Clemencia reseña Jorge ignacio celis mejia
Jorge ignacio celis mejia Iglesia san ignacio de loyola
Iglesia san ignacio de loyola 22dpr
22dpr Ignacio taboada
Ignacio taboada Ejercicios espirituales online
Ejercicios espirituales online Ignacio grossmann
Ignacio grossmann Juan ignacio fraschini
Juan ignacio fraschini Soy ignacio me gusta mucho tocar la guitarra in english
Soy ignacio me gusta mucho tocar la guitarra in english Orden religiosa fundada por san ignacio de loyola
Orden religiosa fundada por san ignacio de loyola Fundamentos del futbol
Fundamentos del futbol Fundamentos de handebol
Fundamentos de handebol Fundamentos de la etica cristiana
Fundamentos de la etica cristiana Fundamentos da linguagem visual
Fundamentos da linguagem visual Fundamentos do grego bíblico william mounce
Fundamentos do grego bíblico william mounce Los fundamentos de handball
Los fundamentos de handball Fundamentos de los sistemas operativos
Fundamentos de los sistemas operativos Fundamentos de javascript
Fundamentos de javascript Fundamentos da psicopedagogia
Fundamentos da psicopedagogia Objetivo de baloncesto
Objetivo de baloncesto