ALCANOS Y CICLOALCANOS Q F Mario Olaya Quereval








- Slides: 75

ALCANOS Y CICLOALCANOS Q. F. Mario Olaya Querevalú Trujillo 2009

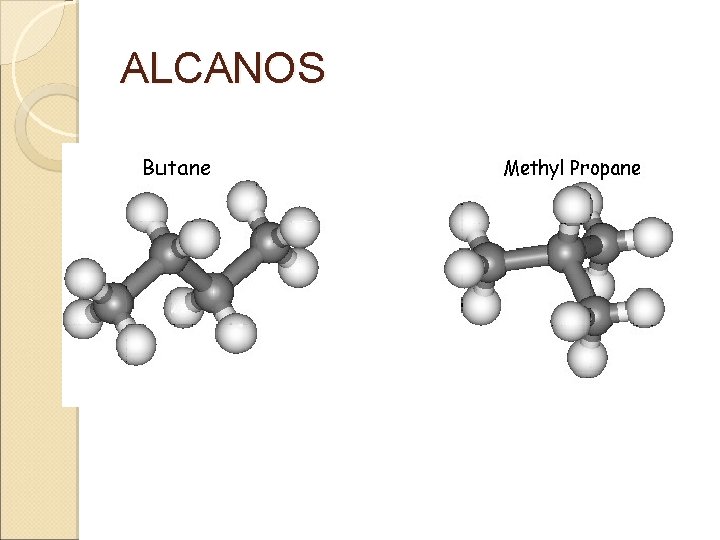
ALCANOS

1. - INTRODUCCIÓN Los alcanos son los hidrocarburos (compuestos de C e H) más simples, no tienen grupo funcional y las uniones entre átomos de carbono (con hibridación sp 3) son enlaces simple. q =109. 5º, d. C-C = 1. 54 Å, d. C-H = 1. 09 Å A pesar de ello son muy importantes porque: su estudio nos permitirá entender el comportamiento del esqueleto de los compuestos orgánicos (conformaciones, formación de radicales) constituyen una de las fuentes de energía y materias primas más importantes para la sociedad actual (petróleo y sus derivados).

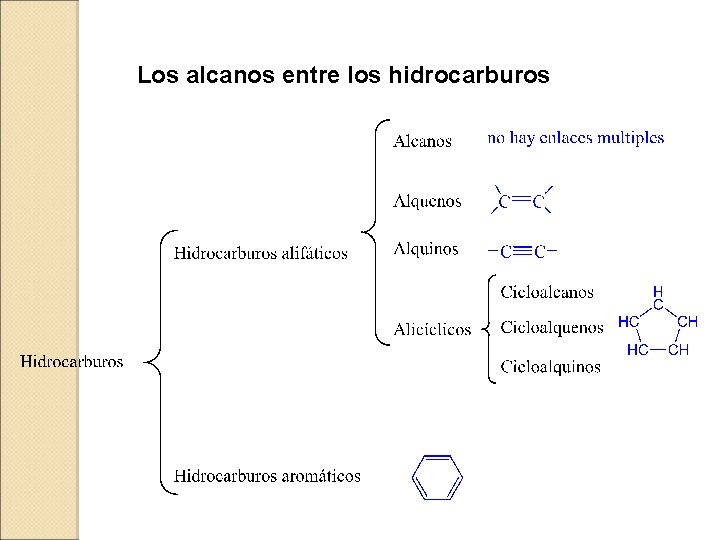
Los alcanos entre los hidrocarburos

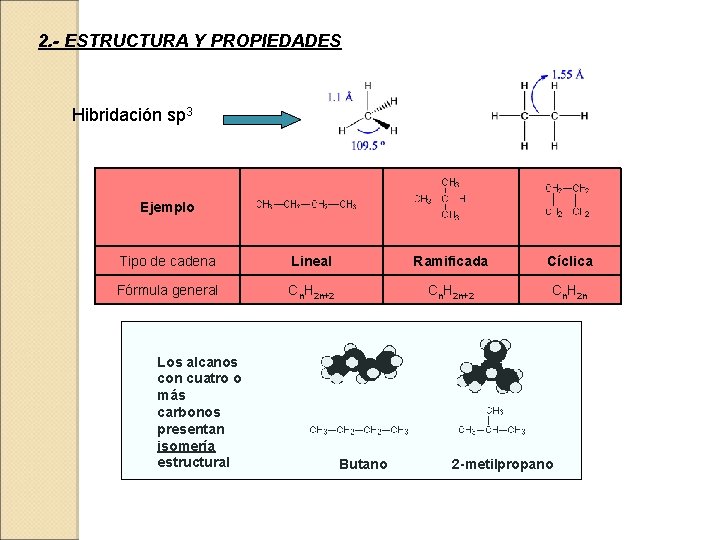
2. - ESTRUCTURA Y PROPIEDADES Hibridación sp 3 Ejemplo Tipo de cadena Lineal Ramificada Cíclica Fórmula general Cn. H 2 n+2 Cn. H 2 n Los alcanos con cuatro o más carbonos presentan isomería estructural Butano 2 -metilpropano

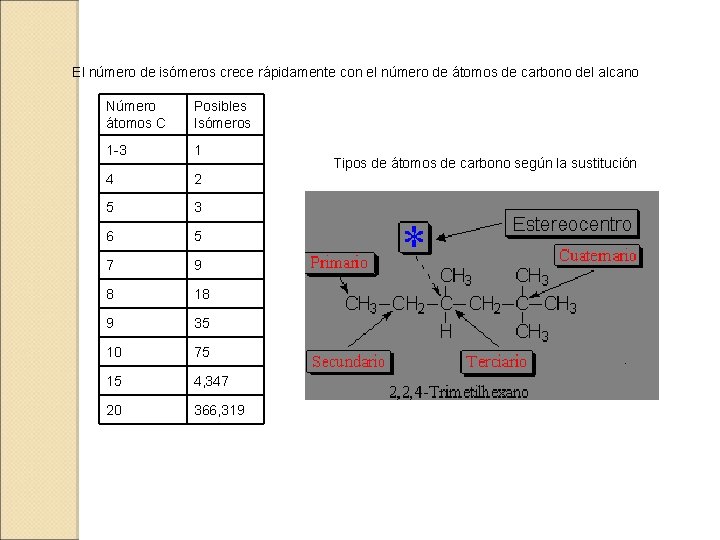
El número de isómeros crece rápidamente con el número de átomos de carbono del alcano Número átomos C Posibles Isómeros 1 -3 1 4 2 5 3 6 5 7 9 8 18 9 35 10 75 15 4, 347 20 366, 319 Tipos de átomos de carbono según la sustitución

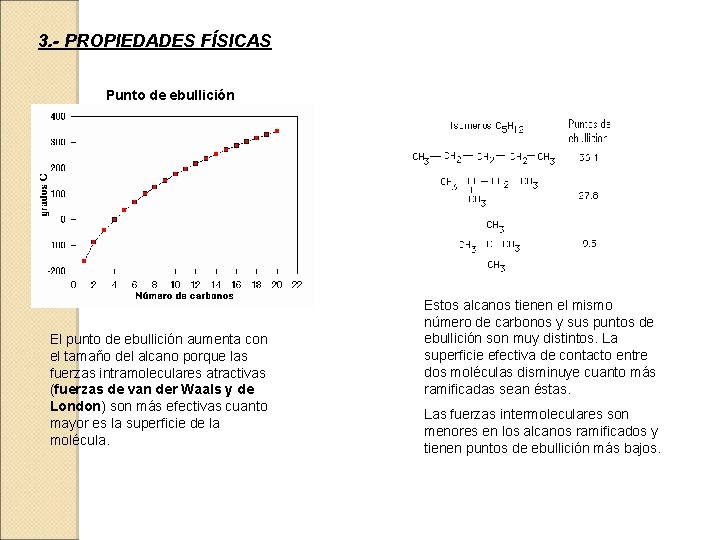
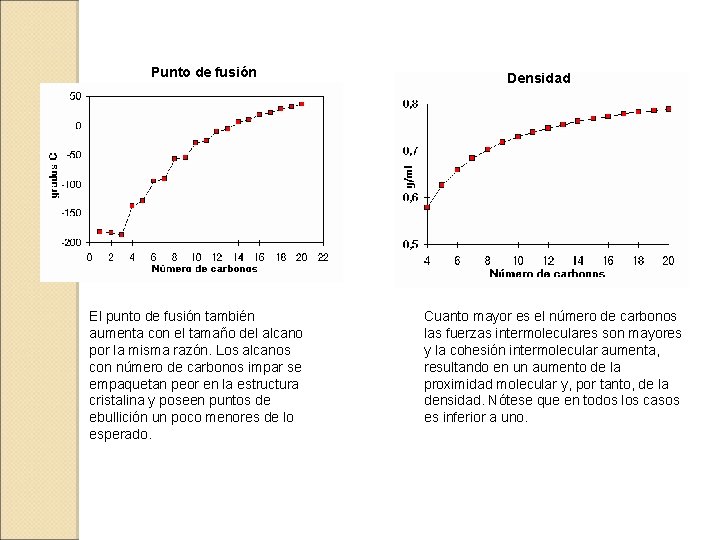
3. - PROPIEDADES FÍSICAS Punto de ebullición El punto de ebullición aumenta con el tamaño del alcano porque las fuerzas intramoleculares atractivas (fuerzas de van der Waals y de London) son más efectivas cuanto mayor es la superficie de la molécula. Estos alcanos tienen el mismo número de carbonos y sus puntos de ebullición son muy distintos. La superficie efectiva de contacto entre dos moléculas disminuye cuanto más ramificadas sean éstas. Las fuerzas intermoleculares son menores en los alcanos ramificados y tienen puntos de ebullición más bajos.

Punto de fusión El punto de fusión también aumenta con el tamaño del alcano por la misma razón. Los alcanos con número de carbonos impar se empaquetan peor en la estructura cristalina y poseen puntos de ebullición un poco menores de lo esperado. Densidad Cuanto mayor es el número de carbonos las fuerzas intermoleculares son mayores y la cohesión intermolecular aumenta, resultando en un aumento de la proximidad molecular y, por tanto, de la densidad. Nótese que en todos los casos es inferior a uno.

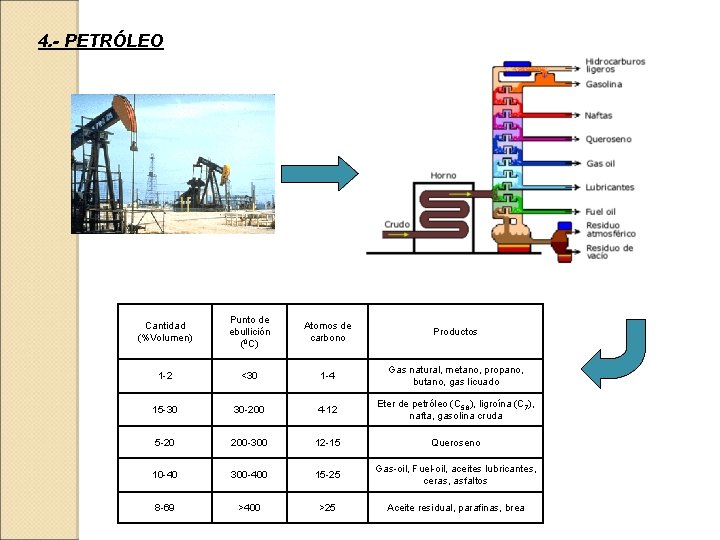
4. - PETRÓLEO Cantidad (%Volumen) Punto de ebullición (0 C) Atomos de carbono Productos 1 -2 <30 1 -4 Gas natural, metano, propano, butano, gas licuado 15 -30 30 -200 4 -12 Eter de petróleo (C 5, 6), ligroína (C 7), nafta, gasolina cruda 5 -20 200 -300 12 -15 Queroseno 10 -40 300 -400 15 -25 Gas-oil, Fuel-oil, aceites lubricantes, ceras, asfaltos 8 -69 >400 >25 Aceite residual, parafinas, brea

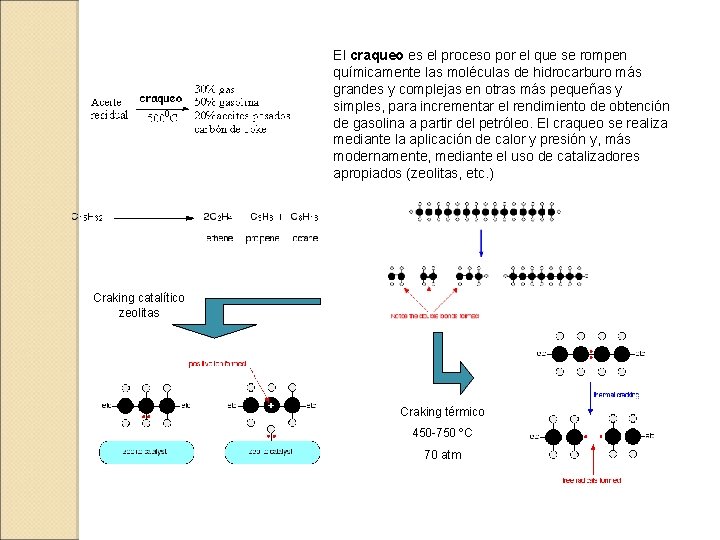
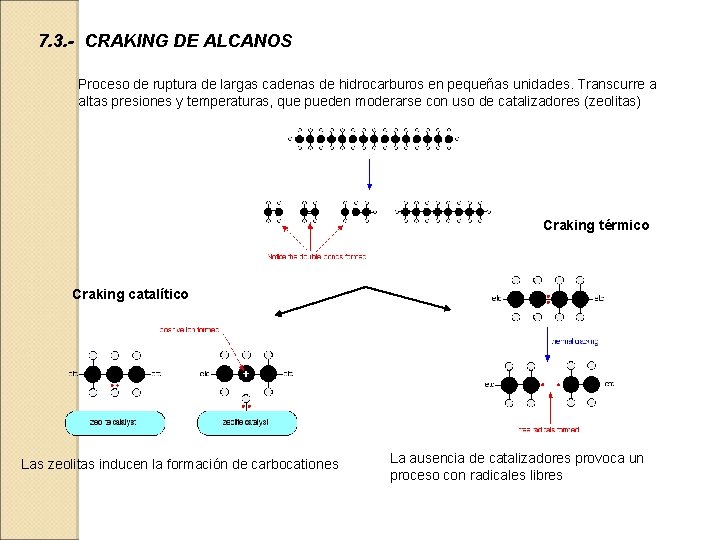
El craqueo es el proceso por el que se rompen químicamente las moléculas de hidrocarburo más grandes y complejas en otras más pequeñas y simples, para incrementar el rendimiento de obtención de gasolina a partir del petróleo. El craqueo se realiza mediante la aplicación de calor y presión y, más modernamente, mediante el uso de catalizadores apropiados (zeolitas, etc. ) Craking catalítico zeolitas Craking térmico 450 -750 ºC 70 atm

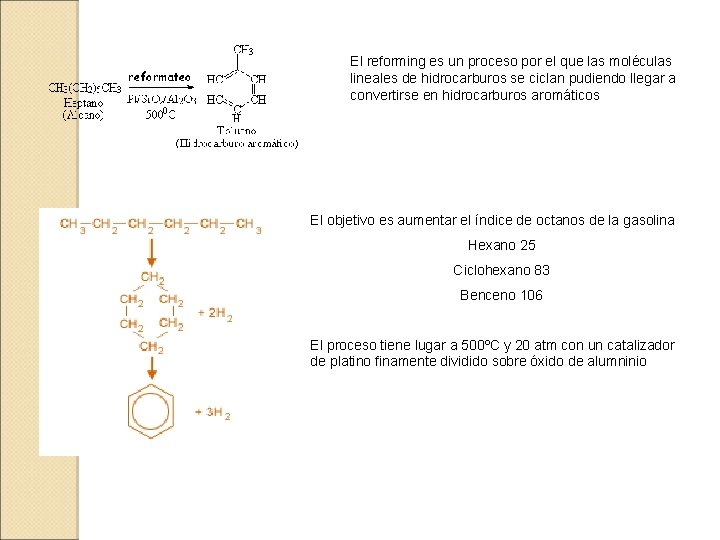
El reforming es un proceso por el que las moléculas lineales de hidrocarburos se ciclan pudiendo llegar a convertirse en hidrocarburos aromáticos El objetivo es aumentar el índice de octanos de la gasolina Hexano 25 Ciclohexano 83 Benceno 106 El proceso tiene lugar a 500ºC y 20 atm con un catalizador de platino finamente dividido sobre óxido de alumninio

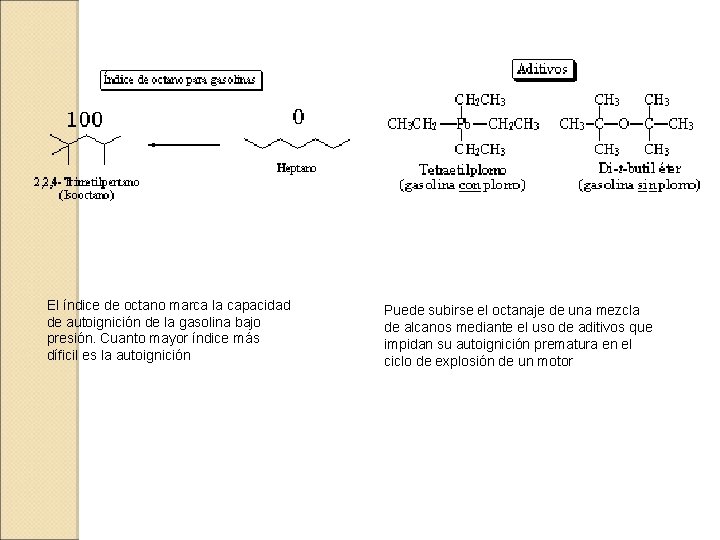
El índice de octano marca la capacidad de autoignición de la gasolina bajo presión. Cuanto mayor índice más díficil es la autoignición Puede subirse el octanaje de una mezcla de alcanos mediante el uso de aditivos que impidan su autoignición prematura en el ciclo de explosión de un motor

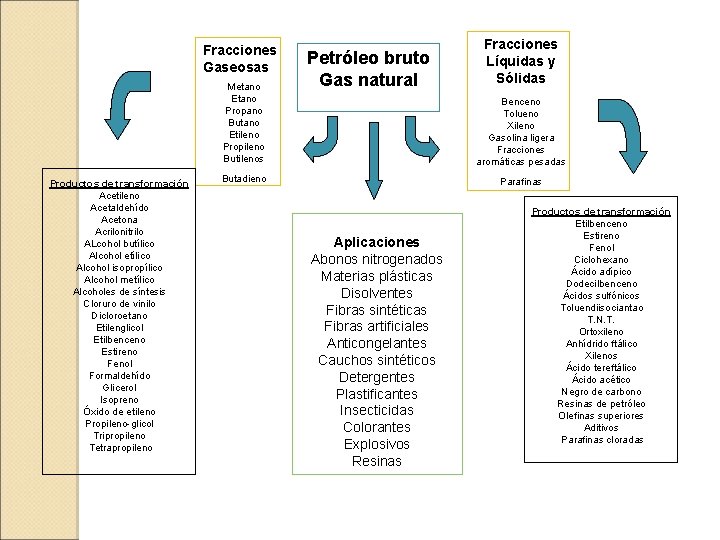
Fracciones Gaseosas Metano Etano Propano Butano Etileno Propileno Butilenos Productos de transformación Acetileno Acetaldehído Acetona Acrilonitrilo ALcohol butílico Alcohol etílico Alcohol isopropílico Alcohol metílico Alcoholes de síntesis Cloruro de vinilo Dicloroetano Etilenglicol Etilbenceno Estireno Fenol Formaldehído Glicerol Isopreno Óxido de etileno Propileno-glicol Tripropileno Tetrapropileno Petróleo bruto Gas natural Fracciones Líquidas y Sólidas Benceno Tolueno Xileno Gasolina ligera Fracciones aromáticas pesadas Butadieno Parafinas Aplicaciones Abonos nitrogenados Materias plásticas Disolventes Fibras sintéticas Fibras artificiales Anticongelantes Cauchos sintéticos Detergentes Plastificantes Insecticidas Colorantes Explosivos Resinas Productos de transformación Etilbenceno Estireno Fenol Ciclohexano Ácido adípico Dodecilbenceno Ácidos sulfónicos Toluendiisociantao T. N. T. Ortoxileno Anhídrido ftálico Xilenos Ácido tereftálico Ácido acético Negro de carbono Resinas de petróleo Olefinas superiores Aditivos Parafinas cloradas

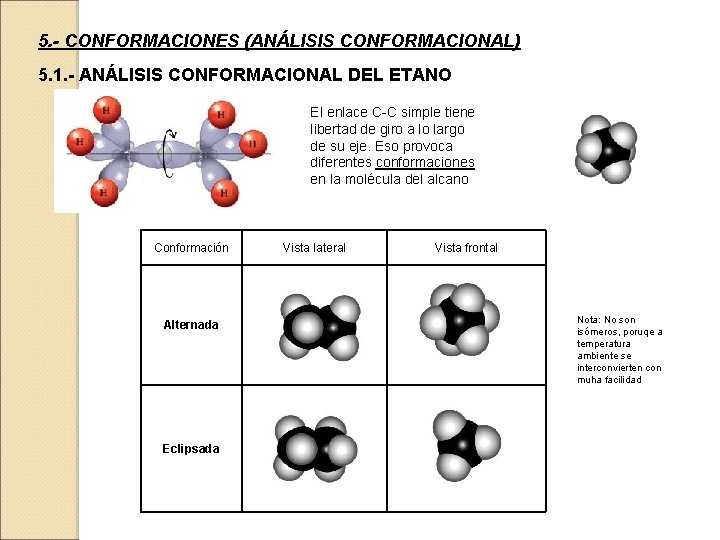
5. - CONFORMACIONES (ANÁLISIS CONFORMACIONAL) 5. 1. - ANÁLISIS CONFORMACIONAL DEL ETANO El enlace C-C simple tiene libertad de giro a lo largo de su eje. Eso provoca diferentes conformaciones en la molécula del alcano Conformación Vista lateral Vista frontal Alternada Eclipsada Nota: No son isómeros, poruqe a temperatura ambiente se interconvierten con muha facilidad

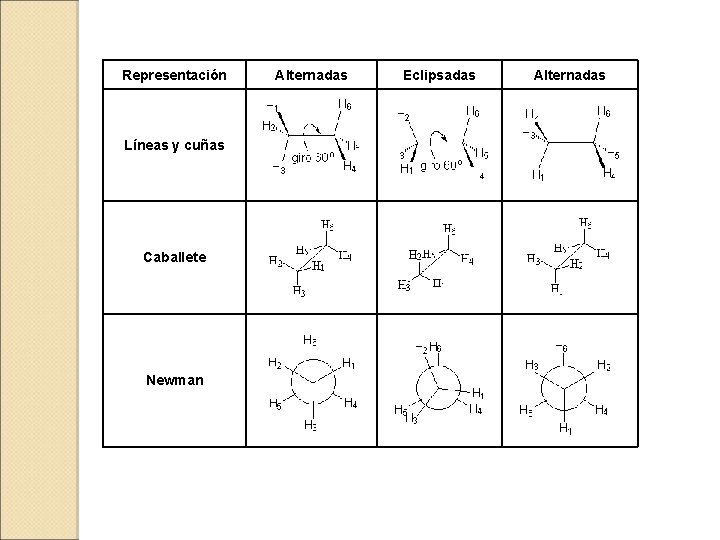
Representación Alternadas Eclipsadas Alternadas Líneas y cuñas Caballete Newman

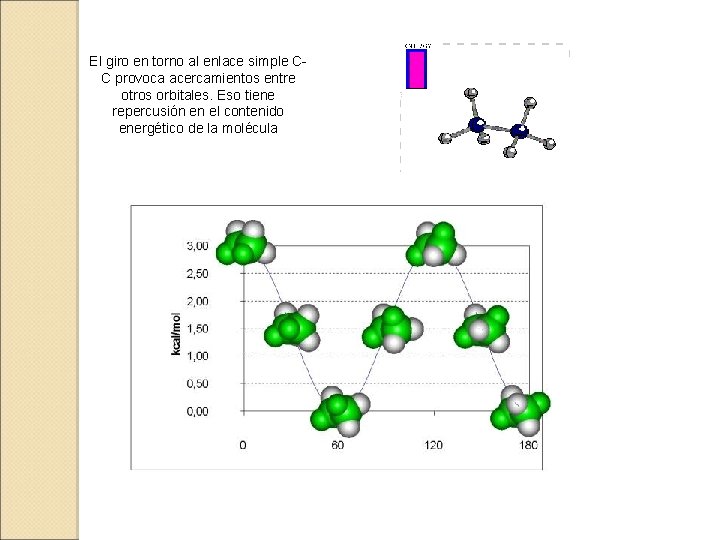
El giro en torno al enlace simple CC provoca acercamientos entre otros orbitales. Eso tiene repercusión en el contenido energético de la molécula


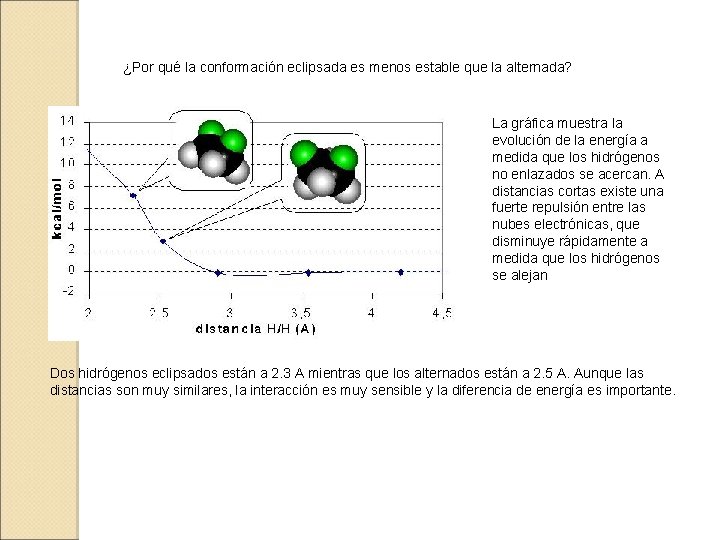
¿Por qué la conformación eclipsada es menos estable que la alternada? La gráfica muestra la evolución de la energía a medida que los hidrógenos no enlazados se acercan. A distancias cortas existe una fuerte repulsión entre las nubes electrónicas, que disminuye rápidamente a medida que los hidrógenos se alejan Dos hidrógenos eclipsados están a 2. 3 A mientras que los alternados están a 2. 5 A. Aunque las distancias son muy similares, la interacción es muy sensible y la diferencia de energía es importante.

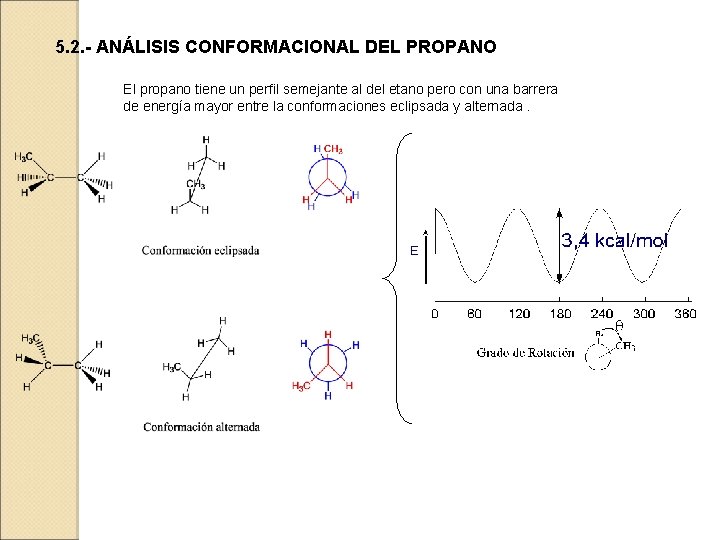
5. 2. - ANÁLISIS CONFORMACIONAL DEL PROPANO El propano tiene un perfil semejante al del etano pero con una barrera de energía mayor entre la conformaciones eclipsada y alternada.

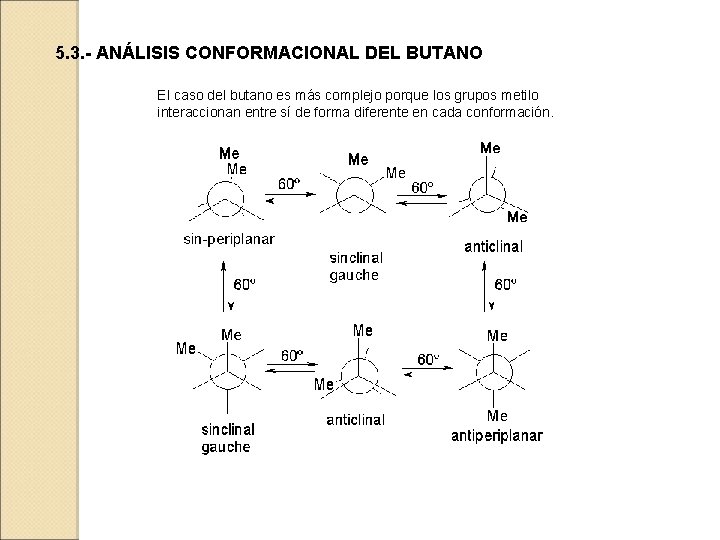
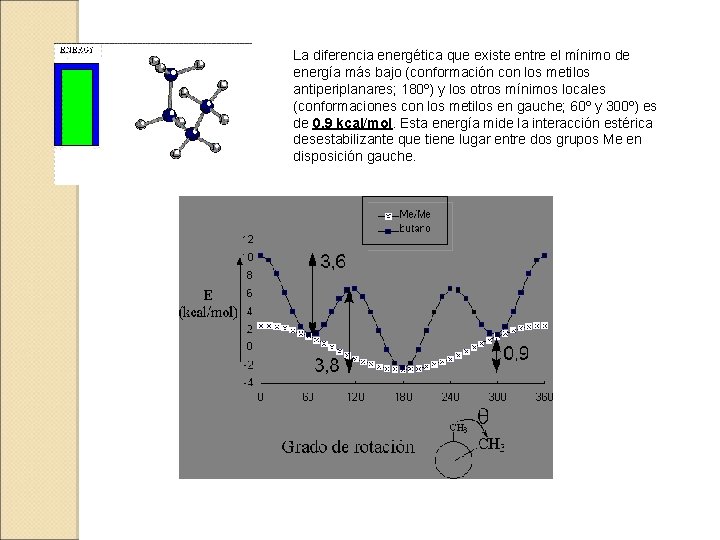
5. 3. - ANÁLISIS CONFORMACIONAL DEL BUTANO El caso del butano es más complejo porque los grupos metilo interaccionan entre sí de forma diferente en cada conformación.

La diferencia energética que existe entre el mínimo de energía más bajo (conformación con los metilos antiperiplanares; 180º) y los otros mínimos locales (conformaciones con los metilos en gauche; 60º y 300º) es de 0. 9 kcal/mol. Esta energía mide la interacción estérica desestabilizante que tiene lugar entre dos grupos Me en disposición gauche.

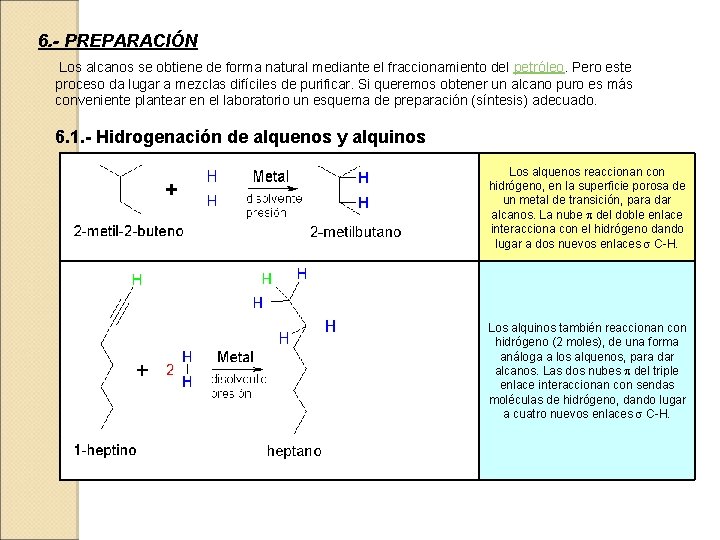
6. - PREPARACIÓN Los alcanos se obtiene de forma natural mediante el fraccionamiento del petróleo. Pero este proceso da lugar a mezclas difíciles de purificar. Si queremos obtener un alcano puro es más conveniente plantear en el laboratorio un esquema de preparación (síntesis) adecuado. 6. 1. - Hidrogenación de alquenos y alquinos Los alquenos reaccionan con hidrógeno, en la superficie porosa de un metal de transición, para dar alcanos. La nube p del doble enlace interacciona con el hidrógeno dando lugar a dos nuevos enlaces s C-H. Los alquinos también reaccionan con hidrógeno (2 moles), de una forma análoga a los alquenos, para dar alcanos. Las dos nubes p del triple enlace interaccionan con sendas moléculas de hidrógeno, dando lugar a cuatro nuevos enlaces s C-H.

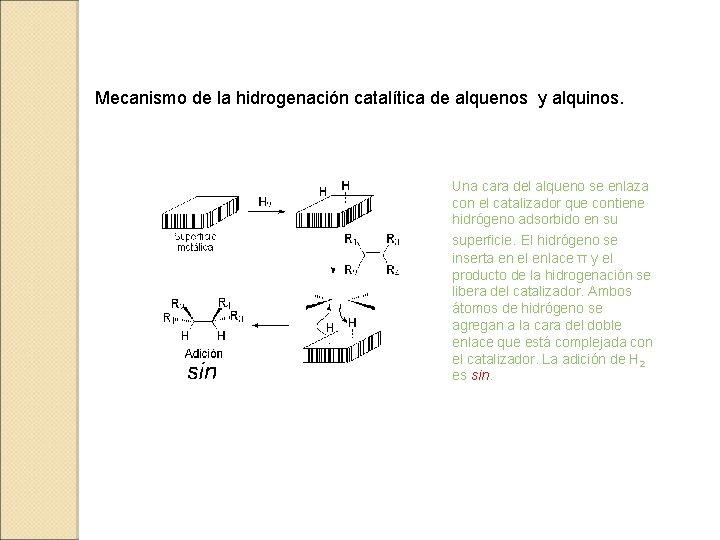
Mecanismo de la hidrogenación catalítica de alquenos y alquinos. Una cara del alqueno se enlaza con el catalizador que contiene hidrógeno adsorbido en su superficie. El hidrógeno se inserta en el enlace π y el producto de la hidrogenación se libera del catalizador. Ambos átomos de hidrógeno se agregan a la cara del doble enlace que está complejada con el catalizador. La adición de H 2 es sin.

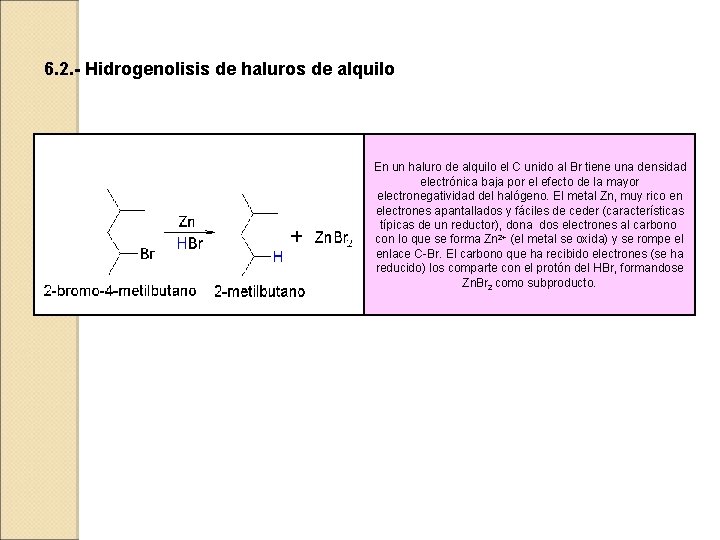
6. 2. - Hidrogenolisis de haluros de alquilo En un haluro de alquilo el C unido al Br tiene una densidad electrónica baja por el efecto de la mayor electronegatividad del halógeno. El metal Zn, muy rico en electrones apantallados y fáciles de ceder (características típicas de un reductor), dona dos electrones al carbono con lo que se forma Zn 2+ (el metal se oxida) y se rompe el enlace C-Br. El carbono que ha recibido electrones (se ha reducido) los comparte con el protón del HBr, formandose Zn. Br 2 como subproducto.

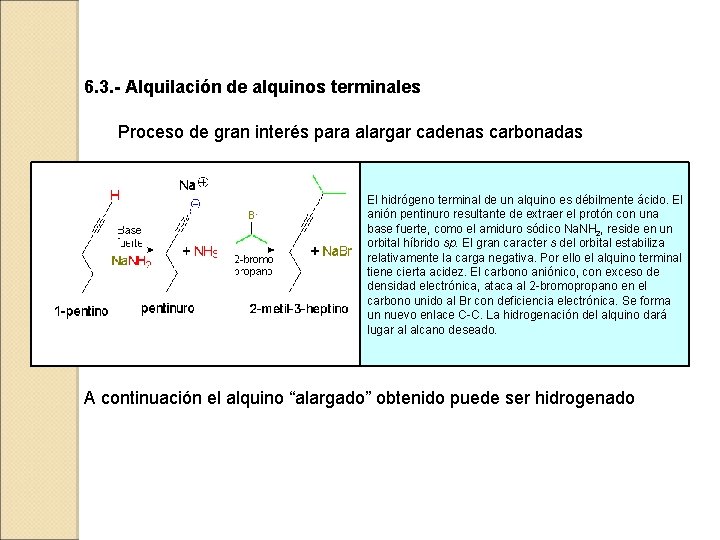
6. 3. - Alquilación de alquinos terminales Proceso de gran interés para alargar cadenas carbonadas El hidrógeno terminal de un alquino es débilmente ácido. El anión pentinuro resultante de extraer el protón con una base fuerte, como el amiduro sódico Na. NH 2, reside en un orbital híbrido sp. El gran caracter s del orbital estabiliza relativamente la carga negativa. Por ello el alquino terminal tiene cierta acidez. El carbono aniónico, con exceso de densidad electrónica, ataca al 2 -bromopropano en el carbono unido al Br con deficiencia electrónica. Se forma un nuevo enlace C-C. La hidrogenación del alquino dará lugar al alcano deseado. A continuación el alquino “alargado” obtenido puede ser hidrogenado

7. - REACTIVIDAD Las reacciones típicas de los alcanos son: Combustión Halogenación Craking

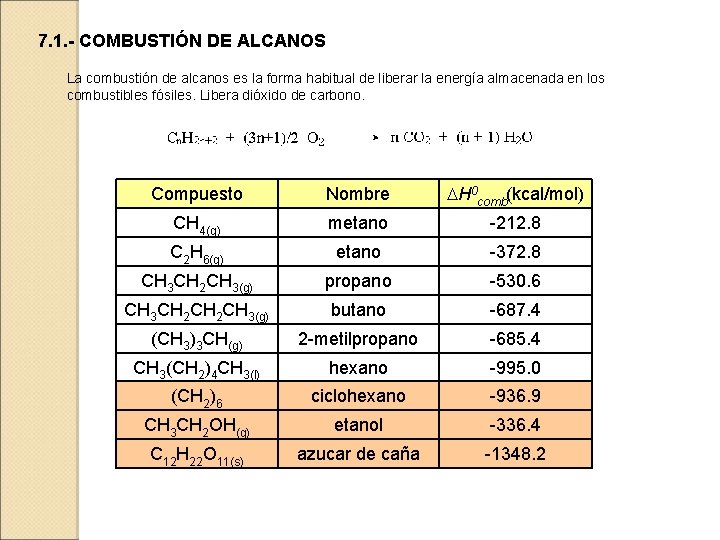
7. 1. - COMBUSTIÓN DE ALCANOS La combustión de alcanos es la forma habitual de liberar la energía almacenada en los combustibles fósiles. Libera dióxido de carbono. Compuesto Nombre DH 0 comb(kcal/mol) CH 4(g) metano -212. 8 C 2 H 6(g) etano -372. 8 CH 3 CH 2 CH 3(g) propano -530. 6 CH 3 CH 2 CH 3(g) butano -687. 4 (CH 3)3 CH(g) 2 -metilpropano -685. 4 CH 3(CH 2)4 CH 3(l) hexano -995. 0 (CH 2)6 ciclohexano -936. 9 CH 3 CH 2 OH(g) etanol -336. 4 C 12 H 22 O 11(s) azucar de caña -1348. 2

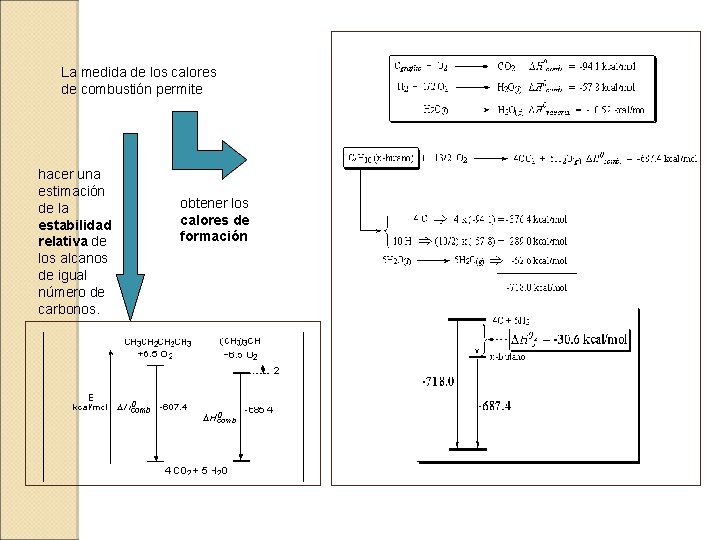
La medida de los calores de combustión permite hacer una estimación de la estabilidad relativa de los alcanos de igual número de carbonos. obtener los calores de formación

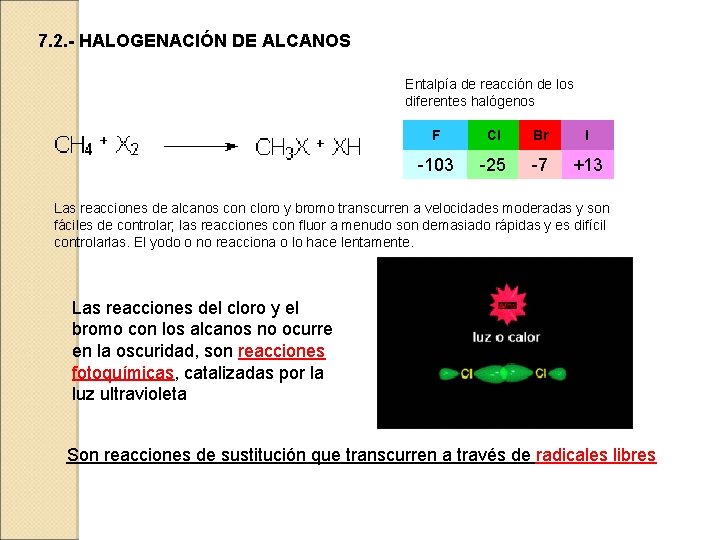
7. 2. - HALOGENACIÓN DE ALCANOS Entalpía de reacción de los diferentes halógenos F Cl Br I -103 -25 -7 +13 Las reacciones de alcanos con cloro y bromo transcurren a velocidades moderadas y son fáciles de controlar; las reacciones con fluor a menudo son demasiado rápidas y es difícil controlarlas. El yodo o no reacciona o lo hace lentamente. Las reacciones del cloro y el bromo con los alcanos no ocurre en la oscuridad, son reacciones fotoquímicas, catalizadas por la luz ultravioleta Son reacciones de sustitución que transcurren a través de radicales libres

7. 2. 1. - CLORACIÓN DEL METANO a pesar de ser exotérmica, la reacción no se produce espontáneamente: se necesita irradiar la mezcla de los gases con luz ultravioleta o “calentar” a 3000 C. ¿Por qué?

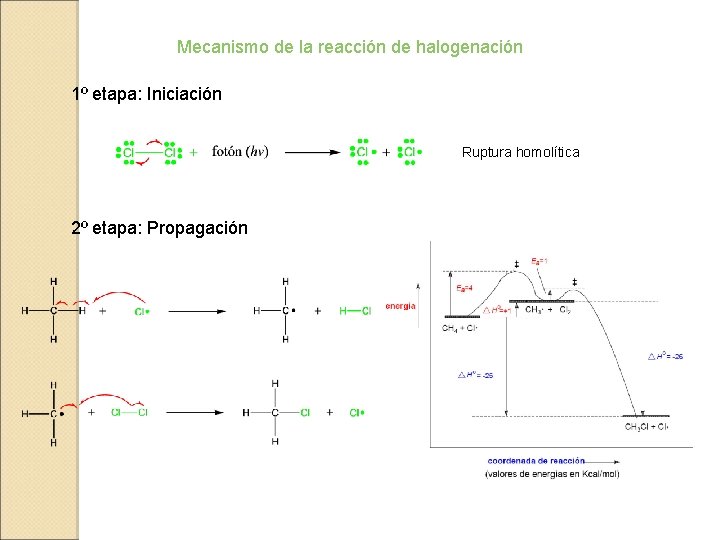
Mecanismo de la reacción de halogenación 1º etapa: Iniciación Ruptura homolítica 2º etapa: Propagación

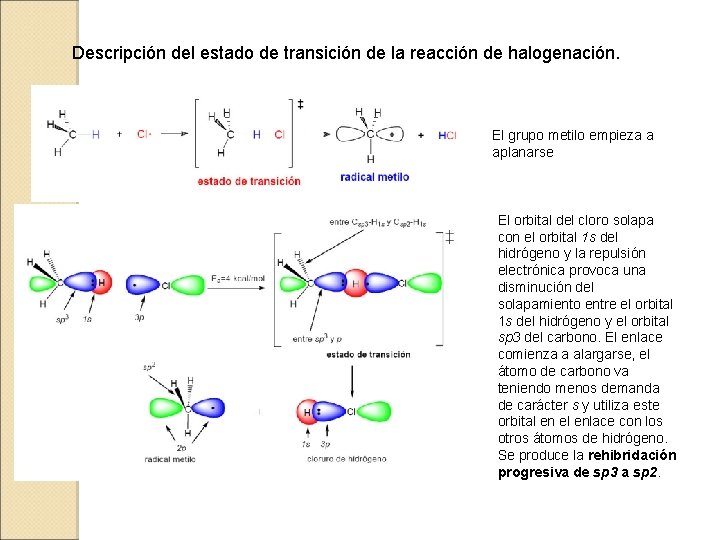
Descripción del estado de transición de la reacción de halogenación. El grupo metilo empieza a aplanarse El orbital del cloro solapa con el orbital 1 s del hidrógeno y la repulsión electrónica provoca una disminución del solapamiento entre el orbital 1 s del hidrógeno y el orbital sp 3 del carbono. El enlace comienza a alargarse, el átomo de carbono va teniendo menos demanda de carácter s y utiliza este orbital en el enlace con los otros átomos de hidrógeno. Se produce la rehibridación progresiva de sp 3 a sp 2.

3º etapa: Terminación Los radicales pueden colapsar entre sí con lo que evitan la deficiencia electrónica. Pero, como son especies que están en muy baja concentración por ser difíciles de producir y muy reactivas, la probabilidad de que colapsen es muy baja. Sin embargo, la obtención de trazas de etano prueba la formación del radical ·CH 3 y apoya el mecanismo propuesto.

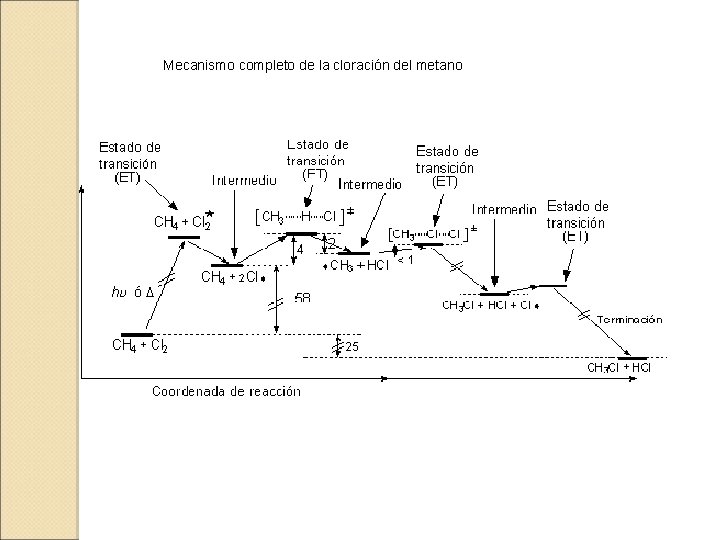
Mecanismo completo de la cloración del metano

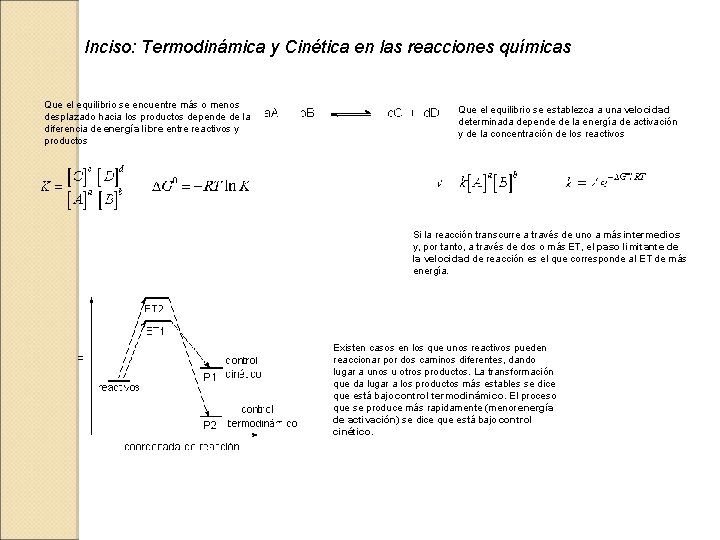
Inciso: Termodinámica y Cinética en las reacciones químicas Que el equilibrio se encuentre más o menos desplazado hacia los productos depende de la diferencia de energía libre entre reactivos y productos Que el equilibrio se establezca a una velocidad determinada depende de la energía de activación y de la concentración de los reactivos Si la reacción transcurre a través de uno a más intermedios y, por tanto, a través de dos o más ET, el paso limitante de la velocidad de reacción es el que corresponde al ET de más energía. Existen casos en los que unos reactivos pueden reaccionar por dos caminos diferentes, dando lugar a unos u otros productos. La transformación que da lugar a los productos más estables se dice que está bajo control termodinámico. El proceso que se produce más rapidamente (menor energía de activación) se dice que está bajo control cinético.

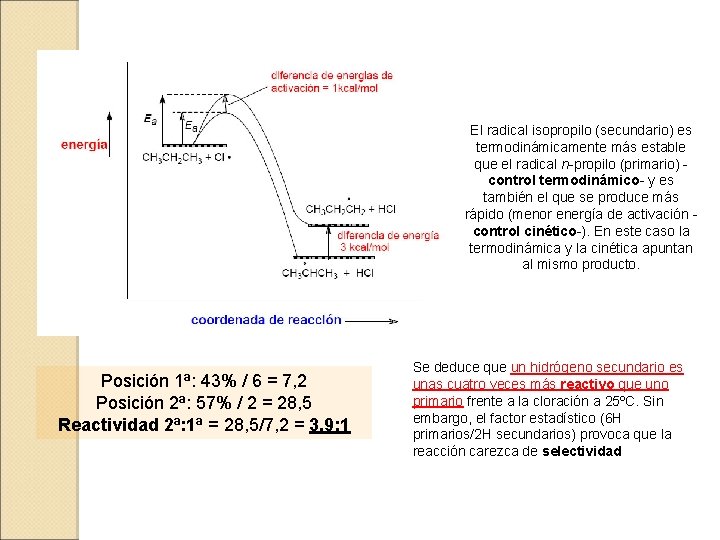
7. 2. 2. - HALOGENACIÓN DE ALCANOS SUPERIORES Cloración del Propano En el caso del propano hay dos tipos de hidrógenos: 6 primarios y 2 secundarios. ¿Qué ocurre al hacerlo reaccionar con cloro? ¡ el cloruro de isopropilo se produce en mayor proporción a pesar de que el número de hidrógenos primarios es mayor que el de secundarios ! Explicación: Los radicales secundarios son más estables que los primarios

El radical isopropilo (secundario) es termodinámicamente más estable que el radical n-propilo (primario) control termodinámico- y es también el que se produce más rápido (menor energía de activación control cinético-). En este caso la termodinámica y la cinética apuntan al mismo producto. Posición 1ª: 43% / 6 = 7, 2 Posición 2ª: 57% / 2 = 28, 5 Reactividad 2ª: 1ª = 28, 5/7, 2 = 3, 9: 1 Se deduce que un hidrógeno secundario es unas cuatro veces más reactivo que uno primario frente a la cloración a 25ºC. Sin embargo, el factor estadístico (6 H primarios/2 H secundarios) provoca que la reacción carezca de selectividad

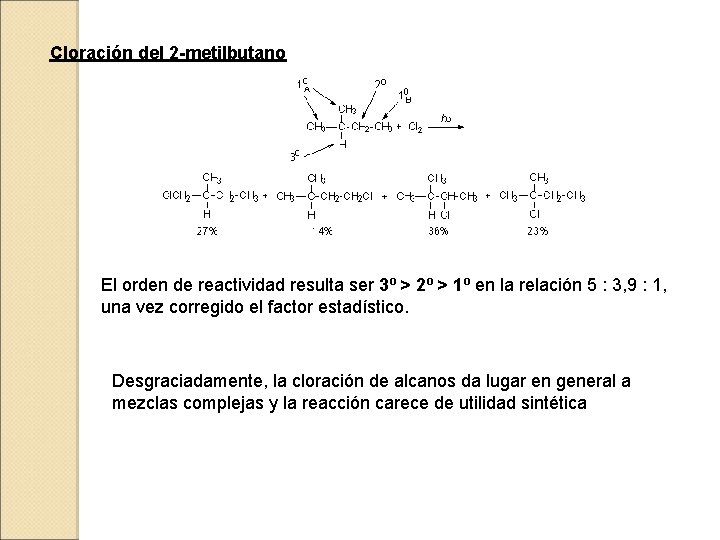
Cloración del 2 -metilbutano El orden de reactividad resulta ser 3º > 2º > 1º en la relación 5 : 3, 9 : 1, una vez corregido el factor estadístico. Desgraciadamente, la cloración de alcanos da lugar en general a mezclas complejas y la reacción carece de utilidad sintética

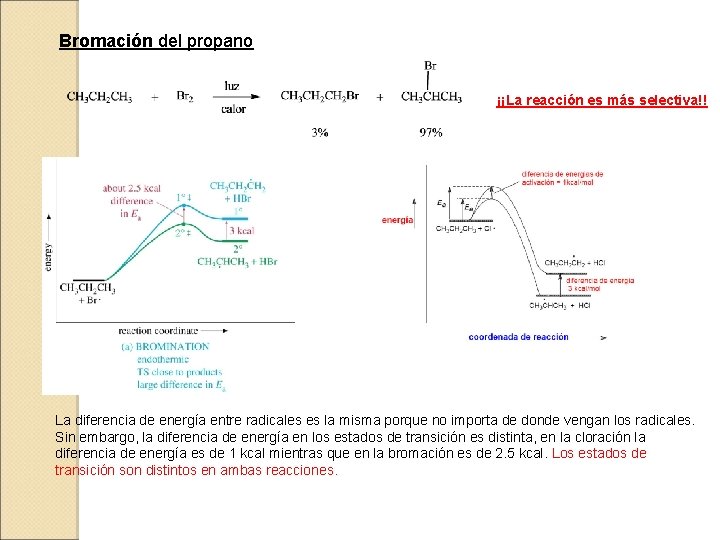
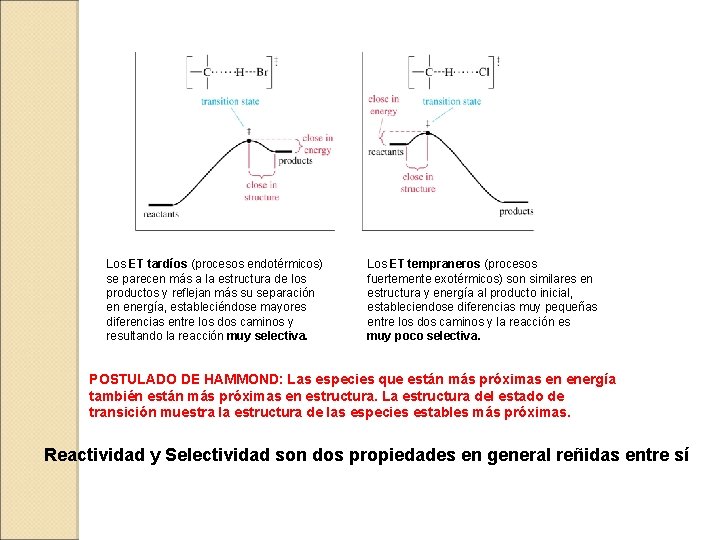
Bromación del propano ¡¡La reacción es más selectiva!! La diferencia de energía entre radicales es la misma porque no importa de donde vengan los radicales. Sin embargo, la diferencia de energía en los estados de transición es distinta, en la cloración la diferencia de energía es de 1 kcal mientras que en la bromación es de 2. 5 kcal. Los estados de transición son distintos en ambas reacciones.

Los ET tardíos (procesos endotérmicos) se parecen más a la estructura de los productos y reflejan más su separación en energía, estableciéndose mayores diferencias entre los dos caminos y resultando la reacción muy selectiva. Los ET tempraneros (procesos fuertemente exotérmicos) son similares en estructura y energía al producto inicial, estableciendose diferencias muy pequeñas entre los dos caminos y la reacción es muy poco selectiva. POSTULADO DE HAMMOND: Las especies que están más próximas en energía también están más próximas en estructura. La estructura del estado de transición muestra la estructura de las especies estables más próximas. Reactividad y Selectividad son dos propiedades en general reñidas entre sí

Fluoración y Bromación del 2 -metilpropano La reacción de fluoración es exotérmica y por tanto el estado de transición está más próximo a los reactivos en energía y estructura por lo que la reacción es poco selectiva.

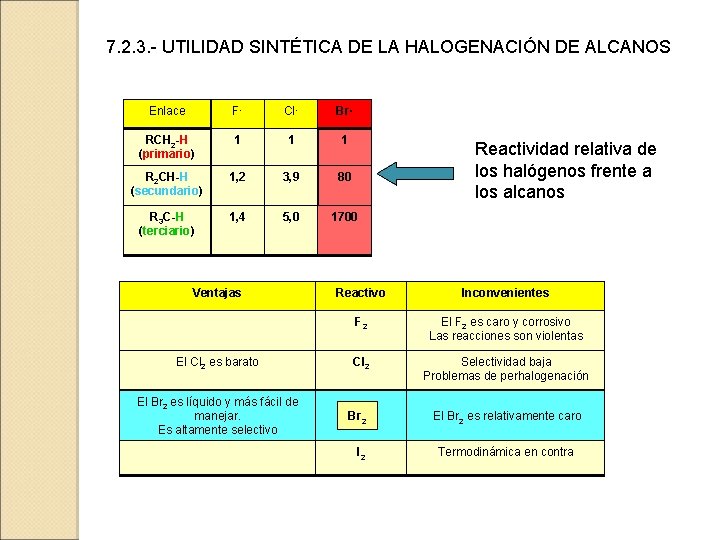
7. 2. 3. - UTILIDAD SINTÉTICA DE LA HALOGENACIÓN DE ALCANOS Enlace F· Cl· Br· RCH 2 -H (primario) 1 1 1 R 2 CH-H (secundario) 1, 2 3, 9 80 R 3 C-H (terciario) 1, 4 5, 0 1700 Ventajas El Cl 2 es barato El Br 2 es líquido y más fácil de manejar. Es altamente selectivo Reactividad relativa de los halógenos frente a los alcanos Reactivo Inconvenientes F 2 El F 2 es caro y corrosivo Las reacciones son violentas Cl 2 Selectividad baja Problemas de perhalogenación Br 2 I 2 El Br 2 es relativamente caro Termodinámica en contra

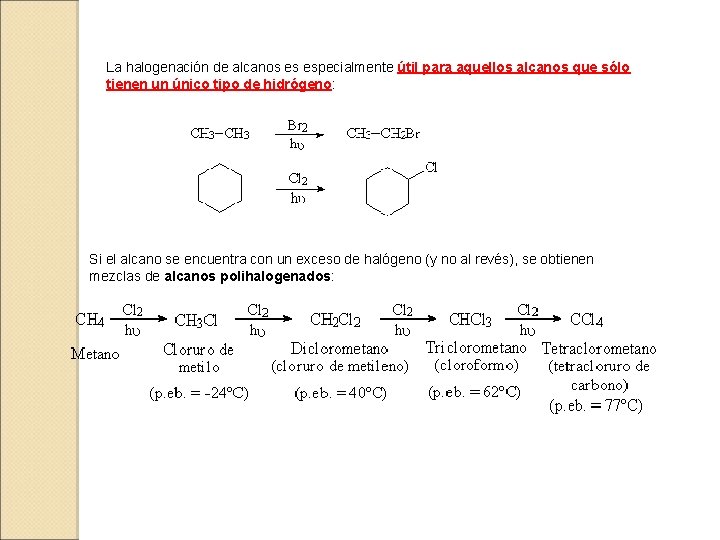
La halogenación de alcanos es especialmente útil para aquellos alcanos que sólo tienen un único tipo de hidrógeno: Si el alcano se encuentra con un exceso de halógeno (y no al revés), se obtienen mezclas de alcanos polihalogenados:

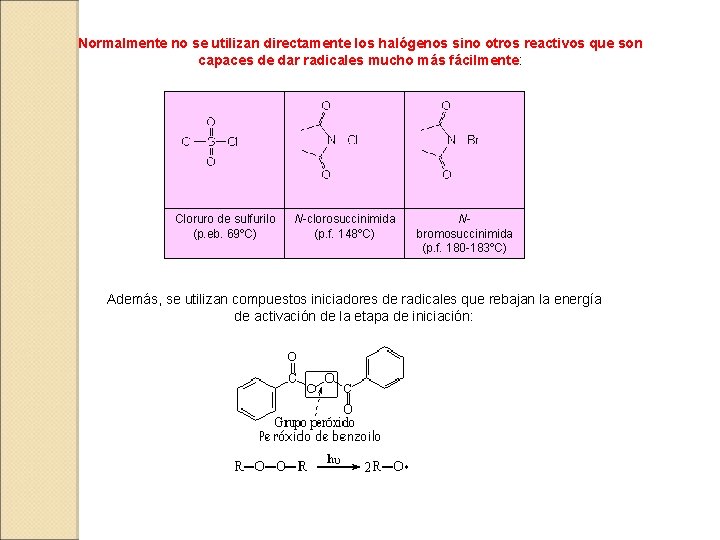
Normalmente no se utilizan directamente los halógenos sino otros reactivos que son capaces de dar radicales mucho más fácilmente: Cloruro de sulfurilo (p. eb. 69ºC) N-clorosuccinimida (p. f. 148ºC) Nbromosuccinimida (p. f. 180 -183ºC) Además, se utilizan compuestos iniciadores de radicales que rebajan la energía de activación de la etapa de iniciación:

7. 3. - CRAKING DE ALCANOS Proceso de ruptura de largas cadenas de hidrocarburos en pequeñas unidades. Transcurre a altas presiones y temperaturas, que pueden moderarse con uso de catalizadores (zeolitas) Craking térmico Craking catalítico Las zeolitas inducen la formación de carbocationes La ausencia de catalizadores provoca un proceso con radicales libres

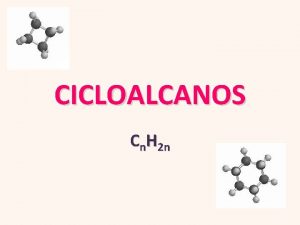
CICLOALCANOS

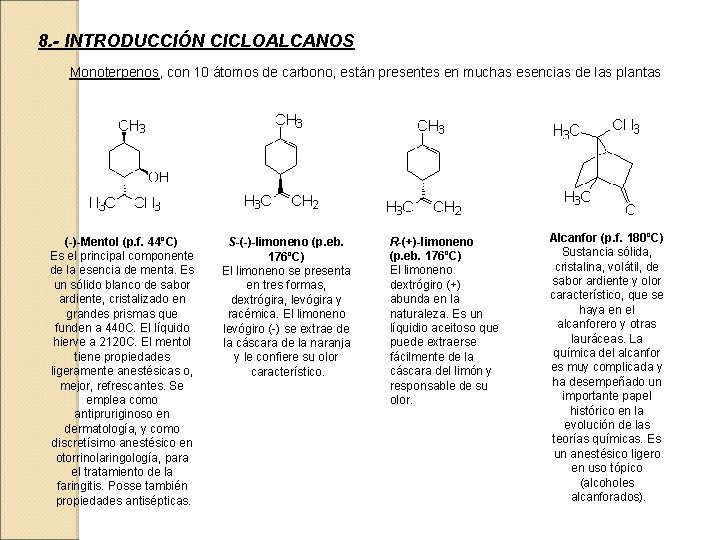
8. - INTRODUCCIÓN CICLOALCANOS Monoterpenos, con 10 átomos de carbono, están presentes en muchas esencias de las plantas (-)-Mentol (p. f. 44ºC) Es el principal componente de la esencia de menta. Es un sólido blanco de sabor ardiente, cristalizado en grandes prismas que funden a 440 C. El líquido hierve a 2120 C. El mentol tiene propiedades ligeramente anestésicas o, mejor, refrescantes. Se emplea como antipruriginoso en dermatología, y como discretísimo anestésico en otorrinolaringología, para el tratamiento de la faringitis. Posse también propiedades antisépticas. S-(-)-limoneno (p. eb. 176ºC) El limoneno se presenta en tres formas, dextrógira, levógira y racémica. El limoneno levógiro (-) se extrae de la cáscara de la naranja y le confiere su olor característico. R-(+)-limoneno (p. eb. 176ºC) El limoneno dextrógiro (+) abunda en la naturaleza. Es un líquidio aceitoso que puede extraerse fácilmente de la cáscara del limón y responsable de su olor. Alcanfor (p. f. 180ºC) Sustancia sólida, cristalina, volátil, de sabor ardiente y olor característico, que se haya en el alcanforero y otras lauráceas. La química del alcanfor es muy complicada y ha desempeñado un importante papel histórico en la evolución de las teorías químicas. Es un anestésico ligero en uso tópico (alcoholes alcanforados).

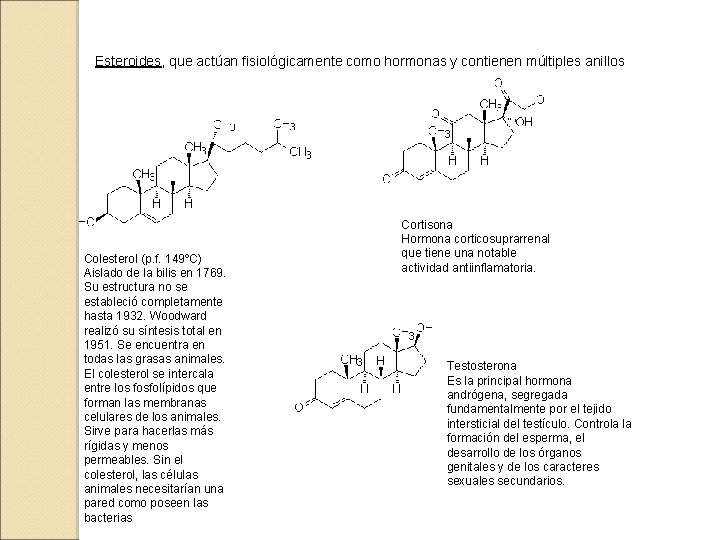
Esteroides, que actúan fisiológicamente como hormonas y contienen múltiples anillos Colesterol (p. f. 149ºC) Aislado de la bilis en 1769. Su estructura no se estableció completamente hasta 1932. Woodward realizó su síntesis total en 1951. Se encuentra en todas las grasas animales. El colesterol se intercala entre los fosfolípidos que forman las membranas celulares de los animales. Sirve para hacerlas más rígidas y menos permeables. Sin el colesterol, las células animales necesitarían una pared como poseen las bacterias Cortisona Hormona corticosuprarrenal que tiene una notable actividad antiinflamatoria. Testosterona Es la principal hormona andrógena, segregada fundamentalmente por el tejido intersticial del testículo. Controla la formación del esperma, el desarrollo de los órganos genitales y de los caracteres sexuales secundarios.

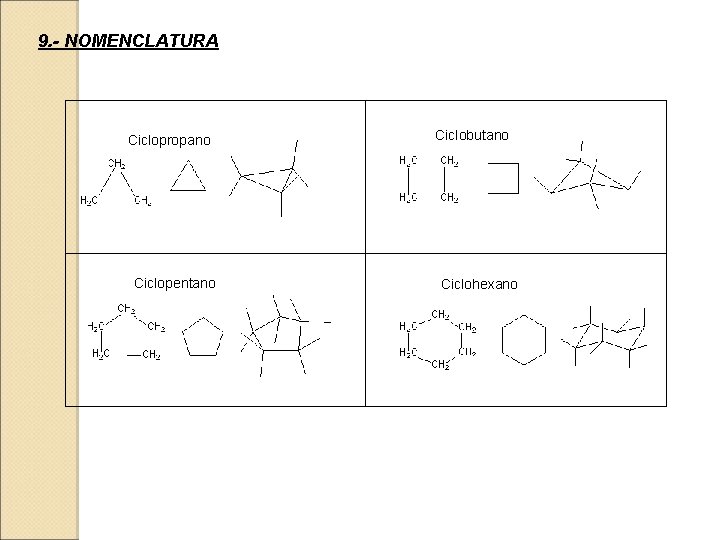
9. - NOMENCLATURA Ciclopropano Ciclopentano Ciclobutano Ciclohexano

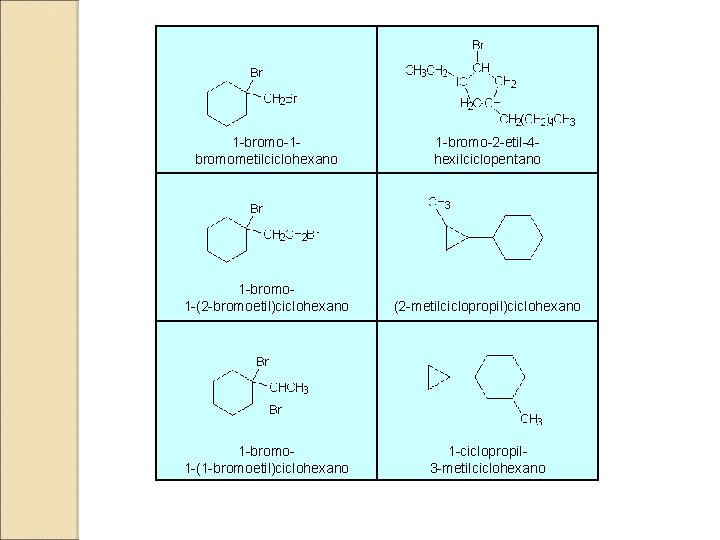
1 -bromo-1 - bromometilciclohexano 1 -bromo-2 -etil-4 - hexilciclopentano 1 -bromo- 1 -(2 -bromoetil)ciclohexano (2 -metilciclopropil)ciclohexano 1 -bromo- 1 -(1 -bromoetil)ciclohexano 1 -ciclopropil- 3 -metilciclohexano

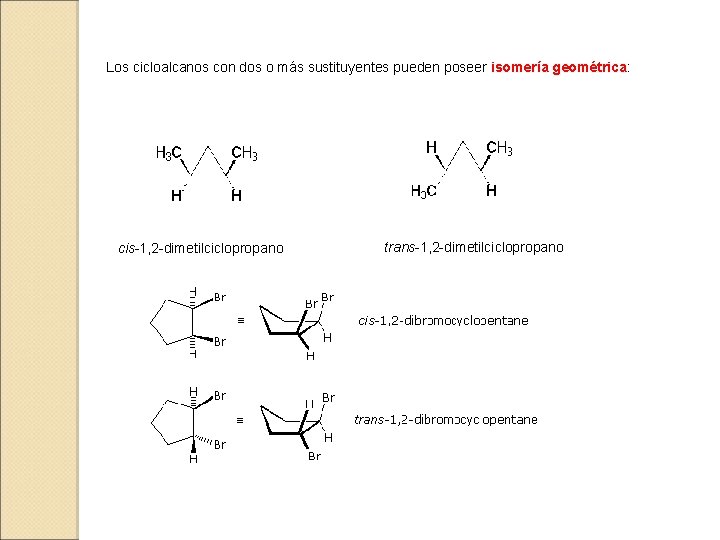
Los cicloalcanos con dos o más sustituyentes pueden poseer isomería geométrica: cis-1, 2 -dimetilciclopropano trans-1, 2 -dimetilciclopropano

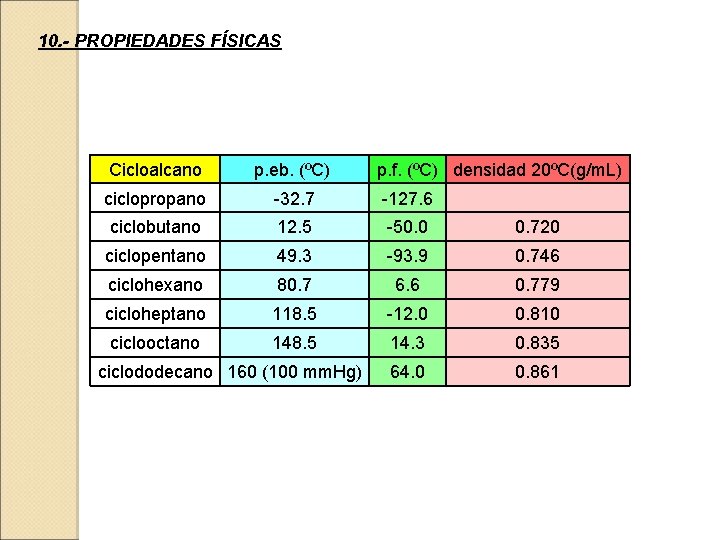
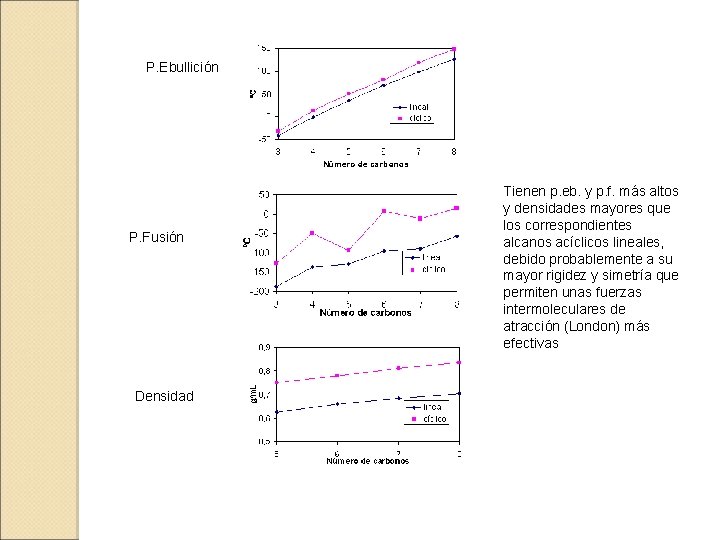
10. - PROPIEDADES FÍSICAS Cicloalcano p. eb. (ºC) ciclopropano -32. 7 -127. 6 ciclobutano 12. 5 -50. 0 0. 720 ciclopentano 49. 3 -93. 9 0. 746 ciclohexano 80. 7 6. 6 0. 779 cicloheptano 118. 5 -12. 0 0. 810 ciclooctano 148. 5 14. 3 0. 835 64. 0 0. 861 ciclododecano 160 (100 mm. Hg) p. f. (ºC) densidad 20ºC(g/m. L)

P. Ebullición P. Fusión Densidad Tienen p. eb. y p. f. más altos y densidades mayores que los correspondientes alcanos acíclicos lineales, debido probablemente a su mayor rigidez y simetría que permiten unas fuerzas intermoleculares de atracción (London) más efectivas

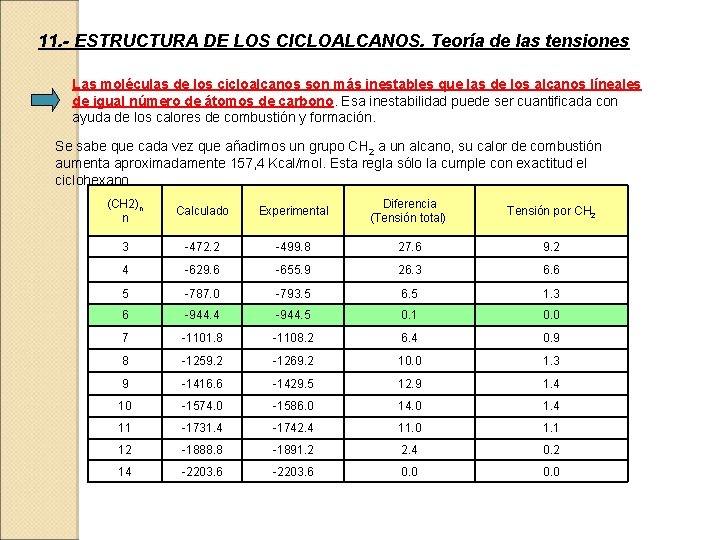
11. - ESTRUCTURA DE LOS CICLOALCANOS. Teoría de las tensiones Las moléculas de los cicloalcanos son más inestables que las de los alcanos líneales de igual número de átomos de carbono. Esa inestabilidad puede ser cuantificada con ayuda de los calores de combustión y formación. Se sabe que cada vez que añadimos un grupo CH 2 a un alcano, su calor de combustión aumenta aproximadamente 157, 4 Kcal/mol. Esta regla sólo la cumple con exactitud el ciclohexano. (CH 2)n n Calculado Experimental Diferencia (Tensión total) Tensión por CH 2 3 -472. 2 -499. 8 27. 6 9. 2 4 -629. 6 -655. 9 26. 3 6. 6 5 -787. 0 -793. 5 6. 5 1. 3 6 -944. 4 -944. 5 0. 1 0. 0 7 -1101. 8 -1108. 2 6. 4 0. 9 8 -1259. 2 -1269. 2 10. 0 1. 3 9 -1416. 6 -1429. 5 12. 9 1. 4 10 -1574. 0 -1586. 0 14. 0 1. 4 11 -1731. 4 -1742. 4 11. 0 1. 1 12 -1888. 8 -1891. 2 2. 4 0. 2 14 -2203. 6 0. 0

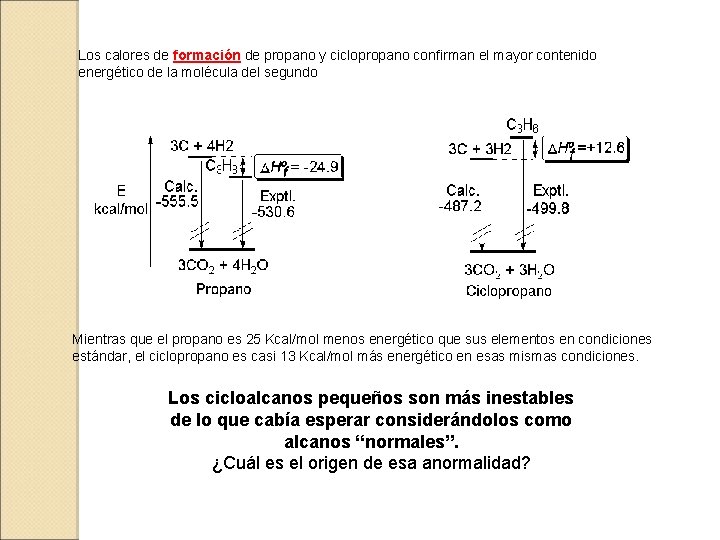
En el caso del ciclopropano la combustión es más exotérmica de lo esperado. Esto quiere decir que la molécula de ciclopropano es más energética de lo esperado. En otras palabras: la molécula de ciclopropano es menos estable de lo esperado.

Los calores de formación de propano y ciclopropano confirman el mayor contenido energético de la molécula del segundo Mientras que el propano es 25 Kcal/mol menos energético que sus elementos en condiciones estándar, el ciclopropano es casi 13 Kcal/mol más energético en esas mismas condiciones. Los cicloalcanos pequeños son más inestables de lo que cabía esperar considerándolos como alcanos “normales”. ¿Cuál es el origen de esa anormalidad?

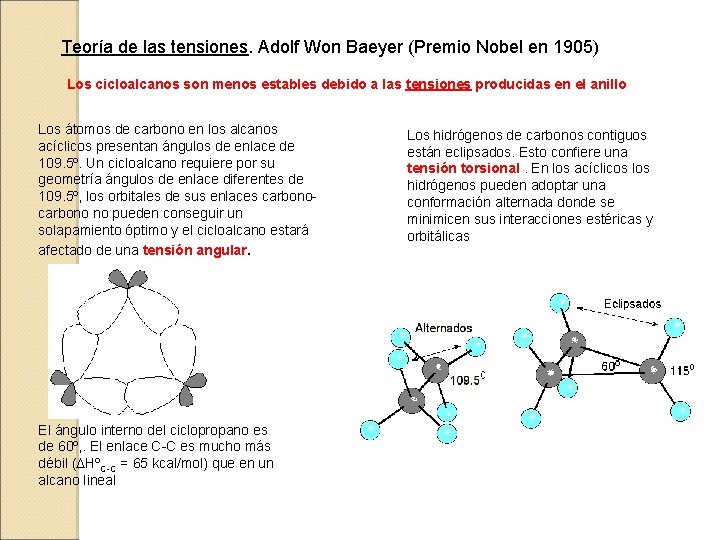
Teoría de las tensiones. Adolf Won Baeyer (Premio Nobel en 1905) Los cicloalcanos son menos estables debido a las tensiones producidas en el anillo Los átomos de carbono en los alcanos acíclicos presentan ángulos de enlace de 109. 5º. Un cicloalcano requiere por su geometría ángulos de enlace diferentes de 109. 5º, los orbitales de sus enlaces carbono no pueden conseguir un solapamiento óptimo y el cicloalcano estará afectado de una tensión angular. El ángulo interno del ciclopropano es de 60º, . El enlace C-C es mucho más débil (DHºC-C = 65 kcal/mol) que en un alcano lineal Los hidrógenos de carbonos contiguos están eclipsados. Esto confiere una tensión torsional. En los acíclicos los hidrógenos pueden adoptar una conformación alternada donde se minimicen sus interacciones estéricas y orbitálicas

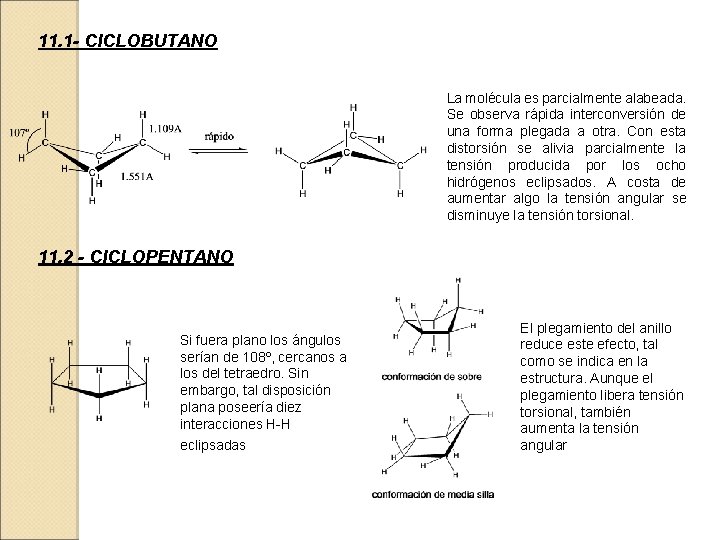
11. 1 - CICLOBUTANO La molécula es parcialmente alabeada. Se observa rápida interconversión de una forma plegada a otra. Con esta distorsión se alivia parcialmente la tensión producida por los ocho hidrógenos eclipsados. A costa de aumentar algo la tensión angular se disminuye la tensión torsional. 11. 2 - CICLOPENTANO Si fuera plano los ángulos serían de 108º, cercanos a los del tetraedro. Sin embargo, tal disposición plana poseería diez interacciones H-H eclipsadas El plegamiento del anillo reduce este efecto, tal como se indica en la estructura. Aunque el plegamiento libera tensión torsional, también aumenta la tensión angular

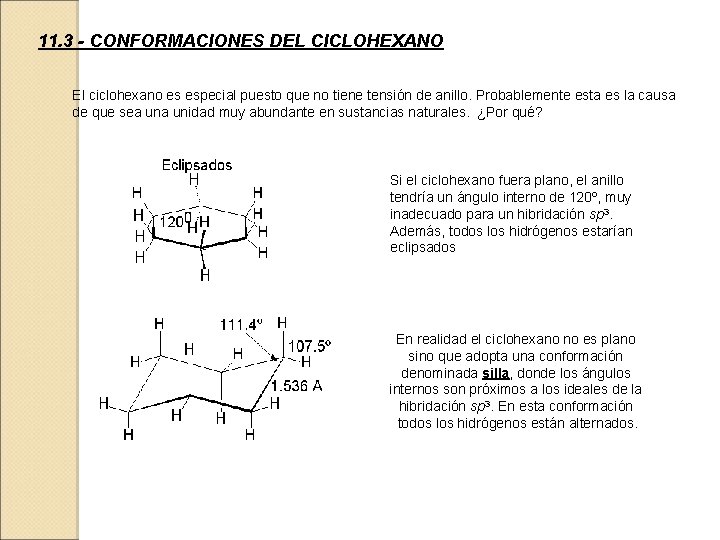
11. 3 - CONFORMACIONES DEL CICLOHEXANO El ciclohexano es especial puesto que no tiene tensión de anillo. Probablemente esta es la causa de que sea unidad muy abundante en sustancias naturales. ¿Por qué? Si el ciclohexano fuera plano, el anillo tendría un ángulo interno de 120º, muy inadecuado para un hibridación sp 3. Además, todos los hidrógenos estarían eclipsados En realidad el ciclohexano no es plano sino que adopta una conformación denominada silla, donde los ángulos internos son próximos a los ideales de la hibridación sp 3. En esta conformación todos los hidrógenos están alternados.

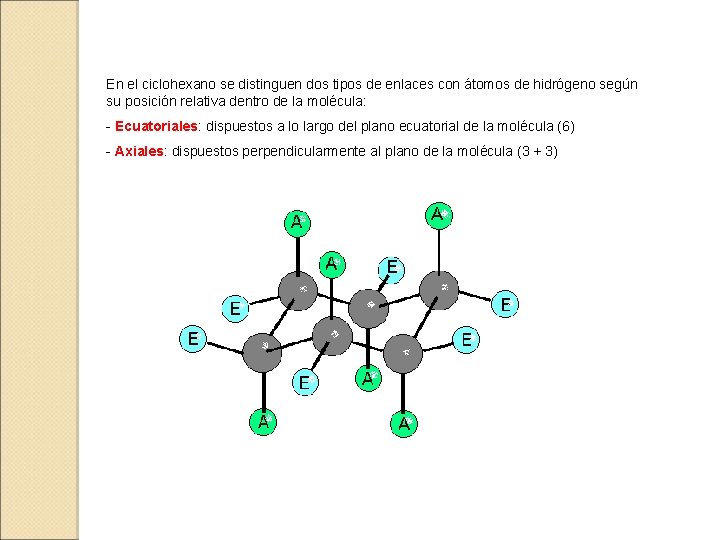
En el ciclohexano se distinguen dos tipos de enlaces con átomos de hidrógeno según su posición relativa dentro de la molécula: - Ecuatoriales: dispuestos a lo largo del plano ecuatorial de la molécula (6) - Axiales: dispuestos perpendicularmente al plano de la molécula (3 + 3)

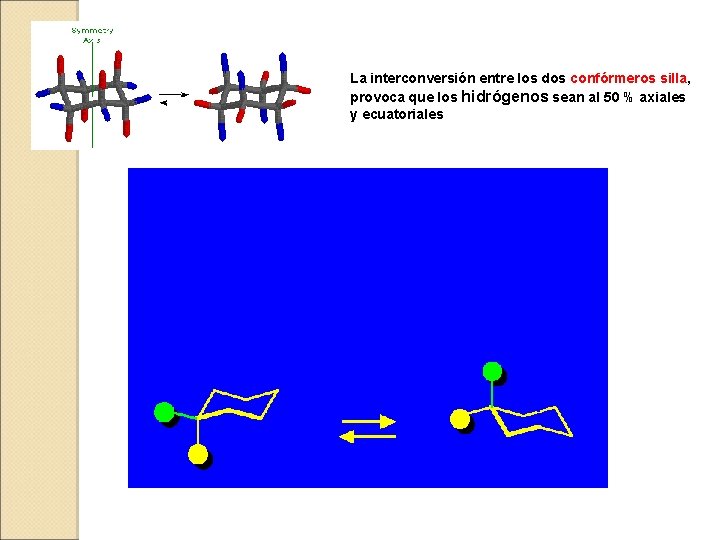
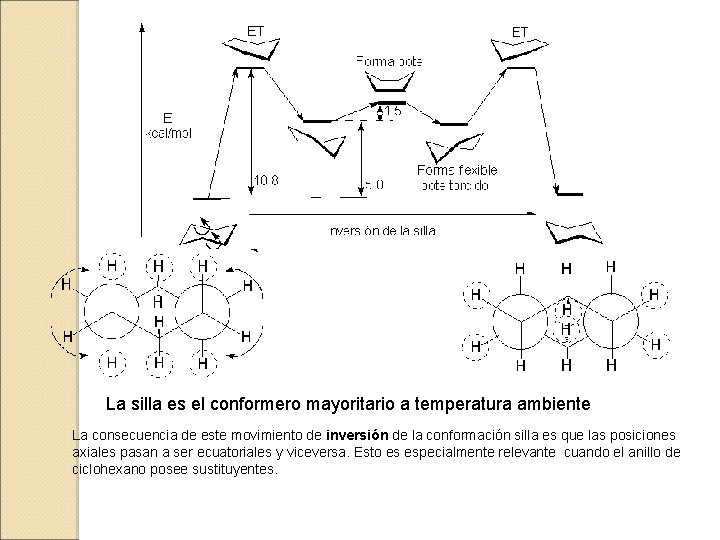
La interconversión entre los dos confórmeros silla, provoca que los hidrógenos sean al 50 % axiales y ecuatoriales

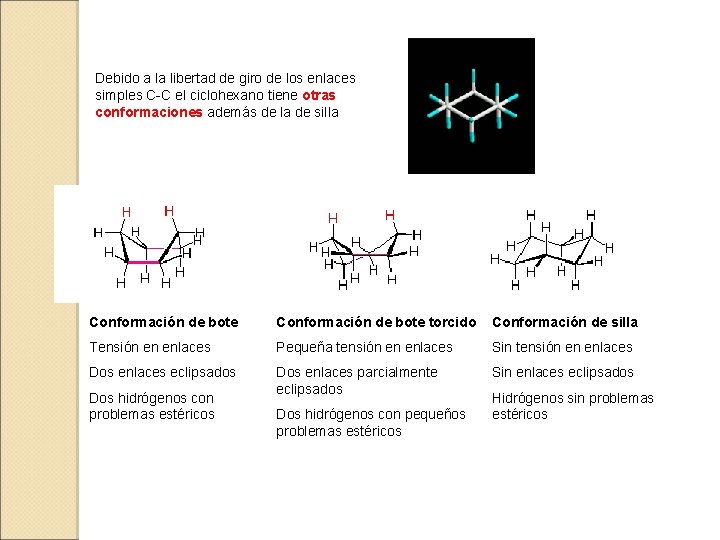
Debido a la libertad de giro de los enlaces simples C-C el ciclohexano tiene otras conformaciones además de la de silla Conformación de bote torcido Conformación de silla Tensión en enlaces Pequeña tensión en enlaces Sin tensión en enlaces Dos enlaces eclipsados Dos enlaces parcialmente eclipsados Sin enlaces eclipsados Dos hidrógenos con problemas estéricos Dos hidrógenos con pequeños problemas estéricos Hidrógenos sin problemas estéricos

La silla es el conformero mayoritario a temperatura ambiente La consecuencia de este movimiento de inversión de la conformación silla es que las posiciones axiales pasan a ser ecuatoriales y viceversa. Esto es especialmente relevante cuando el anillo de ciclohexano posee sustituyentes.

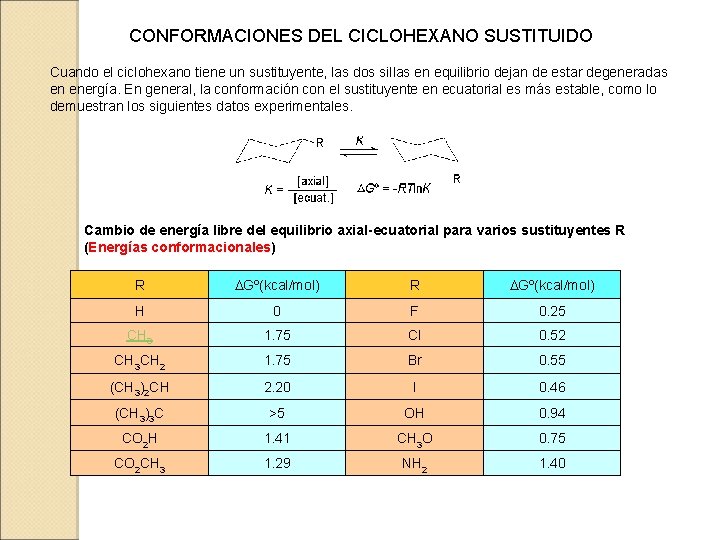
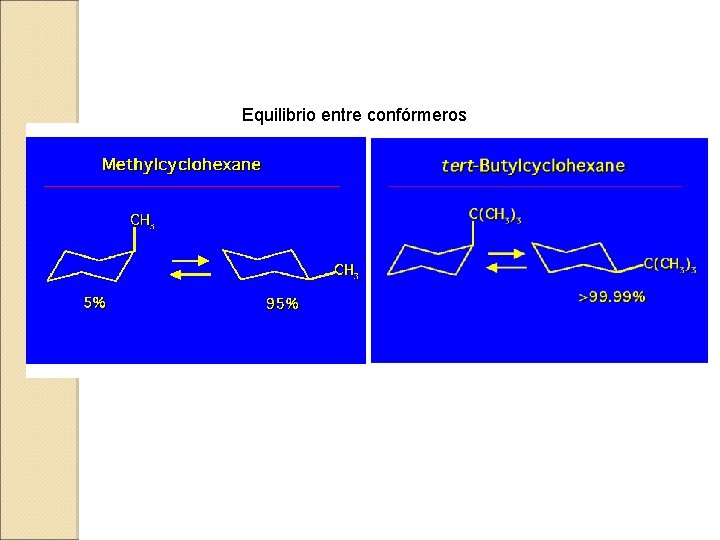
CONFORMACIONES DEL CICLOHEXANO SUSTITUIDO Cuando el ciclohexano tiene un sustituyente, las dos sillas en equilibrio dejan de estar degeneradas en energía. En general, la conformación con el sustituyente en ecuatorial es más estable, como lo demuestran los siguientes datos experimentales. Cambio de energía libre del equilibrio axial-ecuatorial para varios sustituyentes R (Energías conformacionales) R DGº(kcal/mol) H 0 F 0. 25 CH 3 1. 75 Cl 0. 52 CH 3 CH 2 1. 75 Br 0. 55 (CH 3)2 CH 2. 20 I 0. 46 (CH 3)3 C >5 OH 0. 94 CO 2 H 1. 41 CH 3 O 0. 75 CO 2 CH 3 1. 29 NH 2 1. 40

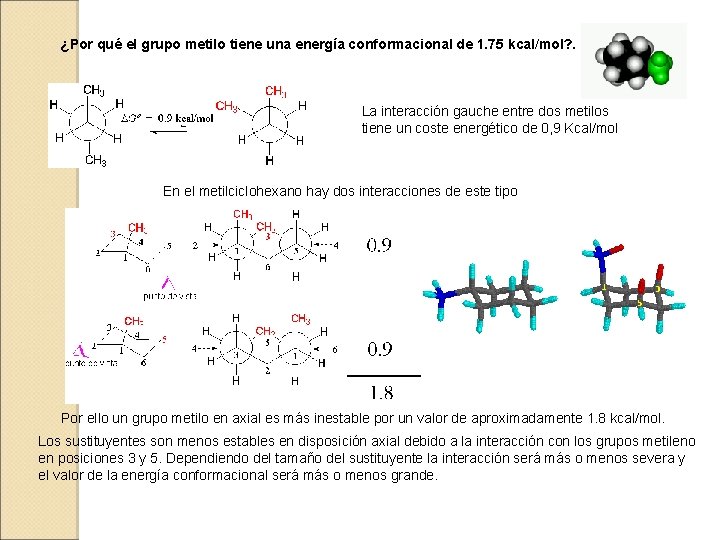
¿Por qué el grupo metilo tiene una energía conformacional de 1. 75 kcal/mol? . La interacción gauche entre dos metilos tiene un coste energético de 0, 9 Kcal/mol En el metilciclohexano hay dos interacciones de este tipo Por ello un grupo metilo en axial es más inestable por un valor de aproximadamente 1. 8 kcal/mol. Los sustituyentes son menos estables en disposición axial debido a la interacción con los grupos metileno en posiciones 3 y 5. Dependiendo del tamaño del sustituyente la interacción será más o menos severa y el valor de la energía conformacional será más o menos grande.

Equilibrio entre confórmeros

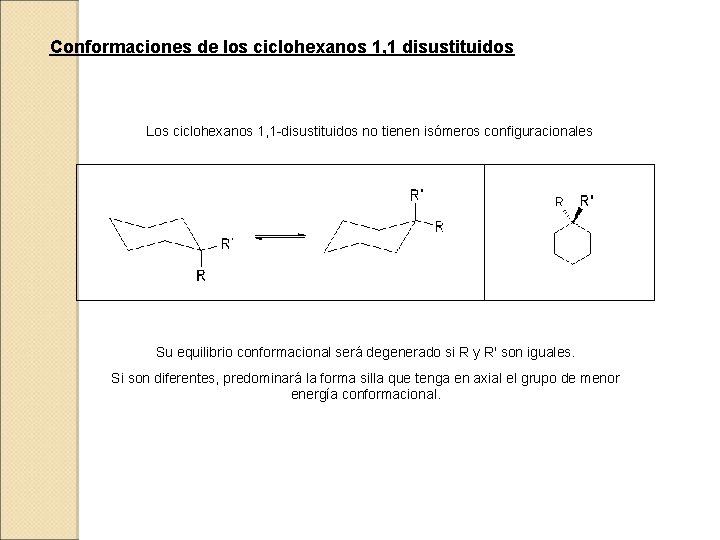
Conformaciones de los ciclohexanos 1, 1 disustituidos Los ciclohexanos 1, 1 -disustituidos no tienen isómeros configuracionales Su equilibrio conformacional será degenerado si R y R' son iguales. Si son diferentes, predominará la forma silla que tenga en axial el grupo de menor energía conformacional.

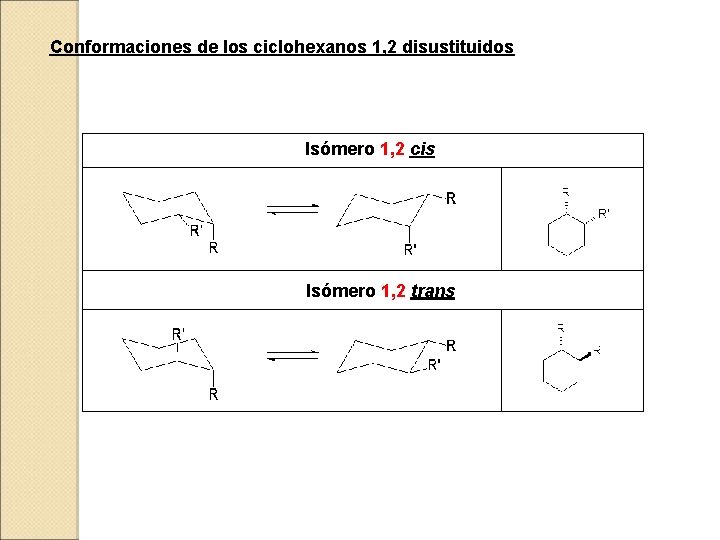
Conformaciones de los ciclohexanos 1, 2 disustituidos Isómero 1, 2 cis Isómero 1, 2 trans

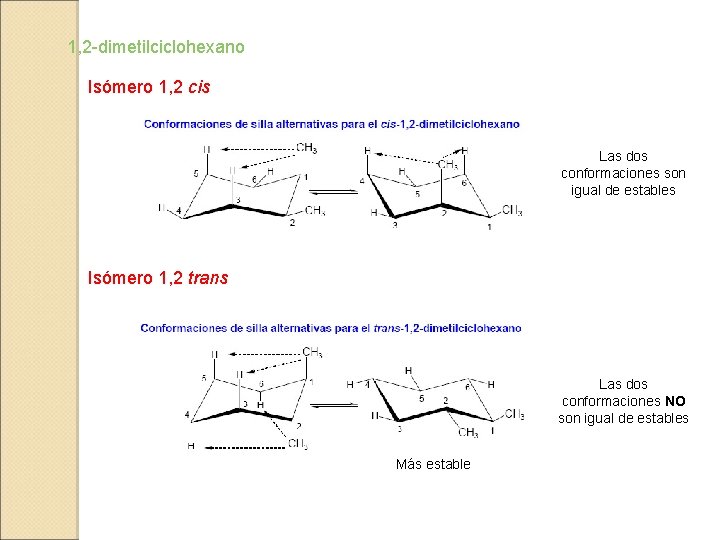
1, 2 -dimetilciclohexano Isómero 1, 2 cis Las dos conformaciones son igual de estables Isómero 1, 2 trans Las dos conformaciones NO son igual de estables Más estable

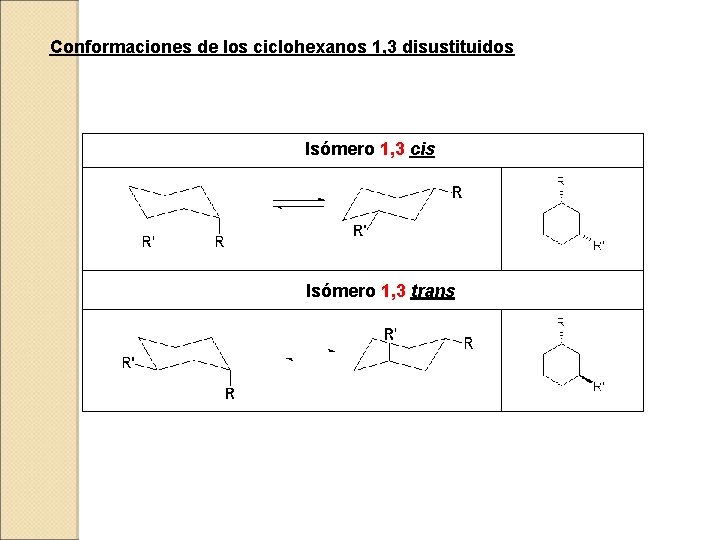
Conformaciones de los ciclohexanos 1, 3 disustituidos Isómero 1, 3 cis Isómero 1, 3 trans

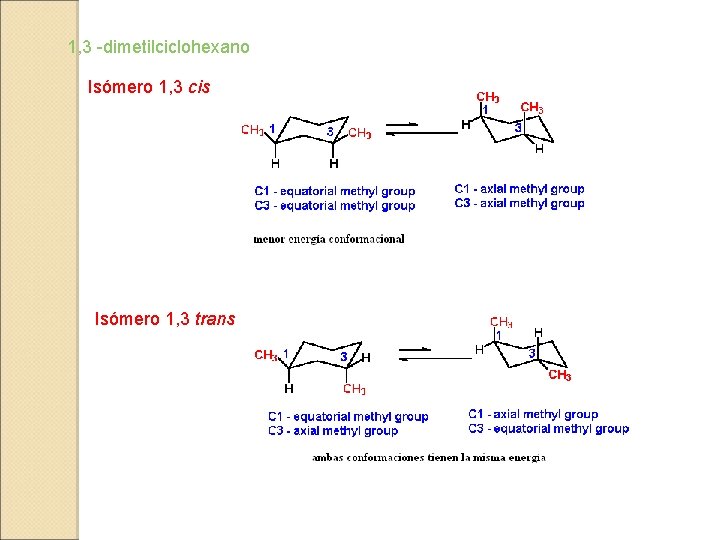
1, 3 -dimetilciclohexano Isómero 1, 3 cis Isómero 1, 3 trans

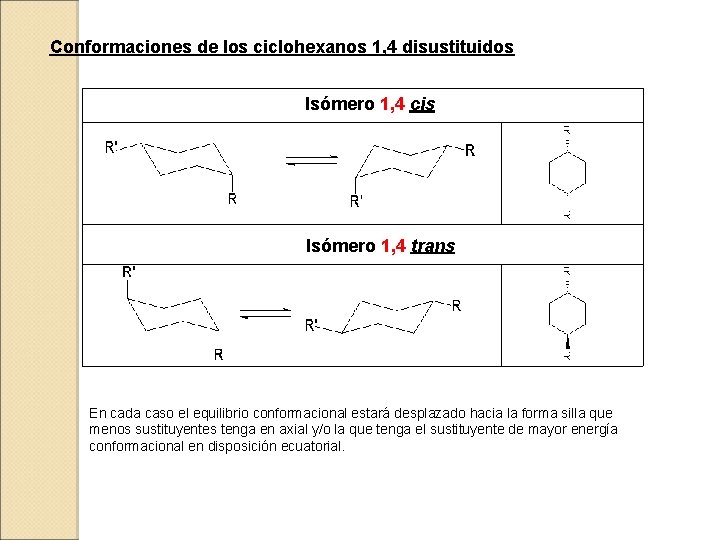
Conformaciones de los ciclohexanos 1, 4 disustituidos Isómero 1, 4 cis Isómero 1, 4 trans En cada caso el equilibrio conformacional estará desplazado hacia la forma silla que menos sustituyentes tenga en axial y/o la que tenga el sustituyente de mayor energía conformacional en disposición ecuatorial.

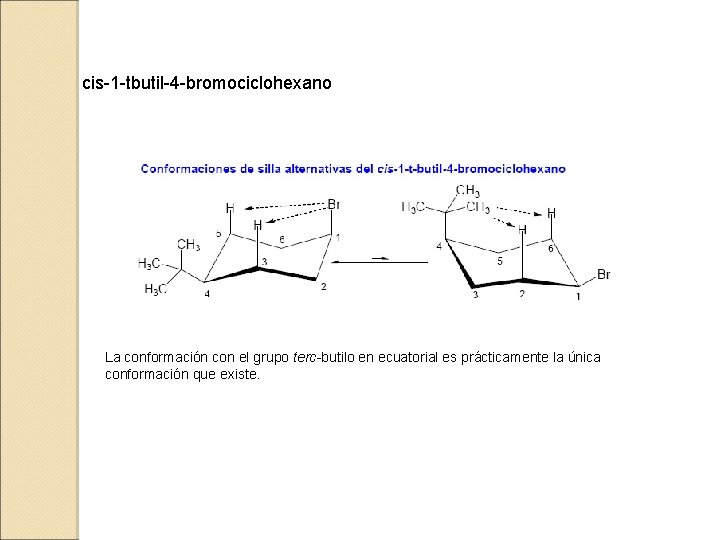
cis-1 -tbutil-4 -bromociclohexano La conformación con el grupo terc-butilo en ecuatorial es prácticamente la única conformación que existe.

12. - CICLOALCANOS SUPERIORES Los cicloalcanos superiores carecen de la simetría del ciclohexano, observándose cierta tensión en los enlaces hasta que el anillo es lo suficientemente grande como para mostrar la alineación en zig-zag típica de los alcanos lineales (ciclotetradecano) En los cicloalcanos superiores no hay verdaderas posiciones axiales y ecuatoriales. Cicloheptano

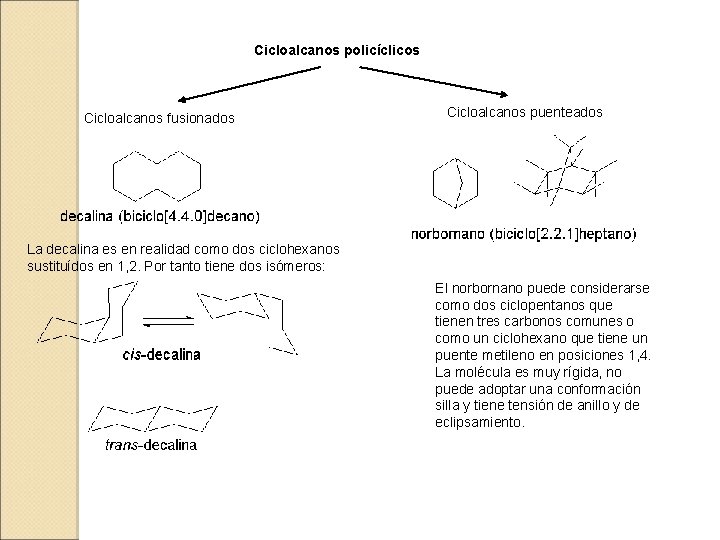
Cicloalcanos policíclicos Cicloalcanos fusionados Cicloalcanos puenteados La decalina es en realidad como dos ciclohexanos sustituídos en 1, 2. Por tanto tiene dos isómeros: El norbornano puede considerarse como dos ciclopentanos que tienen tres carbonos comunes o como un ciclohexano que tiene un puente metileno en posiciones 1, 4. La molécula es muy rígida, no puede adoptar una conformación silla y tiene tensión de anillo y de eclipsamiento.
 Luis agurto
Luis agurto Güzel sanatların sınıflandırılması tablo
Güzel sanatların sınıflandırılması tablo Arroz con leche santa olaya
Arroz con leche santa olaya öyküleme anlatım biçimi
öyküleme anlatım biçimi Camilo olaya
Camilo olaya Jose olaya quien fue
Jose olaya quien fue Ciclano e cicleno
Ciclano e cicleno Cicloalcanos
Cicloalcanos Cicloalcanos
Cicloalcanos Hidrocarburos saturados
Hidrocarburos saturados Nombrar
Nombrar Prefijo sec
Prefijo sec Isopentilo
Isopentilo Formula de alcanos
Formula de alcanos Metil etil propil
Metil etil propil Propinido
Propinido Trans-2-buteno estructura
Trans-2-buteno estructura Propiedades fisicas de los alcanos
Propiedades fisicas de los alcanos Alquinos del 1 al 10
Alquinos del 1 al 10 Etinilbenceno
Etinilbenceno Haluros de alcanoilo
Haluros de alcanoilo Reglas para nombrar alcanos ramificados
Reglas para nombrar alcanos ramificados Usos de alquenos
Usos de alquenos Ciclopropano + cl2
Ciclopropano + cl2 Hidrocarburos alifáticos alcanos
Hidrocarburos alifáticos alcanos Nombrar
Nombrar Nomenclatura de hidrocarbonetos ramificados
Nomenclatura de hidrocarbonetos ramificados Decalina
Decalina Número atomico de carbono
Número atomico de carbono Parafinas alcanos
Parafinas alcanos Tabla de metil etil propil butil
Tabla de metil etil propil butil Mario guerrero corzo
Mario guerrero corzo Mario tenuta
Mario tenuta Mario storyboard
Mario storyboard Mario ohlberger
Mario ohlberger Mario malizia
Mario malizia Fiktivni lik
Fiktivni lik Mario arioli
Mario arioli Mario bieringer
Mario bieringer Mario veganzones
Mario veganzones Dr mario aguilar
Dr mario aguilar Marioa casas sierra
Marioa casas sierra Mario marchand
Mario marchand Me gusta la gente capaz de entender mario benedetti
Me gusta la gente capaz de entender mario benedetti Unsend message mario
Unsend message mario Kahulugan ng kasipagan
Kahulugan ng kasipagan Mario casas training
Mario casas training Mario nonaka
Mario nonaka Mario gineprini
Mario gineprini Foda de mario vargas llosa
Foda de mario vargas llosa Mario milouchev
Mario milouchev Mario vaneechoutte
Mario vaneechoutte Daguerrotipo
Daguerrotipo Mario bieringer
Mario bieringer Mario sõrm
Mario sõrm Why do we celebrate mario molina
Why do we celebrate mario molina Mario gavran
Mario gavran Mario drummonds
Mario drummonds Mario bieringer
Mario bieringer Mario kapl
Mario kapl Presentazione sul tennis
Presentazione sul tennis Mario pezzini
Mario pezzini Restaurantbedienung interviewfragen beruf
Restaurantbedienung interviewfragen beruf O periodo pré socratico e o ponto inicial
O periodo pré socratico e o ponto inicial Mario cea sanchez
Mario cea sanchez Mario utiliza organizadores graficos
Mario utiliza organizadores graficos Como hacerte saber benedetti
Como hacerte saber benedetti Mario herger wikipedia
Mario herger wikipedia Mario hibert
Mario hibert Mario nonaka
Mario nonaka Conocimiento mario bunge
Conocimiento mario bunge Cx-mario adminml
Cx-mario adminml Mario gabriel rangel vargas
Mario gabriel rangel vargas Illustrative graphics
Illustrative graphics Mario tafalla
Mario tafalla Mario bieringer
Mario bieringer