Reviso da aula anterior Alcanos e Cicloalcanos Estereoqumica
































- Slides: 79

Revisão da aula anterior • Alcanos e Cicloalcanos • Estereoquímica • Estabilidade da conformação • Isômeros • Constitucionais • Estereoisômeros: diasterômeros, enantiômeros • Alcenos • Haletos de Alquila

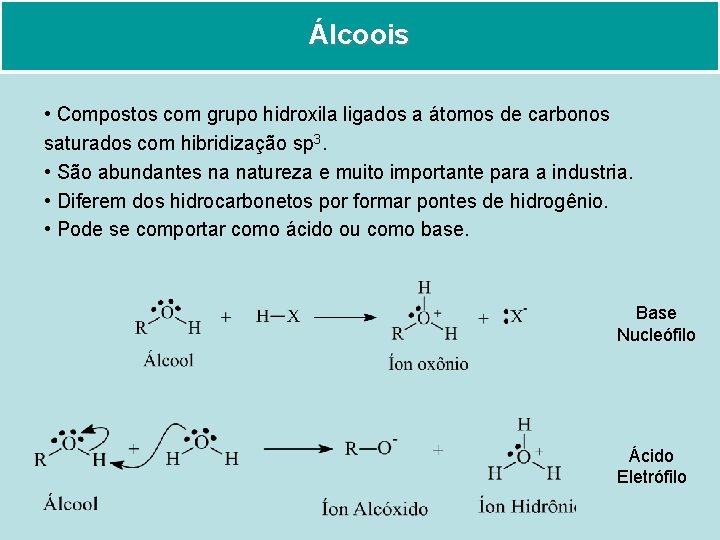
Álcoois

Álcoois • Compostos com grupo hidroxila ligados a átomos de carbonos saturados com hibridização sp 3. • São abundantes na natureza e muito importante para a industria. • Diferem dos hidrocarbonetos por formar pontes de hidrogênio. • Pode se comportar como ácido ou como base. Base Nucleófilo Ácido Eletrófilo

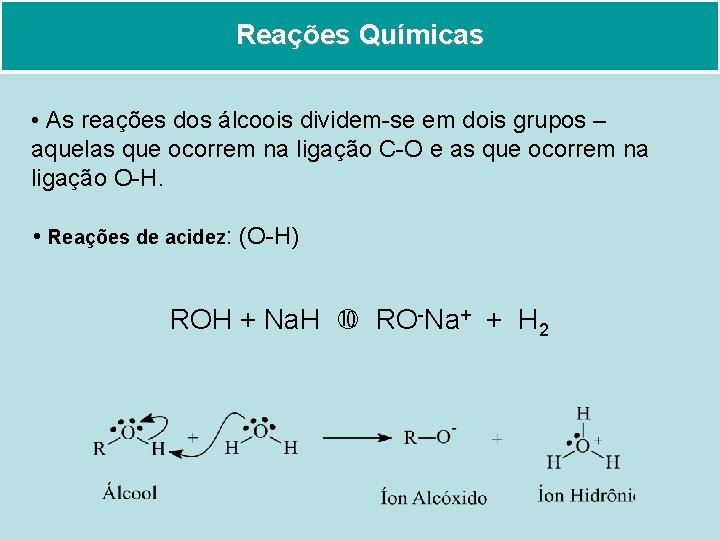
Reações Químicas

Reações Químicas • As reações dos álcoois dividem-se em dois grupos – aquelas que ocorrem na ligação C-O e as que ocorrem na ligação O-H. • Reações de acidez: (O-H) ROH + Na. H RO-Na+ + H 2

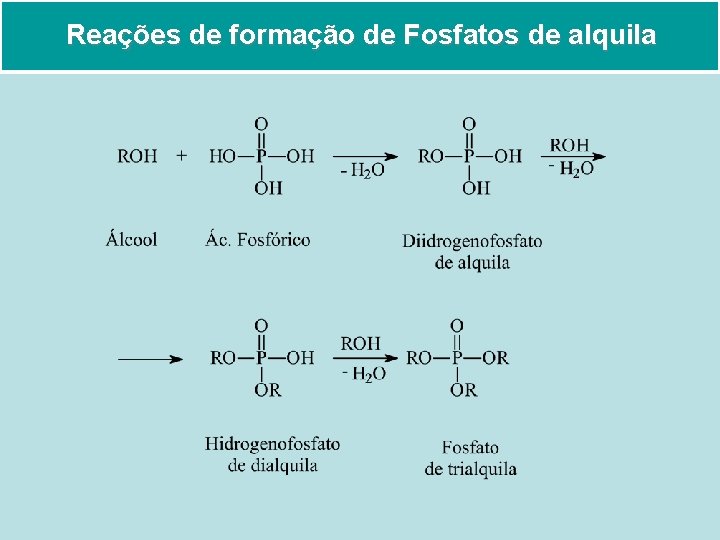
Reações de formação de Fosfatos de alquila

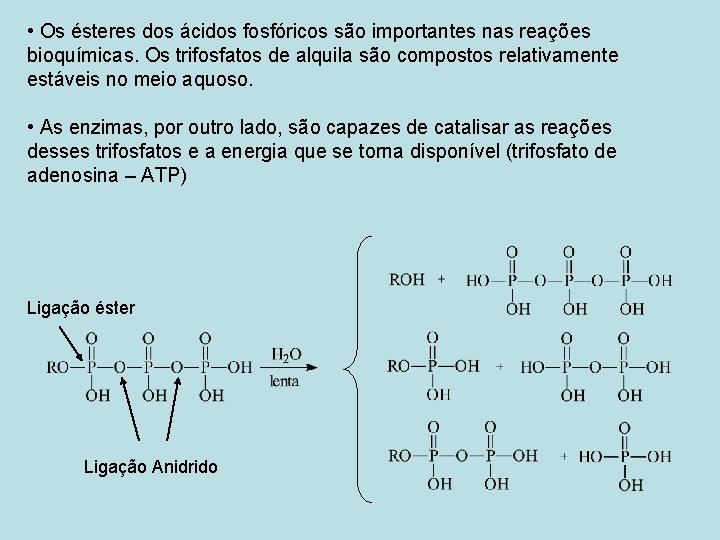
• Os ésteres dos ácidos fosfóricos são importantes nas reações bioquímicas. Os trifosfatos de alquila são compostos relativamente estáveis no meio aquoso. • As enzimas, por outro lado, são capazes de catalisar as reações desses trifosfatos e a energia que se torna disponível (trifosfato de adenosina – ATP) Ligação éster Ligação Anidrido



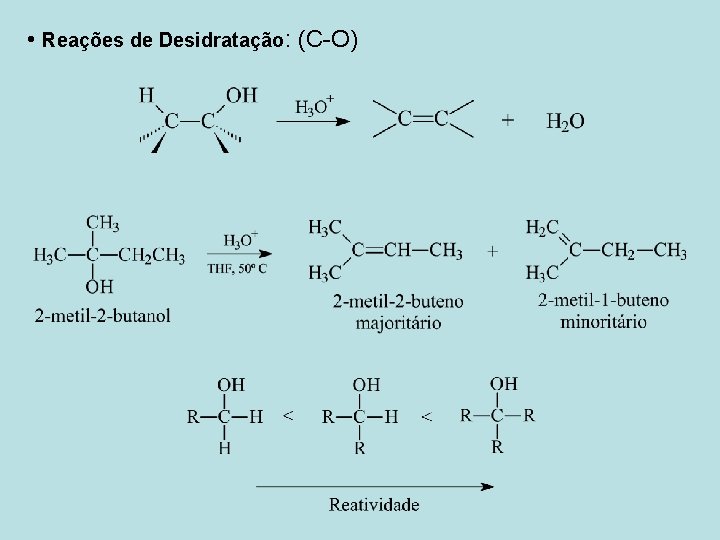
• Reações de Desidratação: (C-O)

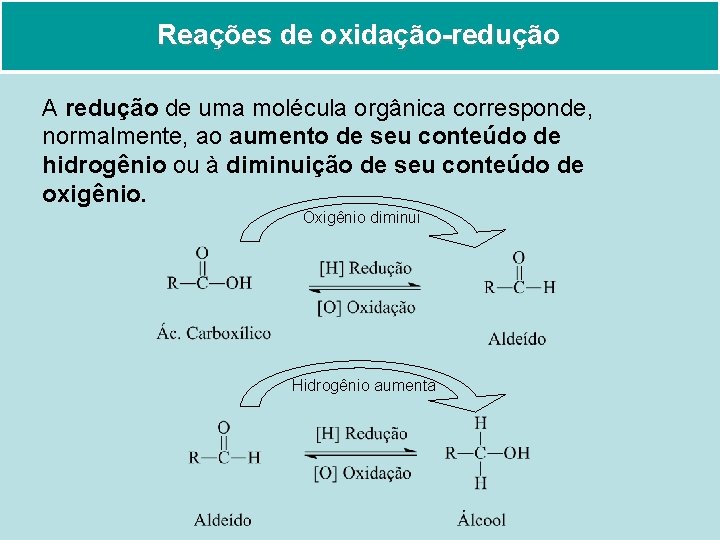
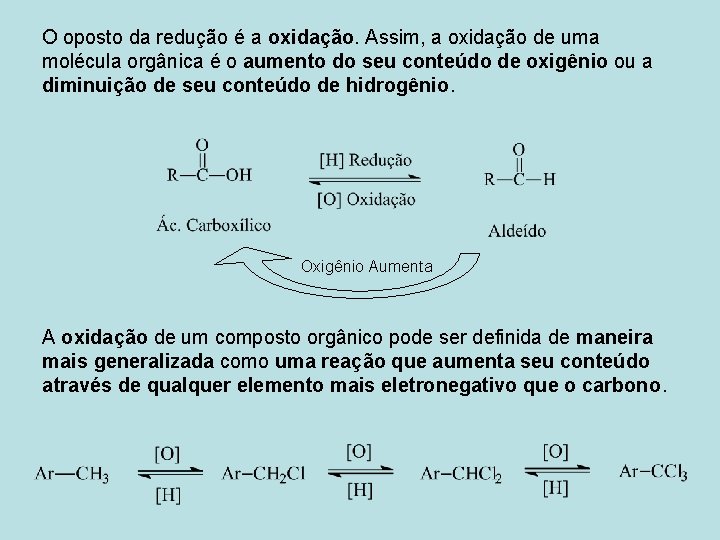
Reações de oxidação-redução A redução de uma molécula orgânica corresponde, normalmente, ao aumento de seu conteúdo de hidrogênio ou à diminuição de seu conteúdo de oxigênio. Oxigênio diminui Hidrogênio aumenta

O oposto da redução é a oxidação. Assim, a oxidação de uma molécula orgânica é o aumento do seu conteúdo de oxigênio ou a diminuição de seu conteúdo de hidrogênio. Oxigênio Aumenta A oxidação de um composto orgânico pode ser definida de maneira mais generalizada como uma reação que aumenta seu conteúdo através de qualquer elemento mais eletronegativo que o carbono.

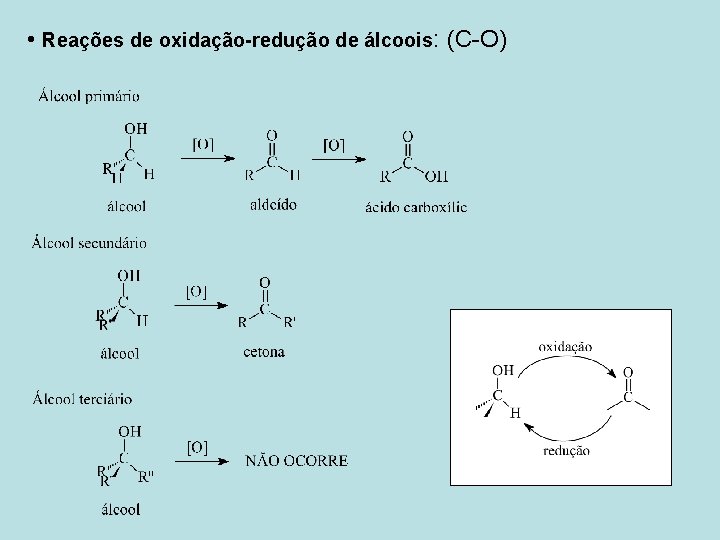
• Reações de oxidação-redução de álcoois: (C-O)

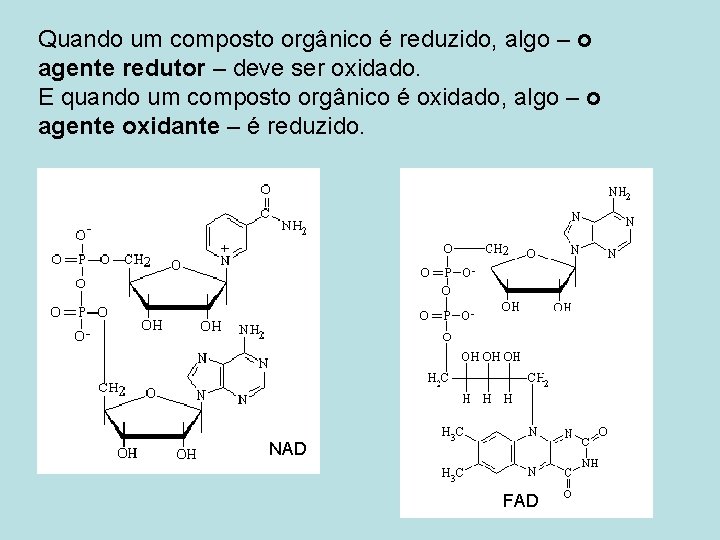
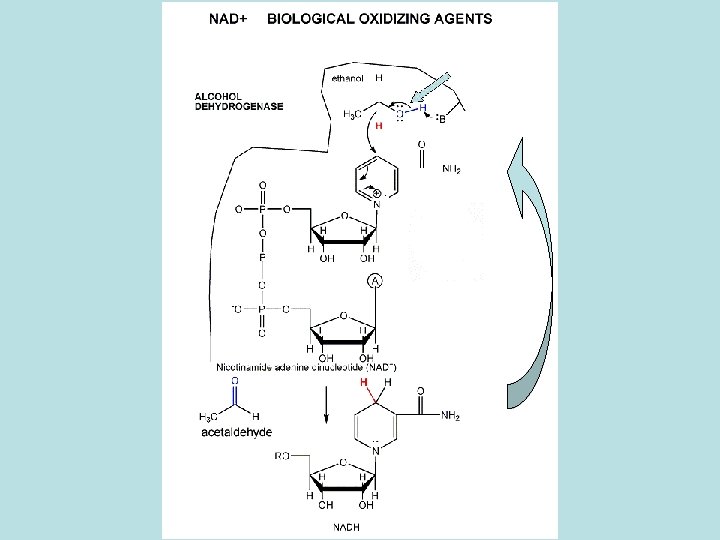
Quando um composto orgânico é reduzido, algo – o agente redutor – deve ser oxidado. E quando um composto orgânico é oxidado, algo – o agente oxidante – é reduzido. NAD FAD



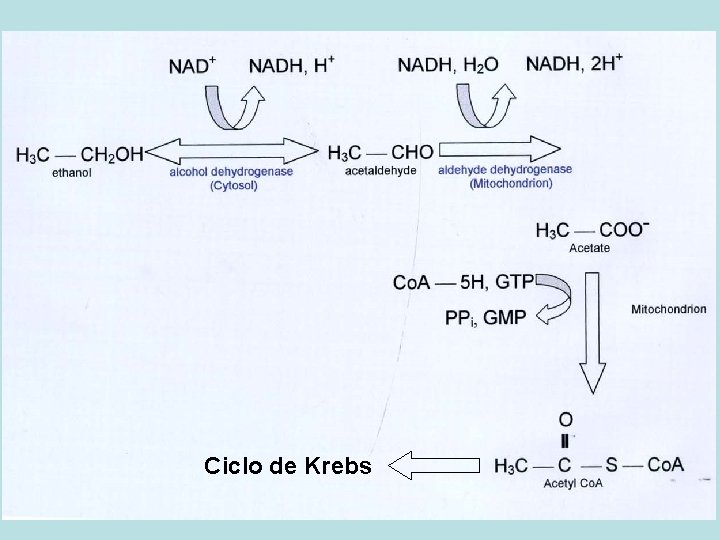
Ciclo de Krebs


Sistemas Insaturados Conjugados

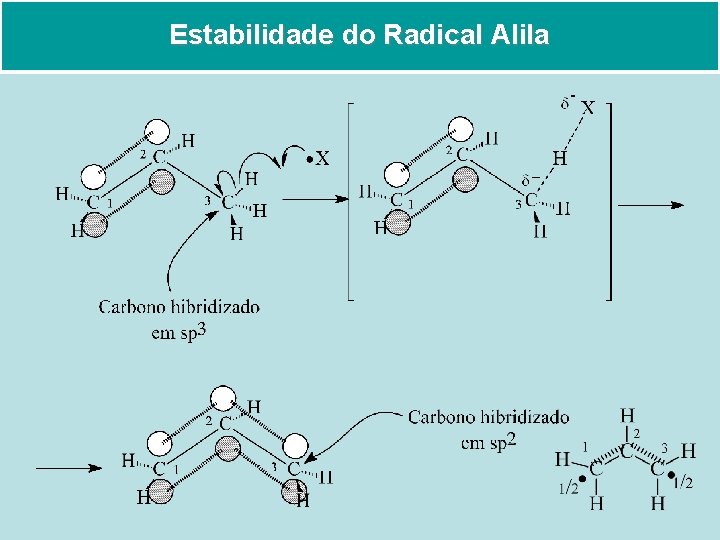
Sistema insaturado Conjugado Sistemas que possuem um orbital p em um átomo adjacente a uma ligação dupla – moléculas como ligações deslocalizadas – são chamados sistemas insaturados conjugados. Esse fenômeno geral é chamado conjugação. Propeno


Estabilidade do Radical Alila

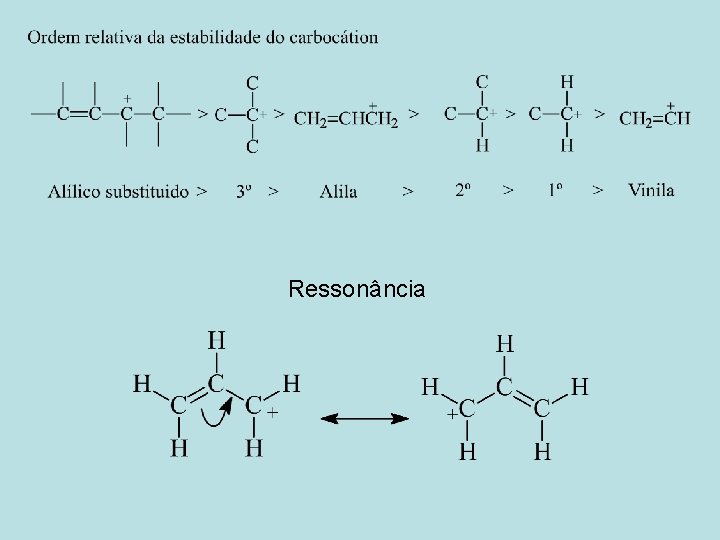
Ressonância

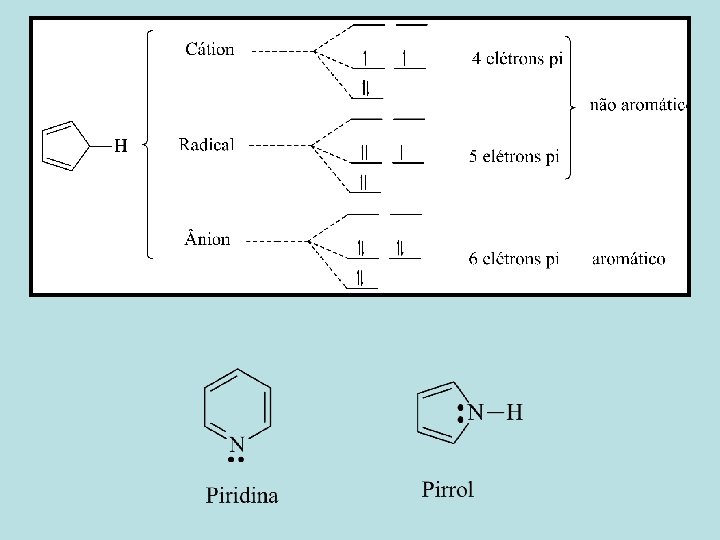
Regras de Ressônancia 1. Estruturas de ressonância só existem no papel. 2. Ao escrever estruturas de ressonância, podemos mover apenas os elétrons. 3. Todas as estruturas de ressonância deve possuir o mesmo número de elétrons não-emparelhados. 4. Todos os átomos que fazem parte do sistema deslocalizado devem ficar em um plano ou quase plano.

Compostos Aromáticos

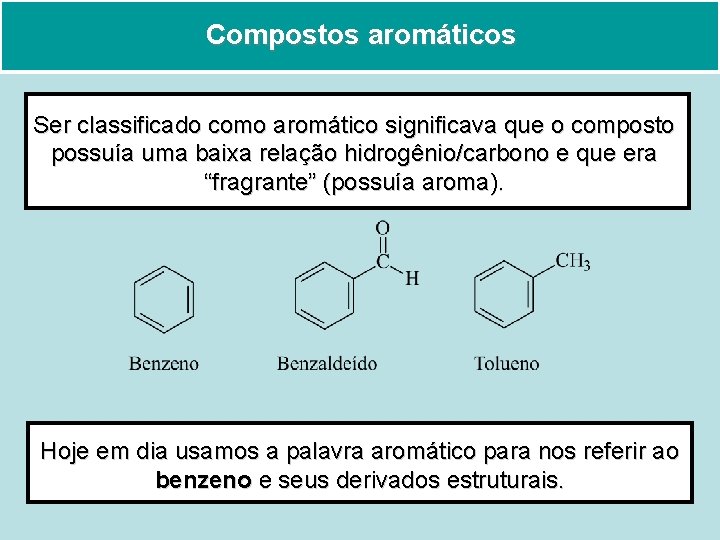
Compostos aromáticos Ser classificado como aromático significava que o composto possuía uma baixa relação hidrogênio/carbono e que era “fragrante” (possuía aroma). Hoje em dia usamos a palavra aromático para nos referir ao benzeno e seus derivados estruturais.

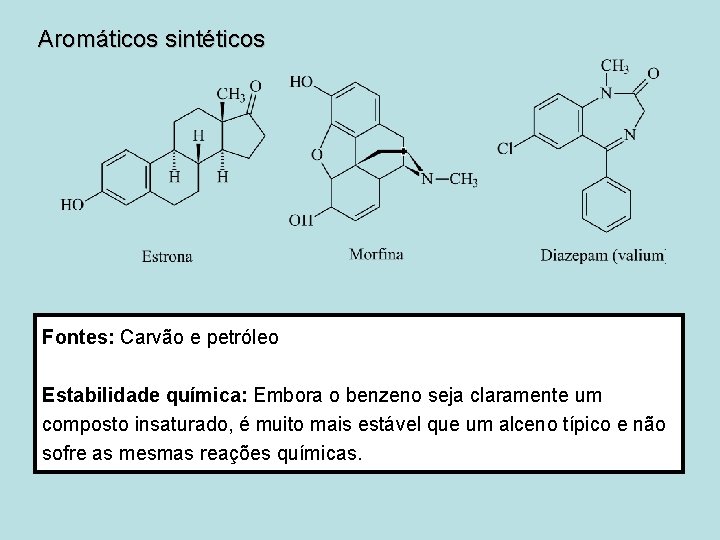
Aromáticos sintéticos Fontes: Carvão e petróleo Estabilidade química: Embora o benzeno seja claramente um composto insaturado, é muito mais estável que um alceno típico e não sofre as mesmas reações químicas.

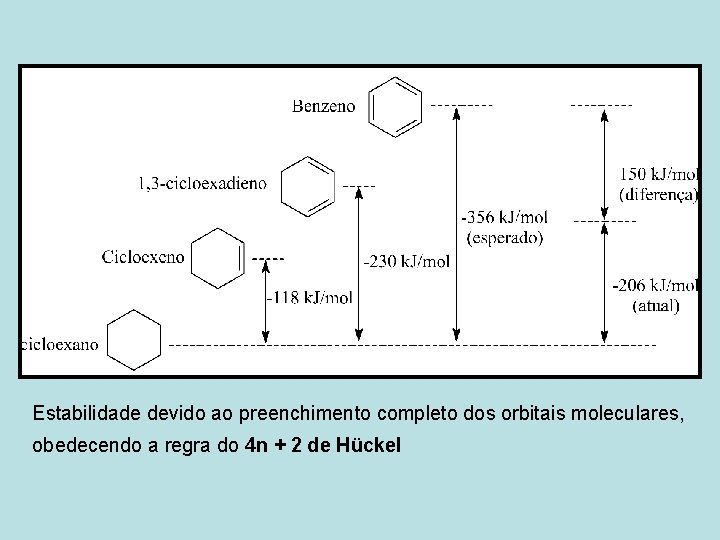
Estabilidade devido ao preenchimento completo dos orbitais moleculares, obedecendo a regra do 4 n + 2 de Hückel


Compostos Carbonílicos

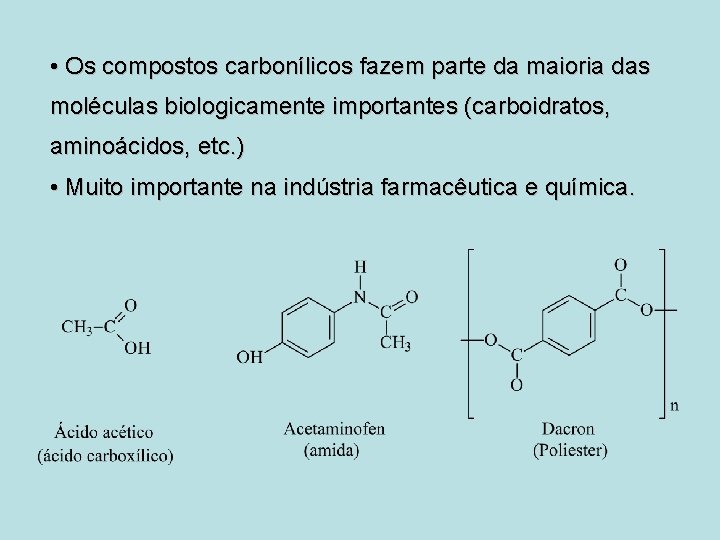
• Os compostos carbonílicos fazem parte da maioria das moléculas biologicamente importantes (carboidratos, aminoácidos, etc. ) • Muito importante na indústria farmacêutica e química.

Grupos de Compostos Carbonílicos

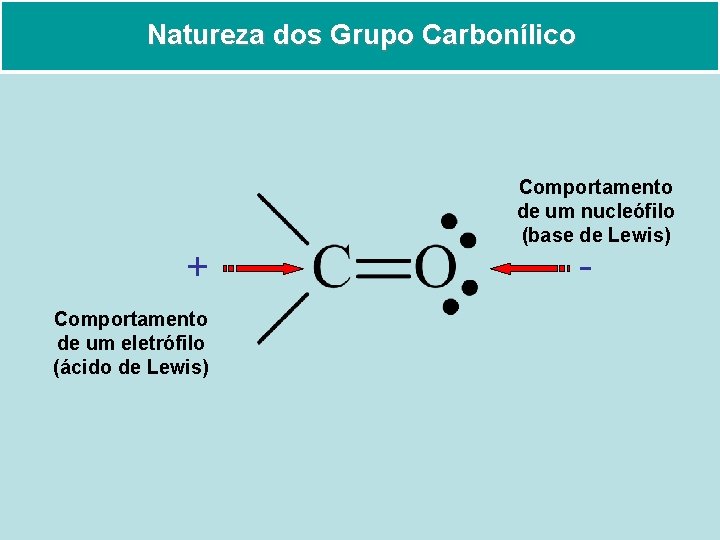
Natureza dos Grupo Carbonílico + Comportamento de um eletrófilo (ácido de Lewis) Comportamento de um nucleófilo (base de Lewis) -

Aldeídos e Cetonas

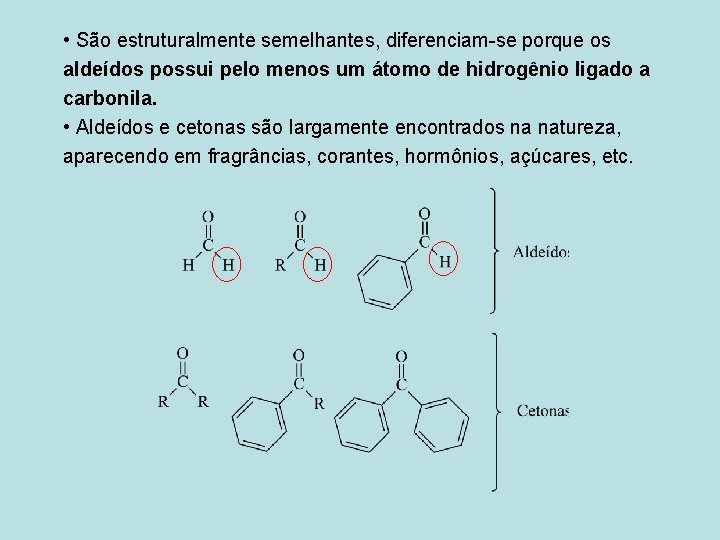
• São estruturalmente semelhantes, diferenciam-se porque os aldeídos possui pelo menos um átomo de hidrogênio ligado a carbonila. • Aldeídos e cetonas são largamente encontrados na natureza, aparecendo em fragrâncias, corantes, hormônios, açúcares, etc.


Reatividade dos Aldeídos e Cetonas

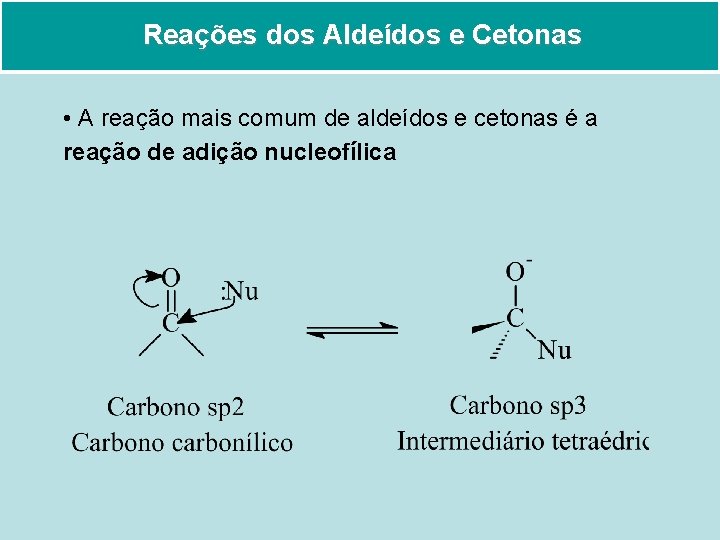
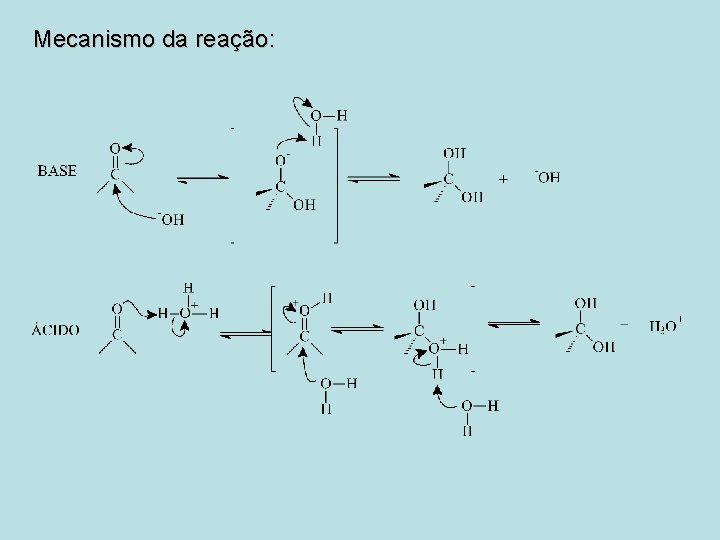
Reações dos Aldeídos e Cetonas • A reação mais comum de aldeídos e cetonas é a reação de adição nucleofílica


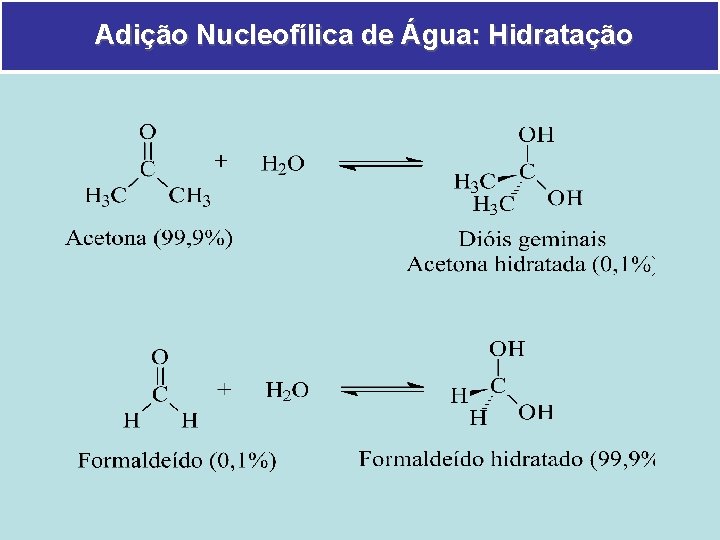
Adição Nucleofílica de Água: Hidratação

Mecanismo da reação:

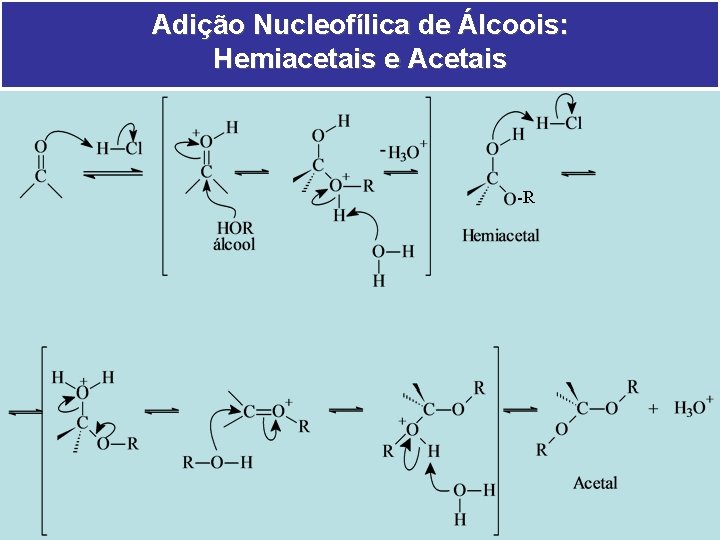
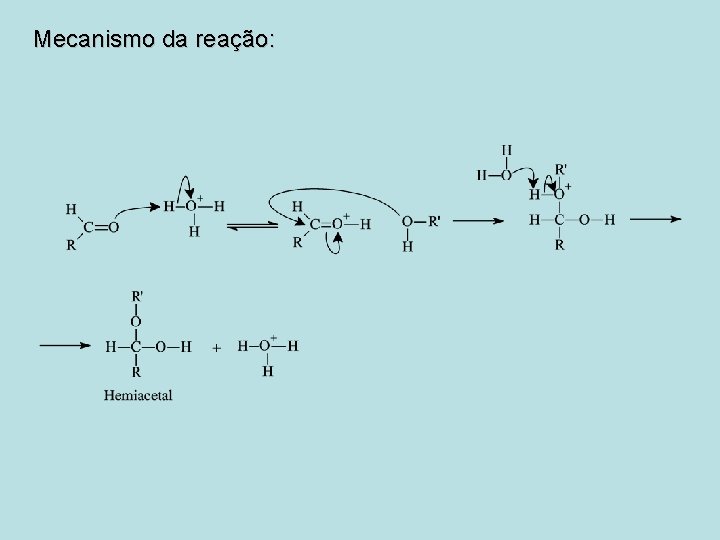
Adição Nucleofílica de Álcoois: Hemiacetais e Acetais -R

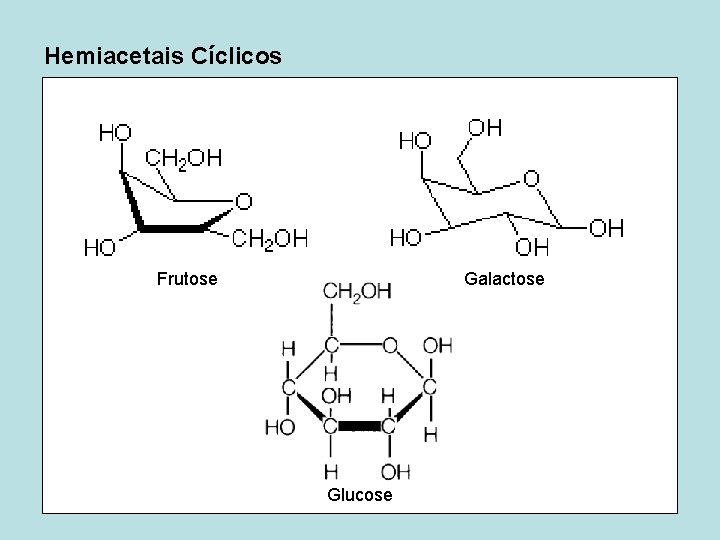
Hemiacetais Cíclicos Frutose Galactose Glucose


Mecanismo da reação:

Formação de Acetais

Glicosídeo Carbono Anomérico Ligação Glicosídica

Formação do Polissacarídeos

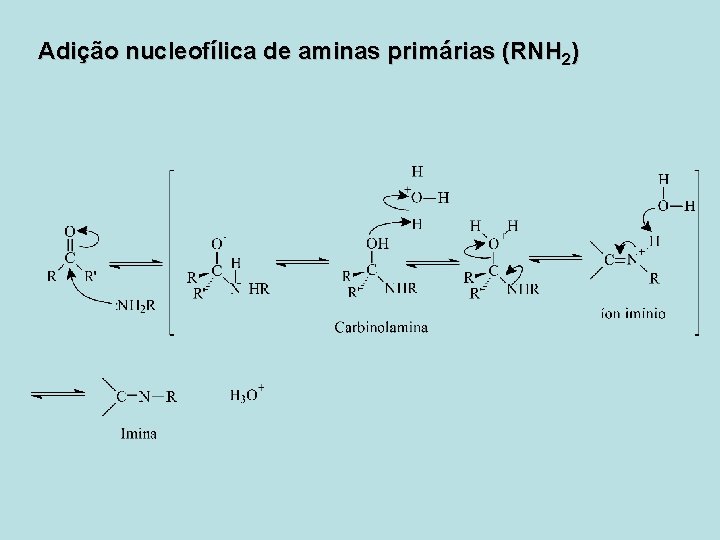
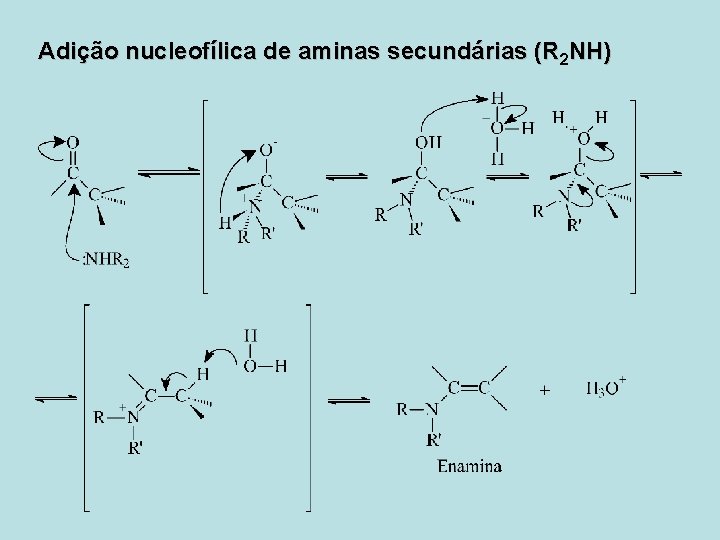
Adição Nucleofílica de Aminas • Adição nucleofílica de aminas primárias (RNH 2) • As aminas primárias reagem com os aldeídos ou cetonas formando iminas (R 2 C=NR), um composto importante em muitos caminhos metabólicos. • Adição nucleofílica de aminas secundárias (R 2 NH) • As aminas secundárias reagem com os aldeídos e cetonas formando enamidas, também conhecidas como aminas insaturadas (R 2 N-CR=CR 2).

Adição nucleofílica de aminas primárias (RNH 2)

Adição nucleofílica de aminas secundárias (R 2 NH)

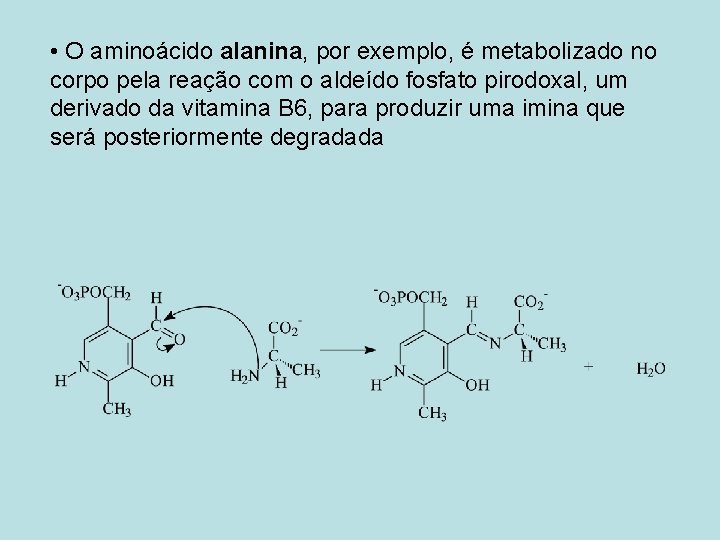
• O aminoácido alanina, por exemplo, é metabolizado no corpo pela reação com o aldeído fosfato pirodoxal, um derivado da vitamina B 6, para produzir uma imina que será posteriormente degradada

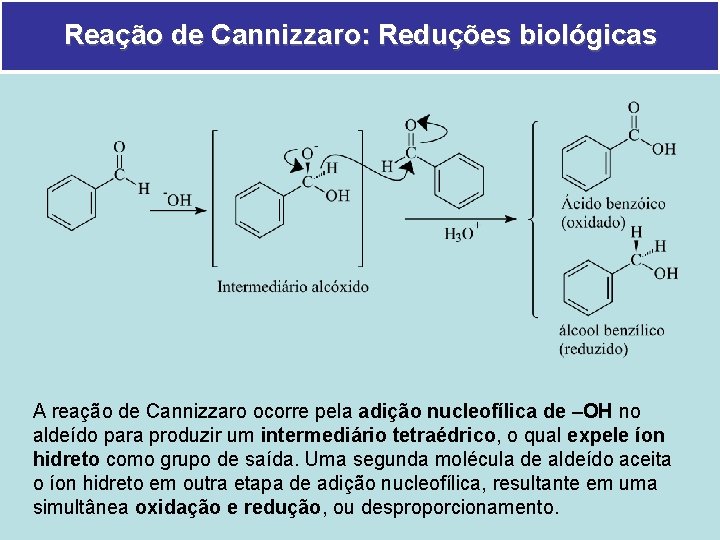
Reação de Cannizzaro: Reduções biológicas A reação de Cannizzaro ocorre pela adição nucleofílica de –OH no aldeído para produzir um intermediário tetraédrico, o qual expele íon hidreto como grupo de saída. Uma segunda molécula de aldeído aceita o íon hidreto em outra etapa de adição nucleofílica, resultante em uma simultânea oxidação e redução, ou desproporcionamento.


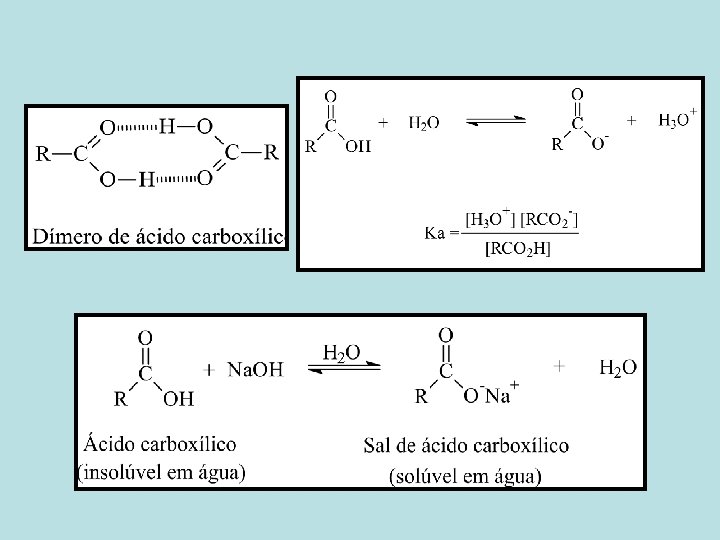
Ácidos Carboxílicos

• O grupo carboxila é um dos grupos funcionais mais amplamente encontrados na química e na bioquímica. • O grupo carboxila é o grupo gerador de uma família enorme de compostos relacionados chamados de compostos acíclicos ou derivados de ácidos carboxílicos.


Reações do Ácido Carboxílico e Derivados

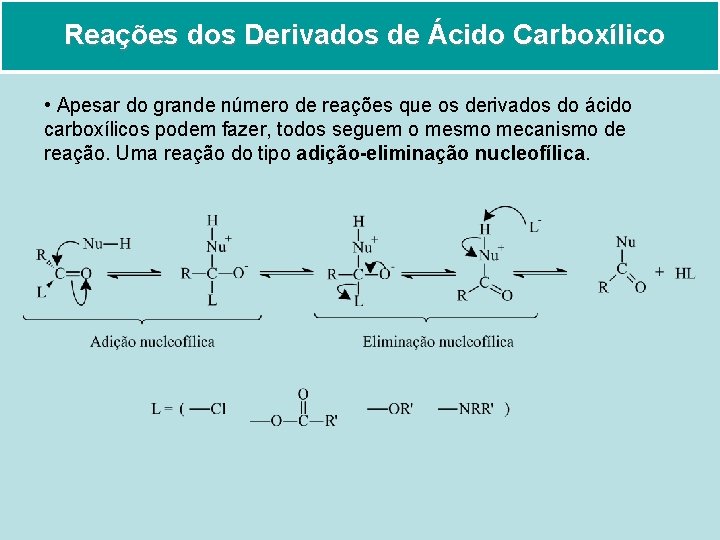
Reações dos Derivados de Ácido Carboxílico • Apesar do grande número de reações que os derivados do ácido carboxílicos podem fazer, todos seguem o mesmo mecanismo de reação. Uma reação do tipo adição-eliminação nucleofílica.

Exemplo:

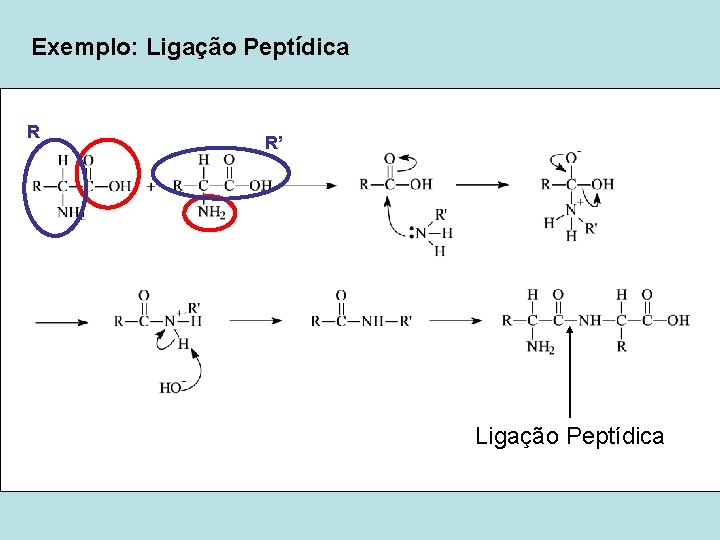
Exemplo: Ligação Peptídica R R’ Ligação Peptídica

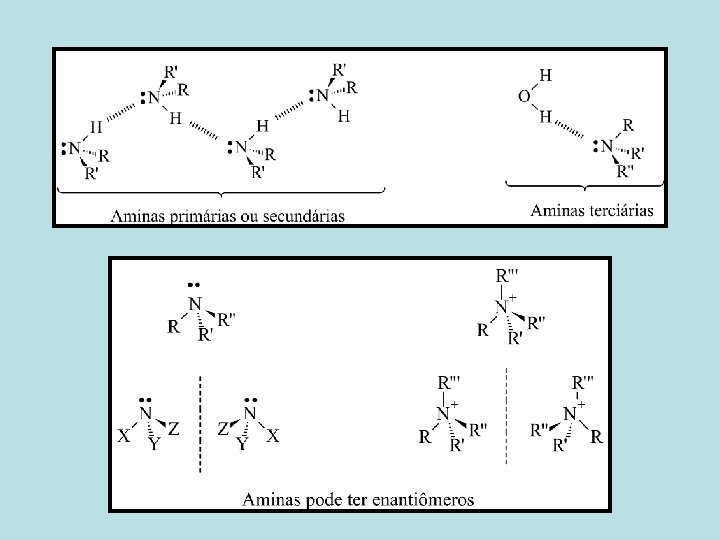
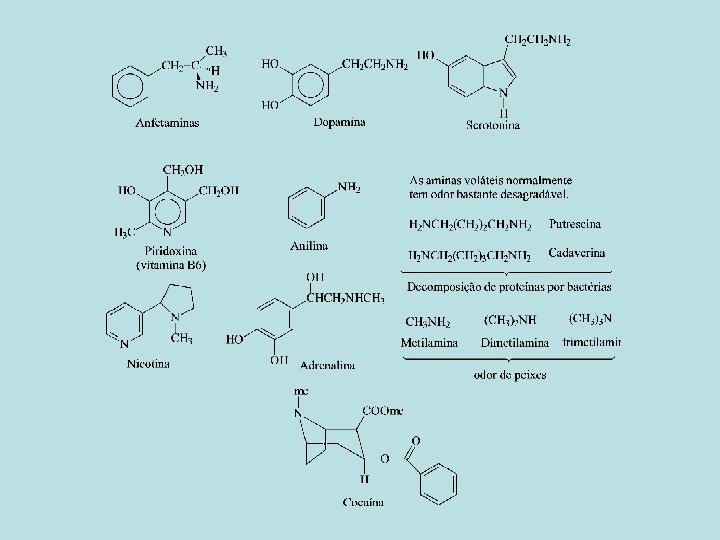
Aminas

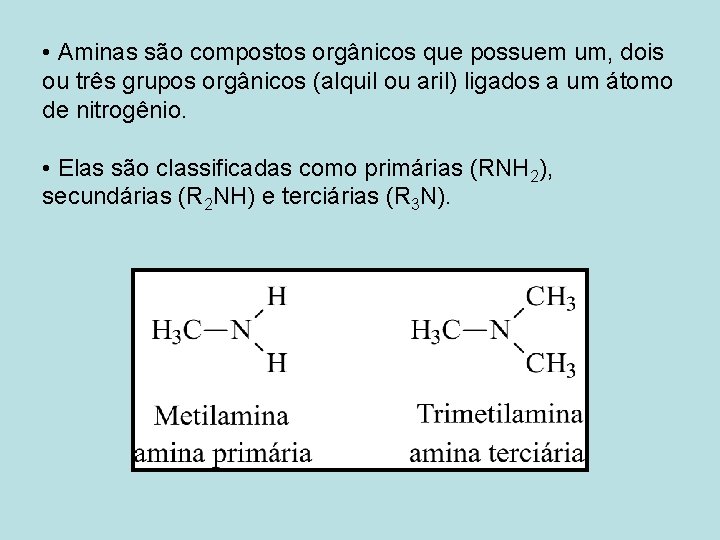
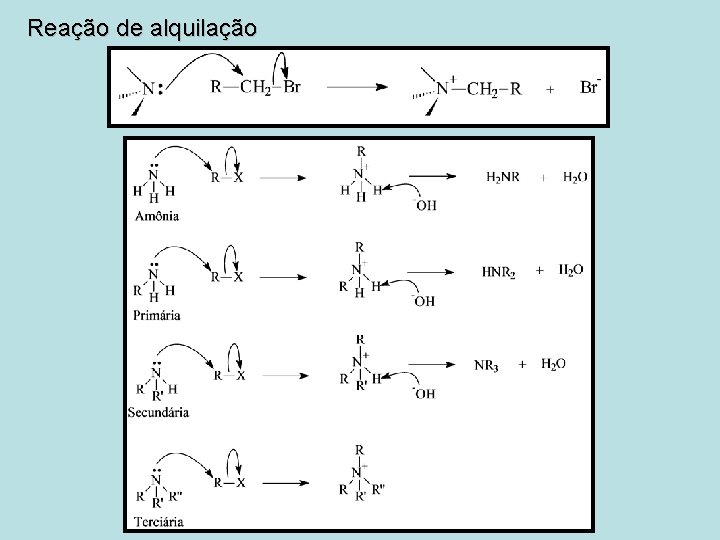
• Aminas são compostos orgânicos que possuem um, dois ou três grupos orgânicos (alquil ou aril) ligados a um átomo de nitrogênio. • Elas são classificadas como primárias (RNH 2), secundárias (R 2 NH) e terciárias (R 3 N).



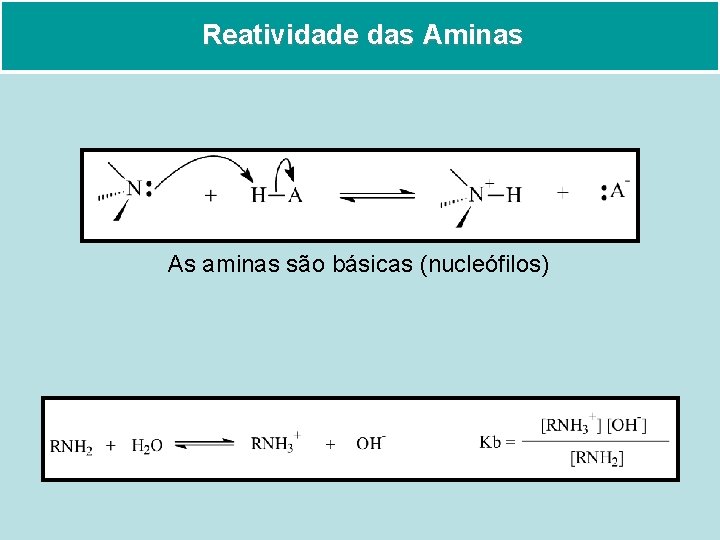
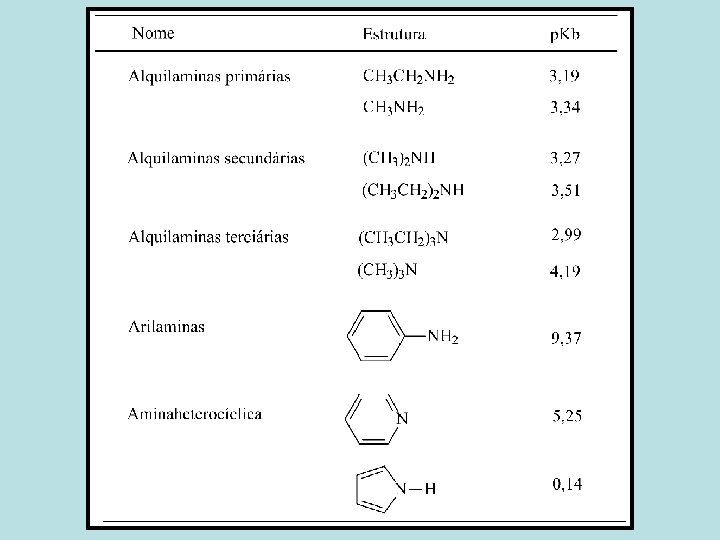
Reatividade das Aminas As aminas são básicas (nucleófilos)


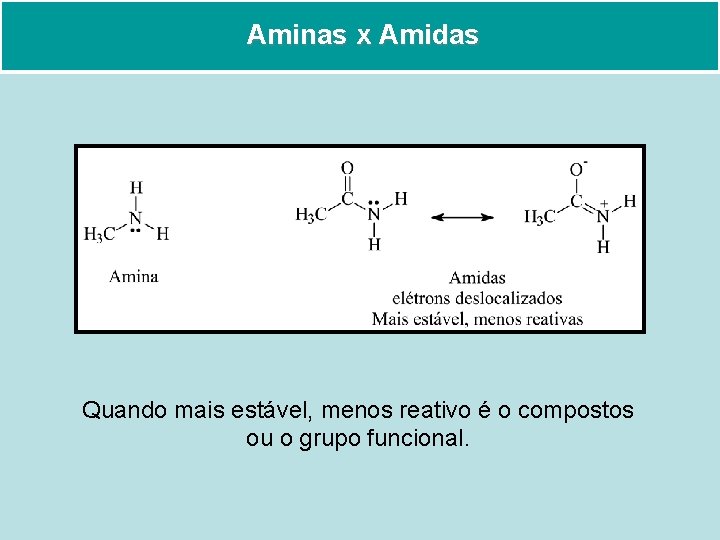
Aminas x Amidas Quando mais estável, menos reativo é o compostos ou o grupo funcional.

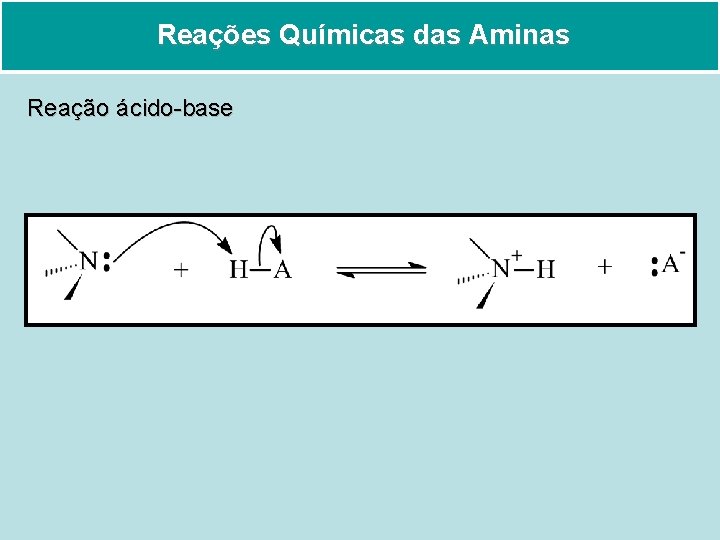
Reações Químicas das Aminas Reação ácido-base

Reação de alquilação

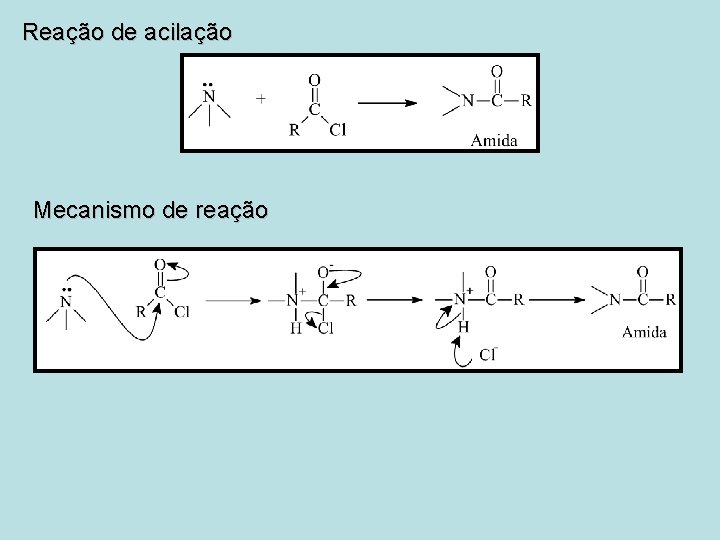
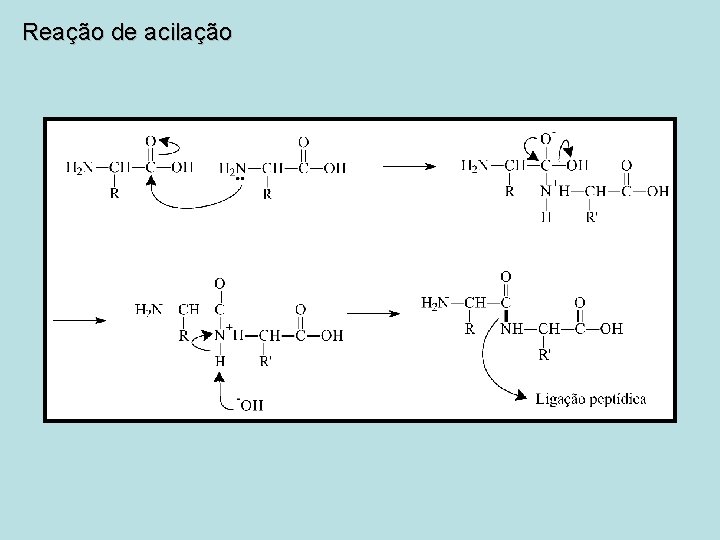
Reação de acilação Mecanismo de reação

Reação de acilação

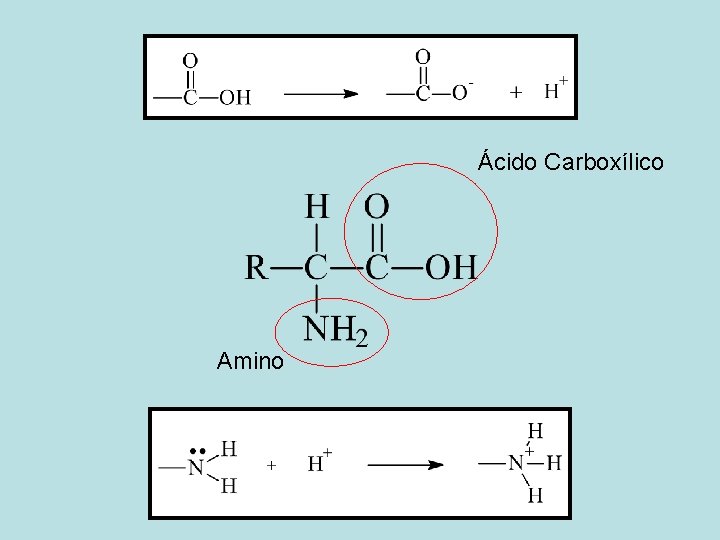
Propriedade ácido-base de Aminoácidos

Ácido Carboxílico Amino

Ácido Base p. Ka Íon dipolar (Zwitterions) p. Ka A forma não dissociada não existe

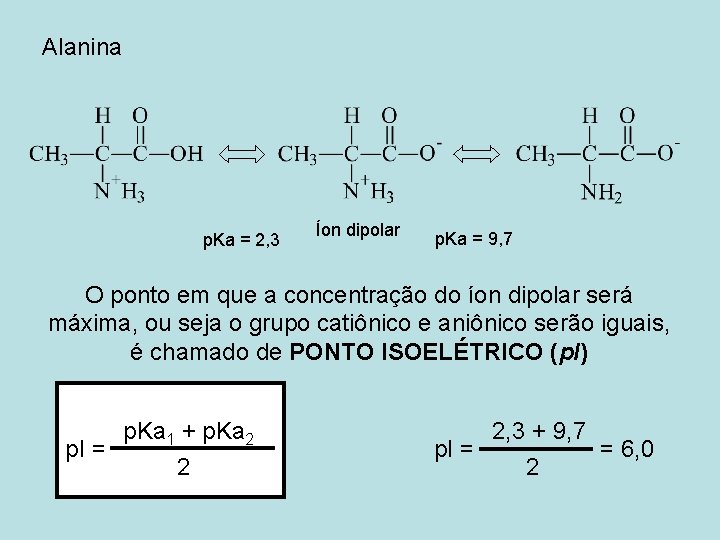
Alanina p. Ka = 2, 3 Íon dipolar p. Ka = 9, 7 O ponto em que a concentração do íon dipolar será máxima, ou seja o grupo catiônico e aniônico serão iguais, é chamado de PONTO ISOELÉTRICO (p. I) p. Ka 1 + p. Ka 2 p. I = 2 2, 3 + 9, 7 p. I = = 6, 0 2

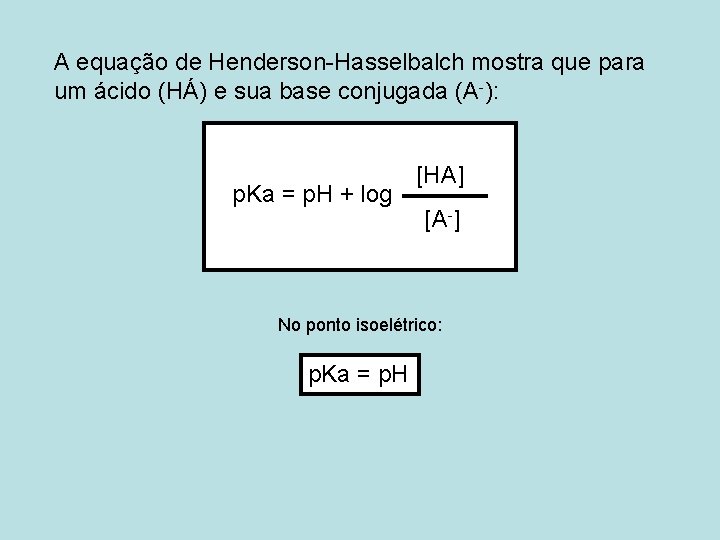
A equação de Henderson-Hasselbalch mostra que para um ácido (HÁ) e sua base conjugada (A-): p. Ka = p. H + log [HA] [A-] No ponto isoelétrico: p. Ka = p. H

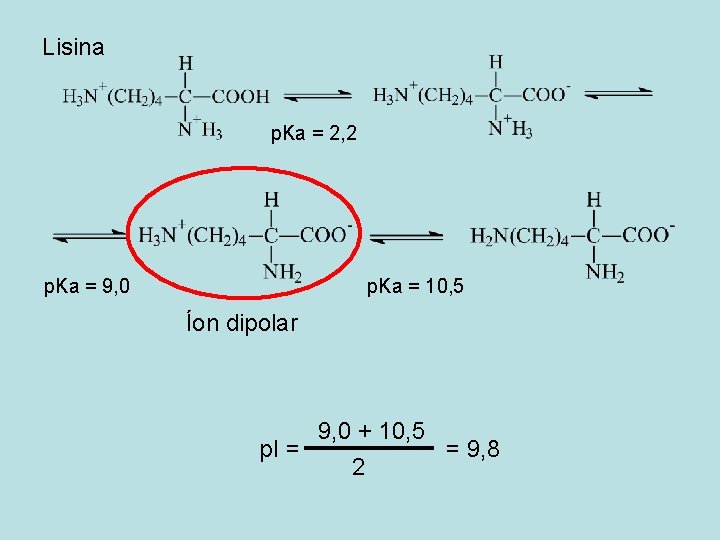
Lisina p. Ka = 2, 2 p. Ka = 9, 0 p. Ka = 10, 5 Íon dipolar 9, 0 + 10, 5 p. I = = 9, 8 2

• Aplicado em técnicas de separação de aminoácidos e proteínas • Utilizado em medidas de eletroforese • Comanda a solubilidade das proteínas.
 Reviso software
Reviso software Conferencia de solvay
Conferencia de solvay Cicloalcanos
Cicloalcanos Uiqpa
Uiqpa Cloruro de secpentilo
Cloruro de secpentilo Iso heptil
Iso heptil Ciclopentano
Ciclopentano Cicloalcanos
Cicloalcanos Propiedades fisicas de los alcanos
Propiedades fisicas de los alcanos Tabla de alquinos
Tabla de alquinos Nomenclatura de alcanos ejercicios resueltos
Nomenclatura de alcanos ejercicios resueltos Formula de los alcanos
Formula de los alcanos Principales usos de los alcanos
Principales usos de los alcanos Acilacion
Acilacion Propiedades fisicas alcanos
Propiedades fisicas alcanos Ejercicios hidrocarburos
Ejercicios hidrocarburos Hidrocarburos
Hidrocarburos Alquilos
Alquilos Nomenclatura dos hidrocarbonetos ramificados
Nomenclatura dos hidrocarbonetos ramificados Reglas para nombrar alcanos ramificados
Reglas para nombrar alcanos ramificados Número atomico de carbono
Número atomico de carbono Parafinas alcanos
Parafinas alcanos Nomenclatura de los alcanos
Nomenclatura de los alcanos Ter pentilo
Ter pentilo Decalina
Decalina Corresponde a
Corresponde a Características de los alcanos, alquenos y alquinos
Características de los alcanos, alquenos y alquinos Princípio ampla defesa
Princípio ampla defesa Aula inaugural de historia 6 ano
Aula inaugural de historia 6 ano Campus virtual farem esteli
Campus virtual farem esteli Aula extendida udla
Aula extendida udla Unimol aula virtuale
Unimol aula virtuale Proyecto de aula lectoescritura
Proyecto de aula lectoescritura Na tabela 1 do slide 7/28 da aula 2
Na tabela 1 do slide 7/28 da aula 2 Plano de aula linguagem educação infantil
Plano de aula linguagem educação infantil Aula constitucional
Aula constitucional Aula administratorvejledning
Aula administratorvejledning De acordo com que vimos durante a aula
De acordo com que vimos durante a aula Aula virtual cpel
Aula virtual cpel Actividades de perdon
Actividades de perdon Ampa margarita salas
Ampa margarita salas Sofos cursos
Sofos cursos Etnografía en el aula
Etnografía en el aula Aula hjemmeside redigering
Aula hjemmeside redigering Aula 21
Aula 21 Colegio privado
Colegio privado Aula virtua uniminuto
Aula virtua uniminuto Aula hjemmeside redigering
Aula hjemmeside redigering 9 ano iii bimestre aula 1
9 ano iii bimestre aula 1 Aula cartoon
Aula cartoon Aula digital itc
Aula digital itc A aula de zumba mistura varios ritmos
A aula de zumba mistura varios ritmos Fim de aula
Fim de aula Aula virtual universidad de valencia
Aula virtual universidad de valencia Funedo aula virtual
Funedo aula virtual Nico es responsable de la biblioteca de su aula
Nico es responsable de la biblioteca de su aula Nivel de serviço logistico
Nivel de serviço logistico Como organizar los rincones de aprendizaje en el aula
Como organizar los rincones de aprendizaje en el aula Aula althia
Aula althia O que significa
O que significa Imes aula virtual
Imes aula virtual Aula virtual universitat de valencia
Aula virtual universitat de valencia Tipos de clima emocional
Tipos de clima emocional Habilidades bncc meio ambiente
Habilidades bncc meio ambiente Aula virtual ies cantabria
Aula virtual ies cantabria Mid-tribulacionismo
Mid-tribulacionismo Ejemplo de observación participante en el aula
Ejemplo de observación participante en el aula Iescanet aula virtual
Iescanet aula virtual Aula virtual do ies xulian magariños
Aula virtual do ies xulian magariños Tele aula
Tele aula Aula
Aula Aula virtual ucaldas
Aula virtual ucaldas Escuela normal superior sarmiento san juan
Escuela normal superior sarmiento san juan Plano de aula regras de convivência educação infantil
Plano de aula regras de convivência educação infantil Plan de aula de español grado noveno
Plan de aula de español grado noveno Paulo cesar sentelhas
Paulo cesar sentelhas Competências socioemocionais
Competências socioemocionais Aula de alongamento
Aula de alongamento Aula virtual santa clara de asis
Aula virtual santa clara de asis Unisan aula virtual
Unisan aula virtual