TRNG H CNG NGHIP TP H CH MINH






























- Slides: 48

TRƯỜNG ĐH CÔNG NGHIỆP TP HỒ CHÍ MINH CƠ SỞ ĐÀO TẠO MIỀN TRUNG KHOA CÔNG NGHỆ VẬT LIỆU HỌC NGÀNH HÓA 2206041140 2 (2, 0, 4) Tài liệu tham khảo: 1, Vật liệu học cơ sở, Nghiêm Hùng, NXB KH & KT – 2002. 2, Vật liệu học , B. N. Arzamaxov, NXB Giáo dục – 2000. 3, Vật liệu cơ khí, KS Nguyễn Thị Yên, NXB Hà Nội - 2004 4, Bài giảng Vật liệu học, TS. Hà Văn Hồng 5, Giáo trình Vật liệu cơ khí, Th. S. Châu Minh Quang

Phần I: CẤU TRÚC VÀ TÍNH CHẤT CỦA VẬT LiỆU Chương 1: CẤU TRÚC CỦA VẬT LiỆU 1. 1 Cấu tạo và liên kết nguyên tử 1. 1. 1. Khái niệm cơ bản về cấu tạo nguyên tử - Nguyeân töû laø haït nhoû nhaát cuûa moät nguyeân toá hoùa hoïc khoâng theå bò phaân chia veà maët hoùa hoïc. + Hạt nhân ở tâm: (+) + Các e bao quanh hạt nhân: (-) + Ở trạng thái bình thường: trung hòa điện tích

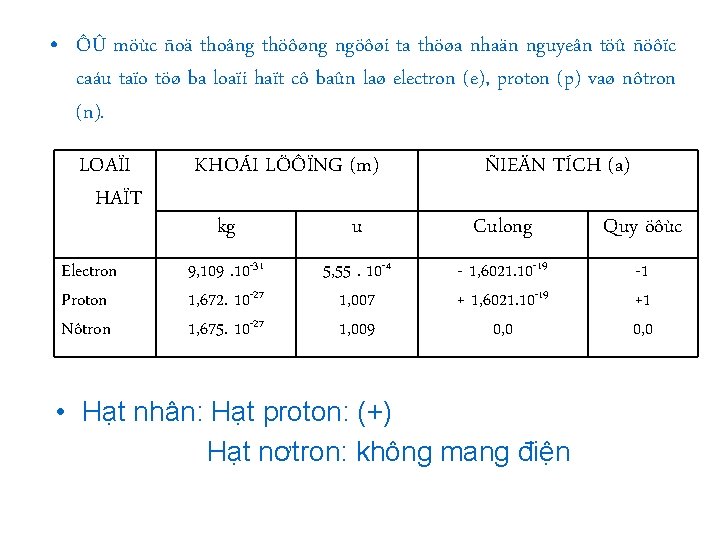
• ÔÛ möùc ñoä thoâng thöôøng ngöôøi ta thöøa nhaän nguyeân töû ñöôïc caáu taïo töø ba loaïi haït cô baûn laø electron (e), proton (p) vaø nôtron (n). LOAÏI HAÏT Electron Proton Nôtron KHOÁI LÖÔÏNG (m) ÑIEÄN TÍCH (a) kg u Culong Quy öôùc 9, 109. 10 -31 1, 672. 10 -27 1, 675. 10 -27 5, 55. 10 -4 1, 007 1, 009 - 1, 6021. 10 -19 + 1, 6021. 10 -19 0, 0 -1 +1 0, 0 • Hạt nhân: Hạt proton: (+) Hạt nơtron: không mang điện

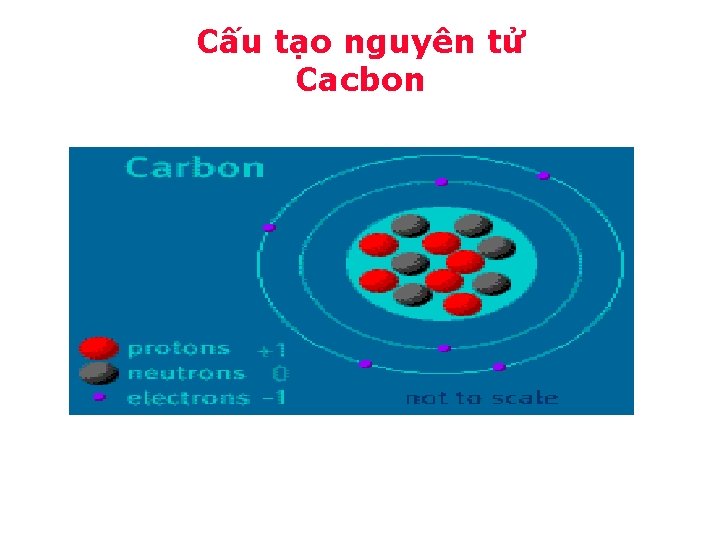
Cấu tạo nguyên tử Cacbon


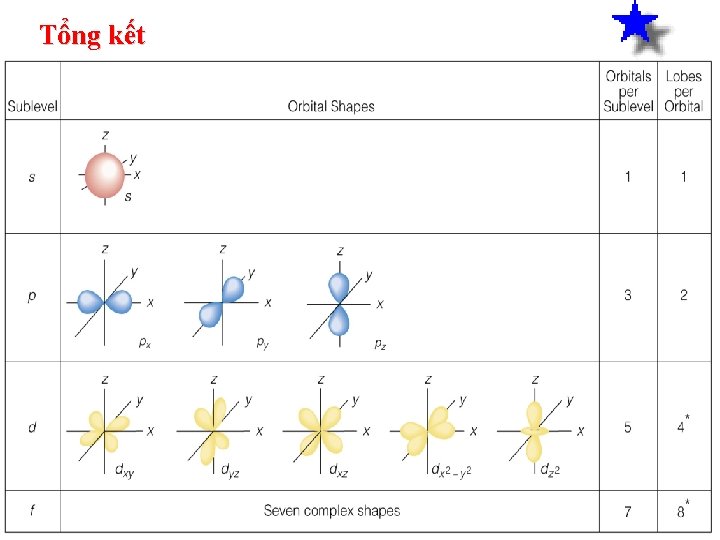
Lớp điện tử: Gồm các điện tử cùng số lượng tử chính n Số lượng tử chính 1 n: Ký hiệu lớp lượng K tử: 2 3 4 5 6 7 L M N O P Q Phân lớp điện tử: Gồm các điện tử cùng số lượng tử chính n và số lượng tử phụ l Số lượng tử orbitan l: 0 Ký hiệu phân lớp lượng s tử: 1 p 2 d 3 f 4 g 5 h

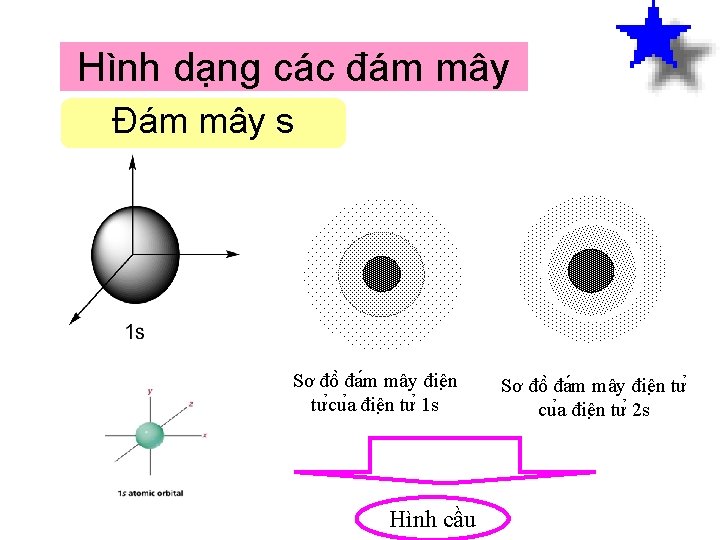
Hình dạng các đám mây Đám mây s Sơ đô đa m mây điê n tư cu a điê n tư 1 s Hình cầu Sơ đô đa m mây điê n tư cu a điê n tư 2 s

Hình dạng các đám mây Đám mây s

Hình dạng các đám mây Đám mây s

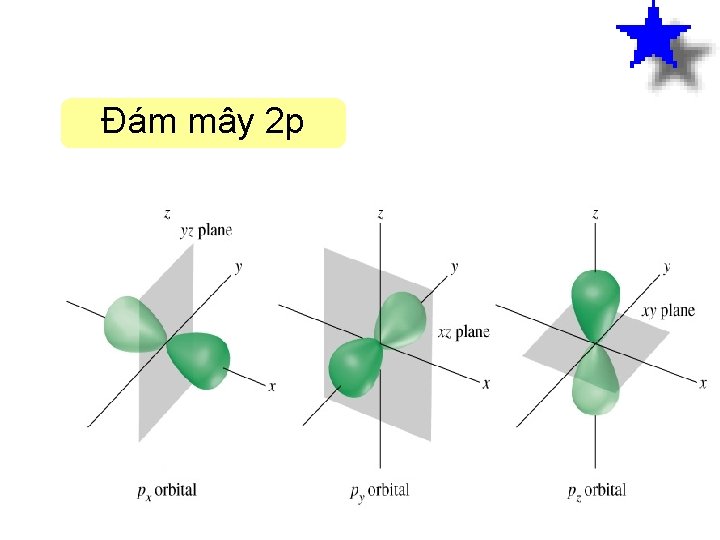
Đám mây 2 p Hình dạng đa m mây điê n tư 2 px Hình dạng đa m mây điê n tư 2 py Hình dạng 8 Hình dạng đa m mây điê n tư 2 pz

Đám mây 2 p

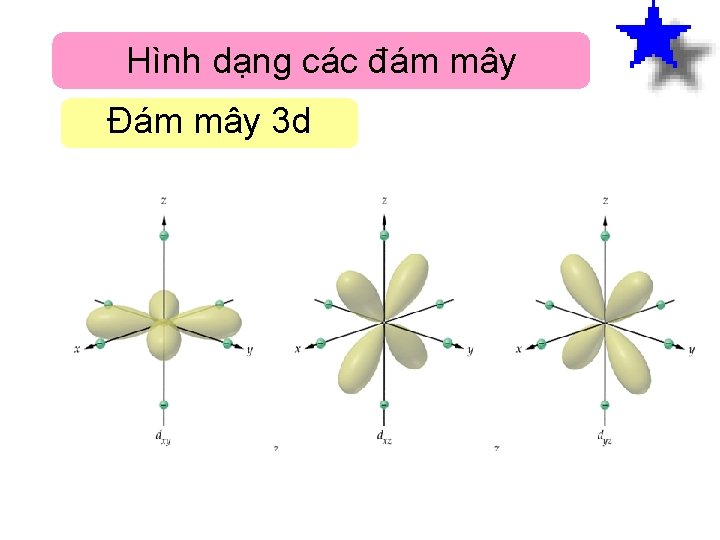
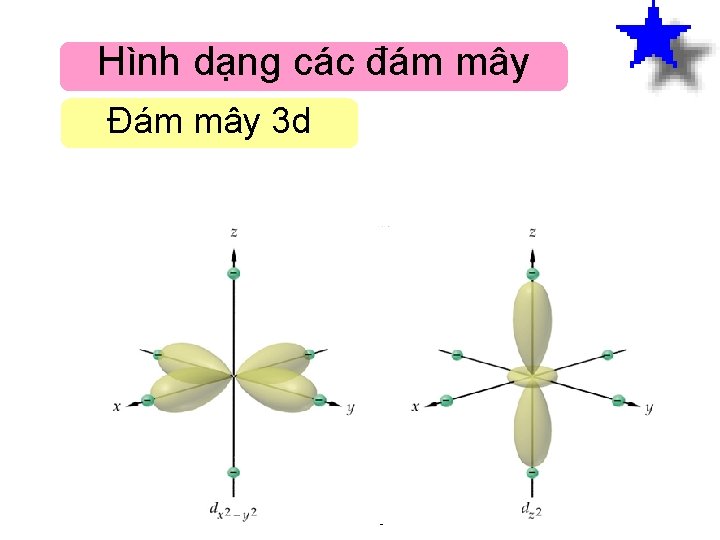
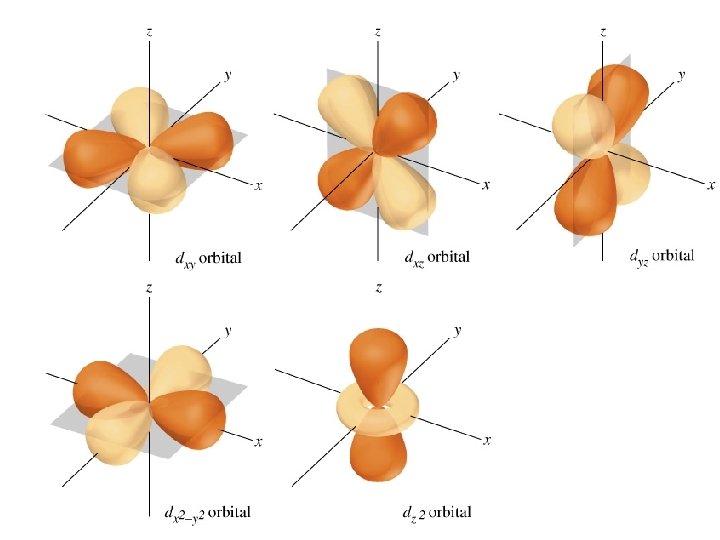
Hình dạng các đám mây Đám mây 3 d

Hình dạng các đám mây Đám mây 3 d


Tổng kết

1. 1. 2. Liên kết nguyên tử -Liên kết cộng hóa trị -Liên kết ion -Liên kết kim loại

1. 2. Sắp xếp nguyên tử trong vật chất

Khí Lỏng Rắn

Hình dạng Thể tích Khí Không xác định Lỏng Không xác định Xác định Rắn Xác định

Quá trình chuyển trạng thái Liberates Energy Khí Hóa hơi Ngưng tụ Lỏng Hóa rắn Nóng chảy Requires Energy Rắn

Trạng thái rắn Ø Chaát raén tinh theå vaø chaát raén voâ ñònh hình - Chaát raén tinh theå + Coù khaû naêng töï keát tinh thaønh caùc haït nhieàu maët, nhieàu caïnh, nhieàu choùp. + Goùc taïo bôûi hai maët töông öùng cuûa tinh theå luoân coù giaù trò khoâng ñoåi. + Beân trong tinh theå caùc nguyeân töû, phaân töû, ion ñöôïc phaân boá moät caùch tuaàn hoøan theo nhöõng quy luaät nhaát ñònh taïo thaønh maïng löôùi khoâng gian ñeàu ñaën. + Nhieät ñoä noùng chaûy cuûa tinh theå xaùc ñònh vaø khoâng thay ñoåi trong suoát quaù trình noùng chaûy. + Khoâng coù tính ñaúng höôùng.

Trạng thái rắn - Chất rắn vô định hình + Không có khả năng kết tinh thành tinh thể có hình dạng xác định. + Các cấu tử sắp xếp hỗn độn. + Không có nhiệt độ nóng chảy nhất định. + Có tính đẳng hướng.

Trạng thái rắn Cộng hoá trị Ø Các kiểu mạng lưới tinh thể ü Mạng lưới cộng hóa trị Được tạo thành từ những nguyên tử liên kết với nhau bằng lực liên kết cộng hóa trị Dùng chung Electron

Trạng thái rắn Ø Các kiểu mạng lưới tinh thể ü Mạng lưới phân tử Các tiểu phân cấu trúc là những phân tử (trừ khí hiếm), chúng hút nhau bằng lực hút yếu Van der Waals, đôi khi cả liên kết hydro. Vì vậy, cấu trúc mạng lưới phân tử dễ nóng chảy, dễ hóa hơi, tương đối mềm.

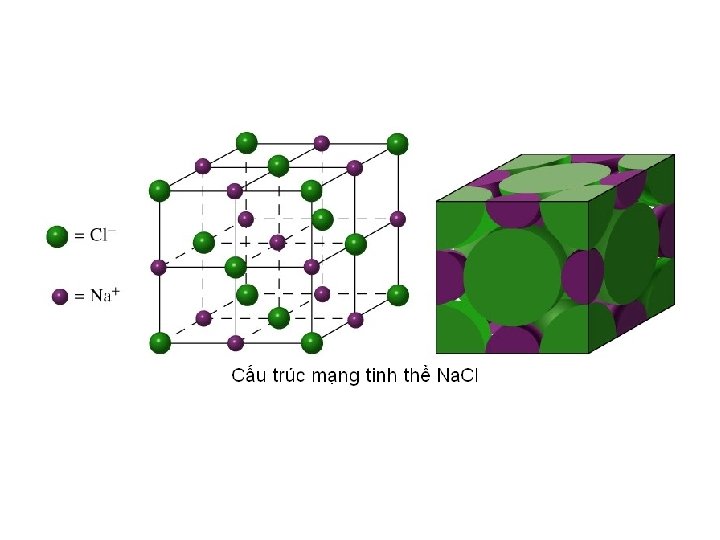
Trạng thái rắn Ø Các kiểu mạng lưới tinh thể Mạng lưới tinh thể ion Được tạo thành từ những ion ngược dấu luân phiên nằm tại nút mạng và liên kết vớI nhau bằng lực hút tĩnh điện. ü Na. Cl:


Trạng thái rắn Ø Các kiểu mạng lưới tinh thể Mạng kim lọai Được đặc trưng bằng các ion dương nằm tại nút mạng và liên kết giữa chúng là liên kết kim lọai ü

1. 3. Khái niệm về mạng tinh thể

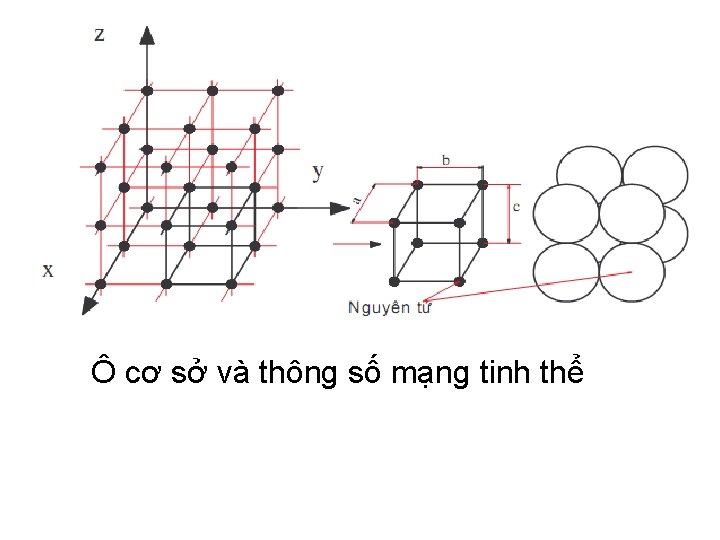
Ô cơ sở và thông số mạng tinh thể

Thông số mạng z c a x b y Moãi oâ maïng cô sôû töông öùng vôùi moät hình hoäp coù 6 thoâng soá maïng goàm 3 ñoä daøi a, b, c vaø 3 ñoä lôùn cuûa caùc goùc , , . Döïa vaøo caùc caïnh vaø caùc goùc treân oâ maïng cô sôû, chia ra 7 heä tinh theå nguyeân thuyû goïi laø 7 maïng löôùi Brave ñôn giaûn.

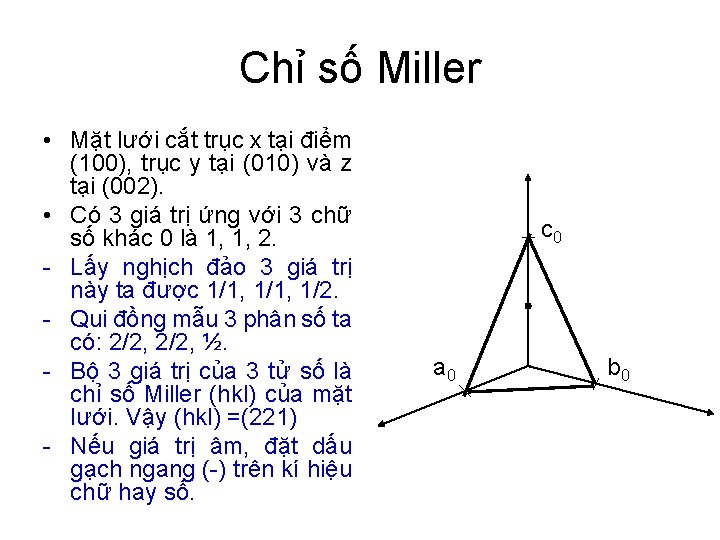
Tọa độ và chỉ số Miller • Vị trí 1đv cấu trúc trong ô mạng cơ sở được xđ bởi 3 tọa độ (x, y, z) hay (a, b, c). Qui ước: • a= 1 trên trục x hay a • b =1 trên trục y hay b • c =1 trên trục z hay c Tọa độ điểm P (1, 1, 1), N(½, ½, 1) Trong tinh thể học, thường dùng chỉ số Miller để kí hiệu tọa độ của 1 mặt lưới của ô mạng cơ sở. Mặt lưới của ô mạng cơ sở là một mp bất kỳ có trong ô mạng đó. z (c) N P y(b) x (a)

Chỉ số Miller • Mặt lưới cắt trục x tại điểm (100), trục y tại (010) và z tại (002). • Có 3 giá trị ứng với 3 chữ số khác 0 là 1, 1, 2. - Lấy nghịch đảo 3 giá trị này ta được 1/1, 1/2. - Qui đồng mẫu 3 phân số ta có: 2/2, ½. - Bộ 3 giá trị của 3 tử số là chỉ số Miller (hkl) của mặt lưới. Vậy (hkl) =(221) - Nếu giá trị âm, đặt dấu gạch ngang (-) trên kí hiệu chữ hay số. c 0 a 0 b 0

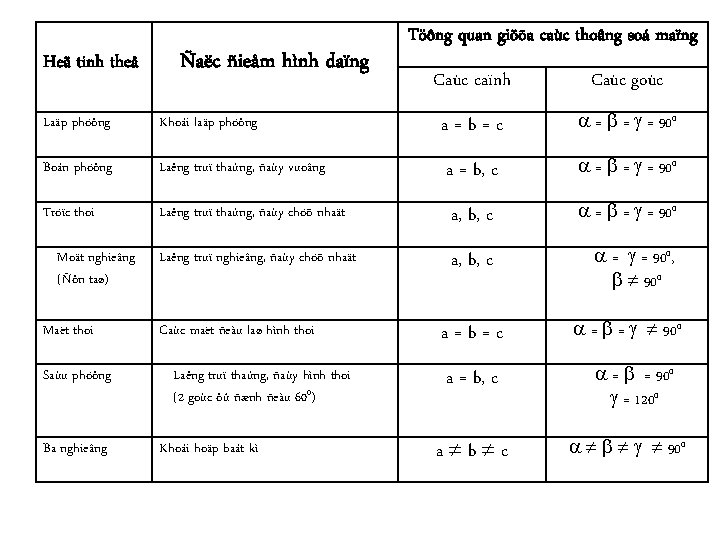
Heä tinh theå Ñaëc ñieåm hình daïng Töông quan giöõa caùc thoâng soá maïng Caùc caïnh Caùc goùc Laäp phöông Khoái laäp phöông a=b=c = = = 900 Boán phöông Laêng truï thaúng, ñaùy vuoâng a = b, c = = = 900 Tröïc thoi Laêng truï thaúng, ñaùy chöõ nhaät a, b, c = = = 900 Laêng truï nghieâng, ñaùy chöõ nhaät a, b, c = = 900, 900 Moät nghieâng (Ñôn taø) Maët thoi Saùu phöông Ba nghieâng Caùc maët ñeàu laø hình thoi Laêng truï thaúng, ñaùy hình thoi (2 goùc ôû ñænh ñeàu 600) Khoái hoäp baát kì a=b=c a = b, c a b c = = 900 = 1200 900

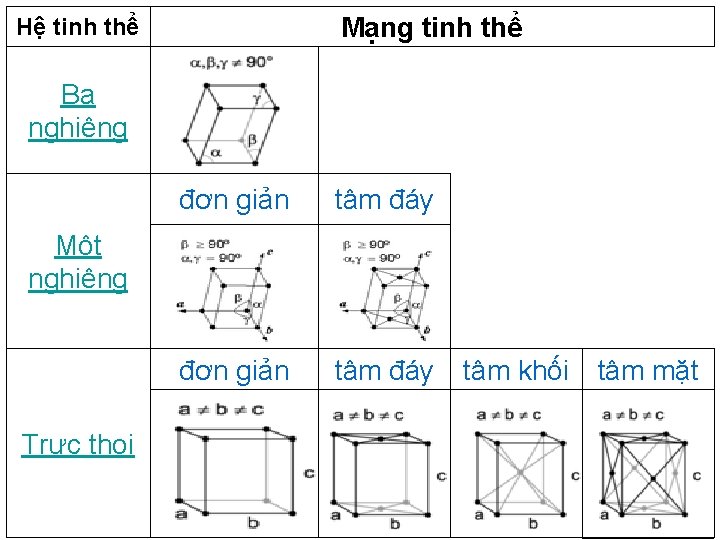
Mạng tinh thể Hệ tinh thể Ba nghiêng đơn giản Một nghiêng Trực thoi tâm đáy đơn giản tâm đáy tâm khối tâm mặt

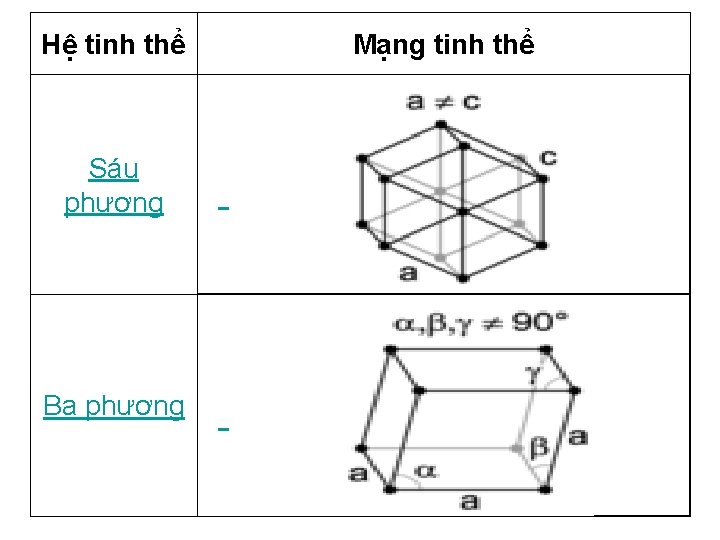
Hệ tinh thể Sáu phương Ba phương Mạng tinh thể

Hệ tinh thể Mạng tinh thể đơn tâm giản khối Bốn phương Lập phương đơn tâm giản khối tâm mặt

• Lập phương đơn giản: là một hình lập phương, mỗi nút mạng là một nguyên tử nằm ở đỉnh của hình lập phương có cạnh là hằng số mạng. Cấu trúc lập phương đơn giản chỉ chứa 1 nguyên tử trong một ô nguyên tố. • Lập phương tâm mặt (hay lập phương diện tâm): là cấu trúc lập phương với các nguyên tử nằm ở các đỉnh hình lập phương (8 nguyên tử) và 6 nguyên tử khác nằm ở tâm của các mặt của hình lập phương. Cấu trúc này chứa 4 nguyên tử trong một ô nguyên tố. Trong tinh thể học, cấu trúc lập phương tâm mặt được ký hiệu là fcc (Face-centered cubic). Các chất điển hình có cấu trúc fcc là nhôm, đồng. . . • Lập phương tâm khối: là cấu trúc lập phương với 8 nguyên tử ở các đỉnh hình lập phương và 1 nguyên tử ở tâm của hình lập phương. Cấu trúc này chứa 2 nguyên tử trong một ô nguyên tố, và thường được ký hiệu là bcc (Body-centered cubic).

Hệ số xếp chặt • Cấu trúc lập phương đơn giản có hệ số xếp chặt chỉ là 52%. • Cấu trúc lập phương tâm mặt có hệ số xếp chặt là 74%. • Cấu trúc lập phương tâm khối có hệ số xếp chặt 68%.

Các chất có cấu trúc lập phương • Cấu trúc đơn nguyên tử: Cấu trúc lập phương đơn nguyên tử tồn tại khá nhiều trong các kim loại (điển hình là kim loại chuyển tiếp). Cấu trúc lập phương đơn giản có hệ số xếp chặt rất thấp nên kém bền hơn, chất điển hình mang cấu trúc này là Polonium (Po). Cấu trúc fcc và bcc tồn tại phổ biến ở các kim loại, ví dụ như đồng, nhôm. . . mang cấu trúc fcc, sắt, crôm. . . mang cấu trúc bcc. • Cấu trúc đa nguyên tử: Cấu trúc lập phương cũng tồn tại trong các chất có nhiều loại nguyên tử, ví dụ trong các hợp kim, hợp chất. . . Muối ăn (Na. Cl) là hợp chất điển hình với cấu trúc fcc, hợp kim Fe(Si) là hợp kim điển hình mang cấu trúc bcc. . .

Mạng tinh thể lập phương thể tâm (Lập phương tâm khối) ĐN: Là mạng tinh thể có ô cơ sở là hình lập phương, trong đó các nguyên tử nằm ở các đỉnh và tâm khối. Mỗi ô nv = 8đỉnh. 1/8 + 1 giữa = 2 nguyên tử

Mạng tinh thể lập phương tâm mặt (lập phương diện tâm) Mỗi ô mạng cơ sở có 8 ng tử ở đỉnh, 6 ng tử ở 6 mặt (mà mỗi ng tử chung 2 mặt tiếp xúc của 2 ô mạng). Vậy mỗi ô cơ sở có: 1/8. 8 + ½. 6 = 4 ng tử

Mạng tinh thể sáu phương xếp chặt


Số phối trí • Là số đơn vị cấu trúc (hay số quả cầu) bao quanh 1 đv cấu trúc (1 quả cầu) đang xét trong 1 ô mạng cơ sở. Ô MẠNG CƠ SỞ Tứ diện Bát diện Lập phương nguyên thủy Sáu phương đặc khít Lập phương tâm mặt SỐ PHỐI TRÍ 4 6 8 12 12

Kiểu mạng tinh thể và số sắp xếp • Hợp chất trung hòa điện tích: đ tích âm = đ tích dương • Yếu tố quyết định đến kiểu tinh thể và số phối trí của mạng ceramic là tương quan rc/ra < 0, 155 Khoảng 0, 155 – 0, 225 Khoảng 0, 225 – 0, 414 Khoảng 0, 414 – 0, 732 Khoảng 0, 732 – 1, 0 Số phối trí max 2 3 4 6 8

Tính thù hình của kim loại

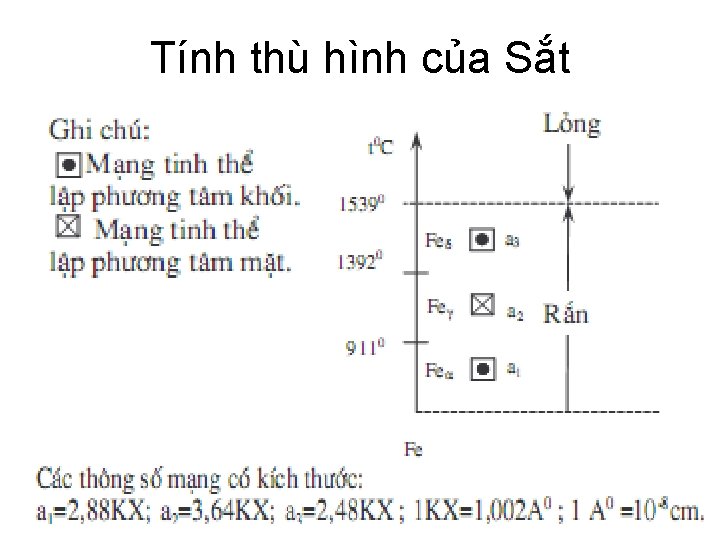
Tính thù hình của Sắt

 Sutron data logger
Sutron data logger Trc t
Trc t Logo cng
Logo cng Lng vs cng
Lng vs cng Cng h
Cng h Cng fyllestasjoner norge
Cng fyllestasjoner norge Kỹ thuật bào chế viên nang cứng
Kỹ thuật bào chế viên nang cứng Sccs library
Sccs library Lng cng
Lng cng Cng vs lng
Cng vs lng Cng cesp
Cng cesp Cng forklift
Cng forklift Cng vn
Cng vn Cng decanting station
Cng decanting station Cng b
Cng b Ho chi minh city technical and economic college
Ho chi minh city technical and economic college Chứng minh định lý kuratowski
Chứng minh định lý kuratowski Hong minh
Hong minh Mình tròn thân trắng dáng hình thon thon
Mình tròn thân trắng dáng hình thon thon Thành phố hồ chí minh nằm bên sông nào
Thành phố hồ chí minh nằm bên sông nào Cách chứng minh hai đường thẳng song song
Cách chứng minh hai đường thẳng song song Hỡi người hãy nhớ mình là bụi tro
Hỡi người hãy nhớ mình là bụi tro Huy hiệu đội thiếu niên tiền phong hồ chí minh
Huy hiệu đội thiếu niên tiền phong hồ chí minh Ho chi minh city technical and economic college
Ho chi minh city technical and economic college Welcome to ho chi minh city
Welcome to ho chi minh city Chứng minh hình bình hành
Chứng minh hình bình hành E se eu chorar toda lagrima
E se eu chorar toda lagrima Ho chi minh city international university
Ho chi minh city international university V gc
V gc Bài thơ bình minh trong vườn
Bài thơ bình minh trong vườn Dr minh ta
Dr minh ta Hcmc industry and trade college
Hcmc industry and trade college Tuan minh le
Tuan minh le Senhor meu deus
Senhor meu deus Khmer rouge apush
Khmer rouge apush Cờ đội thiếu niên tiền phong hồ chí minh
Cờ đội thiếu niên tiền phong hồ chí minh Ho chi minh 1945
Ho chi minh 1945 Con ve cũng mệt vì hè
Con ve cũng mệt vì hè Bao minh insurance corporation
Bao minh insurance corporation Minh mai md
Minh mai md để nguyên nước chấm cổ truyền
để nguyên nước chấm cổ truyền What did the vietminh declare as its main goal
What did the vietminh declare as its main goal Covid ho chi minh city
Covid ho chi minh city Giêsu chúng con tới đây sấp mình
Giêsu chúng con tới đây sấp mình