Tissu osseux Physiologie rgulation de la calcmie et












































- Slides: 87

Tissu osseux Physiologie : régulation de la calcémie et de la phosphorémie Biologie cellulaire du remodelage Application à la physiopathologie

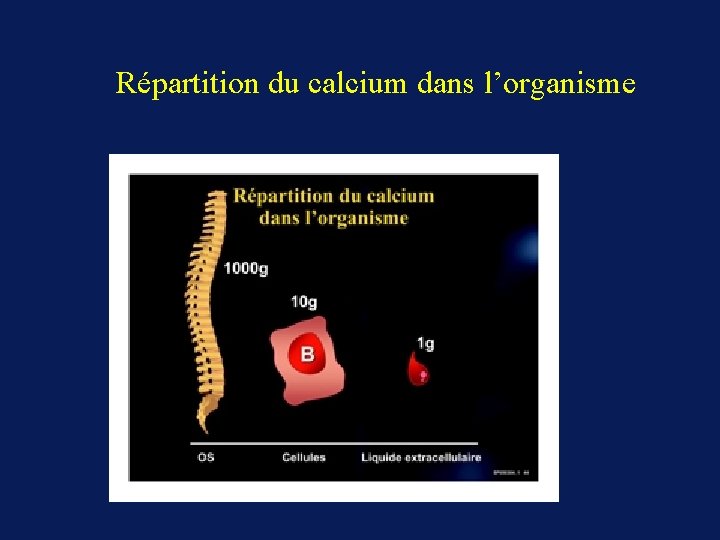
Répartition du calcium dans l’organisme

Echanges du calcium 25 mmole = 1 gr

Les régulateurs de la calcémie • Hormone parathyroidienne • Vitamine D • Calcitonine • Récepteur au calcium • Récepteur de la parathormone

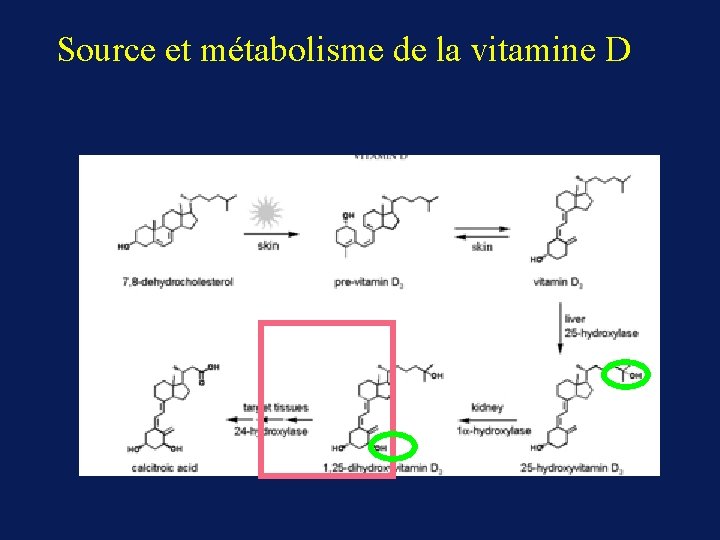
Vitamine D • Source alimentaire et cutanée (hormone) • Stéroïde. • Métabolite actif synthétisé par hydroxylation dans le foie (forme circulante) et le rein • Récepteur = facteur de transcription (récepteur nucléaire), présent dans l’intestin ++ et dans de nombreuses cellules à un taux plus faible

Source et métabolisme de la vitamine D

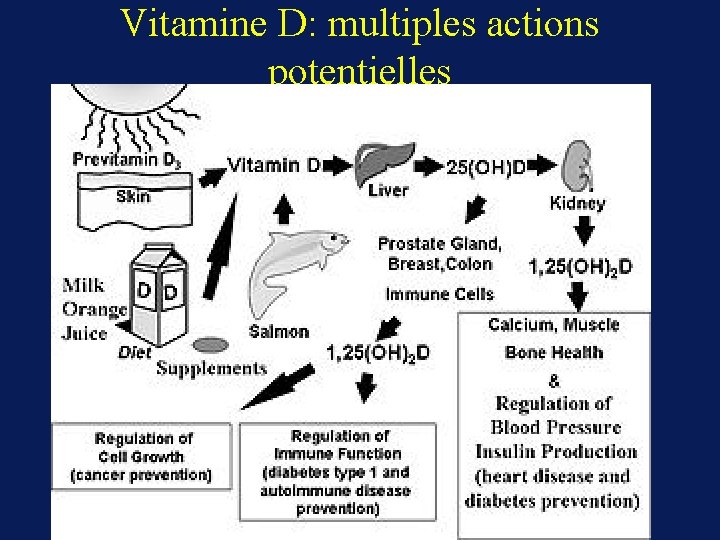
Vitamine D: multiples actions potentielles

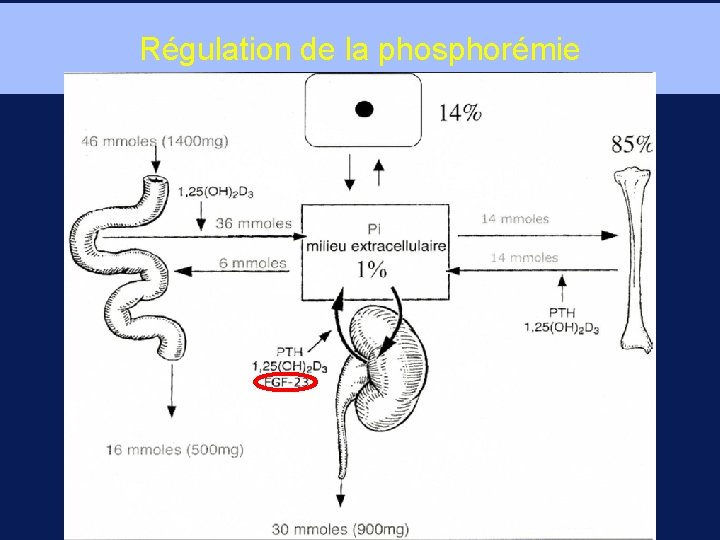
Action biologique de la Vitamine D • La forme circulante qui reflète les stocks de l’organisme est la 25(OH)D • Action biologique est due à la 1, 25 (OH)2 D 3 qui a la meilleur affinité pour le récepteur. • La 1 a hydroxylase rénale est stimulée par PTH et hypocalcémie • Augmentation de l’absorption intestinale du calcium +++ →↑ calcémie • Augmentation de la différenciation des cellules osseuses et autres (cutanées, hématopoïétique) • Diminue la transcription de l’hormone parathyroïdienne

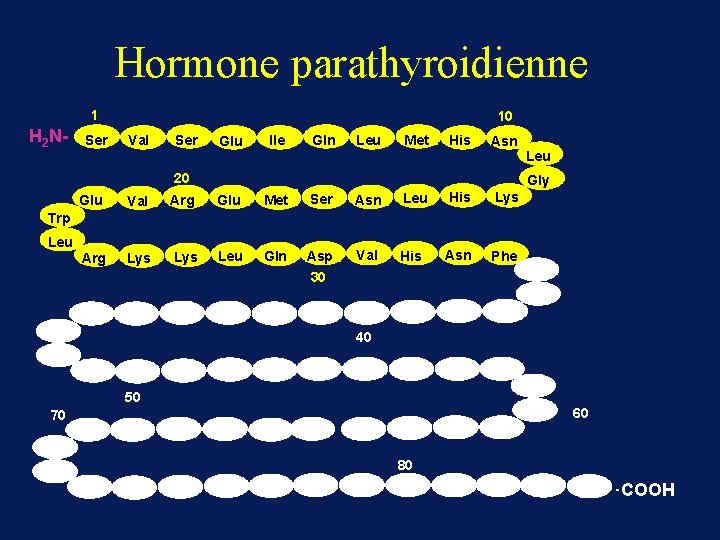
Hormone parathyroidienne (PTH) • Synthétisée dans les 4 glandes parathyroïdes • Hormone polypeptidique 1 -84. Seule la partie 1 -34 est nécessaire à l’action biologique • Agit sur un récepteur à 7 domaines trans-membranaire qui est exprimé dans le rein, les cellules osseuses,

Hormone parathyroidienne 1 H 2 N- Ser 10 Val Ser Glu Ile Gln Leu Met His Asn 20 Leu Gly Glu Val Arg Glu Met Ser Asn Leu His Lys Arg Lys Leu Gln Asp Val His Asn Phe Trp Leu 30 40 50 60 70 80 - COOH

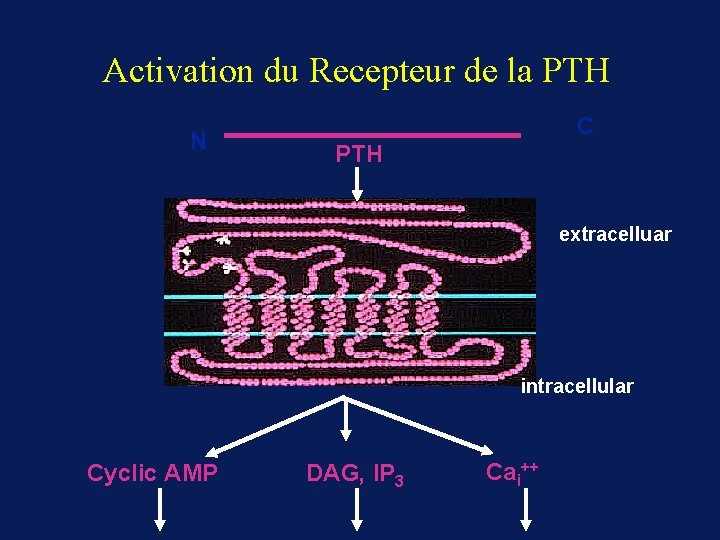
Activation du Recepteur de la PTH N C PTH extracelluar intracellular Cyclic AMP DAG, IP 3 Cai++

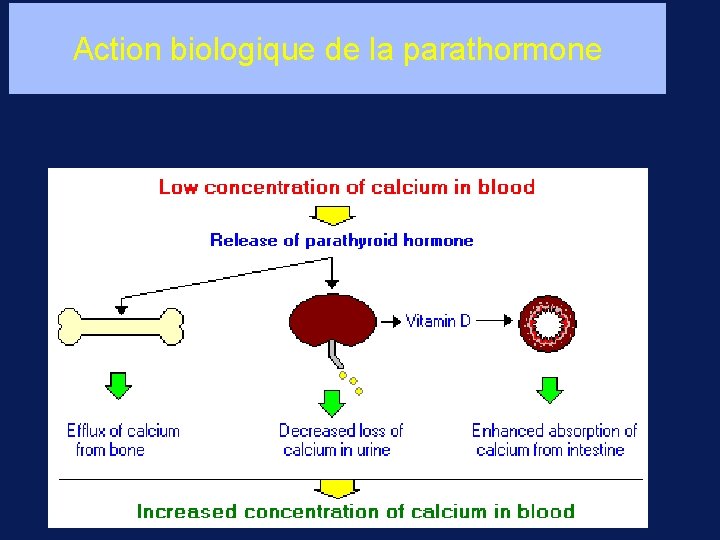
Action biologique de la parathormone • Rein hydroxylation en 1 a vitamine D → absorption intestinale du calcium : : réabsorption tubulaire du calcium → diminution calciurie • Cellules osseuses résorption osseuse Augmente la calcémie

Action biologique de la parathormone

Régulation des hormones par le taux de calcium sérique • Parathormone : synthése lors de l’augmentation de la calcémie grâce à un récepteur du calcium • Vitamine D : synthése lors de la diminution de la calcémie (augmentation de l’hydroxylase rénale due à PTH et ↓calcémie)

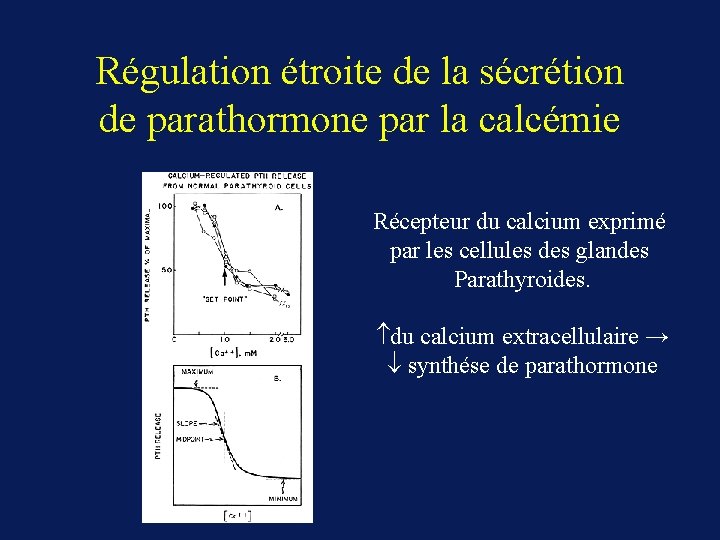
Régulation étroite de la sécrétion de parathormone par la calcémie Récepteur du calcium exprimé par les cellules des glandes Parathyroides. du calcium extracellulaire → synthése de parathormone

Récepteur du calcium

Rôle du récepteur au calcium • En l’absence de récepteur au calcium : hypercalcémie indépendante du taux de parathormone • Activation constitutive du récepteur : hypocalcémie simulant une hypoparathyroidie

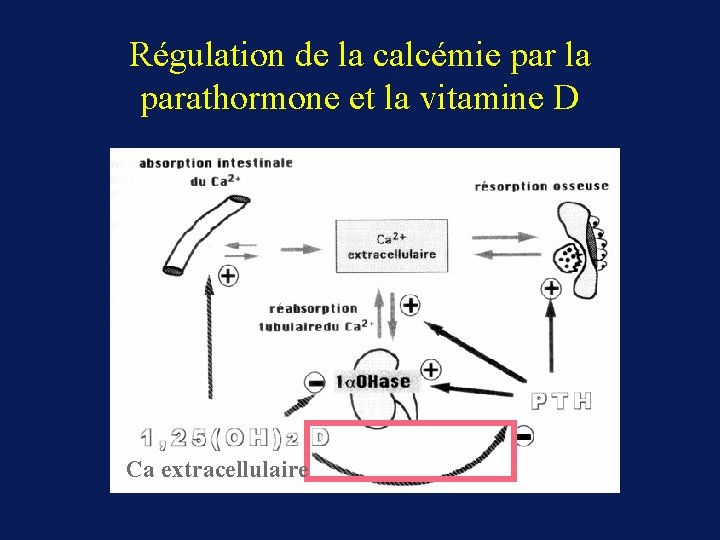
Régulation de la calcémie par la parathormone et la vitamine D Ca extracellulaire

Régulation de la phosphorémie

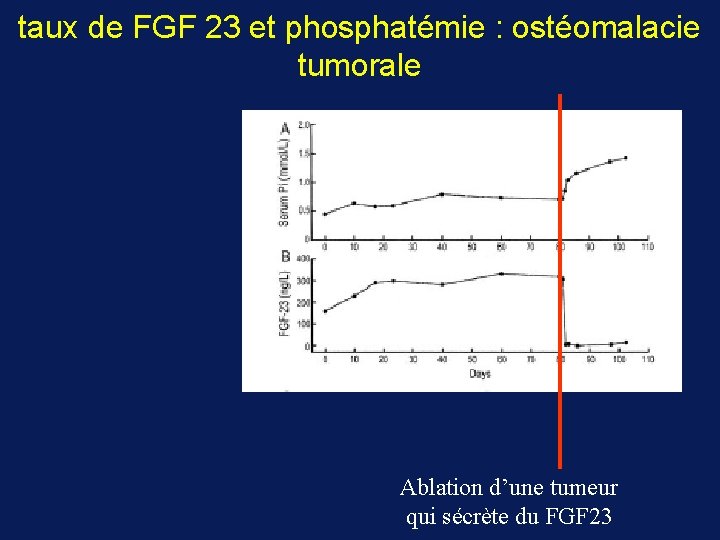
taux de FGF 23 et phosphatémie : ostéomalacie tumorale Ablation d’une tumeur qui sécrète du FGF 23

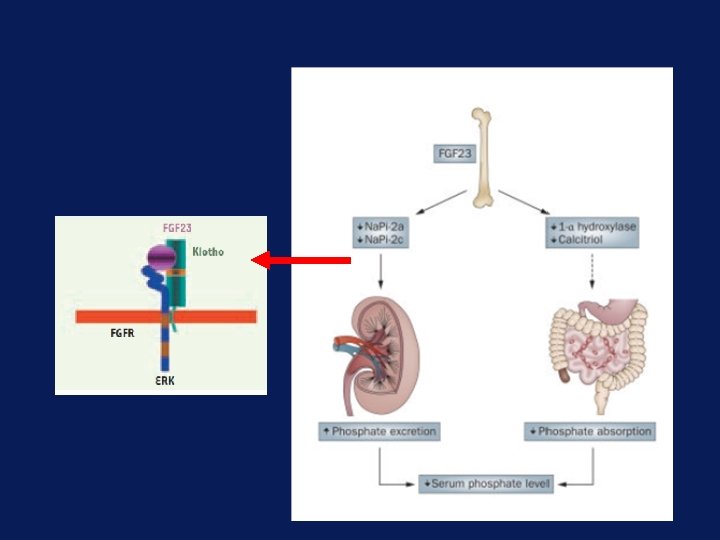
FGF 23 • • • « phosphatonine » : circulant, ↓ la phosphoremie par son action rénale : ↓ la réabsorption rénale (↓ co transporteur du phosphore) ↓ absorption intestinale (↓ production de vitamine D active : 1 -a hydroxylase rénale) Mutation activatrice ou tumeurs hypophosphatémiante → ↑ production de FGF 23 et hypophosphatémie sévère Sécrété essentiellement par les ostéocytes

Action de FGF 23 • FGF 23 se lie à plusieurs FGF-R mais ils nécessitent un co- facteur, Klotho, pour traduire le signal • Klotho est exprimé dans le tubule rénale


Klotho et vieillissement Souris invalidées pour Klotho Kuoro et al Nature 1997

FGF 23 et klotho • Les souris invalidées pour FGF 23 ont une phosphatémie ↑et une durée de vie ↓ identique aux souris invalidées pour Klotho • Le vieillissement accéléré due à l’inhibition de Klotho est il du à l’hyperphosphatémie?

Les anomalies du métabolisme minéral sont une cause de vieillissement prématuré

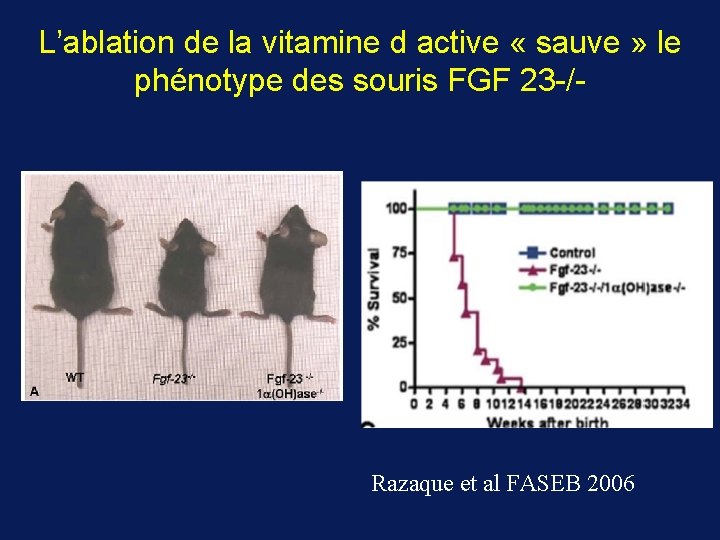
L’ablation de la vitamine d active « sauve » le phénotype des souris FGF 23 -/- Razaque et al FASEB 2006

Le tissu osseux • Les ostéoblastes et la matrice osseuse • Les ostéocytes • Les ostéoclastes • Le remodelage osseux et ses implications • La perte osseuse du vieillissement

Matrice organique 95% : Collagène I 5% : Protéines non collagèniques : Ostéocalcine : spécifique ostéoblaste Dosable dans le sang Témoigne du nombre d’ostéoblastes Rôle des protéines non collagènique : • adhésion des cellules osseuses à la matrice • faciliter ou inhiber la minéralisation • lier les facteurs de croissance Nombreux facteurs de croissances

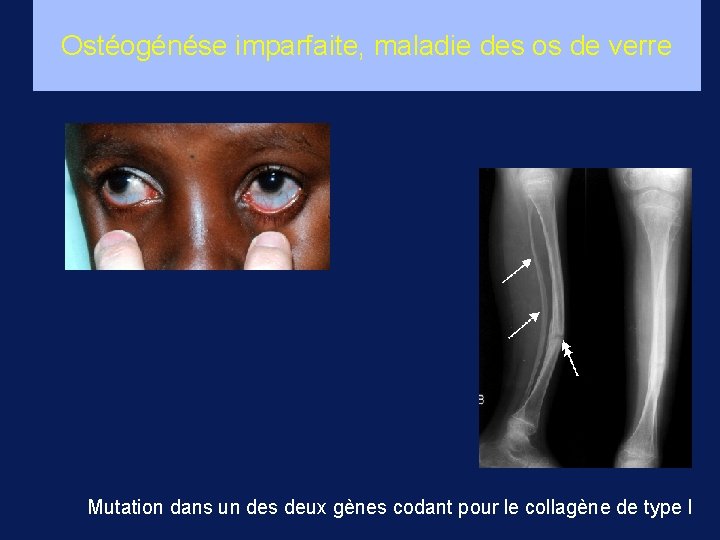
Ostéogénése imparfaite, maladie des os de verre Mutation dans un des deux gènes codant pour le collagène de type I

Matrice : Phase minérale 1. 2 kg de calcium, 600 gr de phosphore ⇨ rôle de réservoir Majorité phosphate de calcium hydraté sous forme de cristal d’hydroxy-apatite. Ca 10 (PO 4)6 (OH)2 Mécanisme de la minéralisation : - apport de calcium et phosphore grâce à la phosphatase alcaline - Rôle de protéines non collagèniques - Phénomène actif sous la dépendance des ostéoblastes

Ostéoblaste : synthétise et minéralise la matrice Os minéralisé ostéocyte Ostéoïde ostéoblastes Moelle hematopoiétique C. Stromale Pré-ostéoblaste

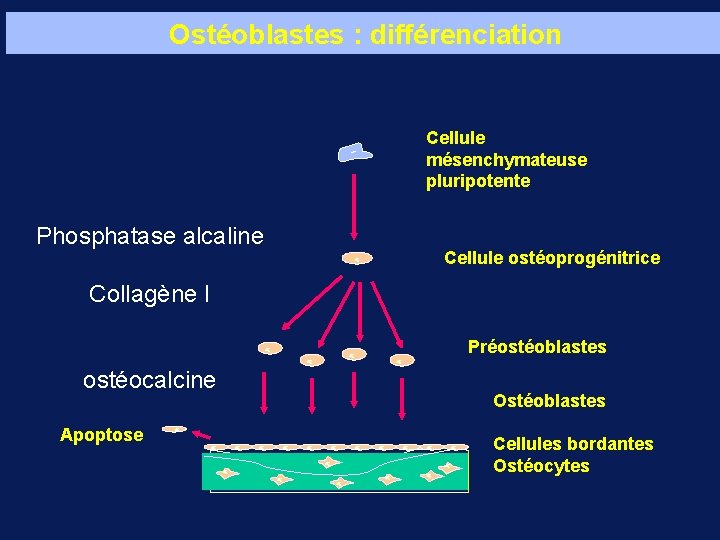
Ostéoblastes : différenciation Cellule mésenchymateuse pluripotente Phosphatase alcaline Cellule ostéoprogénitrice Collagène I Préostéoblastes ostéocalcine Apoptose Ostéoblastes Cellules bordantes Ostéocytes

ostéoblastes • Deux gènes « clefs » – Runx 2 – LRP 5

My , D o 2 F ME myocytes x 2 n u R / 1 a Cbf ostéoblastes PPAR 2 Cellules souches mésenchymateuses Sox 9 adipocytes chondrocytes

Rôle de Runx 2 dans la différenciation ostéoblastique sauvage Runx 2 -/- • Délétion du gène chez la souris : (pas Arrêt de la différenciation ostéoblastique et absence de tissu ossifié (Cell 1997)

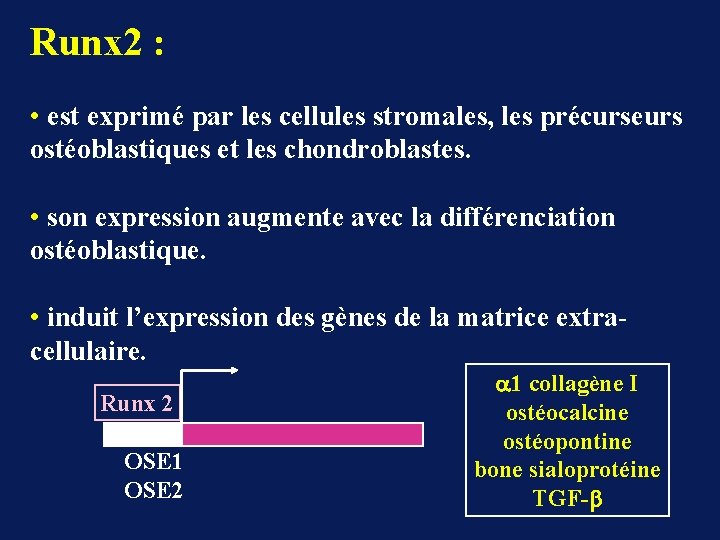
Runx 2 : • est exprimé par les cellules stromales, les précurseurs ostéoblastiques et les chondroblastes. • son expression augmente avec la différenciation ostéoblastique. • induit l’expression des gènes de la matrice extracellulaire. Runx 2 OSE 1 OSE 2 1 collagène I ostéocalcine ostéopontine bone sialoprotéine TGF-

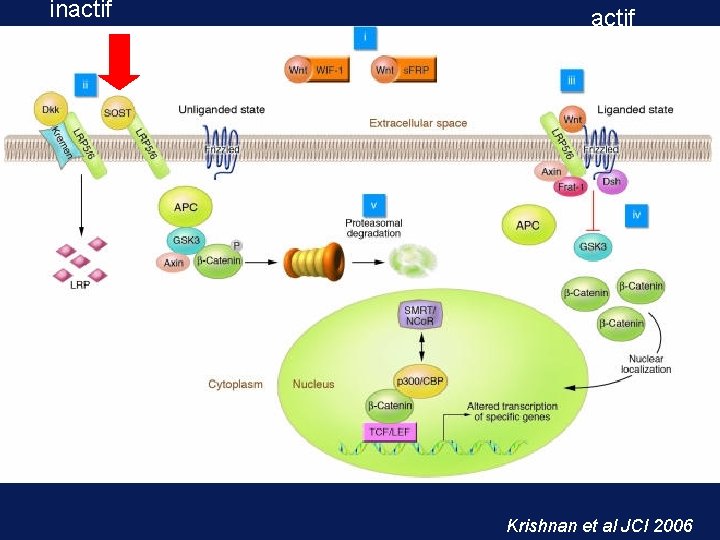
ostéoblastes • Deux gènes « clefs » – Runx 2 : facteur de transcription indispensable à la différenciation – LRP 5 : co –récepteur de la voie wnt dont l’activation (en inhibant GSK) induit le passage de la b-caténine dans le noyau et l’augmentation de plusieurs gènes de prolifération dont ceux des ostéoblastes

inactif Krishnan et al JCI 2006

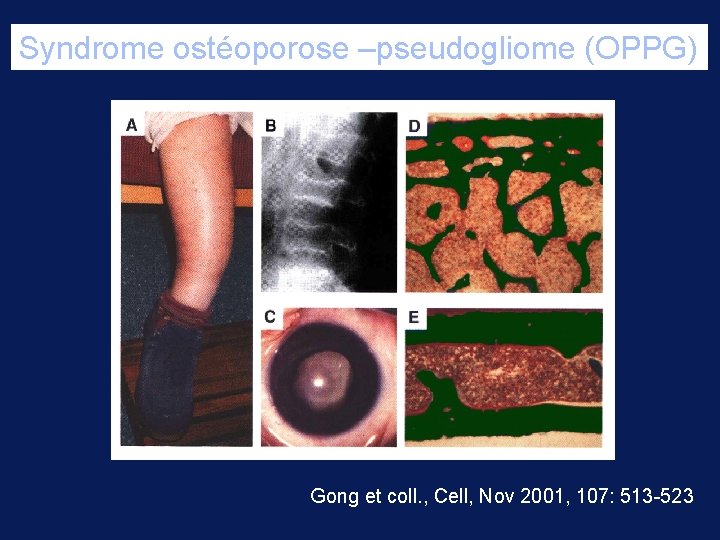
Syndrome ostéoporose –pseudogliome (OPPG) Gong et coll. , Cell, Nov 2001, 107: 513 -523

Des mutations « activatrices » dans le gène de LRP 5 sont responsables d’une masse osseuse élevée par augmentation de la formation osseuse Boyden et coll, NEJM, Mai 2002, 346: 1516

Lrp -5 Low-density lipoprotein Receptor-related Protein 5 ü Données de clinique humaine • Inactivation du gène Lrp-5 → syndrome ostéoporose pseudogliome (maladie récessive ) • Mutation du gène Lrp-5 empêchant sa liaison à son inhibiteur naturel Dkk → Syndrome de masse osseuse élevée dans une famille ü Données expérimentales • Invalidation chez la souris : ostéoporose avec formation osseuse diminuées

LRP 5 et formation osseuse Signal intermittent normal jamais Ostéoporose pas de liaison De wnt à lrp 5 toujours Osteosclérose Pas de liaison de lrp 5 à Dkk

Le tissu osseux • Les ostéoblastes et la matrice osseuse • Les ostéocytes • Les ostéoclastes • Le remodelage osseux et ses implications • La perte osseuse du vieillissement

Ostéocytes • Représentant 90% des cellules osseuses, emmurés dans le minéral et reliées par des canalicules • Moyens d’étude : une lignée cellulaire MLO-Y 4 et des souris invalidés pour certains gènes spécifiquement dans le ostéocytes • Stade terminale de différenciation des ostéoblastes, marqueurs particuliers

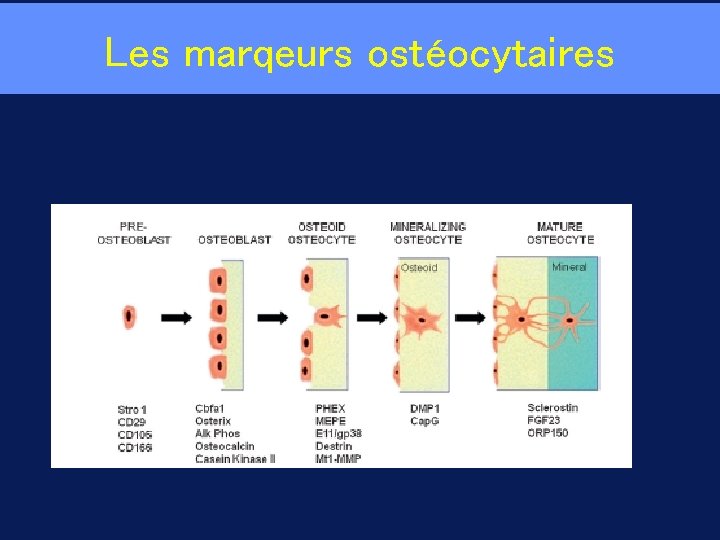
Les marqeurs ostéocytaires

Viabilité et Apoptose des ostéocytes • Mécano-senseurs : Effet positif des contraintes mécaniques • Régulateurs du métabolisme phosphocalcique (FGF 23 et PTH-R) • et du remodelage osseux (RANKL et sclérostine)

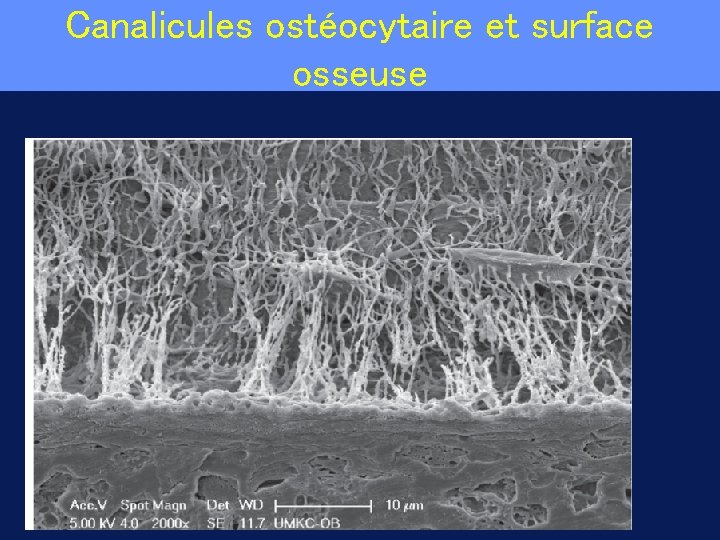
Canalicules ostéocytaire et surface osseuse

Les ostéocytes : cellules sécrétrices • FGF-23 • Sclérostine • RANK-L

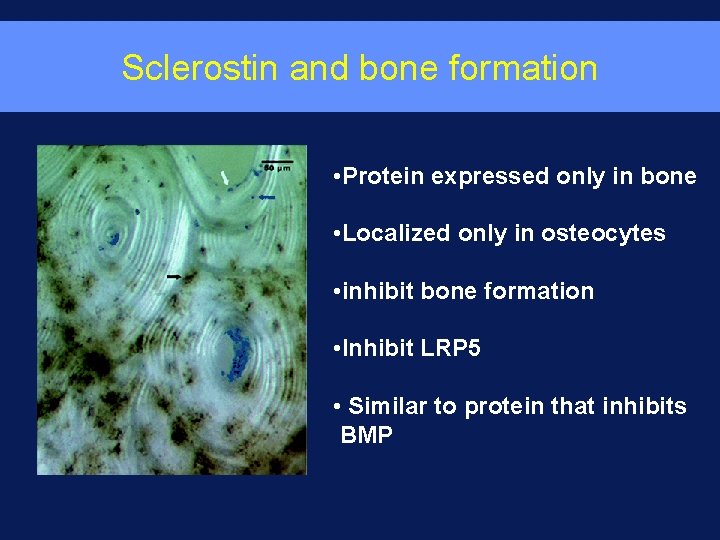
Sclerostin and bone formation • Protein expressed only in bone • Localized only in osteocytes • inhibit bone formation • Inhibit LRP 5 • Similar to protein that inhibits BMP

inactif Krishnan et al JCI 2006

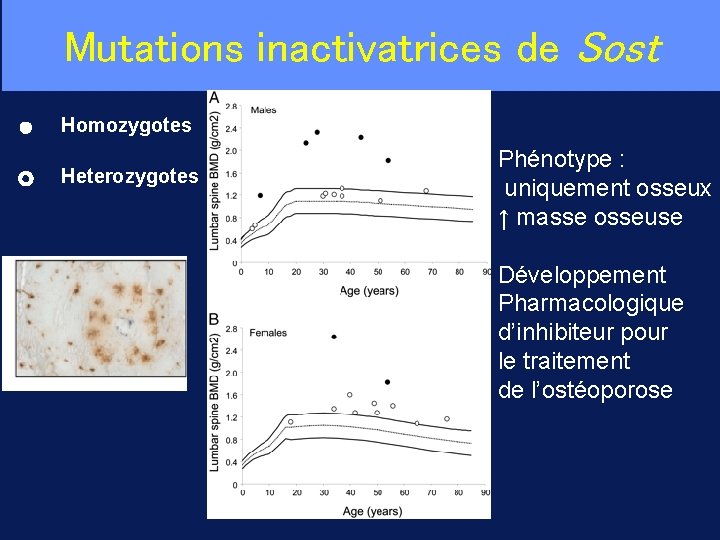
Mutations inactivatrices de Sost Homozygotes Heterozygotes Phénotype : uniquement osseux ↑ masse osseuse Développement Pharmacologique d’inhibiteur pour le traitement de l’ostéoporose

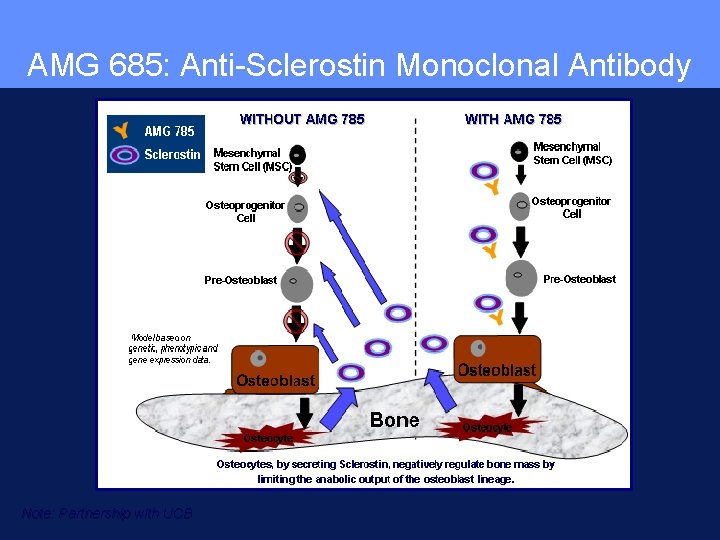
AMG 685: Anti-Sclerostin Monoclonal Antibody Note: Partnership with UCB

Le tissu osseux • Les ostéoblastes et la matrice osseuse • Les ostéocytes • Les ostéoclastes • Le remodelage osseux et ses implications • La perte osseuse du vieillissement

ostéoclastes

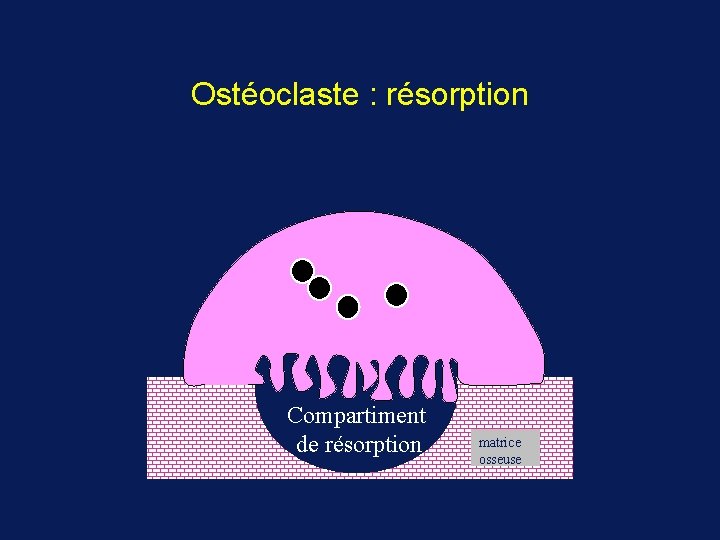
Ostéoclaste : résorption Compartiment de résorption matrice osseuse

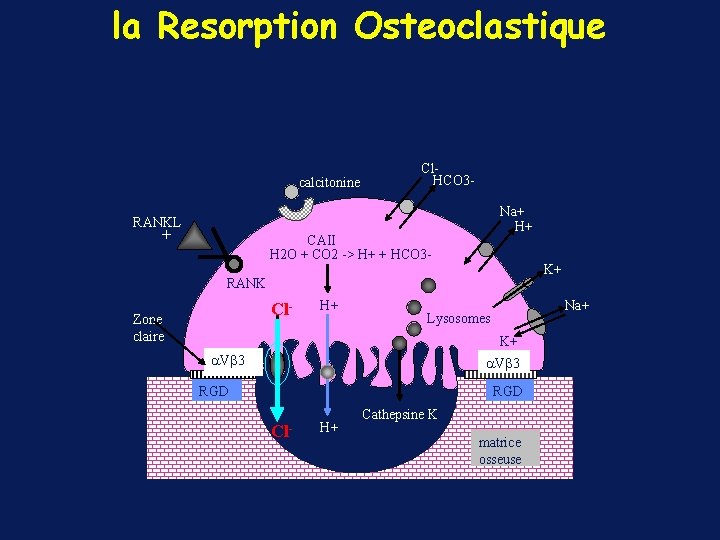
Ostéoclastes • Cellule très différenciée • Fonction de dégradation extracellulaire dans un compartiment entre la bordure plissé et l’os (lysosome secondaire) - Adhésion au tissu osseux - Acidification extracellulaire - Sécrétion de protéases actives à PH acide (Cathepsine K)

la Resorption Osteoclastique calcitonine Cl. HCO 3 Na+ H+ RANKL + CAII H 2 O + CO 2 -> H+ + HCO 3 - K+ RANK Cl- Zone claire H+ Na+ Lysosomes K+ a. Vb 3 RGD Cl- H+ Cathepsine K matrice osseuse

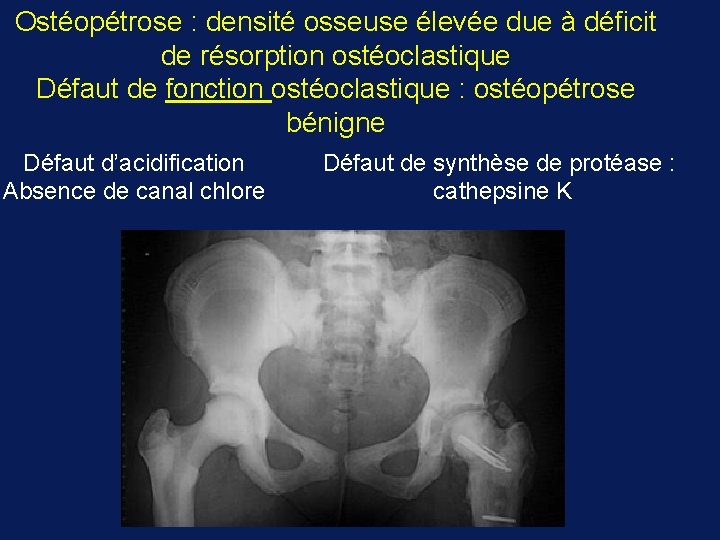
Ostéopétrose : densité osseuse élevée due à déficit de résorption ostéoclastique Défaut de fonction ostéoclastique : ostéopétrose bénigne Défaut d’acidification Absence de canal chlore Défaut de synthèse de protéase : cathepsine K

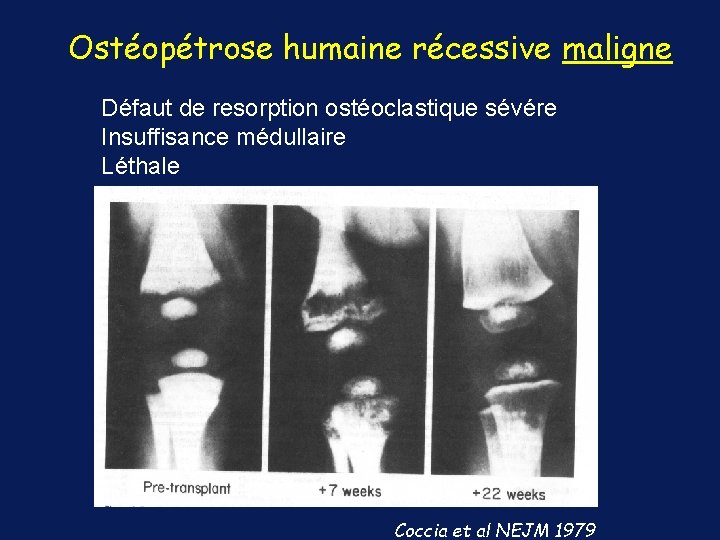
Ostéopétrose humaine récessive maligne Défaut de resorption ostéoclastique sévére Insuffisance médullaire Léthale Coccia et al NEJM 1979

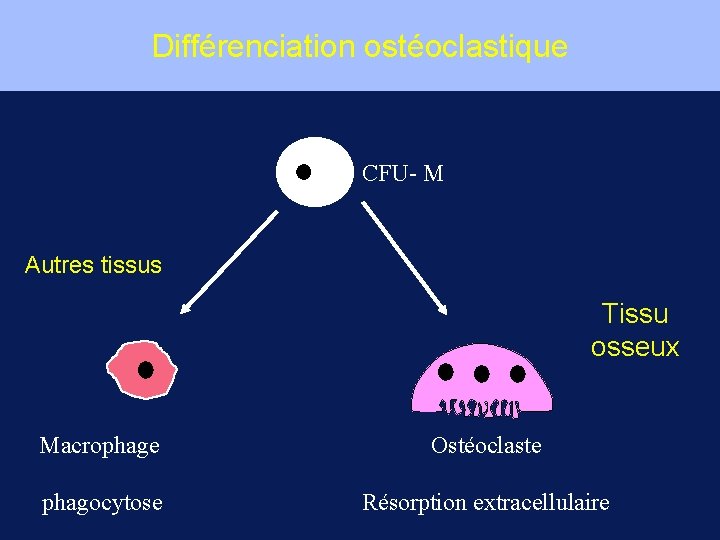
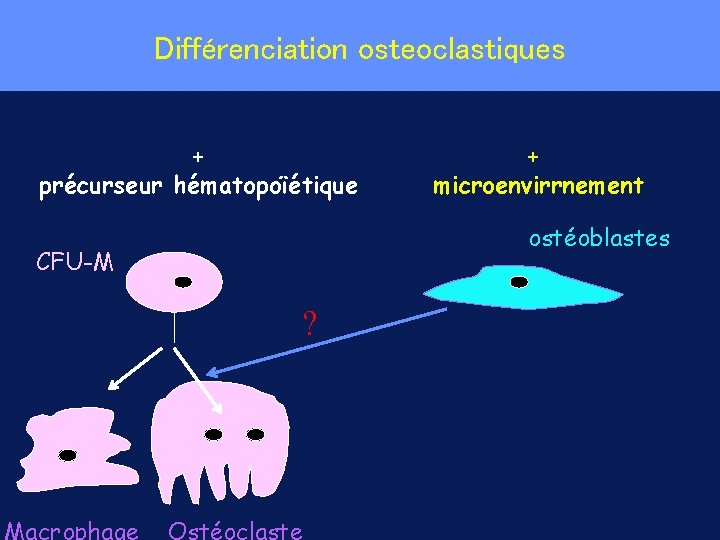
Différenciation ostéoclastique CFU- M Autres tissus Tissu osseux Macrophage Ostéoclaste phagocytose Résorption extracellulaire

Différenciation osteoclastiques + précurseur hématopoïétique + microenvirrnement ostéoblastes CFU-M ?

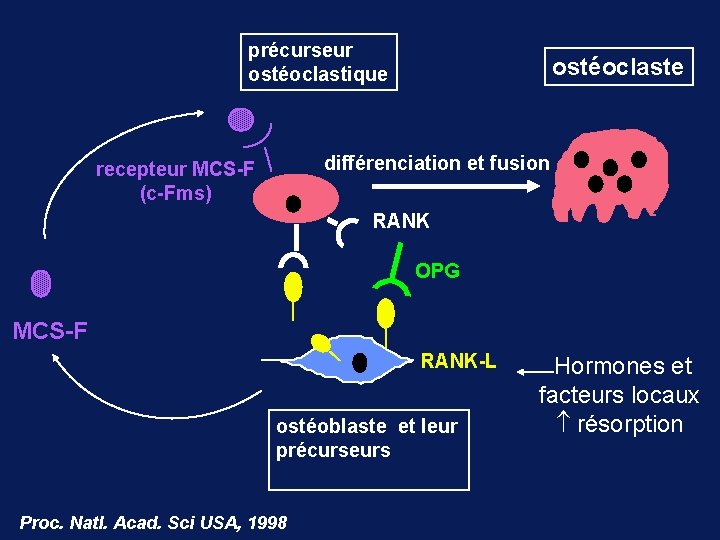
précurseur ostéoclastique ostéoclaste différenciation et fusion recepteur MCS-F (c-Fms) RANK OPG MCS-F RANK-L ostéoblaste et leur précurseurs Proc. Natl. Acad. Sci USA, 1998 Hormones et facteurs locaux résorption

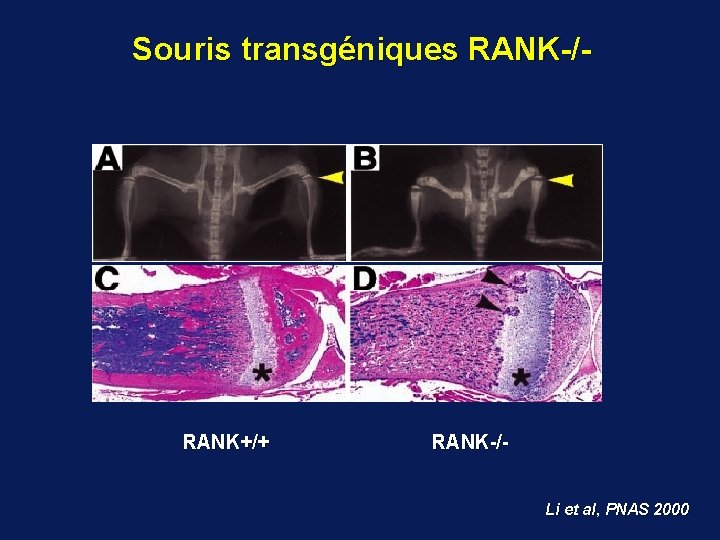
Souris transgéniques RANK-/- RANK+/+ RANK-/Li et al, PNAS 2000

Ostéoprotégérine chez l’homme : déficience et traitement Ostéoporose sévère due à une mutation inactivatrice dans le gène de l’ostéoprotégérine : nbreux ostéoclastes Injection sous cutanée d’ostéoprotégérine ⇨ Augmentation de la masse osseuse

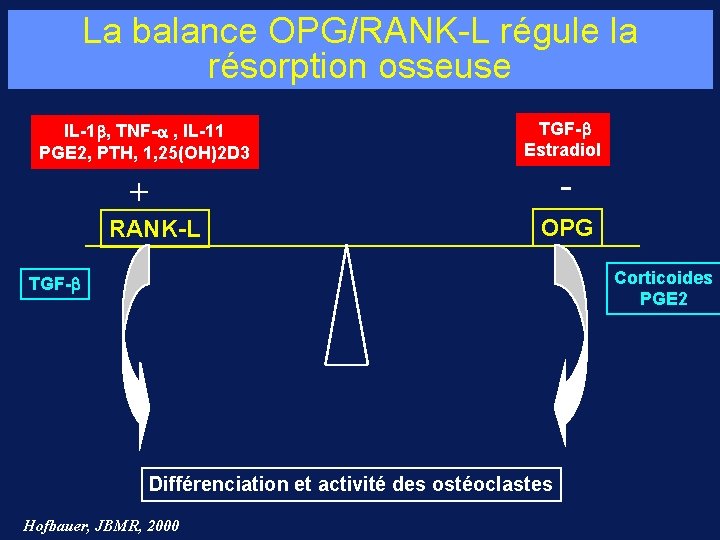
La balance OPG/RANK-L régule la résorption osseuse IL-1 , TNF- , IL-11 PGE 2, PTH, 1, 25(OH)2 D 3 TGF- Estradiol + - RANK-L OPG Corticoides PGE 2 TGF- Différenciation et activité des ostéoclastes Hofbauer, JBMR, 2000

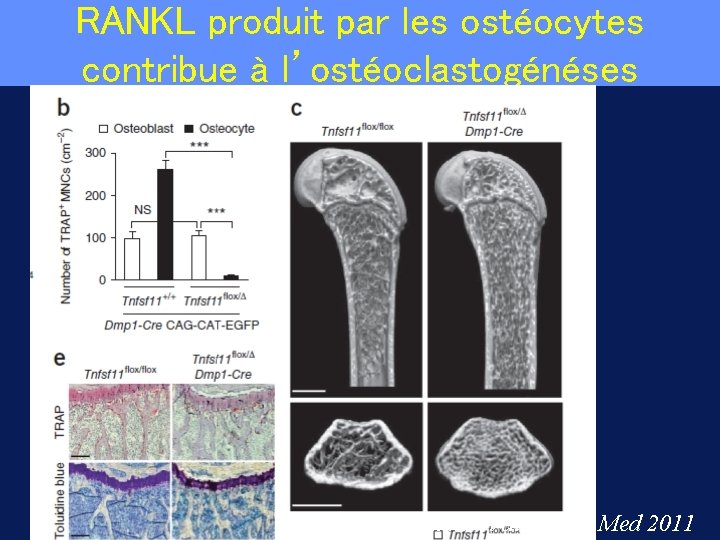
RANKL produit par les ostéocytes contribue à l’ostéoclastogénéses Nakashima et al Nature Med 2011

Le tissu osseux • Les ostéoblastes et la matrice osseuse • Les ostéocytes • Les ostéoclastes • Le remodelage osseux et ses implications • La perte osseuse du vieillissement

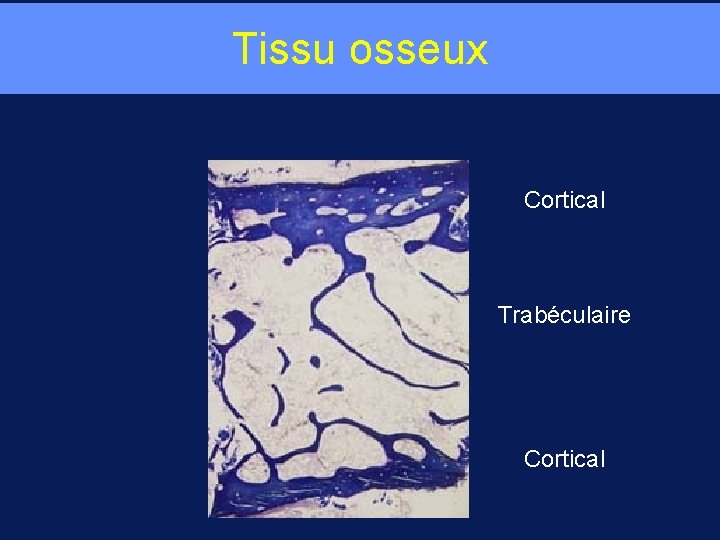
Tissu osseux Cortical Trabéculaire Cortical

Le tissu osseux est formé de multiples « unités fonctionnelles » Os trabéculaire Os cortical

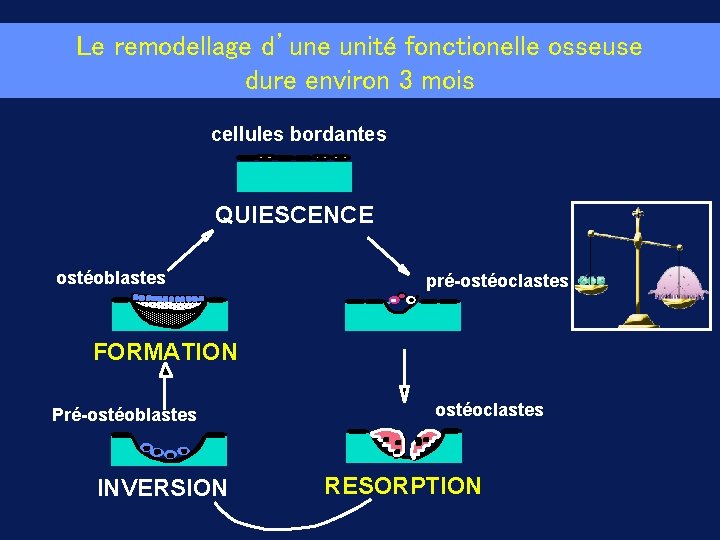
Le remodellage d’une unité fonctionelle osseuse dure environ 3 mois cellules bordantes QUIESCENCE ostéoblastes pré-ostéoclastes FORMATION Pré-ostéoblastes INVERSION ostéoclastes RESORPTION

Os trabéculaire et cortical : activation différente des unités de remodelage trabéculaire cortical Masse 20% 80% Renouvellé Surface chaque année 80% 25% 20% 3% Tr Fréquence d’activation plus grande dans l’os trabéculaire que cortical → os trabéculaire = renouvellement plus important et plus réactif au changement de la balance

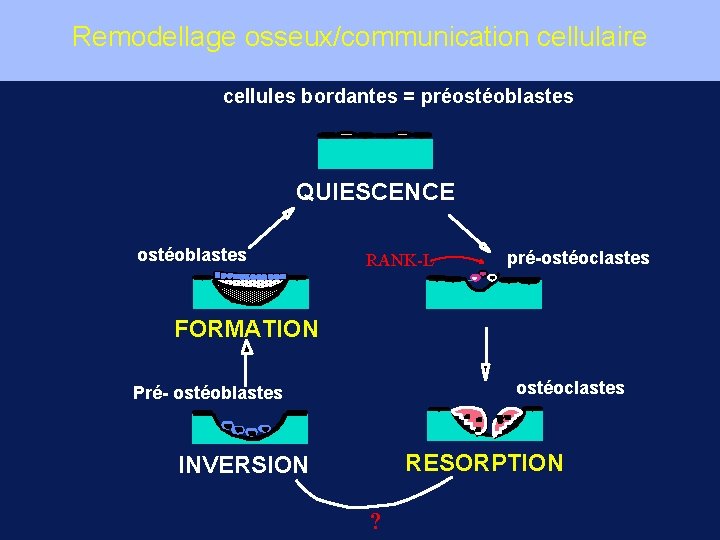
Remodellage osseux dépend de communications entre ostéoblastes et ostéoclastes • Activation du remodellage : – Sécrétion par les ostéoblastes/ostéocytes d’un facteur (RANK-L) induisant la différenciation des ostéoclastes • Couplage formation / résorption : – Libération de la matrice osseuse par les ostéoclastes de facteurs de croissance activant prolifération et différenciation ostéoblastique

Remodellage osseux/communication cellulaire cellules bordantes = préostéoblastes QUIESCENCE ostéoblastes RANK-L pré-ostéoclastes FORMATION ostéoclastes Pré- ostéoblastes RESORPTION INVERSION ?

Facteurs de croissance et os Ø Ne sont pas spécifiques du tissu osseux : IGF-I, TGF-ß, FGFs, GM-CSF, TGF-ß, , BMPs, (bone morphogenic protein) Ø Facteurs solubles produits localement par les ostéoblastes et inclus dans la matrice osseuse Ø Maintiennent leur activité biologique par leur liaison à des protéines de support ØAugmentent la prolifération et/ou la différenciation et des ostéoblastes

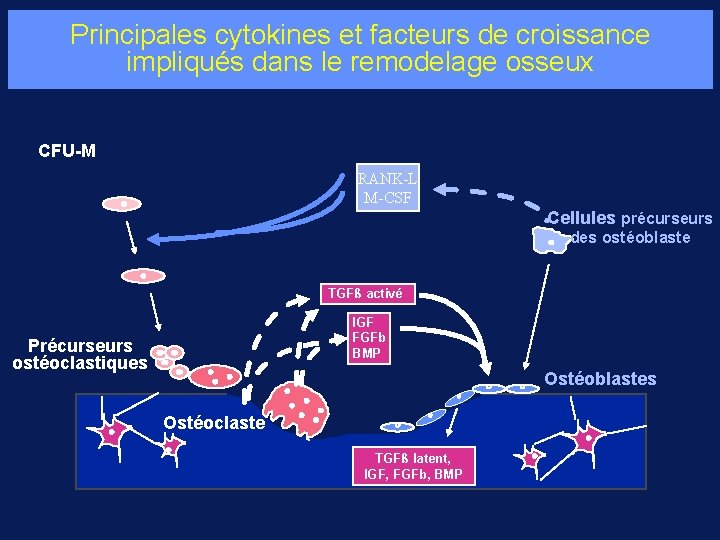
Principales cytokines et facteurs de croissance impliqués dans le remodelage osseux CFU-M RANK-L M-CSF Cellules précurseurs des ostéoblaste TGFß activé IGF FGFb BMP Précurseurs ostéoclastiques Ostéoblastes Ostéoclaste TGFß latent, IGF, FGFb, BMP

Le tissu osseux • Les ostéoblastes et la matrice osseuse • Les ostéocytes • Les ostéoclastes • Le remodelage osseux et ses implications • La perte osseuse du vieillissement

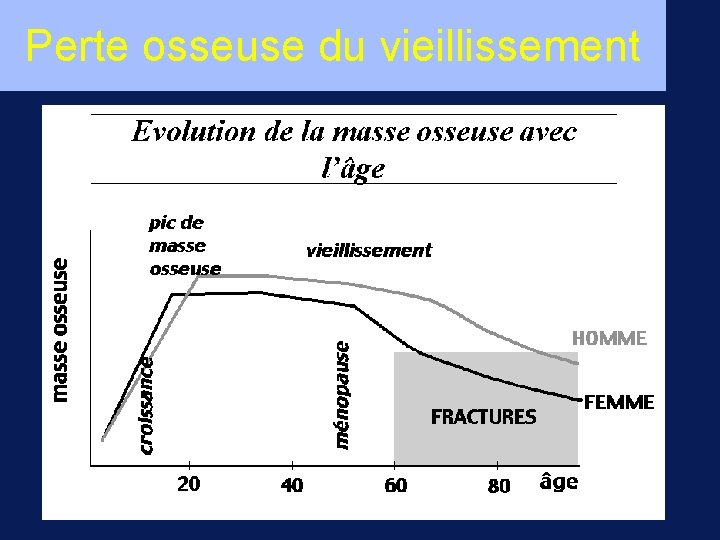
Perte osseuse du vieillissement

Perte osseuse du vieillissement • Débute vers 50 ans et persiste au cours du vieillissement • Est due à une résorption est plus importante que la formation (déséquilibre du remodelage) • Les femmes ont un capital osseux plus bas et perdent plus que les hommes lors du vieillissement (50 vs 30% d’os trabéculaire) • La perte osseuse n’est pas symptomatique

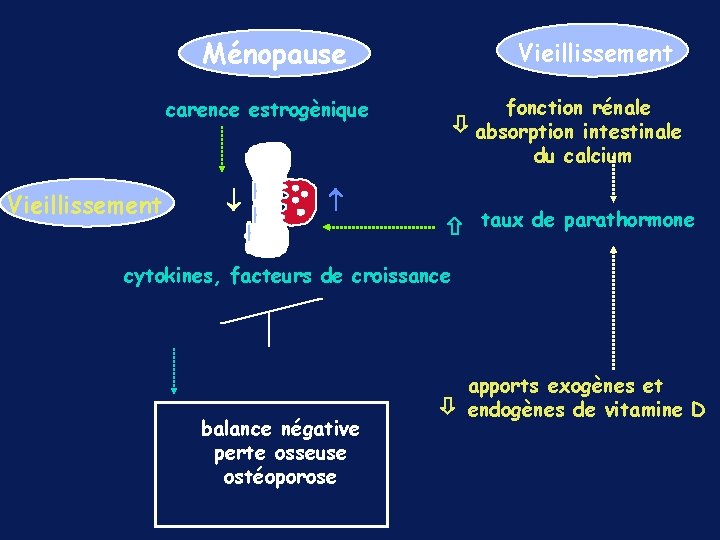
Physiopathologie de la perte osseuse du vieillissement • Facteurs endocriniens • Hyperparathyroïdie secondaire • Carence en estrogènes • Diminution des stimulations mécaniques osseuses (ostéocytes) masse musculaire diminuée activité physique moindre • Diminution de l’activité des ostéoblastes


Ménopause Vieillissement fonction rénale absorption intestinale du calcium carence estrogènique Vieillissement taux de parathormone cytokines, facteurs de croissance balance négative perte osseuse ostéoporose apports exogènes et endogènes de vitamine D

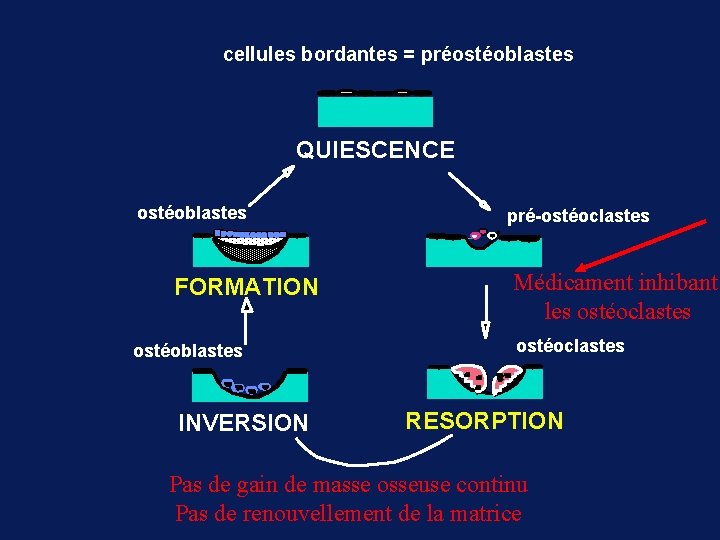
Communication inter cellulaire dans le tissu osseux : implications • Traitement par inhibiteurs de résorption • Cercle vicieux des métastases osseuses

cellules bordantes = préostéoblastes QUIESCENCE ostéoblastes FORMATION ostéoblastes INVERSION pré-ostéoclastes Médicament inhibant les ostéoclastes RESORPTION Pas de gain de masse osseuse continu Pas de renouvellement de la matrice

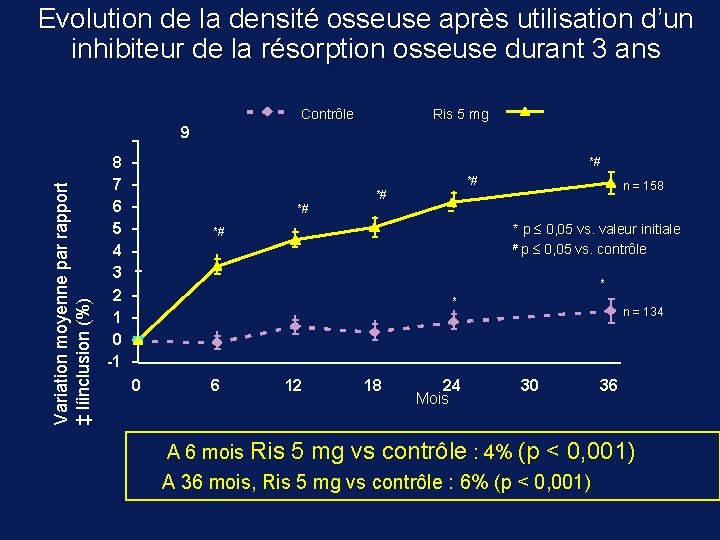
Evolution de la densité osseuse après utilisation d’un inhibiteur de la résorption osseuse durant 3 ans Contrôle Ris 5 mg Variation moyenne par rapport ‡ líinclusion (%) 9 8 7 6 5 4 3 2 1 0 -1 *# *# *# n = 158 *# * p £ 0, 05 vs. valeur initiale # p £ 0, 05 vs. contrôle *# * * 0 6 12 18 24 Mois n = 134 30 36 A 6 mois Ris 5 mg vs contrôle : 4% (p < 0, 001) A 36 mois, Ris 5 mg vs contrôle : 6% (p < 0, 001)

Ostéolyse d’un cancer

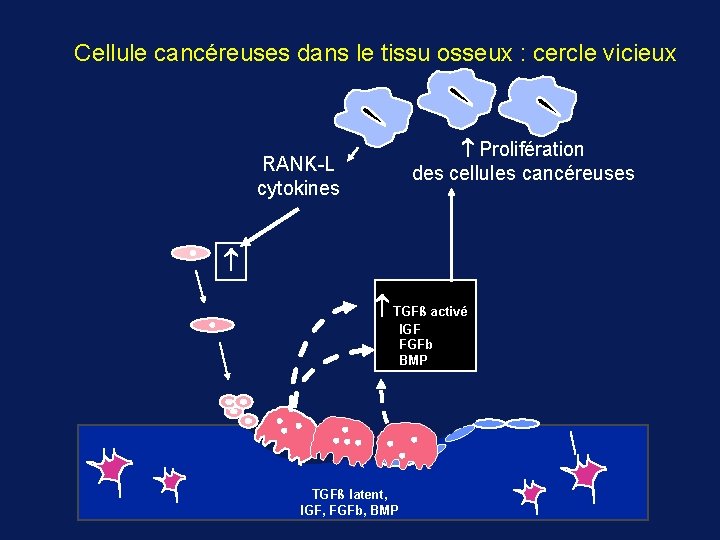
Cellule cancéreuses dans le tissu osseux : cercle vicieux Prolifération des cellules cancéreuses RANK-L cytokines TGFß activé IGF FGFb BMP TGFß latent, IGF, FGFb, BMP
 Rgulation
Rgulation Rgulation
Rgulation Rgulation
Rgulation Rgulation
Rgulation Accollement
Accollement Dépériostage def
Dépériostage def Taille moyenne garçon 13 ans
Taille moyenne garçon 13 ans âge osseux poignet greulich et pyle
âge osseux poignet greulich et pyle Salmon et durie
Salmon et durie âge osseux poignet greulich et pyle
âge osseux poignet greulich et pyle Variantes anatomiques des sinus de la face
Variantes anatomiques des sinus de la face Osteoblastome
Osteoblastome Algodystrophie
Algodystrophie Physiologie de la vision
Physiologie de la vision Renin angiotensin aldosteron system amboss
Renin angiotensin aldosteron system amboss Georges dolisi
Georges dolisi Anhydrase carbonique
Anhydrase carbonique Simultankontrast physiologie
Simultankontrast physiologie Physiologie de la salivation
Physiologie de la salivation 2ter hauptsatz der thermodynamik
2ter hauptsatz der thermodynamik Physiologie des noyaux gris centraux
Physiologie des noyaux gris centraux Slidetodoc
Slidetodoc Hypophosphatémiante
Hypophosphatémiante Lac tissu chirurgie
Lac tissu chirurgie Le tissu nerveux
Le tissu nerveux Sang tissu conjonctif
Sang tissu conjonctif Plaque motrice
Plaque motrice Tissu fibreux
Tissu fibreux Tissu nodal localisation
Tissu nodal localisation Foetogenese
Foetogenese Tissu nodal localisation
Tissu nodal localisation Tissu glucodépendant
Tissu glucodépendant Le tissu nerveux
Le tissu nerveux Duite tissage
Duite tissage Tissus épithéliaux
Tissus épithéliaux Le tissu nerveux
Le tissu nerveux Le tissu nerveux
Le tissu nerveux Mastocito
Mastocito