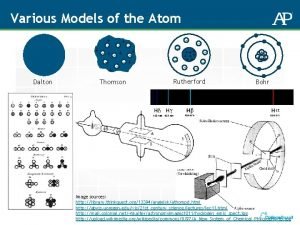
TEORI ATOM MODERN 1 KEDUDUKAN POSISI ELEKTRON DALAM













































- Slides: 50

TEORI ATOM MODERN 1. KEDUDUKAN (POSISI) ELEKTRON DALAM ATOM 1. 1. Teori kuantum radiasi Isaac Newton (1642 - 1727) telah berhasil menguraikan sinar matahari dg. prisma kaca menjadi warna-warna pelangi penyusunnya: ungu, nila, biru, hijau, kuning, jingga dan merah

Newton: Penyebaran cahaya menurut garis lurus lebih mudah diterangkan dg. menganggap bahwa cahaya terdiri atas partikel-partikel (Teori Korpuskular Cahaya) Christian Huygens, Augustin Jean Fresnel dan Thomas Young: Cahaya bersifat sebagai gelombang (Teori Gelombang Cahaya)

James Clerk Maxwell: Gelombang elektromagnetik dg. sifat-sifat seperti cahaya dapat terjadi dg. mengayun- ayunkan muatan listrik Heinrich Hertz: Gelombang elektromagnetik terdiri atas medan listrik dan medan magnit yang bergelombang

Gambaran sebuah gelombang Max Planck: Energi suatu benda hanya dapat bertambah atau berkurang dengan kelipatan satuan energi. Satuan energi itu disebut kuantum cahaya atau foton

Jumlah energi yang panjang gelombangnya yang diserap atau dipancarkan oleh suatu benda padat berbanding lurus dengan frekuensinya, (nu), yang dinyatakan dalam persamaan: dengan: E : besarnya energi dalam Joule (nu) : frekuensi radiasi (dalam getaran/detik) = c/ (c : kecepatan cahaya = 3 x 1010 cm/detik) h : tetapan Planck ( 0, 66252 x 10 -33 Joule. detik)

Albert Einstein: Merumuskan hukum Planck tsb. secara lebih umum (1905) Niels Bohr: Menggunakan Teori Kuantum ini untuk menafsirkan spektrum atom hidrogen

2. Spektra radiasi Energi radiasi terdiri atas sejumlah besar gelombang elektromagnetik dg. yang berbeda-beda. Dg. spektrometer, bagian-bagian radiasi dapat dipisahkan spektrum radiasi Spektrum Sinar tampak

Warna Pelangi Gelombang Elektromagnetik lengkap

3. Sifat khas spektrum Setiap zat dapat memberikan spektrum yg. khas dengan cara memancarkan energi radiasi, yg. dapat digambarkan sbb. :

4. Macam spektrum Ditinjau dari proses pembentukannya, terdapat dua macam spektrum, yaitu : 1. Spektrum Emisi (Spektrum Pancaran) Spektrum ini terbentuk bila suatu zat dipanaskan atau dieksitasi secara listrik.

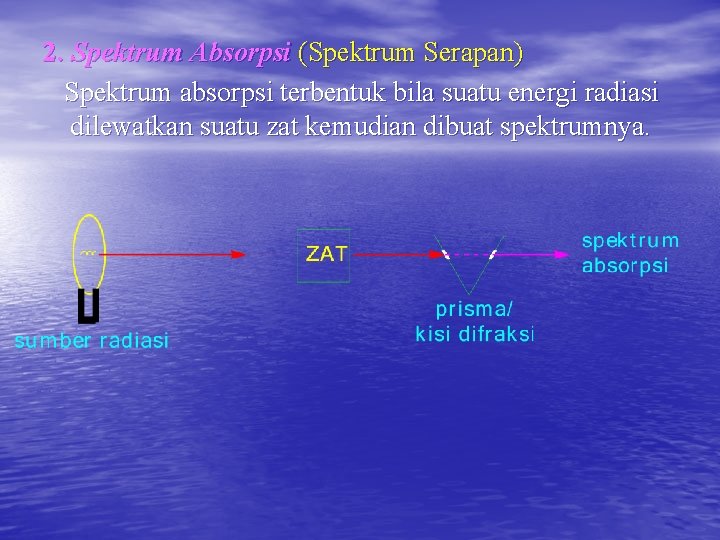
2. Spektrum Absorpsi (Spektrum Serapan) Spektrum absorpsi terbentuk bila suatu energi radiasi dilewatkan suatu zat kemudian dibuat spektrumnya.

Ditinjau dari penampakannya terdapat dua macam spektrum, yaitu: 1. Spektrum kontinyu Yaitu spektrum yang terdiri atas sejumlah warna dengan panjang gelombang yang berubah secara teratur. Contoh: Spektrum sinar matahari (pelangi)

2. Spektrum diskontinyu Yaitu spektrum yang terdiri atas radiasi yang panjang gelombangnya berdiri sendiri-sendiri (berubah secara mendadak) Spektrum diskontinyu ini masih dibagi lagi menjadi: 2. a. Spektrum garis absorpsi dapat diperoleh dari uap atom-atom usur yang dipanaskan (dibakar)

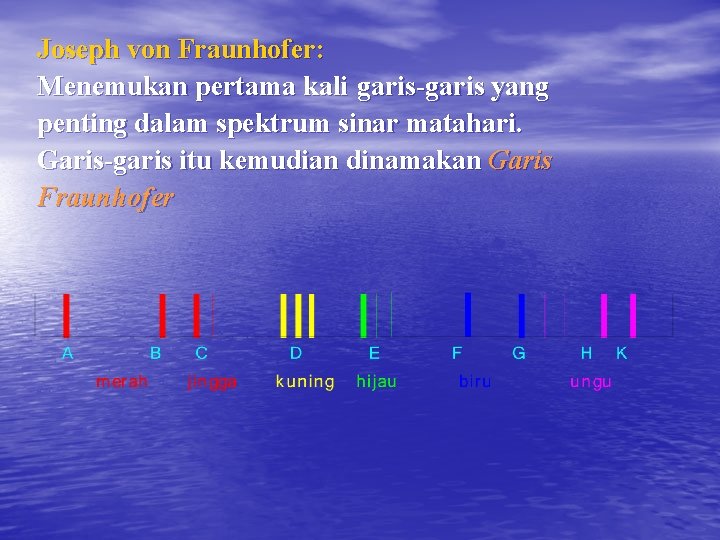
Joseph von Fraunhofer: Menemukan pertama kali garis-garis yang penting dalam spektrum sinar matahari. Garis-garis itu kemudian dinamakan Garis Fraunhofer

Contoh spektrum garis yang penting Spektrum uap natrium dg. 5875 - 5895 Angström yang penting bagi pengukuran indeks bias dan pemutaran bidang polarisasi

2. b. Spektrum pita merupakan ciri khas suatu molekul, sehingga dapat digunakan untuk identifikasi senyawa

3. SPEKTRUM ATOM HIDROGEN 3. 1. Deret spektrum Johann Jakob Balmer Merumuskan perhitungan panjang gelombang garis-garis spektrum atom hidrogen, ditemukan rumus yg. sekarang masih dipakai:

• Deret Balmer dari spektrum emisi hidrogen, • pada daerah sinar tampak dan ultra violet

Deret-deret lain Deret Lyman, pada daerah ultra violet, dg. persamaan: dg. n = 2, 3, 4, . . . . Deret Paschen , pada daerah infra merah, dg. persamaan: dg. n = 4, 5, 6, . . . .

Deret Brackett, pada daerah infra merah, dg. persamaan: dg. n = 5, 6, 7, . . . . Deret Pfund, pada daerah infra merah, dg. persamaan: dg. n = 6, 7, 8, . . . .

Penggabungan deret-deret Kelima deret tsb. ternyata dapat dihubungkan satu dg. yang lain dg. persamaan: dg. harga-harga m dan n sbb. : Deret spektrum Lyman Balmer Paschen Brackett Pfund m n 1 2 3 4 5 2, 3, 4, . . . . 3, 4, 5, . . . . 4, 5, 6, . . . . 5, 6, 7, . . . . 6, 7, 8, . . . .

Kesimpulan: Ada hubungan yang erat antara garis spektrum dengan bangun atom. Hal ini pertama kali diterangkan dg. Teori Atom Bohr dan kemudian dg. Mekanika Gelombang

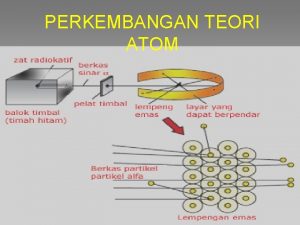
4. TEORI ATOM BOHR 4. 1. Kelemahan Bangun Atom Rutherford Bila elektron mengelilingi inti atom, mengalami percepatan yang mengarah ke pusat lintasan (inti atom) karena adanya gaya sentrifugal. Elektron bermuatan memancarkan energi secara kontinyu menurut Teori Elektrodinamika James Clerk Maxwell dan hal ini bertentangan dg. kenyataan. Selain itu dg. memancarkan energinya secara terus menerus, elektron tsb. akan kehilangan energinya dan akan jatuh ke inti atom kehancuran atom tsb.

Teori Atom Bohr Niels Bohr mengajukan Teori Atom yang berdasarkan Teori Kuantum Radiasi (1913) Teori Atom Bohr bertitik tolak pada beberapa postulat (anggapan) sbb:

Postulat-postulat Bohr 1. Elektron tidak dapat bergerak mengelilingi inti atom pada sebarang lintasan, melainkan hanya pada lintasan yang memenuhi persya-ratan sewaktu elektron mempunyai momentum sudut yang besarnya kelipatan harga h/2 (h = tetapan Planck). Lintasan ini disebut Lintasan Kuantum.

2. Bila elektron berada dalam lintasan kuantumnya, maka elektron tersebut tidak memancarkan energi. Dikatakan bahwa elektron berada dalam keadaan stasioner atau dalam tingkat energi tertentu. 3. Bila elektron berpindah dari tingkat energi E 1 ke tingkat energi E 2, dengan E 2 < E 1, maka akan terjadi radiasi energi dengan frekuensi yang dapat dihitung dari Teori Kuantum sbb: E 1 - E 2 = h

Bila E 1 < E 2, maka akan terjadi absorpsi energi oleh elektron tersebut. 4. 2. Jari-jari atom hidrogen Menurut Teori Bohr, elektron bergerak dalam lintasan yang berupa lingkaran. Jari-jari lingkaran ini, untuk atom hidrogen, dapat dihitung sbb. :

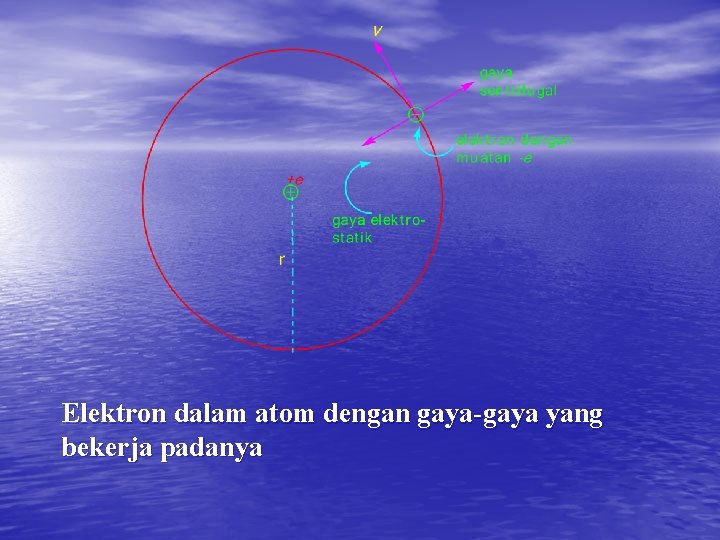
Elektron dalam atom dengan gaya-gaya yang bekerja padanya

Perumusan Elektron dengan massa m, muatan -e dan kecepatan v mengelilingi inti atom yang muatannya +e dalam lingkaran yang jarinya r. Elektron tersebut akan mengalami gaya sentrifugal sebesar mv 2/r yang diimbangi oleh gaya elektrostatik sebesar e 2/r 2

Krn gaya sentrifugal = gaya elektrostatik: m v 2/r = e 2/r 2 e 2 = mv 2 r. . . . (3. 11) Momentum sudut elektron, mvr, menurut anggapan Bohr adalah kelipatan dari harga h/2 , jadi:

Bila (3. 12) dimasukkan ke dalam (3. 11), didapat:

Jadi: Bila dimasukkan harga-harga: h = 6, 625 x 10 -27 erg. detik m = 9, 11 x 10 -28 gram e = 4, 802 x 10 -10 s. e. s. diperoleh: r = 0, 53 x 10 -8 n 2 cm

Dg. mengambil harga-harga n = 1, 2, 3, dst. , dapat dihitung jari-jari lintasan kuantum pertama, kedua, ketiga dst. : r 1 = 0, 53 x 10 -8 cm r 2 = 2, 12 x 10 -8 cm r 3 = 4, 77 x 10 -8 cm

4. 3. Penafsiran spektrum hidrogen Dg. Teori Atom Bohr dapat ditafsirkan spektrum atom hidrogen dan partikel-partikel lainnya yg. serupa dg. atom hidrogen: Yang hanya memiliki 1 elektron: ion Li 2+ dan ion Be 3+

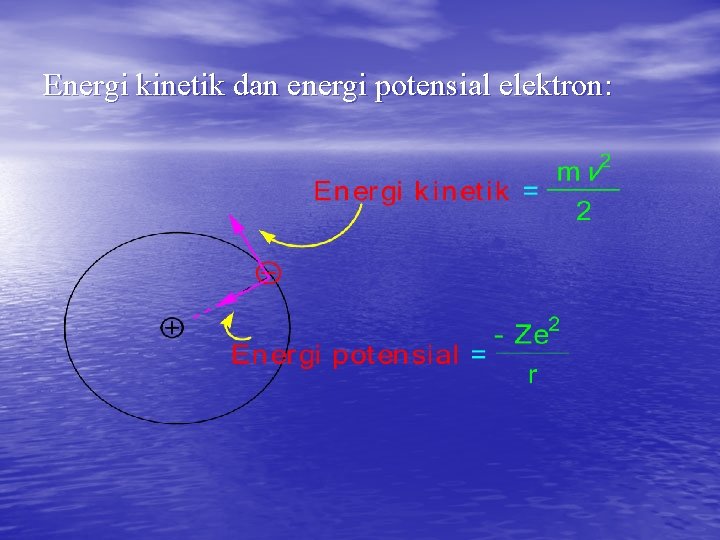
4. 4. Energi elektron terdiri atas energi kinetik dan energi potensial yg. dapat diuraikan sbb: 1. Energi potensial ini berasal dari gaya elektrostatik X jarak antara elektron dan inti atom (r)

2. Energi kinetik ini berasal dari gerakan elektron mengelilingi inti atom dg. kecepatan v dan massa m, = mvdv = ½ mv 2

Energi kinetik dan energi potensial elektron:

Energi total elektron Gaya sentrifugal = gaya elektrostatik (3. 11): mv 2/r = e 2/r 2 didapat:

Bila persamaan (3. 16) disubstitusikan ke dlm persamaan (3. 15), maka akan didapat : Dari momentum sudut elektron :

Jika persamaan (3. 18) dimasukkan ke dalam persamaan (3. 16), maka akan didapat:

Dari persamaan (3. 19) dan (3. 16) akan didapat :

Persamaan (3. 20) menyatakan energi total elektron yg. berada dalam lintasan kuantum yg. ditentukan oleh bilangan kuantum utama, n.

4. 5. Radiasi karena perpindahan elektron Bila suatu elektron berpindah dari orbit n 2 ke orbit n 1 dg. n 2 > n 1, maka akan terjadi radiasi (pemancaran) energi. Besarnya energi yang dipancarkan adalah:

En 2 - En 1 = h (Planck - Einstein) maka: dan:


atau: Bila diisikan harga-harga: : 3, 1416; Z : 1 (hidrogen); e : 4, 802 x 10 -10 s. e. s h : 6, 62 x 10 -27 erg. detik ; c : 2, 997 x 1010 cm/detik dan m : 9, 11 x 10 -28 gram ke dalam persamaan (3. 23), maka akan didapat harga:

R = 109700 yg. sesuai dengan tetapan Rydberg, RH, yg. secara eksperimental ditemukan sebesar 109677, 58 Persamaan (3. 22): persamaan deret-deret spektrum atom hidrogen oleh Lyman dkk. Dari persamaan (3. 22) tsb. dapat disusun tingkat energi (energy level) elektron dlm. atom hidrogen.

4. 6. Bilangan kuantum menyatakan keadaan elektron dalam atom. Ada empat bilangan kuantum, yaitu: 1. Bilangan kuantum utama Bilangan kuatum utama dg. lambang n = bilangan kuantum menurut Bohr. Bilangan kuantum utama ini menyatakan energi suatu elektron yg. menempati suatu lintasan (orbital) yg. juga menentukan besarnya orbital tsb, dan tiap-tiap harga n menyatakan kulit lintasan, yaitu:

• n = 1 : kulit K • n = 2 : kulit L • n = 3 : kulit M • n = 4 : kulit N • n = 5 : kulit O • n = 6 : kulit P • n = 7 : kulit Q

Garis-garis spektrum atom hidrogendan tingkatan energi elektron
 Aturan aufbau
Aturan aufbau Menurut bohr elektron-elektron dalam atom
Menurut bohr elektron-elektron dalam atom Tata penghormatan
Tata penghormatan Posisi kedudukan
Posisi kedudukan Haluan loxodrom yaitu garis haluan yang memotong
Haluan loxodrom yaitu garis haluan yang memotong Uang dalam perekonomian modern
Uang dalam perekonomian modern Uang dalam perekonomian modern
Uang dalam perekonomian modern Kedudukan teori dalam penelitian kualitatif
Kedudukan teori dalam penelitian kualitatif Bilangan kuantum 20ca
Bilangan kuantum 20ca Perkembangan teori atom democritus
Perkembangan teori atom democritus Atom berikut ini yang mempunyai jumlah elektron 32 adalah
Atom berikut ini yang mempunyai jumlah elektron 32 adalah Bentuk molekul berdasarkan teori domain elektron
Bentuk molekul berdasarkan teori domain elektron The structure of the atom section 2 defining the atom
The structure of the atom section 2 defining the atom Sebutkan keterampilan gerak menyundul dalam permainan sepak
Sebutkan keterampilan gerak menyundul dalam permainan sepak Bola tampar bola
Bola tampar bola Bagaimana posisi indonesia dalam aspek kewilayahan
Bagaimana posisi indonesia dalam aspek kewilayahan Dalil hukum taklifi
Dalil hukum taklifi Maksud protokol majlis
Maksud protokol majlis Makalah asesmen dalam bk
Makalah asesmen dalam bk Kedudukan manusia dalam organisasi
Kedudukan manusia dalam organisasi Perkembangan kurikulum pendidikan ips sd
Perkembangan kurikulum pendidikan ips sd Bagaimana kedudukan pembukaan dalam uud 1945
Bagaimana kedudukan pembukaan dalam uud 1945 Kedudukan psikologi perkembangan dalam pendidikan
Kedudukan psikologi perkembangan dalam pendidikan Imunologi farmasi
Imunologi farmasi Geografi pertanian
Geografi pertanian Bendera ppim hitam putih
Bendera ppim hitam putih Cara menggunakan penggaris t
Cara menggunakan penggaris t Kedudukan analisis dalam rpl
Kedudukan analisis dalam rpl Kedudukan korban dalam sistem peradilan pidana
Kedudukan korban dalam sistem peradilan pidana Mohammedan recht
Mohammedan recht Kedudukan magnet elementer di dalam sebuah magnet adalah
Kedudukan magnet elementer di dalam sebuah magnet adalah Suatu unsur netral mempunyai 2 elektron dalam kulit pertama
Suatu unsur netral mempunyai 2 elektron dalam kulit pertama Contoh isotop
Contoh isotop History of the atom
History of the atom Kuantum sayıları çıkmış sorular
Kuantum sayıları çıkmış sorular Bunyi teori atom thomson
Bunyi teori atom thomson Dalton thomson rutherford
Dalton thomson rutherford Dalton thomson rutherford bohr
Dalton thomson rutherford bohr Teori?
Teori? Demokritos atom modeli
Demokritos atom modeli Kelemahan atom niels bohr
Kelemahan atom niels bohr Isi teori niels bohr
Isi teori niels bohr Teori atom democritus
Teori atom democritus Democritus atom model
Democritus atom model Teori atom democritus
Teori atom democritus Kelebihan teori atom mekanika kuantum
Kelebihan teori atom mekanika kuantum Que propuso niels bohr
Que propuso niels bohr Atom
Atom Teori atom dalton
Teori atom dalton Teori atom democritus
Teori atom democritus Sejarah perkembangan hpi
Sejarah perkembangan hpi