MODEL ATOM MEKANIKA KUANTUM Kedudukan elektron dalam atom











- Slides: 19

MODEL ATOM MEKANIKA KUANTUM Kedudukan elektron dalam atom berada pada daerah ruang dengan jarak tertentu dari inti atom. Daerah ruang ini disebut ORBITAL

Perkembangan Model Atom Dalton Neil Bohr Thomson Mekanika Kuantum Rutherford

Bilangan Kuantum • Menyatakan kedudukan/letak elektron dalam atom 1. Bil. Kuantum Utama (n) menyatakan kulit tempat elektron berlokasi. 2. Bil. Kuantum Azimut (l) Menyatakan sub kulit tempat elektron berlokasi. 3. Bil. Kuantum Magnetik (m) Menyatakan Orbital tempat elektron berlokasi 4. Bil. Kuantum spin (s) Menyatakan arah rotasi elektron

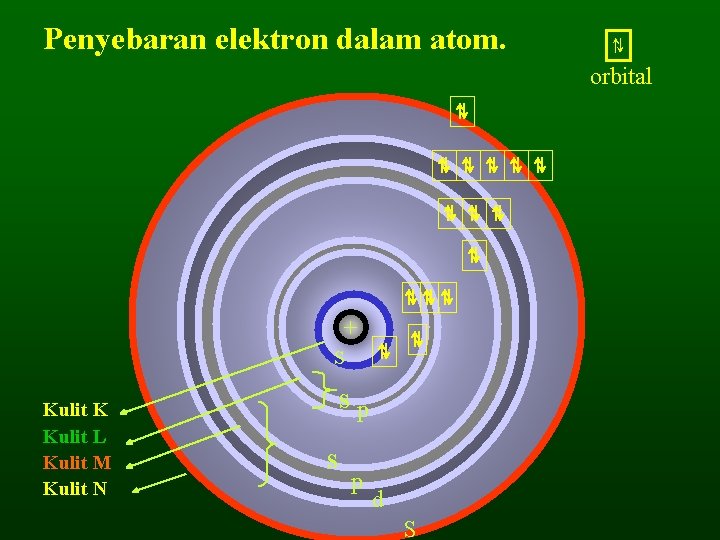
Penyebaran elektron dalam atom. ⇅ ⇅ ⇅⇅⇅ + s Kulit K Kulit L Kulit M Kulit N ⇅ ⇅ sp s p d S ⇅ orbital

Ada 4 Bilangan kuantum 1. Bilangan kuantum utama. (n) 2. menyatakan kulit tempat elektron berlokasi. 3. nilainya 1, 2, 3, 4……dst 4. n = 1 Kulit K 5. n = 2 Kulit L 6. n = 3 Kulit M 7. 8. n = 4 Kulit N dst n=1 n=2 n=3 n=4 n=5 n=6

Ada 4 Bilangan Azimut (l) menyatakan sub kulit tempat elektron berlokasi. nilainya 0, 1, 2, 3, sd (n-1) n=1 Kulit K l=0 Sub kulit s n=2 Kulit L l=0 l=1 Sub kulit s Sub kulit p n=3 Kulit M l=0 l=1 l=2 Sub kulit s Sub kulit p Sub kulit d n=4 Kulit N l=0 l=1 l=2 l=3 Sub kulit s p d f

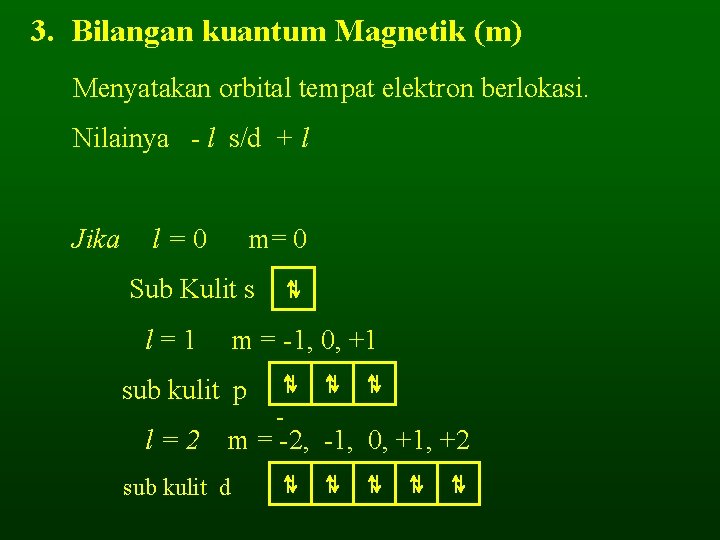
3. Bilangan kuantum Magnetik (m) Menyatakan orbital tempat elektron berlokasi. Nilainya - l s/d + l Jika l=0 m= 0 Sub Kulit s l=1 m = -1, 0, +1 sub kulit p l=2 ⇅ ⇅ - m = -2, -1, 0, +1, +2 sub kulit d ⇅ ⇅ ⇅

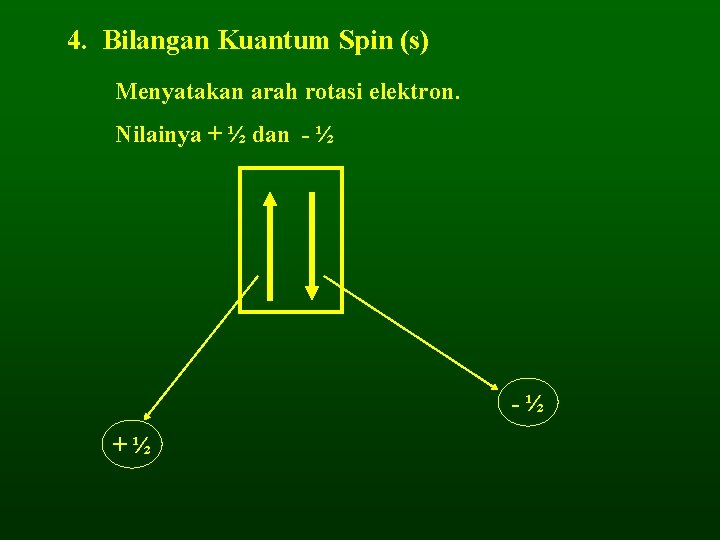
4. Bilangan Kuantum Spin (s) Menyatakan arah rotasi elektron. Nilainya + ½ dan - ½ -½ +½

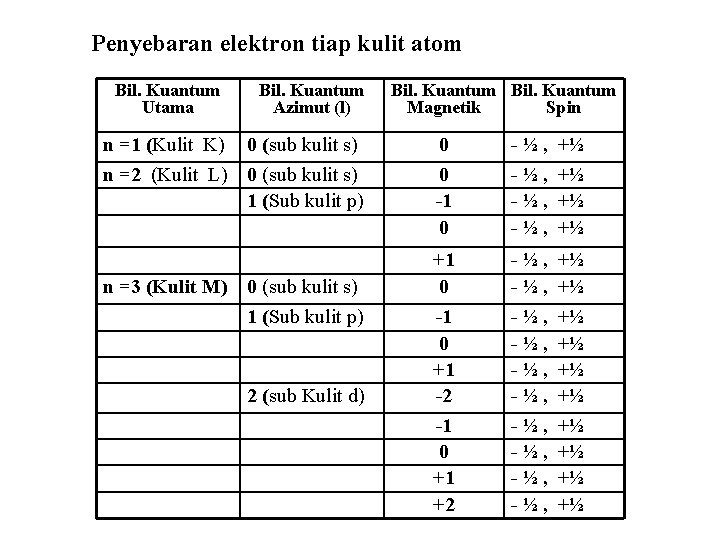
Penyebaran elektron tiap kulit atom Bil. Kuantum Utama Bil. Kuantum Azimut (l) n =1 (Kulit K) 0 (sub kulit s) n =2 (Kulit L) 0 (sub kulit s) 1 (Sub kulit p) n =3 (Kulit M) 0 (sub kulit s) 1 (Sub kulit p) 2 (sub Kulit d) Bil. Kuantum Magnetik Spin 0 0 -1 0 -½, -½, +½ +½ +1 0 - ½ , +½ -1 0 +1 -2 -1 0 +1 +2 -½, -½, +½ +½

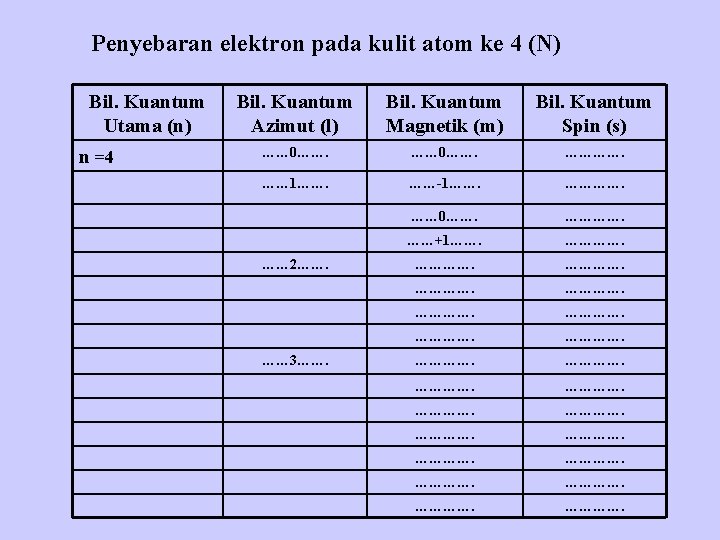
Penyebaran elektron pada kulit atom ke 4 (N) Bil. Kuantum Utama (n) n =4 Bil. Kuantum Azimut (l) Bil. Kuantum Magnetik (m) Bil. Kuantum Spin (s) …… 0……. …………. …… 1……. ……-1……. …… 0……. ……+1……. …………. …………. …… 2……. …… 3…….

Buatlah Kesimpulan • Jumlah Elektron yang dapat menempati setiap orbital. • Jumlah Elektron yang dapat menempati setiap sub kulit. • Jumlah Elektron yang dapat menempati setiap Kulit. (Kulit K, L, M dan N)

KONFIGURASI ELEKTRON 1. Aturan Aufbau. 2. Penempatan elektron kedalam kulit/sub kulit atom, dimulai dari sub kulit yang tingkat energinya rendah ke sub kulit yang tingkat energinya tinggi. K=1 L=2 s s p M=3 s p d N=4 s p p f O=5 s p p f P=6 s p d Q=7 s p Perhatikan jumlah max. eletron tiap sub kulit.

Tuliskan konfigurasi elektron dari atom: 11 Na = 1 s 2 K 20 Ca = 1 s 2 K 26 Fe = 1 s 2 K 2 s 2 2 p 6 L 3 s 1 M 2 s 2 2 p 6 L 3 s 2 3 p 6 M 4 s 2 3 d 6 N 4 s 2 N

1. Aturan Hund. 2. Pengisian elektron ke dalam orbital akan menempati susunan setengah penuh kemudian penuh. (susunan penuh atau setengah penuh lebih stabil) 15 P = 1 s 2 2 p 6 3 s 2 3 p 3 ⇅ ⇅ ⇅⇅⇅ ⇅ Susunan setengah penuh (lebih stabil) ⇅ Susunan tidak setengah penuh (tidak stabil)

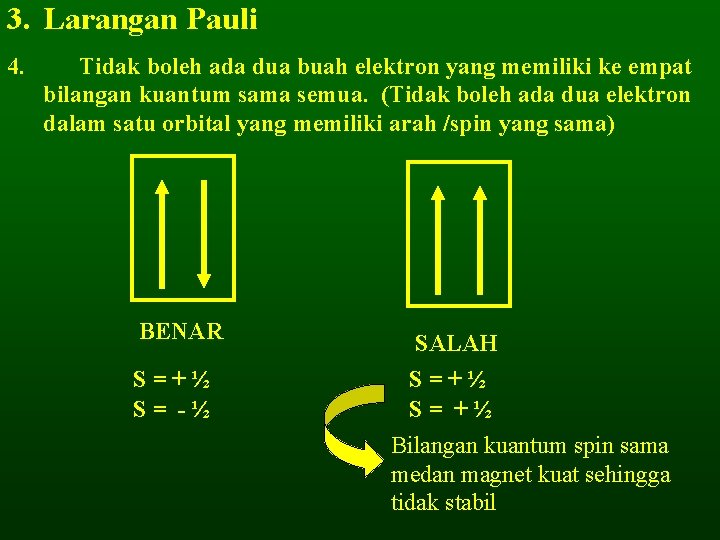
3. Larangan Pauli 4. Tidak boleh ada dua buah elektron yang memiliki ke empat bilangan kuantum sama semua. (Tidak boleh ada dua elektron dalam satu orbital yang memiliki arah /spin yang sama) BENAR S=+½ S= -½ SALAH S=+½ S= +½ Bilangan kuantum spin sama medan magnet kuat sehingga tidak stabil

Penyingkatan Konfigurasi elektron dengan konfigurasi gas Mulia 10 Ne = 1 s 2 2 p 6 2 s 2 2 p 6 3 s 2 3 p 3 15 P = 1 s 2 15 P = (Ne) 3 s 2 3 p 3

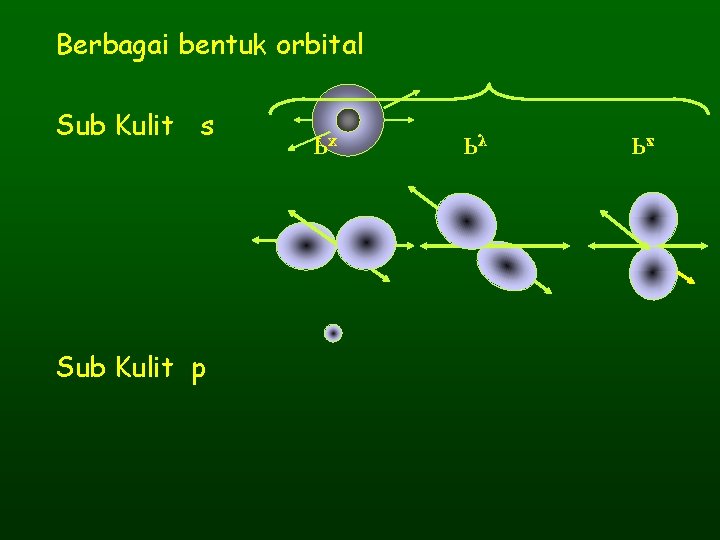
Berbagai bentuk orbital Sub Kulit s Sub Kulit p Px Py Pz

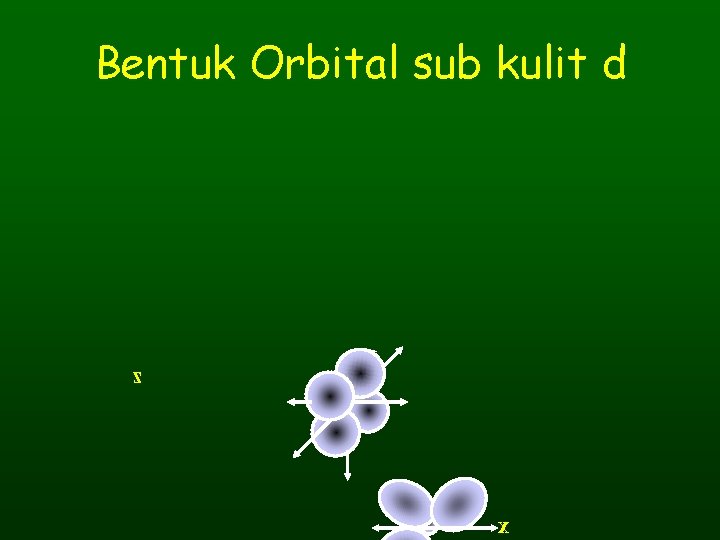
Bentuk Orbital sub kulit d z x

Contoh Soal, 1. Tentukan keempat bilangan kuantum elektron terakhir dari atom : 2. a. 15 P b. 25 Mn c. 27 Co 2. Suatu atom memiliki elektron terakhir dengan bilangan kuantum n = 3 l = 2 m = -1 s=-½ Tentukanlah : a. Konfigurasi elektron atom tersebut. b. Letak atom tersebut dalam Sistem Periodik c. Nomor atom tesebut.
 Konfigurasi elektron mekanika kuantum
Konfigurasi elektron mekanika kuantum Teori perkembangan atom
Teori perkembangan atom Menurut bohr elektron-elektron dalam atom
Menurut bohr elektron-elektron dalam atom Atom kuantum modeli
Atom kuantum modeli Kelemahan teori dalton
Kelemahan teori dalton Atom berikut ini yang mempunyai jumlah elektron 32 adalah
Atom berikut ini yang mempunyai jumlah elektron 32 adalah Contoh soal mekanika fluida aliran dalam pipa
Contoh soal mekanika fluida aliran dalam pipa Contoh soal flownet mekanika tanah
Contoh soal flownet mekanika tanah Hambatan dalam renang
Hambatan dalam renang Fungsi hukum taklifi
Fungsi hukum taklifi Susunan kerusi mengikut protokol
Susunan kerusi mengikut protokol Kualitatif
Kualitatif Alat pencatatan asesmen layanan bk adalah
Alat pencatatan asesmen layanan bk adalah Bagaimana kedudukan manusia dalam organisasi
Bagaimana kedudukan manusia dalam organisasi Kedudukan ips terpadu dalam kurikulum 2013
Kedudukan ips terpadu dalam kurikulum 2013 Bagaimana kedudukan pembukaan dalam uud nri tahun 1945
Bagaimana kedudukan pembukaan dalam uud nri tahun 1945 Uang dalam perekonomian modern
Uang dalam perekonomian modern Uang dalam perekonomian modern
Uang dalam perekonomian modern Kedudukan psikologi perkembangan dalam pendidikan
Kedudukan psikologi perkembangan dalam pendidikan Kedudukan dan peran imunologi dalam ilmu kefarmasian
Kedudukan dan peran imunologi dalam ilmu kefarmasian