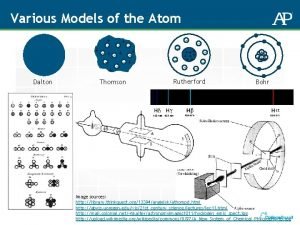
Democritus Perkembangan Teori Atom Dalton Teori Atom Thomson
Democritus Perkembangan Teori Atom Dalton Teori Atom Thomson Teori Atom Rutherford Teori Atom Bohr +


Istilah Atom Teori Atom Dalton Atomos a = tidak tomos = terbagi Teori Atom Thomson Teori Atom Rutherford Teori Atom Bohr ATOM ADALAH BAGIAN YANG PALING KECIL DARI SUATU ZAT YANG TIDAK DAPAT DIBAGI LAGI

Seperti apa partikel terkecil tersebut? Luas permukaan yang paling kecil dibandingkan dengan bentuk-bentuk yang lain yang memiliki volume sama

Aneka Buah -buahan berbentuk bulat
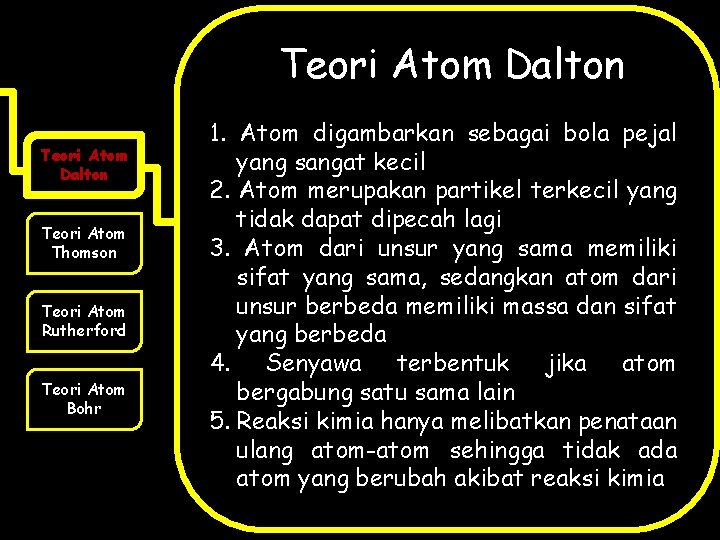
Teori Atom Dalton Teori Atom Thomson Teori Atom Rutherford Teori Atom Bohr 1. Atom digambarkan sebagai bola pejal yang sangat kecil 2. Atom merupakan partikel terkecil yang tidak dapat dipecah lagi 3. Atom dari unsur yang sama memiliki sifat yang sama, sedangkan atom dari unsur berbeda memiliki massa dan sifat yang berbeda 4. Senyawa terbentuk jika atom bergabung satu sama lain 5. Reaksi kimia hanya melibatkan penataan ulang atom-atom sehingga tidak ada atom yang berubah akibat reaksi kimia
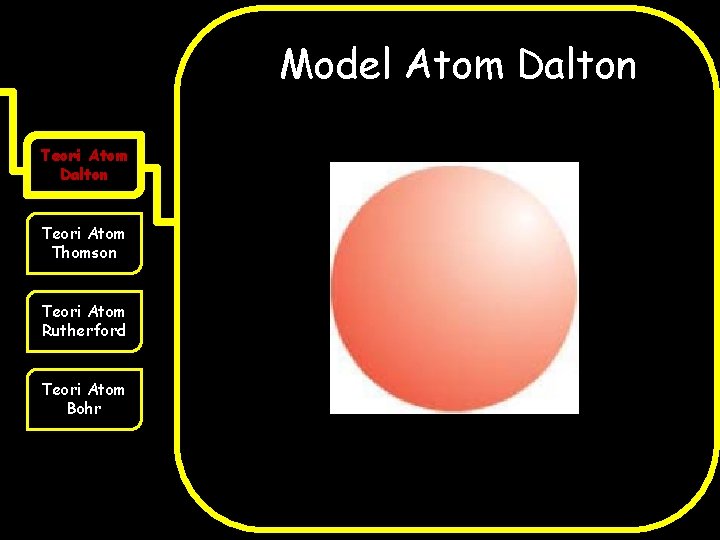
Model Atom Dalton Teori Atom Thomson Teori Atom Rutherford Teori Atom Bohr
Teori Atom Dalton Teori Atom Thomson Teori Atom Rutherford Teori Atom Bohr Ditunjang oleh 2 hukum alam : 1. Hukum kekekalan massa (Hukum Lavoisier) : Massa zat sebelum dan sesudah reaksi adalah sama 2. Hukum perbandingan tetap (Hukum Proust) : Perbandingan massa unsur-unsur dalam suatu senyawa adalah tetap

Kelemahan model atom Dalton Teori Atom Thomson Teori Atom Rutherford Teori Atom Bohr Menurut Teori Dalton nomor 5, tidak ada atom yang berubah akibat reaksi kimia. Akan tetapi kini ternyata dengan reaksi kimia nuklir, suatu atom dapat berubah menjadi atom lain
Teori Atom Thomson Pada abad ke 18, Thomson menemukan elektron Teori Atom Dalton melalui eksperimennya menggunakan tabung sinar katode Teori Atom Thomson Teori Atom Rutherford Menyusun Model Atom Thomson Teori Atom Bohr Menyempurnakan Model Atom Dalton

Teori Atom Thomson ATOM BERBENTUK SEPERTI BOLA PEJAL Teori Atom Dalton Teori Atom Thomson YANG BERMUATAN POSITIF DAN ELEKTRON TERSEBAR DALAM BOLA TERSEBUT Model Atom Thomson Teori Atom Rutherford Teori Atom Bohr - - - - - ANALOG TEORI ATOM THOMSON ADALAH MODEL ROTI KISMIS DENGAN ROTI SEBAGAI ATOM YANG BERMUATAN POSITIF DAN KISMIS SEBAGAI ELEKTRON YANG TERSEBAR MERATA DI SELURUH BAGIAN ROTI. ATOM SECARA KESELURUHAN BERSIFAT NETRAL.

Model Atom Thomson Model atom Thomson disusun setelah Teori Atom Dalton Teori Atom Thomson Teori Atom Rutherford Teori Atom Bohr dirinya menemukan elektron Kelemahan model atom Thomson telah mengemukakan gagasan tentang adanya muatan positif dalam atom. Hanya saja Thomson belum bisa menjelaskan lebih rinci mengenai muatan positif ini.

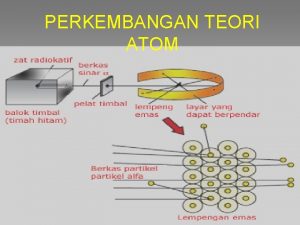
Teori Atom Rutherford Teori Atom Dalton Teori Atom Thomson Teori Atom Rutherford Teori Atom Bohr Sebelumnya, model atom Thomson belum mengatakan adanya inti di dalam atom. Kemudian Ernest Rutherford, menemukan bukti bahwa di dalam atom terdapat inti atom yang bermuatan positif. Hal ini diperoleh melalui eksperimennya. Rutherford menembakkan partikel alfa pada suatu lempeng logam tipis. Hasil eksperimennya menunjukkan bahwa sebagian besar partikel alfa diteruskan dan ada sebagian kecil yang pantulkan atau dibelokkan. Partikel alfa yang diteruskan mengindikasikan bahwa sebagian besar bagian atom merupakan tempat yang kosong Partikel alfa yang dipantulkan(dibelokkan) mengindikasikan bahwa didalam atom itu terdapat inti atom yang bermuatan positif

+ + + + Sumber partikel alfa (inti 2 He 4) + + + celah Lempeng logam Au

Ruang hampa + Teori Atom Dalton - Elektron Jari – jari atom Inti atom Teori Atom Thomson Teori Atom Rutherford Teori Atom Bohr Seandainya ukuran atom sebesar stadion sepak bola, inti atom tidak lebih besar dari bola

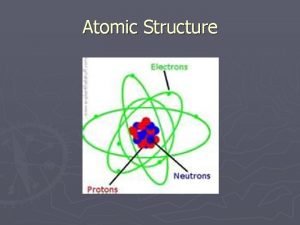
Teori Atom Rutherford Teori Atom Dalton Teori Atom Thomson Teori Atom Rutherford Teori Atom Bohr 1. ATOM TERDIRI DARI INTI ATOM YANG BERMUATAN POSITIF DAN ELEKTRON YANG BERMUATAN NEGATIF BEREDAR MENGELILINGI INTI ATOM 2. ATOM BERSIFAT NETRAL MUATAN POSITIF DALAM INTI SAMA DENGAN MUATAN NEGATIF Model atom Rutherford
Kelemahan teori atom Rutherford Teori Atom Dalton Teori Atom Thomson Teori Atom Rutherford Teori Atom Bohr 1. Ketidakmampuannya untuk menerangkan mengapa elektron tidak jatuh ke inti atom akibat gaya tarik elektrostatis inti terhadap elektron. 2. Berdasarkan Teori Maxwell: Jika elektron sebagai partikel bermuatan mengelilingi inti yang memiliki muatan berlawanan, lintasannya akan berbentuk spiral sehingga elektron akan kehilangan tenaga dan akhirnya jatuh ke inti. 3. Hal itu berarti kehancuran bagi atom. Padahal kenyataannya, atom bersifat stabil

Teori Atom Bohr Teori Atom Dalton Teori Atom Thomson Teori Atom Rutherford Teori Atom Bohr didasarkan pada penelitiannya tentang spektrum garis atom hidrogen Kesimpulan percobaan: Spektrum garis menunjukkan bahwa elektron dalam atom berada pada tingkat energi tertentu dalam atom

Teori Atom Bohr Teori Atom Dalton Teori Atom Thomson Teori Atom Rutherford Teori Atom Bohr 1. Dalam atom, elektron beredar mengelilingi inti atom pada orbit tertentu yang dikenal sebagai lintasan stasioner/tetap (kulit atom). 2. Selama elektron berada dalam lintasan stasioner, energi akan tetap, sehingga tidak ada energi yang dipancarkan maupun diserap. 3. Elektron dapat berpindah dari lintasan yang lebih rendah ke lintasan yang lebih tinggi jika menyerap energi. Sebaliknya, elektron dapat berpindah dari lintasan yang lebih tinggi ke lintasan yang lebih rendah jika memancarkan energi

MODEL ATOM BOHR 11 p 12 n + n=1 n=2 n=3 n=4 n=5 n=6 Atom Natrium, Na K L M N O

Kelemahan Teori Atom Bohr Teori Atom Thomson 1. Hanya dapat menerangkan spektrum dari atom yang mengandung 1 elektron (atom Hidrogen) Teori Atom Rutherford 2. Tidak sesuai dengan spektrum atom yang berelektron banyak Teori Atom Dalton Teori Atom Bohr 3. Tidak dapat menjelaskan letak elektron dengan pasti

Teori atom modern Kelemahan dari teori atom Bohr kemudian disempurnakan oleh teori atom modern. Menurut teori atom modern, elektron yang mengelilingi inti berada dalam suatu orbital tertentu. Orbital adalah ruang dimana suatu elektron kemungkian besar ditemukan. Jadi, teori atom modern mampu meramalkan keboleh jadian ditemukannya elektron.

Teori Atom Dalton Teori Atom Thomson - - - - Teori Atom Rutherford Disempurnakan lagi MODEL ATOM MODERN Teori Atom Bohr
- Slides: 23