KONFIGURASI ELEKTRON PENGERTIAN KONFIGURASI ELEKTRON adalah penempatan elektron



- Slides: 11

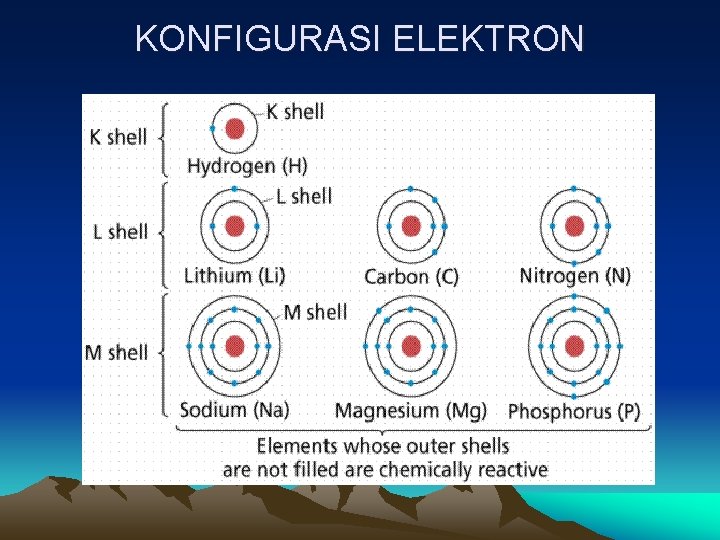
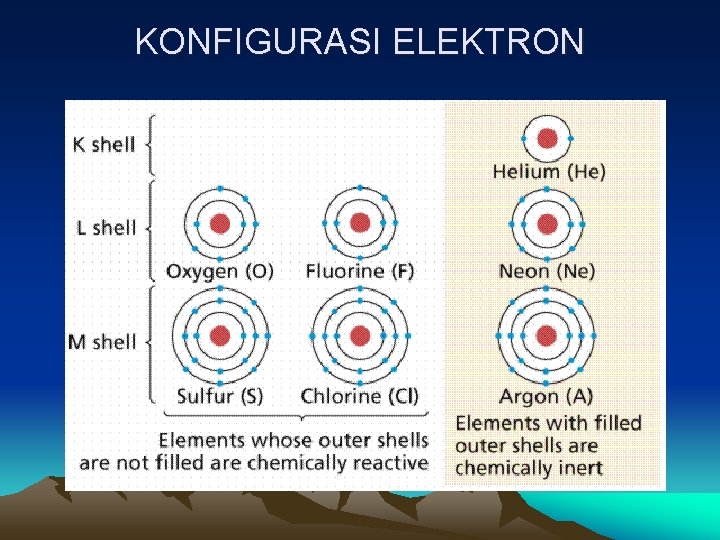
KONFIGURASI ELEKTRON PENGERTIAN KONFIGURASI ELEKTRON adalah penempatan elektron dalam suatu atom menurutan tertentu sesuai dengan energi elektron bersangkutan. • Pengisian elektron dimulai dari energi rendah energi tinggi • Elektron-elektron yang terdapat pada kulit yang sama belum tentu memiliki energi yang sama, tergantung pada sub kulitnya. • Kulit elektron dari energi rendah ke tinggi : K, L, M, N dst. Sub kulit : s, p, d, f.

KONFIGURASI ELEKTRON

KONFIGURASI ELEKTRON

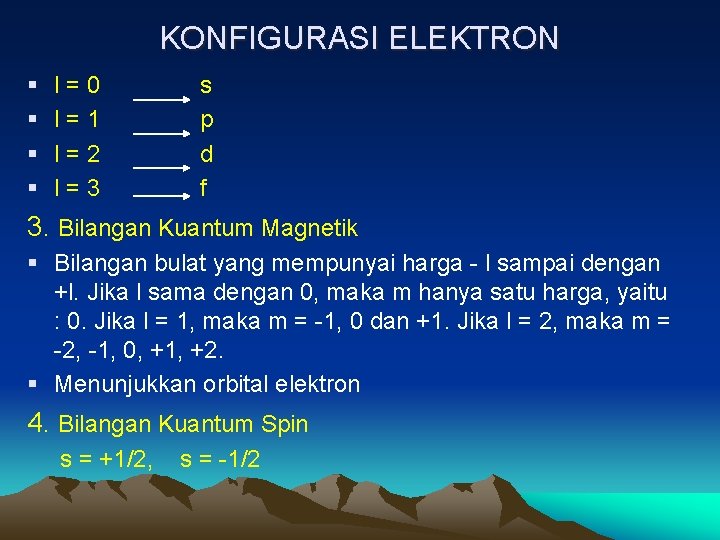
KONFIGURASI ELEKTRON MACAM-MACAM BILANGAN KUANTUM 1. Bilangan Kuantum Utama (n) § Bilangan bulat positif, harga : 1, 2, 3, 4 …. dst § Kulit utama elektron. n= 1(kulit elektron K), n = 2 (kulit elektron L), n = 3 (kulit elektron M), n = 4 (kulit elektron N) 2. Bilangan Kuantum Azimuth (l) § Sub kulit elektron § Harga, antara 0 sampai dengan (n-1). Jika n = 1, maka l = 0 saja. Jika n = 2, maka l = 0 dan 1. Jika n = 3, maka l = 0, 1 dan 2. Jika n = 4, maka l = 0, 1, 2 dan 3.

KONFIGURASI ELEKTRON § § l=0 l=1 l=2 l=3 s p d f 3. Bilangan Kuantum Magnetik § Bilangan bulat yang mempunyai harga - l sampai dengan +l. Jika l sama dengan 0, maka m hanya satu harga, yaitu : 0. Jika l = 1, maka m = -1, 0 dan +1. Jika l = 2, maka m = -2, -1, 0, +1, +2. § Menunjukkan orbital elektron 4. Bilangan Kuantum Spin s = +1/2, s = -1/2

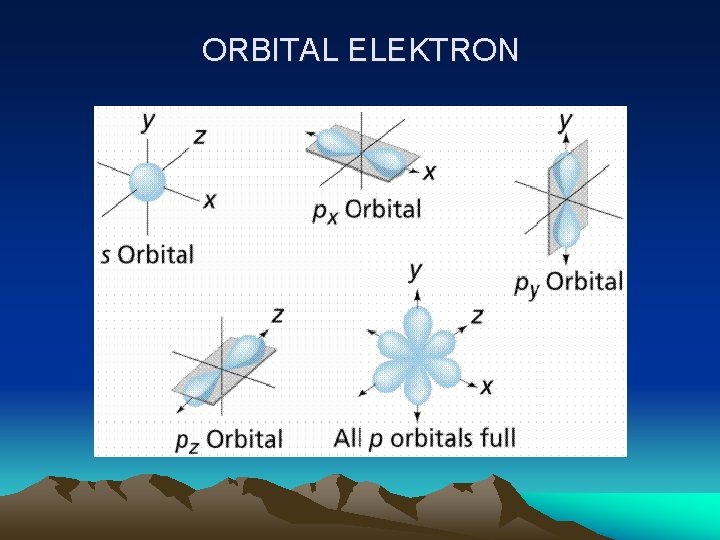
ORBITAL ELEKTRON

KONFIGURASI ELEKTRON l=0 m = 0 (1 orbital) = 2 elektron l=1 m = -1, 0, +1 (3 orbital) = 6 elektron l=2 m = -2, -1, 0, +1, +2 (5 orbital) = 10 elektron l=3 m = -3, -2, -1, 0, +1, +2, +3 (7 orbital) = 14 elektron Urutan Pengisian Elektron 1 s 2 s 2 p 3 s 3 p 3 d 4 s 4 p 4 d 4 f 5 s 5 p 5 d 5 f 6 s 6 p 6 d 7 s 7 p 8 s

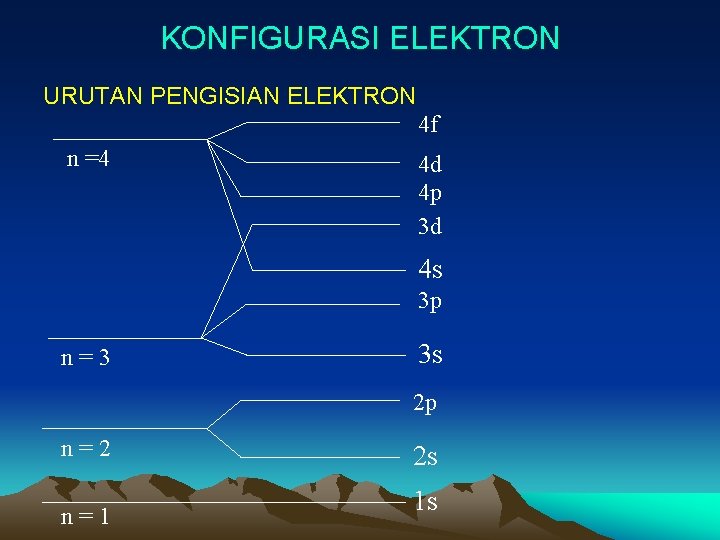
KONFIGURASI ELEKTRON URUTAN PENGISIAN ELEKTRON 4 f n =4 4 d 4 p 3 d 4 s 3 p n=3 3 s 2 p n=2 n=1 2 s 1 s

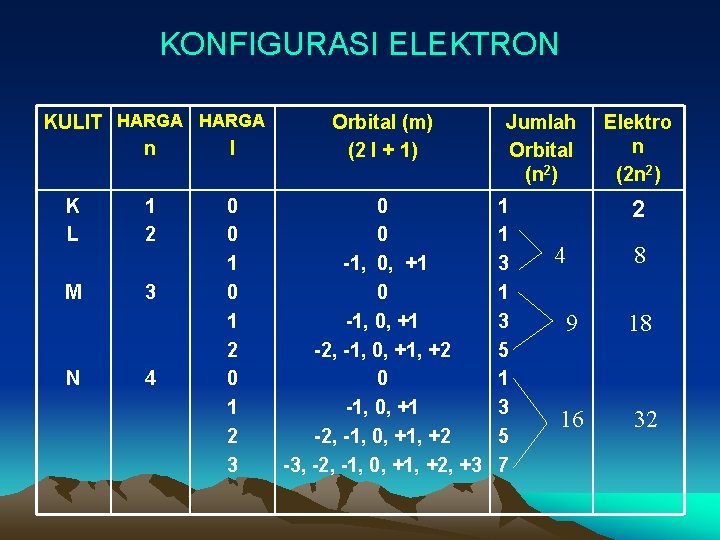
KONFIGURASI ELEKTRON KULIT HARGA n l K L 1 2 M 3 N 4 0 0 1 2 3 Orbital (m) (2 l + 1) 0 0 -1, 0, +1 -2, -1, 0, +1, +2 -3, -2, -1, 0, +1, +2, +3 Jumlah Orbital (n 2) 1 1 3 5 7 Elektro n (2 n 2) 2 4 8 9 18 16 32

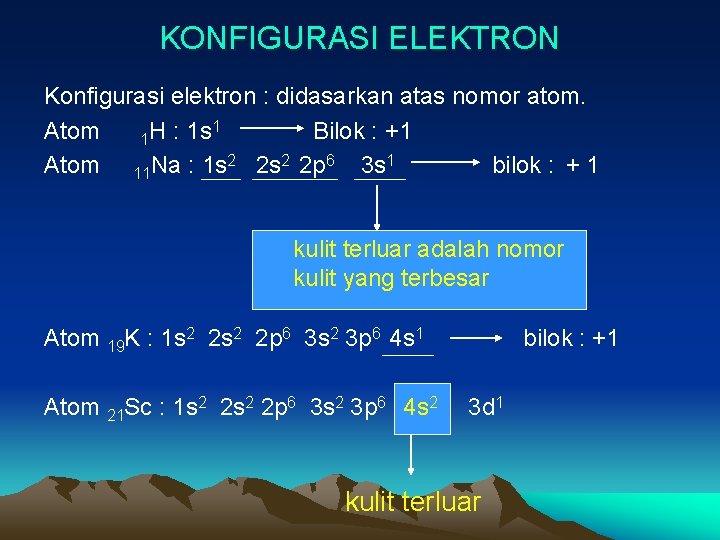
KONFIGURASI ELEKTRON Konfigurasi elektron : didasarkan atas nomor atom. 1 Atom H : 1 s Bilok : +1 1 Atom 11 Na : 1 s 2 2 p 6 3 s 1 bilok : + 1 kulit terluar adalah nomor kulit yang terbesar Atom 19 K : 1 s 2 2 p 6 3 s 2 3 p 6 4 s 1 Atom 21 Sc : 1 s 2 2 p 6 3 s 2 3 p 6 4 s 2 bilok : +1 3 d 1 kulit terluar

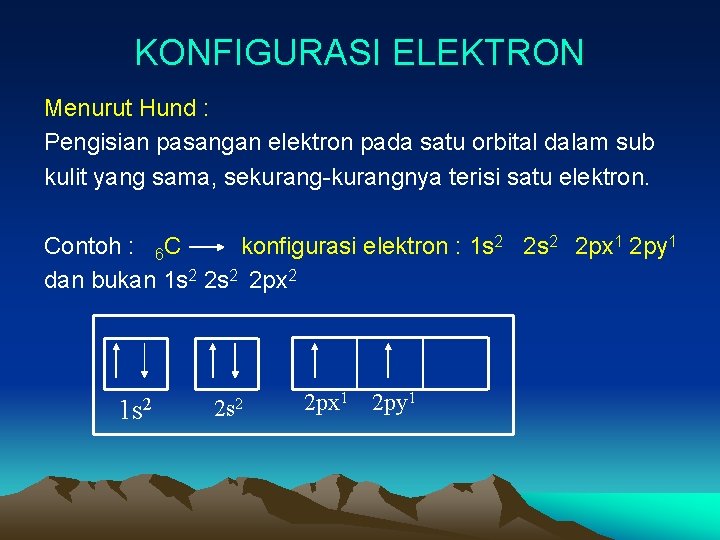
KONFIGURASI ELEKTRON Menurut Hund : Pengisian pasangan elektron pada satu orbital dalam sub kulit yang sama, sekurang-kurangnya terisi satu elektron. Contoh : 6 C konfigurasi elektron : 1 s 2 2 px 1 2 py 1 dan bukan 1 s 2 2 px 2 1 s 2 2 px 1 2 py 1
 Pengertian konfigurasi elektron
Pengertian konfigurasi elektron Lambang atom no 31
Lambang atom no 31 Konfigurasi elektron yang cocok untuk transisi
Konfigurasi elektron yang cocok untuk transisi Cara menyingkat konfigurasi elektron
Cara menyingkat konfigurasi elektron Simbol radius
Simbol radius Konfigurasi elektron
Konfigurasi elektron Konfigurasi elektron
Konfigurasi elektron Kedudukan elektron
Kedudukan elektron Konfigurasi elektron v
Konfigurasi elektron v Konfigurasi elektron
Konfigurasi elektron Perbedaan seleksi dan penempatan
Perbedaan seleksi dan penempatan Pengertian penempatan pegawai
Pengertian penempatan pegawai