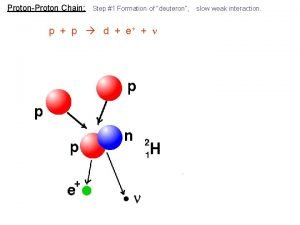
Istilah Isotop Unsurunsur sama yang jumlah proton sama











- Slides: 12

Istilah Isotop Unsur-unsur : sama yang (jumlah proton sama), tetapi jumlah netron berbeda (massa atom berbeda) Contoh : Isobar : Unsur-unsur berbeda (jumlah proton berbeda) tetapi massa atom sama. 14 Contoh : 6 C Isoton : Unsur-unsur berbeda dengan jumlah netron sama Contoh : Isoelektron : unsur atau ion-ion yang jumlah elektron sama. Contoh :

Isotop, Isobar, Isoton dan Isoelektron a. Isotop adalah unsur-unsur yang sejenis (nomor atom sama/ proton sama) tetapi nomor massa berbeda. Hal ini disebabkan jumlah netron yang dimiliki oleh atom-atom itu berbeda. Contoh : 8 O 16, 8 O 17, 8 O 18 p = 8 , n = 16 – 8 = 8 17 8 O p = 8 , n = 17 – 8 = 9 18 p = 8 , n = 18 – 8 = 10 O 8 8 O 16

b. Isobar adalah unsur-unsur yang berbeda (nomor atom berbeda) tetapi memiliki nomor massa sama. Contoh : 18 Ar 40 dan 20 Ca 40 40 p Ar = 18 18 nomor massa = 40 40 = 20 20 Ca p nomor massa = 40 c. Isoton adalah unsur-unsur yang berbeda tetapi mempunyai jumlah netron yang sama. Contoh : 6 C 14 dan 8 O 16 14 p = 6 6 C n = 14 – 6 = 8 16 8 O p = 8 n = 16 – 8 = 8

d. Isoelektron adalah unsur atau ion dengan jumlah elektron sama. Contoh : e = 10

SOAL 1. Unsur A mempunyai 10 proton dan 12 netron, sedangkan unsur B mempunyai nomor massa 23 dan nomor atom 11. Kedua unsur tersebut termasuk …. A. Isoton B. Isotop C. Isobar D. Isokhlor E. Isomer 2. Jumlah proton, elektron, dan netron dari adalah … A. 11, dan 12 B. 23, 11, dan 11 C. 11, 23, dan 11 D. 11, 12, dan 11 E. 11, 10, dan 12 11 Na 23

3. Suatu unsur netral mempunyai 2 elektron dalam kulit pertama, 8 elektron dalam kulit kedua, dan 7 elektron dalam kulit ketiga. Nomor atom unsur itu adalah: A. 2 B. 6 C. 7 D. 8 E. 17 4. Atom unsur A memiliki jumlah proton sebanyak 19 dan netron sebanyak 20 maka pernyataan yang tidak benar untuk atom unsur A adalah memiliki A. nomor atom 19 B. 19 elektron C. 39 nukleon D. notasi 1939 A E. massa atom relative 20

5. Berikut ini yang bukan merupakan isotop adalah… 6. Karbon dialam dijumpai dalam dua isotop, 98, 90% 12 C dan 1, 10% 13 C. Hitung massa rata-rata 1 atom karbon.

7. Unsur Galium mempunyai dua isotop yaitu 69 Ga dan 71 Ga. Jika diketahui bahwa 3 dari lima atom Galium adalah 69 Ga, maka massa ataom relatif (Ar), Galium adalah… a. 68 b. 69, 8 c. 69, 0 d. 70, 0 e. 71, 0 8. Perhitungan massa atom. Hitung massa atom magnesium dengan menggunakan distribusi isotop berikut: 24 Mg: 78, 70%; 25 Mg: 10, 13%, 26 Mg: 11, 17%. 9. Massa molekular mokelul yang mengandung isotop. Hitung massa molekular air H 2 O dan air berat D 2 O (2 H 2 O) dalam bilangan bulat. Jawab Massa molekular H 2 O = 1 x 2 + 16 = 18, massa molekular D 2 O = (2 x 2) + 16 = 20

Ar = Massa atom relatif menyatakan massa rata-rata dari isotop-isotop suatu unsur yang terdapat di alam. Contoh Atom H di alam dijumpai dalam 2 isotop yaitu isotop 1 H 1 dengan massa 1, 0078 amu dan isotop 1 H 2 dengan massa 2, 0141 amu serta kelimpahan masing-masing isotop 99, 985% dan 0, 015% Sehingga massa rata-rata 1 atom H = m 1 x%1 + m 2 x%2 Ar H = m 1 x%1 + m 2 x%2 1 amu = (1, 0078 amu. 99, 985% )+ (2, 0141 amu. 0, 015%) 1 amu = 1, 0079

1 amu = 1/12 x massa 1 atom C-12 1 amu = 1 sma = 1, 66 x 10 -24 gram 6. Karbon dialam dijumpai dalam dua isotop, 98, 90% 12 C dan 1, 10% 13 C. Hitung massa rata-rata 1 atom karbon.

1. Diketahui unsur X memiliki isotop X-12 dan X-13 (Ar X= 12, 25), Berapakah persentase kelimpahan isotop X-12? Massa X-12 dianggap = 12 amu dan massa X-13 dianggap = 13 amu (Kelimpahan isotop 1 + isotop 2 = 100%) 2. Jika Unsur M terdiri atas 3 isotop dengan kelimpahan masing-masing M-24 = 78, 99%, M-25 = 10% dan M-26 = 11, 01%. Berapakah Ar unsur M tersebut!

1. Diketahui unsur X memiliki 2 isotop X-12 dan X-13 (Ar X= 12, 25), Berapakah persentase kelimpahan isotop X-12? Massa X-12 dianggap = 12 amu dan massa X-13 dianggap = 13 amu (Kelimpahan isotop 1 + isotop 2 = 100%) 2. Jika Unsur M terdiri atas 3 isotop dengan kelimpahan masing-masing M-24 = 78, 99%, M-25 = 10% dan M-26 = 11, 01%. Berapakah Ar unsur M tersebut!