STRUKTUR DAN GAYA ANTAR MOLEKUL STRUKTUR MOLEKUL MENGAPA






















- Slides: 37

STRUKTUR DAN GAYA ANTAR MOLEKUL STRUKTUR MOLEKUL

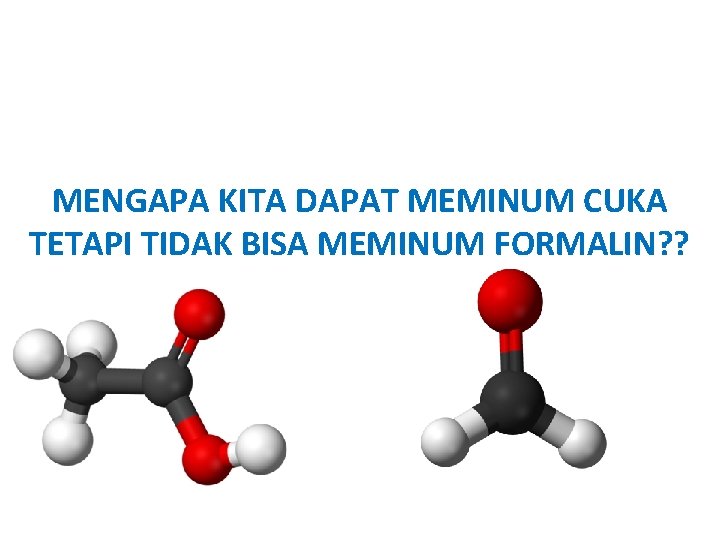
MENGAPA KITA DAPAT MEMINUM CUKA TETAPI TIDAK BISA MEMINUM FORMALIN? ?

Susunan Atom Dalam Molekul • Jumlah cara penyusunan atom dalam molekul tidak banyak sebab dibatasi oleh sudut antarikatan dan sifat partikel penyusunnya. • Teori yang mengkaji aspek struktur molekul, antara lain : – teori domain elektron (berdasarkan teori Lewis) – Teori ikatan valensi (berdasarkan mekanika kuantum) – teori hibridisasi

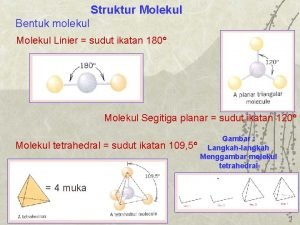
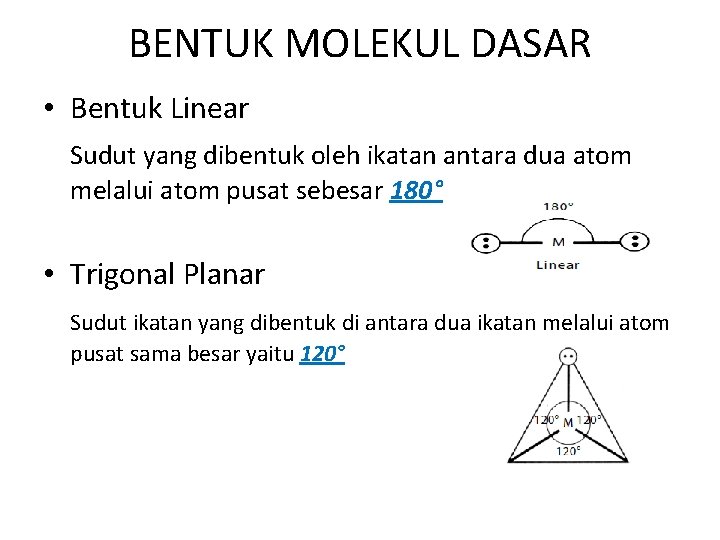
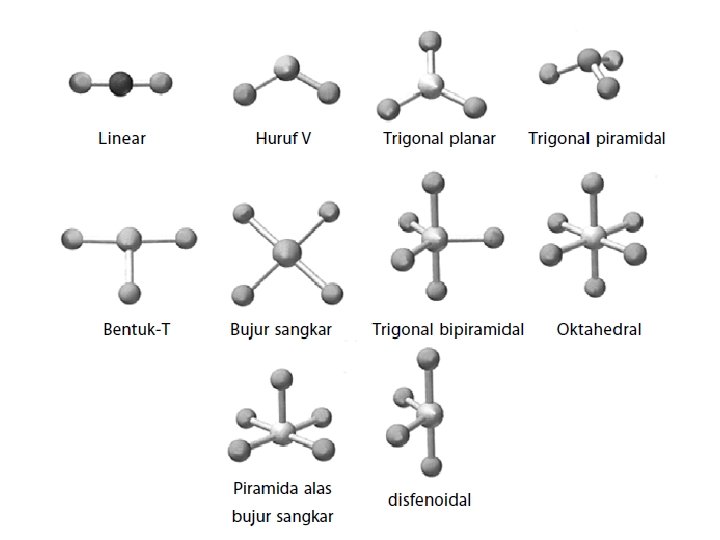
BENTUK MOLEKUL DASAR • Bentuk Linear Sudut yang dibentuk oleh ikatan antara dua atom melalui atom pusat sebesar 180° • Trigonal Planar Sudut ikatan yang dibentuk di antara dua ikatan melalui atom pusat sama besar yaitu 120°

• Tetrahedral Sudut ikatan yang dibentuk sama besar, yaitu 109, 5°. • Trigonal Bipiramidal Sudut ikatan yang terletak pada pusat bidang datar segitiga masing-masing 120°, sedangkan sudut ikatan antara bidang pusat dan titik sudut atas serta bawah bidang adalah 90°.

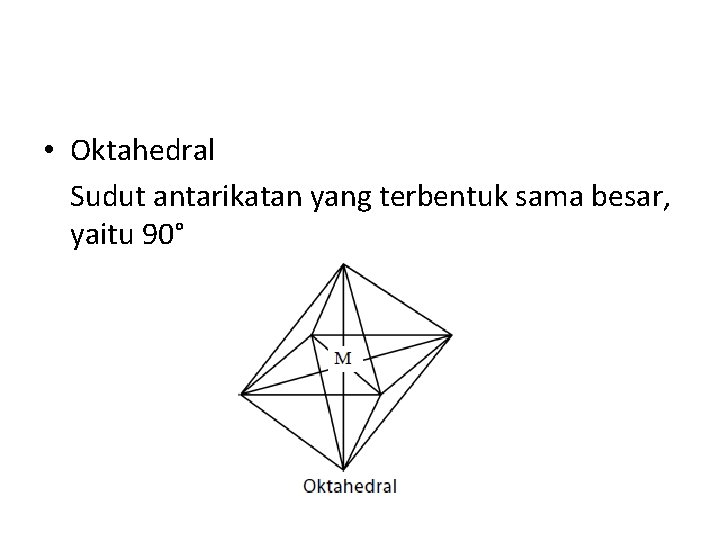
• Oktahedral Sudut antarikatan yang terbentuk sama besar, yaitu 90°

TEORI DOMAIN ELEKTRON • Teori ini didasarkan pada jumlah pasangan elektron ikatan dan pasangan elektron bebas dalam kulit valensi atom pusat suatu molekul • Teori ini menyatakan bahwa bentuk molekul dapat ditentukan berdasarkan tolakan pasangan elektron dalam kulit valensi atom pusat

TEORI DOMAIN ELEKTRON • molekul-molekul akan dikelompokkan ke dalam tiga kategori, yaitu molekul-molekul yang memiliki atom pusat : – berikatan kovalen tunggal yang jenuh – berikatan kovalen tunggal yang memiliki elektron bebas – berikatan kovalen rangkap.

Atom Pusat Yang Berikatan Kovalen Tunggal Yang Jenuh • Pasangan elektron ikatan dalam kulit valensi atom pusat akan mengalami tolakan disebabkan muatannya sejenis. • Guna meminimalkan tolakan tersebut maka pasangan elektron ikatan akan menjauh satu sama lain

Atom Pusat Yang Berikatan Kovalen Tunggal Yang Memiliki Elektron Bebas • PEB (yang pergerakan elektronya lebih leluasa) menolak lebih kuat dari PEI sebab pasangan elektron bebas memerlukan ruang lebih besar untuk bergerak dibandingkan pasangan elektron ikatan.

TABEL PENGAMATAN PERCOBAAN GEOMETRI MOLEKUL Jumlah Domain Elektron Total No 1 2 3 4 5 6 7 8 9 10 11 Molekul Be. Cl 2 BH 3 CCl 4 PCl 3 PCl 5 Xe. F 2 Cl. F 3 Cl. F 5 H 2 S SF 4 SF 6 Ikatan Bebas Struktur Ruang Domain Elektron Sudut ikatan Geometri Molekul

TEORI DOMAIN ELEKTRON • Secara umum, teori domain elektron dapat dirumuskan sebagai berikut : AXn. Em Ket : A = atom pusat X = PEI E = PEB n = jumlah domain ikatan m = jumlah domain bebas

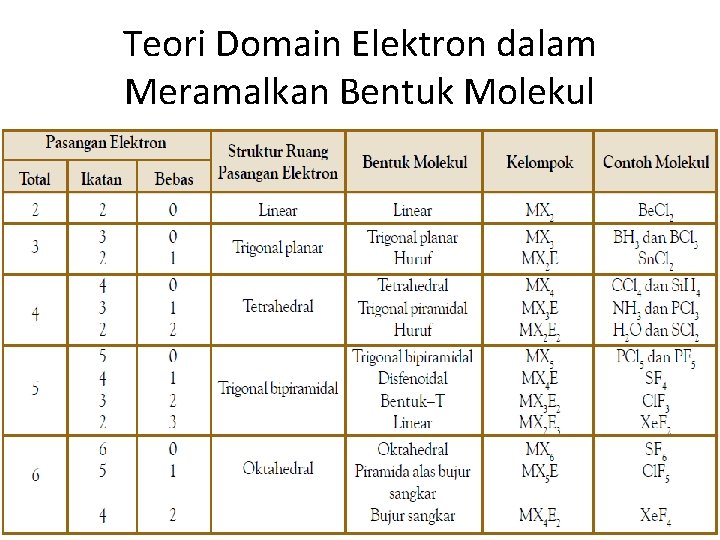
Teori Domain Elektron dalam Meramalkan Bentuk Molekul


TEORI IKATAN VALENSI DAN HIBRIDISASI • Menurut teori ikatan valensi, ikatan akan terbentuk antara dua atom jika memenuhi syarat sebagai berikut : – Ketika membentuk ikatan, orbital-orbital pada atom pusat mengadakan restrukturisasi melalui proses hibridisasi membentuk orbital hibrida. – Selanjutnya, orbital hibrida ini berikatan dengan orbital atom lain.

– Orbital-orbital yang berikatan harus bertumpang tindih (overlapping) satu sama lain. – Jumlah elektron dalam orbital ikatan yang bertumpang tindih maksimal dua elektron dengan spin berlawanan. – Kekuatan ikatan bergantung pada derajat tumpang tindih. Semakin besar daerah tumpang tindih, semakin kuat ikatan yang terbentuk – Orbital-orbital atom selain orbital-s dalam berikatan memiliki arah tertentu sesuai orientasi orbital atom yang berikatan. .

Hibridisasi Orbital Atom • Proses pencampuran orbital-orbital atom membentuk orbital baru dengan tingkat energi berada di antara orbital-orbital yang dicampurkan • Orbital hasil pencampuran dinamakan orbital hibrida. Mengapa orbital-orbital berhibridisasi?

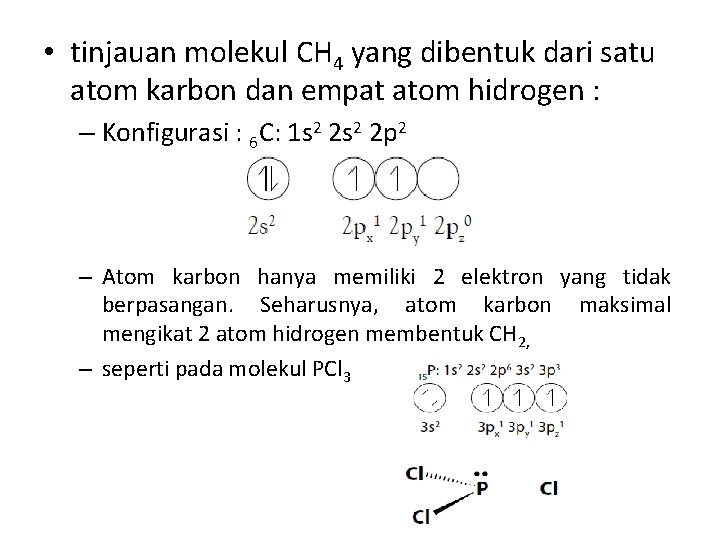
• tinjauan molekul CH 4 yang dibentuk dari satu atom karbon dan empat atom hidrogen : – Konfigurasi : 6 C: 1 s 2 2 p 2 – Atom karbon hanya memiliki 2 elektron yang tidak berpasangan. Seharusnya, atom karbon maksimal mengikat 2 atom hidrogen membentuk CH 2, – seperti pada molekul PCl 3

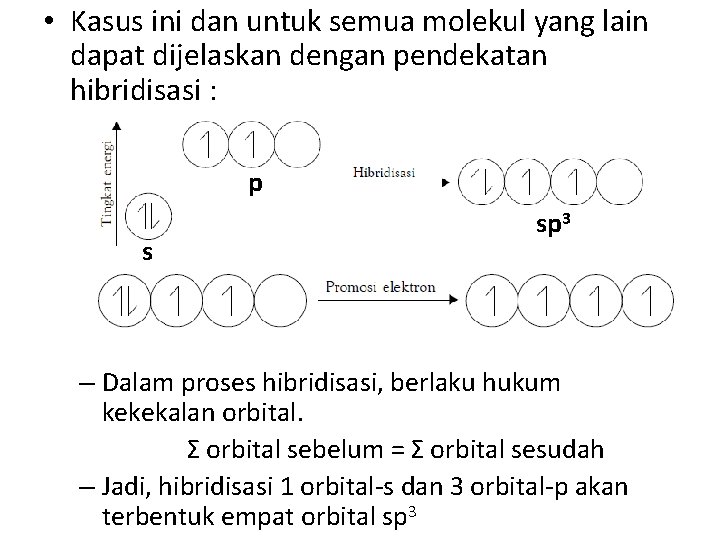
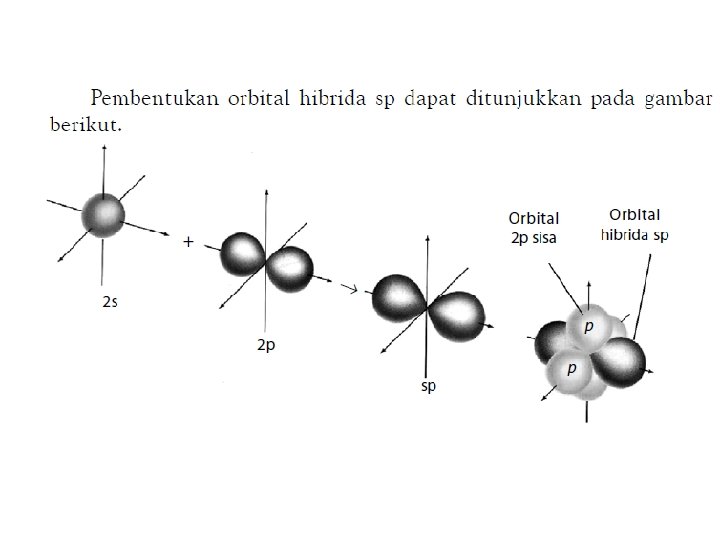
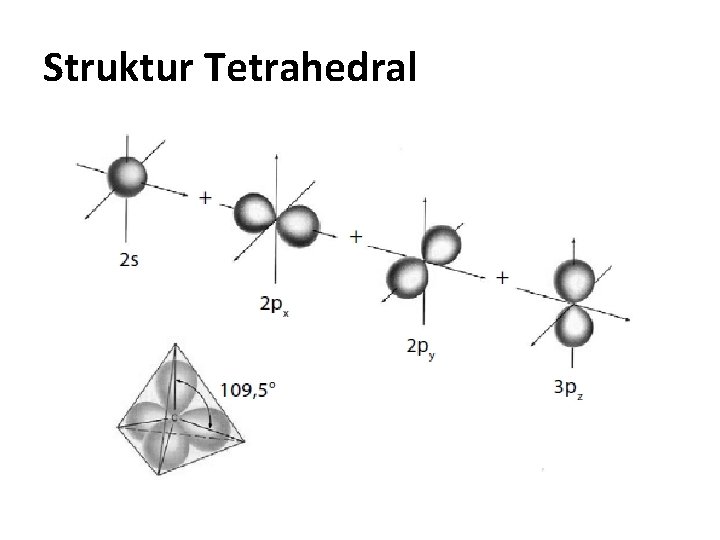
• Kasus ini dan untuk semua molekul yang lain dapat dijelaskan dengan pendekatan hibridisasi : p s sp 3 – Dalam proses hibridisasi, berlaku hukum kekekalan orbital. Σ orbital sebelum = Σ orbital sesudah – Jadi, hibridisasi 1 orbital-s dan 3 orbital-p akan terbentuk empat orbital sp 3

Bentuk Molekul dan Valensi Terarah • Menurut teori ikatan valensi, pada pembentukan ikatan, orbital hibrida dari atom pusat harus bertumpang tindih dengan orbital atom lain dengan arah tertentu. • Pada molekul CH 4, orbital hibrida sp 3 dari atom karbon akan bertumpang tindih dengan orbital-s dari atom hidrogen membentuk ikatan terlokalisasi sp 3–s sepanjang sumbu ikatan C–H. • Oleh karena ikatan yang terbentuk memiliki orientasi tertentu dalam ruang maka ikatan ini disebut ikatan valensi terarah. • Orbital-orbital hibrida yang terbentuk dari orbital atom juga memilki struktur tertentu di dalam ruang

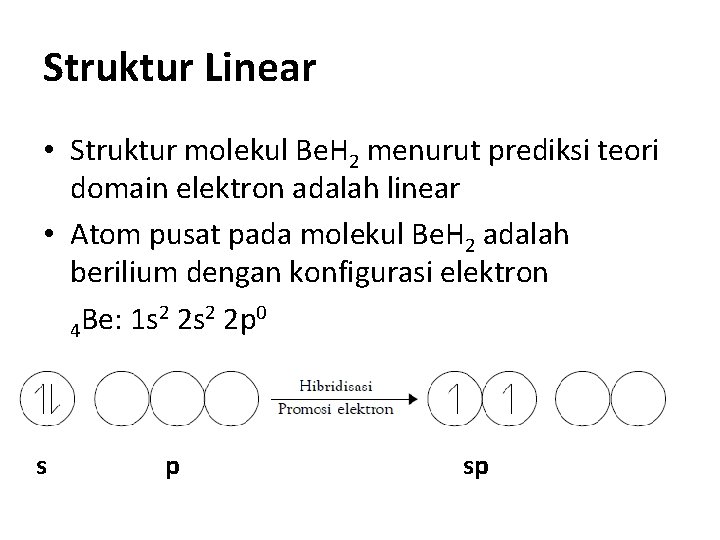
Struktur Linear • Struktur molekul Be. H 2 menurut prediksi teori domain elektron adalah linear • Atom pusat pada molekul Be. H 2 adalah berilium dengan konfigurasi elektron 2 2 s 2 2 p 0 Be: 1 s 4 s p sp


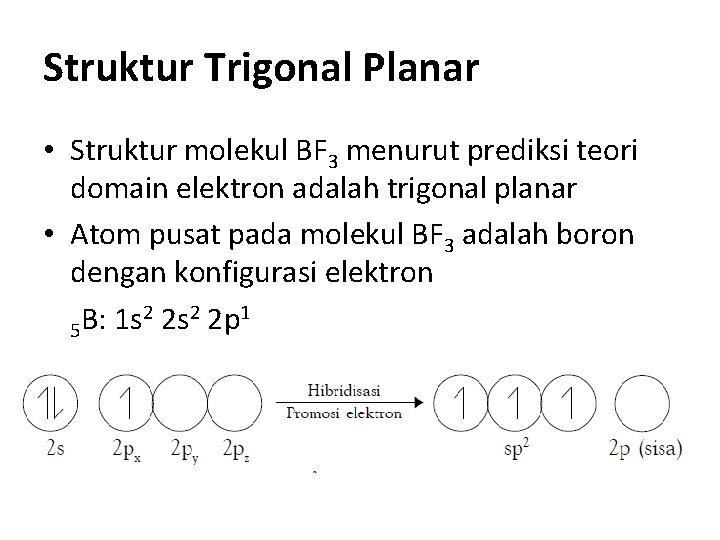
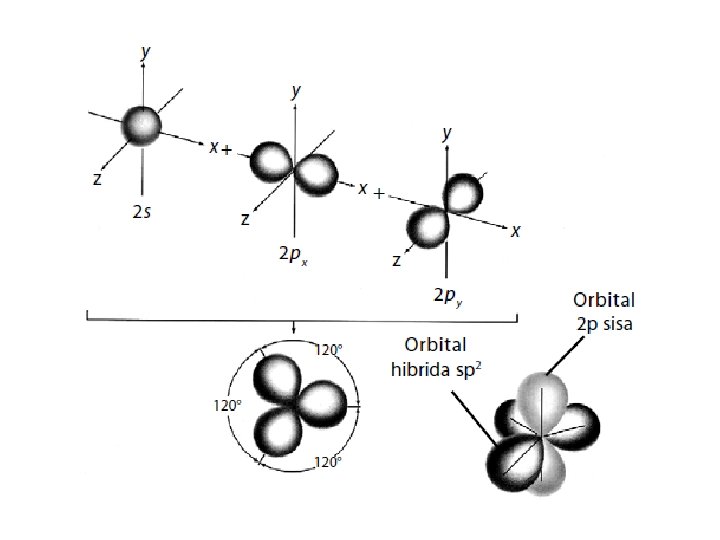
Struktur Trigonal Planar • Struktur molekul BF 3 menurut prediksi teori domain elektron adalah trigonal planar • Atom pusat pada molekul BF 3 adalah boron dengan konfigurasi elektron 2 2 s 2 2 p 1 B: 1 s 5


Struktur Tetrahedral

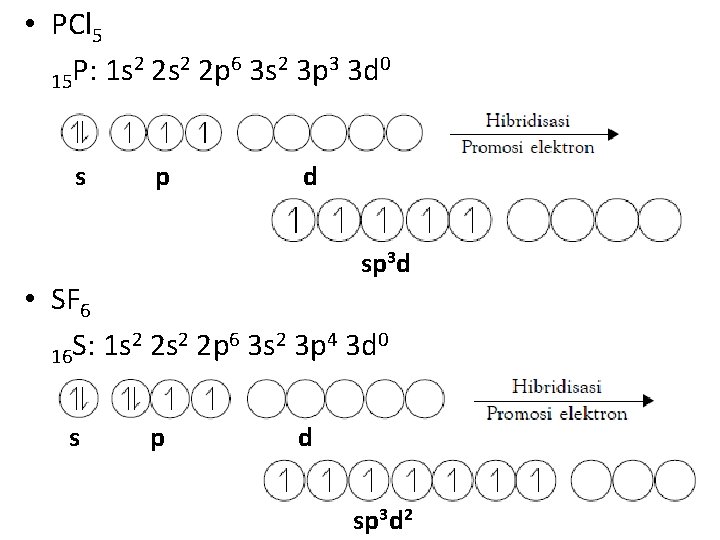
Struktur Trigonal bipiramidal dan Oktahedral • Struktur trigonal bipiramidal dan oktahedral merupakan kasus menarik dalam teori ikatan valensi dengan hibridisasinya • Orbital hibrida yang terbentuk melibatkan orbital-d dan senyawa yang terbentuk tergolong superoktet • Contoh molekul dengan bentuk trigonal bipiramidal adalah PCl 5 dan contoh molekul oktahedral adalah SF 6.

• PCl 5 2 2 s 2 2 p 6 3 s 2 3 p 3 3 d 0 P: 1 s 15 s p d sp 3 d • SF 6 2 2 s 2 2 p 6 3 s 2 3 p 4 3 d 0 S: 1 s 16 s p d sp 3 d 2

STRUKTUR DAN GAYA ANTAR MOLEKUL

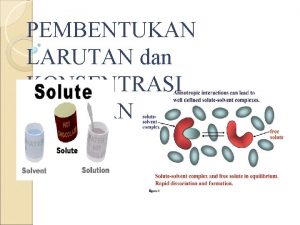
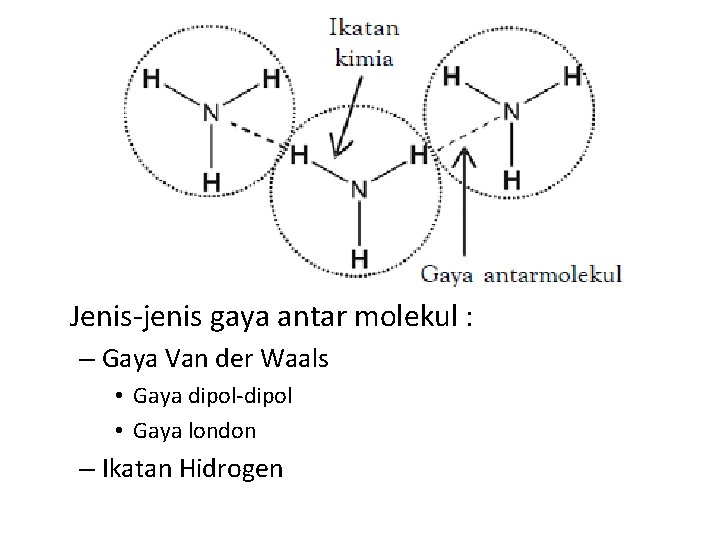
GAYA ANTAR MOLEKUL • Gaya antarmolekul adalah gaya aksi di antara molekul-molekul yang menimbulkan tarikan antarmolekul dengan berbagai tingkat kekuatan. • Pada suhu tertentu, kekuatan tarikan antarmolekul menentukan wujud zat, yaitu gas, cair, atau padat • Kekuatan gaya antarmolekul lebih lemah dibandingkan ikatan kovalen maupun ikatan ion

Jenis-jenis gaya antar molekul : – Gaya Van der Waals • Gaya dipol-dipol • Gaya london – Ikatan Hidrogen

Gaya Dipol-Dipol • Gaya dipol-dipol adalah gaya yang terjadi di antara molekul-molekul yang memiliki sebaran muatan tidak homogen, yakni molekul-molekul dipol atau molekul polar. • Molekul-molekul polar memiliki dua kutub muatan yang berlawanan. Oleh karena itu, di antara molekul-molekulnya akan terjadi antaraksi yang disebabkan kedua kutub muatan yang dimilikinya. • Tarikan dipol-dipol memengaruhi sifat-sifat fisik senyawa, seperti titik leleh, kalor peleburan, titik didih, kalor penguapan, dan sifat fisik lainnya

Titik didih berhubungan dengan energi yang diperlukan untuk memutuskan gaya antaraksi antarmolekul (bukan memutuskan ikatan kimia antaratom). Semakin kuat gaya antaraksi antarmolekul, semakin besar energi yang diperlukan untuk memutuskannya

Gaya London • Gaya London adalah gaya yang terjadi pada atom non polar dan nonpolar • Gaya London atau disebut juga gaya dispersi, yaitu gaya yang timbul akibat dari pergeseran sementara (dipol sementara) muatan elektron dalam molekul homogen

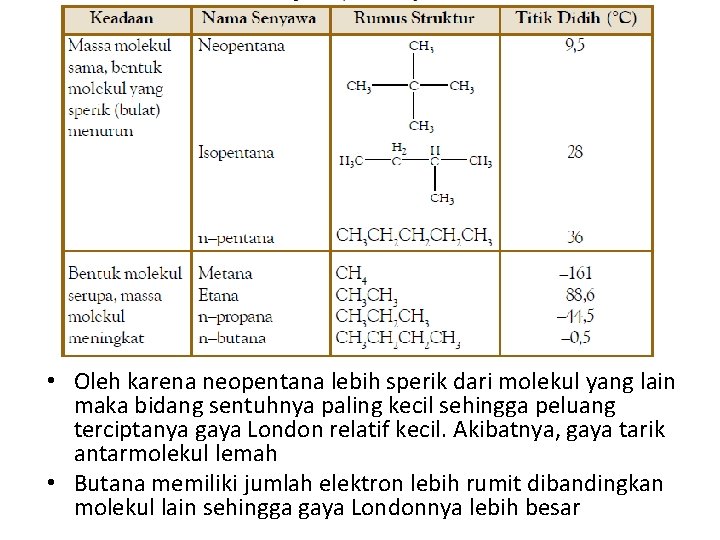
Gaya London • gaya London adalah gaya antaraksi antaratom atau molekul yang memiliki dipol sementara dengan jarak yang sangat berdekatan satu sama lain • Kekuatan gaya London dipengaruhi oleh ukuran, bentuk molekul, dan kemudahan distorsi dari awan elektron

• Oleh karena neopentana lebih sperik dari molekul yang lain maka bidang sentuhnya paling kecil sehingga peluang terciptanya gaya London relatif kecil. Akibatnya, gaya tarik antarmolekul lemah • Butana memiliki jumlah elektron lebih rumit dibandingkan molekul lain sehingga gaya Londonnya lebih besar

Ikatan Hidrogen • Ikatan hidrogen terbentuk pada senyawa polar yang mengandung atom H dan atom yang memiliki keelektronegatifan tinggi, seperti F, O, dan N. • Semakin tinggi skala keelektronegatifan atom yang mengikat atom hidrogen, semakin besar peluangnya untuk membentuk ikatan hidrogen • Dengan hadirnya ikatan hidrogen dalam suatu senyawa menimbulkan pengaruh terhadap sifat fisik senyawa tersebut

• Pasangan seperti NH 3–PH 3; H 2 O–H 2 S; dan HF–HCl berasal dari golongan yang sama dalam tabel periodik • Dari pasangan tersebut, NH 3, H 2 O, dan HF memiliki massa molekul lebih kecil, tetapi memiliki titik leleh dan titik didih lebih tinggi dibandingkan senyawa yang segolongan
 Contoh gaya london
Contoh gaya london Saturated
Saturated Macam macam gaya sentuh
Macam macam gaya sentuh Karya tulis opini
Karya tulis opini Gaya basa ngupamakeun nyaeta
Gaya basa ngupamakeun nyaeta Teknik ikatan tunggal
Teknik ikatan tunggal Mengapa kita harus mempelajari manajemen risiko
Mengapa kita harus mempelajari manajemen risiko Mengapa kita memerlukan ukuran letak dan pusat
Mengapa kita memerlukan ukuran letak dan pusat Bahan penyegar adalah bahan yang mengandung senyawa
Bahan penyegar adalah bahan yang mengandung senyawa Doa sebelum makan
Doa sebelum makan Mengapa iklan dibuat singkat padat dan berisi
Mengapa iklan dibuat singkat padat dan berisi Cara mencari dan disenangi teman
Cara mencari dan disenangi teman Pewarnaan kerajinan dari gips dilakukan pada saat
Pewarnaan kerajinan dari gips dilakukan pada saat Membuat rencana belajar efektif
Membuat rencana belajar efektif Perbedaan populasi sampel dan responden
Perbedaan populasi sampel dan responden Ikatan hidrogen
Ikatan hidrogen Unsur adalah
Unsur adalah Teori vsepr
Teori vsepr Perilaku antar kelompok
Perilaku antar kelompok Pengertian tegangan antarmuka
Pengertian tegangan antarmuka Logam fero adalah
Logam fero adalah Pertukaran barang dan jasa antar
Pertukaran barang dan jasa antar Akuisisi antar perusahaan dan investasi pada entitas lain
Akuisisi antar perusahaan dan investasi pada entitas lain Struktur batin puisi kecuali
Struktur batin puisi kecuali Usaha oleh gaya gesek
Usaha oleh gaya gesek Contoh gaya berpikir linear dan nonlinear
Contoh gaya berpikir linear dan nonlinear Contoh gaya berpikir linear dan nonlinear
Contoh gaya berpikir linear dan nonlinear Gaya terdiri dari tarikan
Gaya terdiri dari tarikan Gaya pembelajaran honey dan mumford
Gaya pembelajaran honey dan mumford Gaya geser
Gaya geser Kesetimbangan netral
Kesetimbangan netral Menyusun gaya secara grafis dan analitis
Menyusun gaya secara grafis dan analitis Gaya belajar model felder dan solomon
Gaya belajar model felder dan solomon Gaya hidup dan budaya konsumen
Gaya hidup dan budaya konsumen Suatu perwujudan dari tingkah laku pemimpin disebut....
Suatu perwujudan dari tingkah laku pemimpin disebut.... Gaya sejajar
Gaya sejajar Rumus beban merata
Rumus beban merata Gaya adalah dorongan tarikan
Gaya adalah dorongan tarikan