MOLEKUL ZAT PADAT DAN PITA ENERGI MOLEKUL Kelas

















- Slides: 30

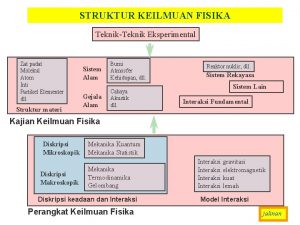
MOLEKUL, ZAT PADAT DAN PITA ENERGI MOLEKUL Kelas III SMA ZAT PADAT PITA ENERGI © edy wiyono 2004

PENDAHULUAN Pada umumnya atom tunggal tidak memiliki konfigurasi elektron yang stabil seperti gas mulia, maka atom bergabung membentuk molekul dengan cara berikatan dengan atom lain.

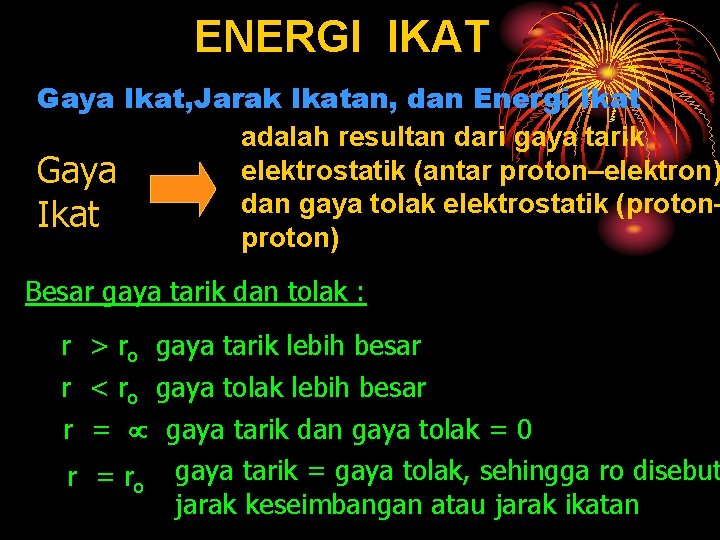
ENERGI IKAT Gaya Ikat, Jarak Ikatan, dan Energi Ikat adalah resultan dari gaya tarik elektrostatik (antar proton–elektron) Gaya dan gaya tolak elektrostatik (proton– Ikat proton) Besar gaya tarik dan tolak : r > ro gaya tarik lebih besar r < ro gaya tolak lebih besar r = gaya tarik dan gaya tolak = 0 r = ro gaya tarik = gaya tolak, sehingga ro disebut jarak keseimbangan atau jarak ikatan

Energi Ikatan (Energi Molekul) Jika r energi potensial sistem nol. Jika nilai r makin kecil, nilai negatif energi potensial semakin bertambah besar. Jika jarak pisah r sama dengan jarak ikat (r = ro), maka energi potensial mencapai minimum.

IKATAN ION Terjadi karena serah terima elektron valensi Contoh Na Na+ + e Cl. Na+ + Cl- Na. Cl Natrium memiliki satu elektron pada kulit terluarnya cenderung untuk melepasnya untuk membentuk Na+ diperlukan energi ionisasi -5, 1 e. V Klor memiliki 7 elektron kulit terluar, agar lebih stabil menangkap 1 elktron dari luar untuk membentuk Cl- dengan membebaskan energi 3, 6 e. V (afinitas elektron)

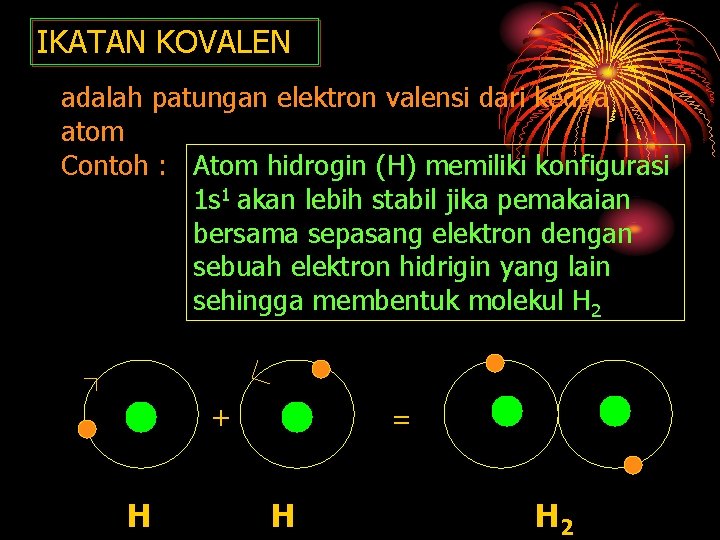
IKATAN KOVALEN adalah patungan elektron valensi dari kedua atom Contoh : Atom hidrogin (H) memiliki konfigurasi 1 s 1 akan lebih stabil jika pemakaian bersama sepasang elektron dengan sebuah elektron hidrigin yang lain sehingga membentuk molekul H 2 + H = H H 2

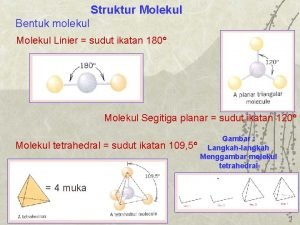
ZAT PADAT Sifat sifat zat padat bergantung pada: q Jenis atom penyusunnya q Struktur materialnya Berdasarkan struktur atom dalam zat padat dikenal dua macam zat padat, yaitu kristal dan amorf. Jenis ikatan pada zat padat : ikatan ion, kovalen, logam, Van der Waals atau ikatan Hidrogin

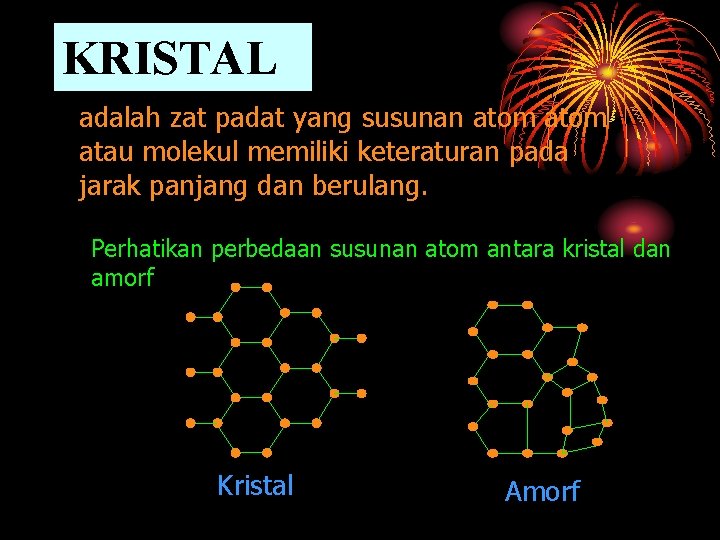
KRISTAL adalah zat padat yang susunan atom atau molekul memiliki keteraturan pada jarak panjang dan berulang. Perhatikan perbedaan susunan atom antara kristal dan amorf Kristal Amorf

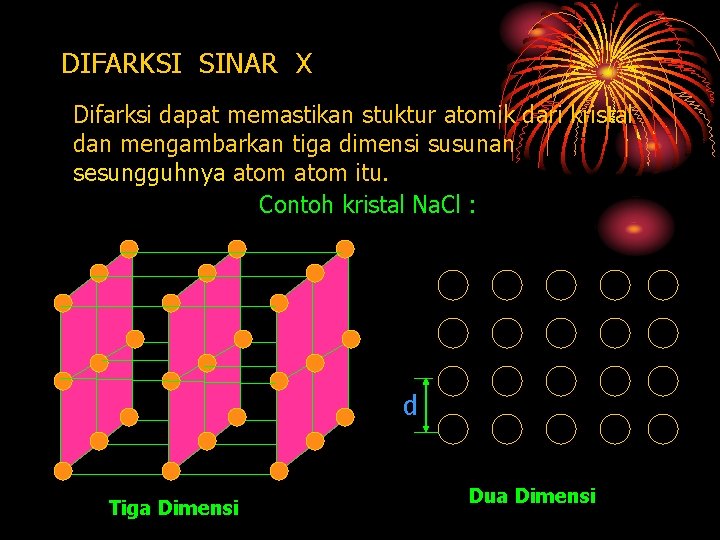
DIFARKSI SINAR X Difarksi dapat memastikan stuktur atomik dari kristal dan mengambarkan tiga dimensi susunan sesungguhnya atom itu. Contoh kristal Na. Cl : d Tiga Dimensi Dua Dimensi

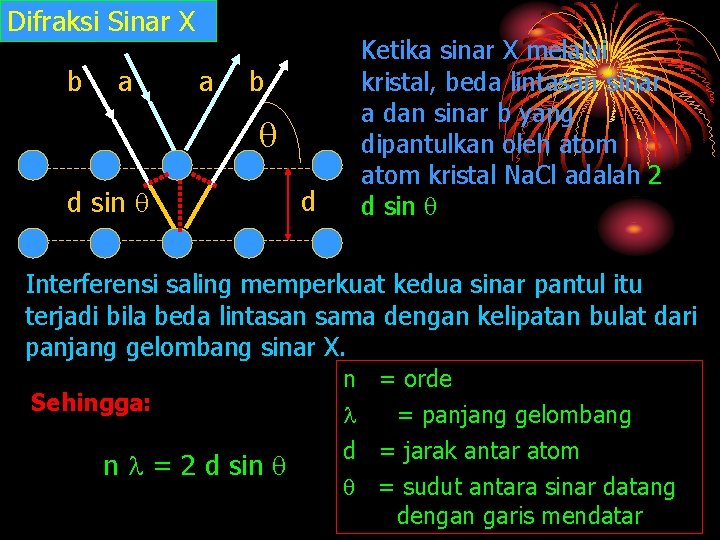
Difraksi Sinar X b a a b d sin d Ketika sinar X melalui kristal, beda lintasan sinar a dan sinar b yang dipantulkan oleh atom kristal Na. Cl adalah 2 d sin Interferensi saling memperkuat kedua sinar pantul itu terjadi bila beda lintasan sama dengan kelipatan bulat dari panjang gelombang sinar X. Sehingga: n = 2 d sin n = orde = panjang gelombang d = jarak antar atom = sudut antara sinar datang dengan garis mendatar

Contoh Soal Berapa jarak pisah bidang difraksi kristal Na. Cl jika panjang gelombang 1, 60 Ǻ membentuk sudut hamburan 32 pada orde pertama?

Berapa jarak pisah bidang difraksi kristal Na. Cl jika panjang gelombang 1, 60 Ǻ membentuk sudut hamburan 32 pada orde pertama? Diketahui: = 1, 60 Ǻ = 32 n=1 Ditanya: d =. . ? Jawab: n = 2 d sin d=

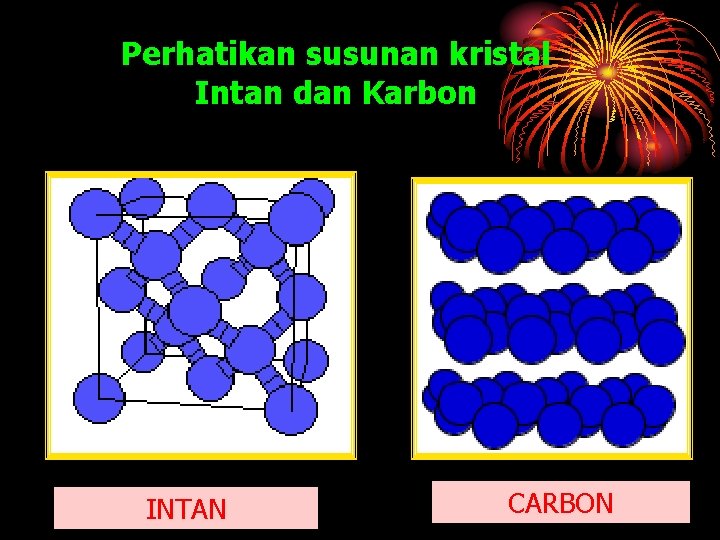
Kekerasan Zat Padat Mengapa Intan dan Arang yang disusun oleh atom yang sama, yaitu atom karbon memiliki kekerasan yang berbeda?

Perhatikan susunan kristal Intan dan Karbon INTAN CARBON

PERBEDAAN INTAN • Atom atom karbon saling mengikat dengan kuat dalam pola tertutup CARBON • Berwarna bening • Atomatomnya hanya terikat kuat pada tiap lembaran, sedangkan ikatan antar atom pada lembaran yang berdekatan relatif lebih lemah • Berwarna hitam • Sangat keras • Tidak keras • Merupakan batu perhiasan dan mahal • Mudah dibuat dan murah

Jenis Ikatan IKATAN PADA KRISTAL Asal ikatan Sifat Kovalen Patungan elektron Sangat keras; titik lebur tinggi; larut dalam sedikit cairan; transparan terhadap cahaya tampak Ionik Gaya tarik menarik elektrostatik antara ion positif dan ioan negatif Keras; titk lebur tinggi; mungkin larut dalam cairan polar seperti air Gaya tarik menarik elektrostatik antara ion positif logam dengan awan elektron Berkilauan, ; menghantarkan kalor dan listrik dengan baik Logam Gaya Van der Waals akibat distribusi Van der Waals muatan yang tidak simetris Hidrogin Gaya tarik menarik elektrostatik kuat antara hidrogin pada satu molekul dengan atom N, O atau F Lunak; titik lebur dan titik didih rendah ; larut dalam cairan kovalen Lebih kuat dari ikatan Van der Wals, titik lebur dan titik adidih lebih tinggi dari ikatan Van der Wals

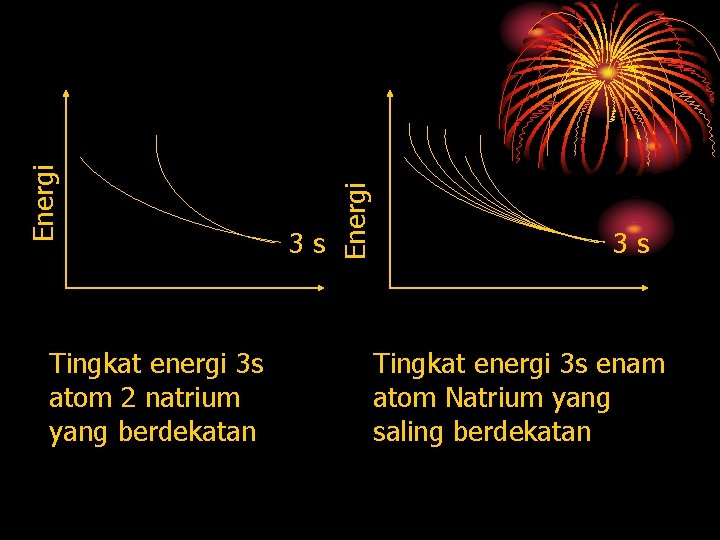
Pita Energi Tingkatan tingkatan energi dalam satu kelompok yang berdekatan

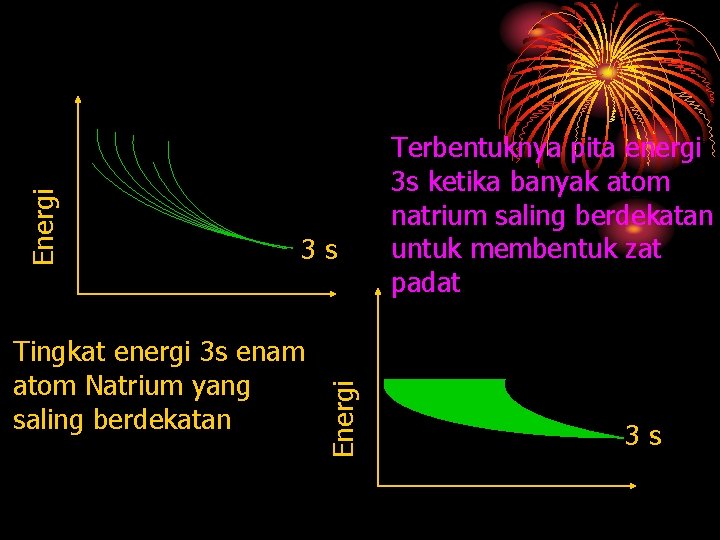
Energi Tingkat energi 3 s atom 2 natrium yang berdekatan 3 s 3 s Tingkat energi 3 s enam atom Natrium yang saling berdekatan

Tingkat energi 3 s enam atom Natrium yang saling berdekatan Energi 3 s Terbentuknya pita energi 3 s ketika banyak atom natrium saling berdekatan untuk membentuk zat padat 3 s

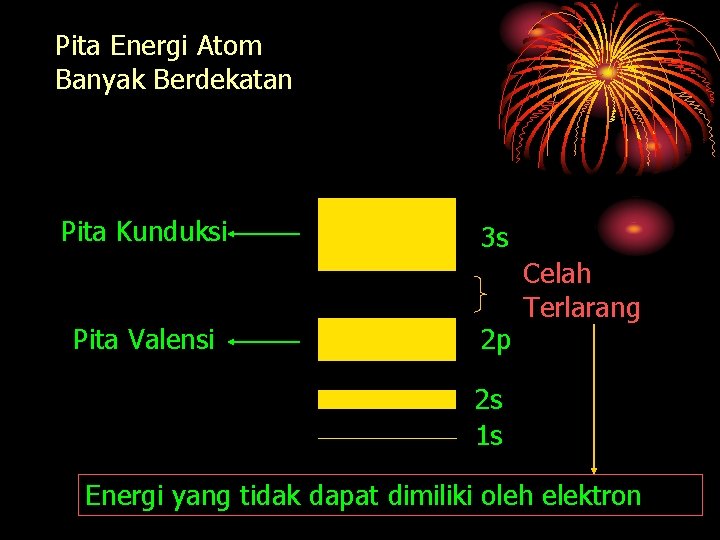
Pita Energi Tingkatan Energi Tingka tan energi kulit luar Tingka tan energi kulit dalam Atom Tunggal Atom Banyak Berdekatan

Pita Energi Atom Banyak Berdekatan Pita Kunduksi Pita Valensi 3 s 2 p Celah Terlarang 2 s 1 s Energi yang tidak dapat dimiliki oleh elektron

Sifat Kunduksi Listrik Kunduktor Natrium dengan konfigurasi elektron : 1 s 2 2 p 6 3 s 1 Kulit terluar 3 s hanya ditempati satu elektron (setengah penuh). Akibatnya elektron bebas yang menempati pita 3 s dengan mudah bergerak dalam kristal, menghasilkan arus listrik. 3 s 2 p 2 s 1 s

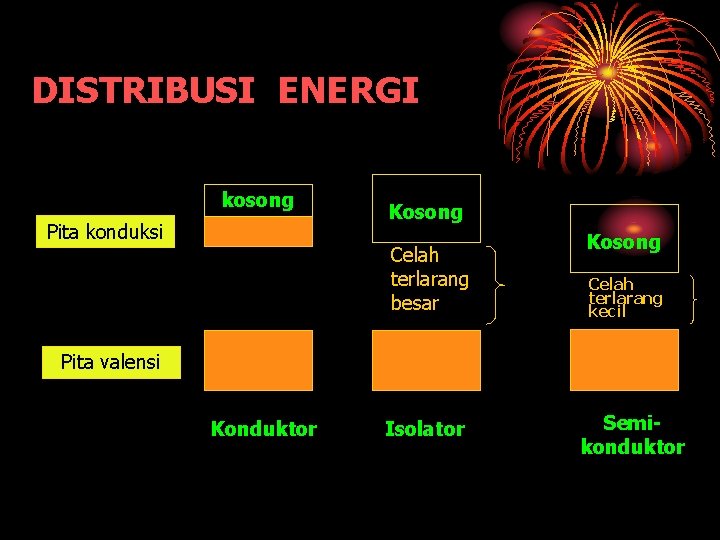
DISTRIBUSI ENERGI kosong Pita konduksi Kosong Celah terlarang besar Kosong Celah terlarang kecil Pita valensi Konduktor Isolator Semikonduktor

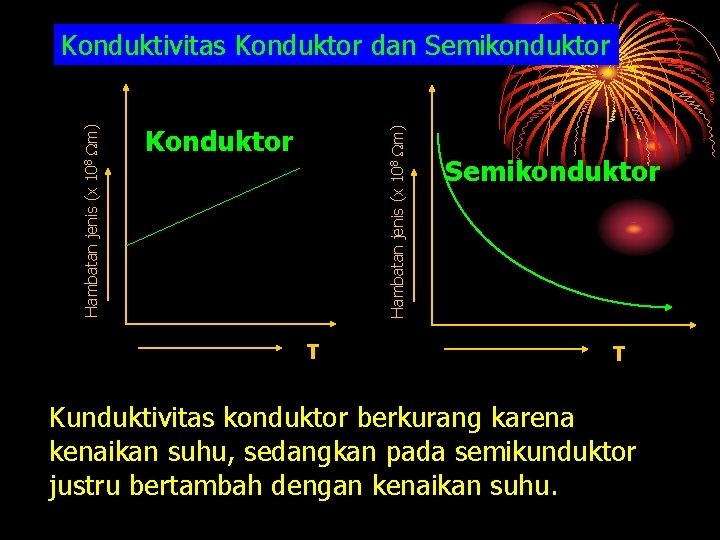
Konduktor Hambatan jenis (x 108 m) Konduktivitas Konduktor dan Semikonduktor T Kunduktivitas konduktor berkurang karena kenaikan suhu, sedangkan pada semikunduktor justru bertambah dengan kenaikan suhu.

Konduktivitas Semikonduktor yang baru kita bicarakan adalah semikonduktor netral, dimana jumlah proton dan elektron sama. Ketika sebuah elektron melompat dari pita valensi ke pita konduksi, maka pita valensi mengalami perubahan. Elektron yang berpindah menimbulkan sebuah kekosongan pada pita valensi (hole)

Pita Konduksi Semikonduktor Intrinsik (murni) Pita Valensi Pita terlarang

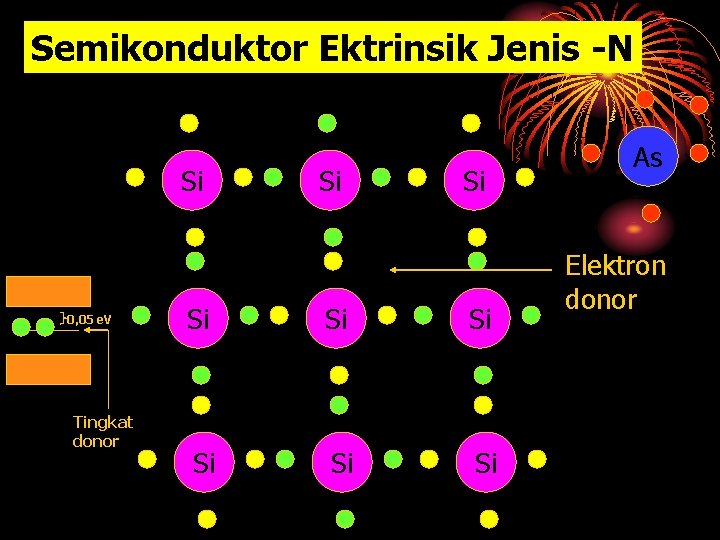
Semikonduktor Ektrinsik Jenis -N Si 0, 05 e. V Tingkat donor Si Si As Elektron donor

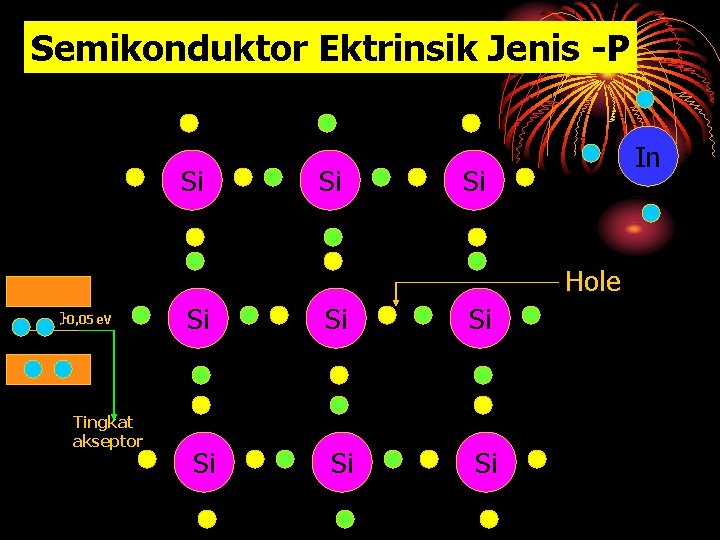
Semikonduktor Ektrinsik Jenis -P Si Si In Si Hole 0, 05 e. V Tingkat akseptor Si Si Si

Ø Atom silikon memiliki 4 elektron valensi, sedang indium 3 elektron valensi. Ø Setelah Indium disisipkan, masih ada 1 elektron valensi silikon yang tidak diikta Indium (terjadi kekosongan) Ø Sehinggapengotor (Indium) dapat menerimasebuah elektron. Ø Pengotor ini disebut atom akseptor

Semoga Bermanfaat Hay sabiq, 7 Maret 2005
 Kunduksi
Kunduksi Seorang perawat bermaksud memberikan larutan garam ke tubuh
Seorang perawat bermaksud memberikan larutan garam ke tubuh Mekanika zat padat dan fluida
Mekanika zat padat dan fluida Pita
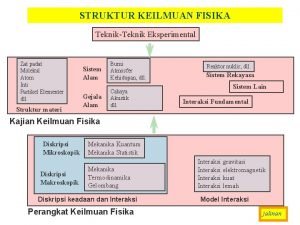
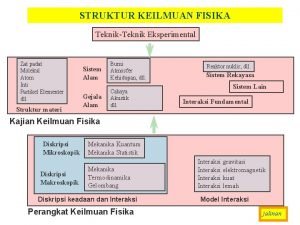
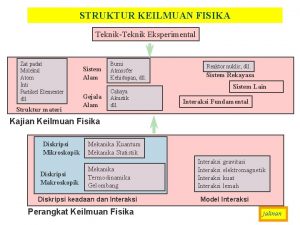
Pita Teori pita energi
Teori pita energi Peta konsep materi dan perubahannya
Peta konsep materi dan perubahannya Peta konsep metabolisme kelas 12
Peta konsep metabolisme kelas 12 Metabolisme energi dan zat gizi makro
Metabolisme energi dan zat gizi makro Contoh gambar tekanan zat padat
Contoh gambar tekanan zat padat Korteks
Korteks Energi listrik menjadi energi cahaya
Energi listrik menjadi energi cahaya Energi kalor menjadi energi listrik
Energi kalor menjadi energi listrik Sebuah setrika listrik 200 w 125 v dipasang pada tegangan
Sebuah setrika listrik 200 w 125 v dipasang pada tegangan Energi listrik adalah energi yang berasal dari muatan
Energi listrik adalah energi yang berasal dari muatan Perbedaan batas kelas dan tepi kelas
Perbedaan batas kelas dan tepi kelas Distribusi frekuensi
Distribusi frekuensi Contoh soal penyederhanaan data kuantitatif
Contoh soal penyederhanaan data kuantitatif Materi pembelajaran pkn kelas rendah
Materi pembelajaran pkn kelas rendah Contoh batas kelas nyata dan semu
Contoh batas kelas nyata dan semu Piramida jumlah
Piramida jumlah Kalimat singkat padat dan jelas
Kalimat singkat padat dan jelas Hakikat iklan baris
Hakikat iklan baris Poster merupakan cetak
Poster merupakan cetak Singkat jelas dan padat
Singkat jelas dan padat Susunan distribusi frekuensi
Susunan distribusi frekuensi Input stream in java
Input stream in java Konsep stream
Konsep stream Yo compre pocas copas
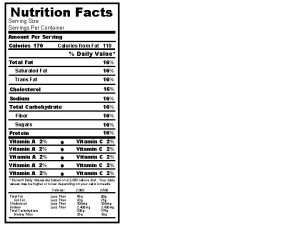
Yo compre pocas copas Chips ahoy nutrition facts
Chips ahoy nutrition facts Halaju
Halaju Penampang tumbuhan
Penampang tumbuhan