STORIA ANTICA 600 a C Teoria di Talete















































- Slides: 70

STORIA ANTICA 600 a. C. Teoria di Talete 400 a. C. Teoria di Democrito 300 a. C. Teoria di Aristotele Medioevo: domina la teoria di Aristotele Rinascimento: si riscopre la teoria di Democrito maria teresa renzi 1

TALETE Filosofo greco del’ 600 a. C. . Fu uno dei primia teorizzarel’origine della materia. Egli sosteneva che: la materia traesse origine dall’acqua , la traesse origine dall’ quale solidificando diventava terra ed evaporando diventava aria. maria teresa renzi 2

DEMOCRITO Filosofo greco (460 – 370 a. C. ). Con democrito nasce la teoria atomica della materia. Intuisce che la materia è formata da piccolissime particelle che lui chiama atomi. maria teresa renzi 3

ARISTOTELE Filosofo greco, negava l’esistenza del vuoto per cui attribuiva a tutti gli elementi una natura materiale. Aristotele negava l’esistenza degli atomi ritenendo la materia costituita da: terra, acqua, fuoco e aria maria teresa renzi 4

STORIA MODERNA 1789: Legge di Lavoisier ( nasce la chimica moderna) 1794: Legge di Proust 1803: Teoria di Dalton 1854: Scoperta del raggio catodico 1869: Tavola periodica ( Mendeleev ) 1886: Scoperta del protone (Goldstein) 1897: teoria atomica di Thomson 1900: Sviluppo della teoria Quantistica ( Plank ) maria teresa renzi 5

L’Atomo di Dalton La comprensione moderna della materia non è emersa fino al 1806 quando John Dalton presentò la sua “teoria atomica”: n Ciascun elemento chimico è composto di atomi. n Gli atomi di un dato elemento sono tutti uguali ed hanno tutti la stessa massa. n Atomi di diversi elementi sono diversi. n Durante una reazione chimica gli atomi coinvolti non si creano nè si distruggono. n I composti chimici si formano quando atomi di 2 o più elementi si combinano insieme. maria teresa renzi 6

Legge delle Proporzioni Multiple Quando due elementi si combinano per dare più di un composto, mantenendo costanti le quantità in massa dell’uno, le quantità in massa dell’altro stanno in un rapporto espresso da numeri interi e piccoli Acqua (H 2 O): Acqua Ossigenata (Perossido di Idrogeno H 2 O 2): L’acqua ossigenata deve contenere il doppio della quantità di ossigeno contenuta nell’acqua, in quanto non si possono aggiungere parti di atomo ma solo multipli interi di essi. maria teresa renzi 7

Legge delle proporzioni multiple Atomi del tipo X Atomi del tipo Y maria teresa renzi Composto con gli elementi Xe. Y 8

La natura elettrica della materia n n n E’ noto, fin dall’antichità, che una bacchetta di ambra, strofinata con una pelle di pecora, acquista la capacità di attirare frammenti di pelo e di altri materiali. “Elektron” è il nome che gli antichi greci davano all’ambra, sostanza che, strofinata, poteva attirare la paglia. “Elettricità” è il nome con il quale noi, oggi, indichiamo tutti i fenomeni attribuibili all’esistenza di cariche elettriche nella materia. maria teresa renzi 9

Esperimenti di elettrostatica nei salotti aristocratici del ‘ 700 n Un giovanetto, sospeso con una corda, viene elettrizzato attraverso i piedi e, con la mano, è in grado di attrarre piccoli pezzetti di carta maria teresa renzi 10

Nel XVIII secolo Franklin immaginava la materia come una spugna: Benjamin Franklin n quando si strofina una bacchetta di 1700 -1790 vetro con un panno di seta, una parte di elettricità si trasferisce dalla seta (-) la vetro(+) ; n quando si strofina una bacchetta d’ambra con un panno di lana, l’elettricità si trasferisce dall’ambra (-) alla lana (+) n La quantità di elettricità (positiva o negativa) di un corpo venne da lui chiamata "carica". n Franklin avanzò anche l'ipotesi fondamentale secondo cui la carica non viene ne creata ne distrutta, solo trasferita. maria teresa renzi 11

1855 Geisler costruì le prime pompe a mercurio e i primi tubi in vetro resistenti a pressioni interne = a 1/10 000 della pressione atmosferica n n nel 1855 Geissler inventò la prima pompa a vuoto al mercurio. Essa permise di ottenere pressioni di 0. 01 mm. Hg. (più tardi questa pompa contribuirà al successo della prima lampada ad incandescenza di Edison 1879). n Heinrich Geissler (1814 -1879), figlio di un soffiatore di vetro, continuò il lavoro del padre unendo ad esso un grande interesse per le scienze naturali sperimentali. n fu così che inserendo due elettrodi (+) e (-), collegati a un rocchetto di Ruhmkorff nin un tubo ad aria rarefatta osservò che alle scariche elettriche subentravano fenomeni di differente luminosità in relazione alla pressione del gas 12 maria teresa renzi interno al tubo

I tubi di geissler maria teresa renzi 13

L’utilizzo del “tubo di Crookes” (1897) permise di scoprire gli elettroni. Si tratta di un tubo di vetro resistente, alle estremità del quale sono applicati due elettrodi, collegati al polo positivo e al polo negativo di un generatore di corrente. maria teresa renzi 14

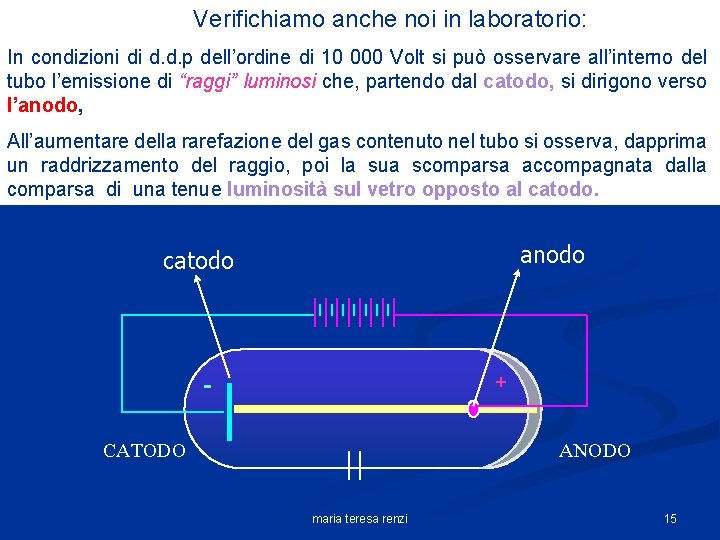
Verifichiamo anche noi in laboratorio: In condizioni di d. d. p dell’ordine di 10 000 Volt si può osservare all’interno del tubo l’emissione di “raggi” luminosi che, partendo dal catodo, si dirigono verso l’anodo, All’aumentare della rarefazione del gas contenuto nel tubo si osserva, dapprima un raddrizzamento del raggio, poi la sua scomparsa accompagnata dalla comparsa di una tenue luminosità sul vetro opposto al catodo. anodo catodo + CATODO ANODO maria teresa renzi 15

Per ottenere d. d. p. periodiche di alcune migliaia di Volt usiamo il rocchetto di Ruhmkorff maria teresa renzi 16

Scarica nell’aria a pressione atmosferica normale Interruttore elettrolitico maria teresa renzi 17

Scarica elettrica nell’aria rarefatta Pompa per estrarre aria da tubi vari Tubo dal quale si può estrarre aria e ottenere la scarica elettrica maria teresa renzi 18

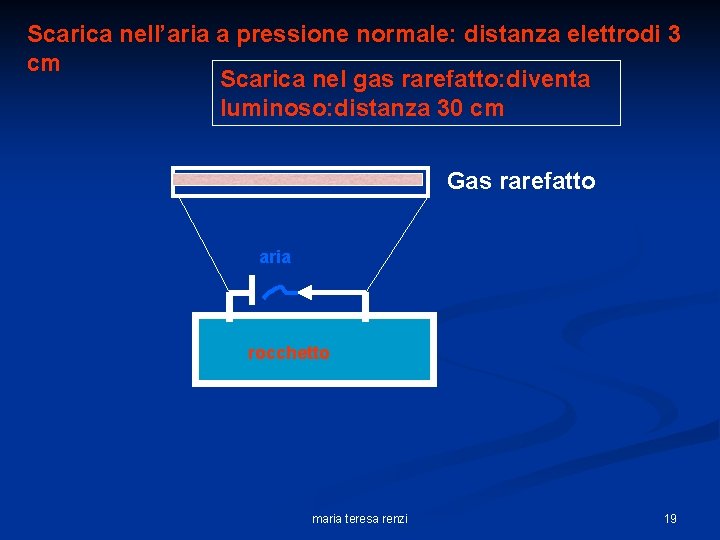
Scarica nell’aria a pressione normale: distanza elettrodi 3 cm Scarica nel gas rarefatto: diventa luminoso: distanza 30 cm Gas rarefatto aria rocchetto maria teresa renzi 19

Scarica nell’aria a pressione normale: distanza elettrodi 3 cm Gas rarefatto aria Pompa per vuoto rocchetto Scarica nel gas rarefatto: diventa luminoso: distanza 30 cm maria teresa renzi 20

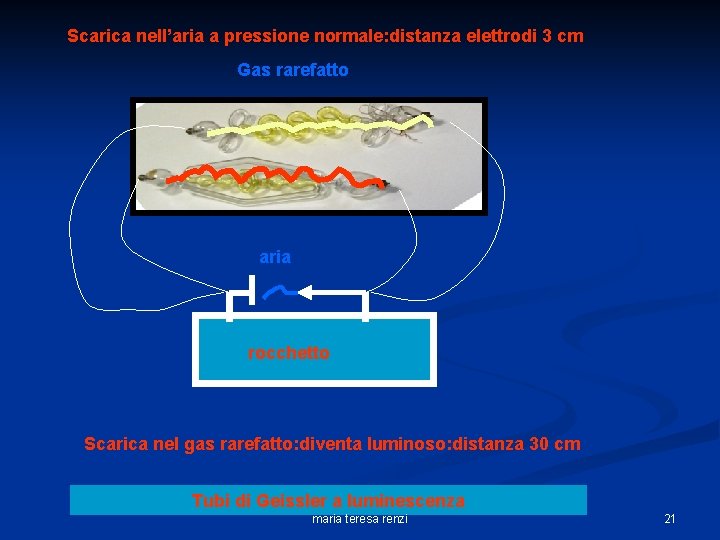
Scarica nell’aria a pressione normale: distanza elettrodi 3 cm Gas rarefatto aria rocchetto Scarica nel gas rarefatto: diventa luminoso: distanza 30 cm Tubi di Geissler a luminescenza maria teresa renzi 21

gli studi sulle sacariche elettriche nei gas rarefatti continuarono negli anni successivi ad opera di Julius Plucker (1801 -1868). i suoi studi principali riguardarono n la spettroscopia n e le scariche elettriche nei gas rarefatti. n n n Egli osservò che le linee spettrali dei gas contenuti in tubi di vetro e sottoposti a d. d. p. erano caratteristiche per ogni sostanza chimica, Per quanto riguarda le scariche elettriche nei gas rarefatti, Plucker osservò che, avvicinando un magnete al tubo di scarica, cambiava la posizione del bagliore sulle pareti. Dedusse che la scarica veniva deviata dai campi magnetici. I suoi esperimenti più importanti furono però quelli che lo portarono ad osservare che la luminescenza che si produceva cambiava a seconda del vuoto che era stato fatto. Abbassando la pressione del gas all'interno del tubo diminuiva la luminescenza nel tubo, mentre il vetro opposto al catodo emanava una luce verdastra. Era come se il catodo emettesse qualcosa che raggiungeva la parte 22 maria teresa renzi opposta al catodo.

n 1869 Gli studi di Plucker sulle scariche elettriche nei gas rarefatti furono continuati da un suo allievo J. W. Hittorf (1824 -1914) che, utilizzando la pompa di Sprengel, tubo di Crookes con croce di Malta: riuscì ad ottenere pressioni inferiori a 0. 001 mbar. Egli pose all'interno dei tubi a vuoto degli ostacoli solidi. Osservò che questi corpi gettavano un'ombra nella parete del tubo opposta al catodo. Hittorf n n n Arrivò cosi ad affermare che ciò che il catodo emetteva si comportava in modo simile ai raggi luminosi e si propagava in linea retta. Si cominciano cosi ad affermare tra gli studiosi della radiazione catodica due diverse interpretazioni dei fenomeni osservati: una interpretazione corpuscolare e una ondulatoria. maria teresa renzi 23

Al rocchetto Scala di Cross Serie di tubi con aria rarefatta in grado crescente se collegati al rocchetto si ottengono scariche e colorazioni diverse in funzione anche della natura dei gas contenuti Al rocchetto Rarefazione crescente maria teresa renzi 24

Rarefazione crescente catodo Applicando lo stesso potenziale a tubi contenenti aria con vuoto crescente si osservano aspetti e colori vari alla fine appare vetro verdastro per effetto dell’urto dei raggi catodici anodo maria teresa renzi 25

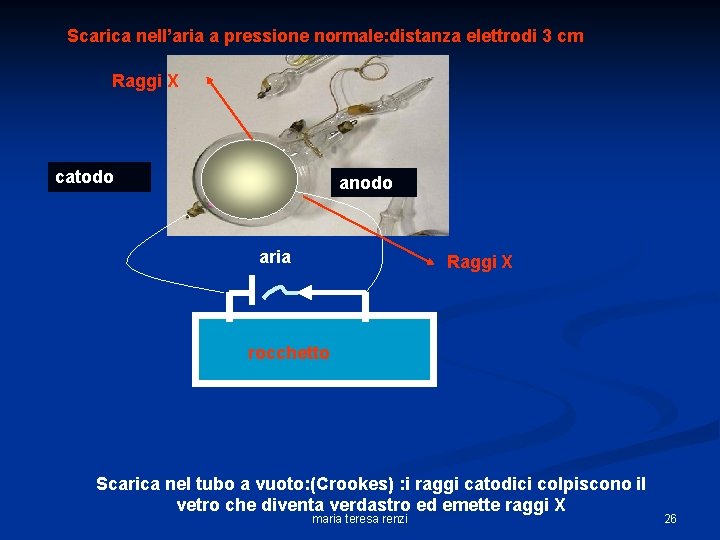
Scarica nell’aria a pressione normale: distanza elettrodi 3 cm Raggi X catodo anodo aria Raggi X rocchetto Scarica nel tubo a vuoto: (Crookes) : i raggi catodici colpiscono il vetro che diventa verdastro ed emette raggi X maria teresa renzi 26

William Crookes (1875 ). n Sostenitore della teoria corpuscolare della radiazione catodica ideò una molteplicità di tubi a vuoto, tra questi va ricordato il tubo di Crookes con mulinello: n n all'interno di un tubo a vuoto era stato posto un mulinello a pale libero di muoversi lungo due rotaie. Applicando una differenza di potenziale agli elettrodi si notava che il mulinello, colpito dalla radiazione catodica, cominciava a girare n. Tubo a vuoto con mulinello i raggi emessi sono formati da particelle con una certa massa maria teresa renzi 27

rocchetto Tubo con aria rarefatta: se collegato al rocchetto il mulinello colpito dalle radiazioni entra in movimento maria teresa renzi 28

maria teresa renzi 29

Applicando la stessa tensione a tubi con gas diversi e stessa densità, si osservano colori diversi per ogni gas o vapore contenuto neon elio Ne-A-Hg argon Tubi luminescenti trasparenti, con gas di varia natura: colore in funzione di gas presente Neon: rosso neon-Ar-Hg: bleu elio: gialla argon: verde maria teresa renzi 30

Tubi fluorescenti: contengono argon, mercurio vaporizzato: i gas colpiti dalla scarica emettono radiazione che viene assorbita da particolari pigmenti (fosfori) usati per opacizzare il vetro trasparente: tali sostanze a loro volta emettono luce con la frequenza desiderata: es. luce bianca Tubo trasparente-colore rosso Tubo con fosfori: colore bianco maria teresa renzi 31

1876 Goldstein n Goldstein decise di dare il nome di "raggi catodici" alla radiazione emessa dal catodo. utilizzando tubi a vuoto contenenti più elettrodi, mostrò che la radiazione era indipendente dalla posizione dell'anodo e che essa veniva emessa in direzione perpendicolare alla superficie del catodo. n maria teresa renzi 32

1897 Thomson chiamò elettroni le “particelle” del raggio catodico ed elaborò un primo modello atomico contenente cariche elettriche maria teresa renzi 33

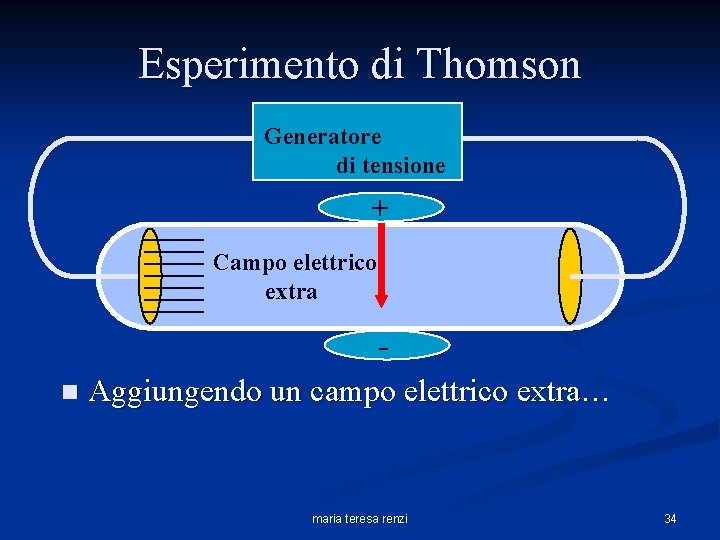
Esperimento di Thomson Generatore di tensione + Campo elettrico extra n Aggiungendo un campo elettrico extra… maria teresa renzi 34

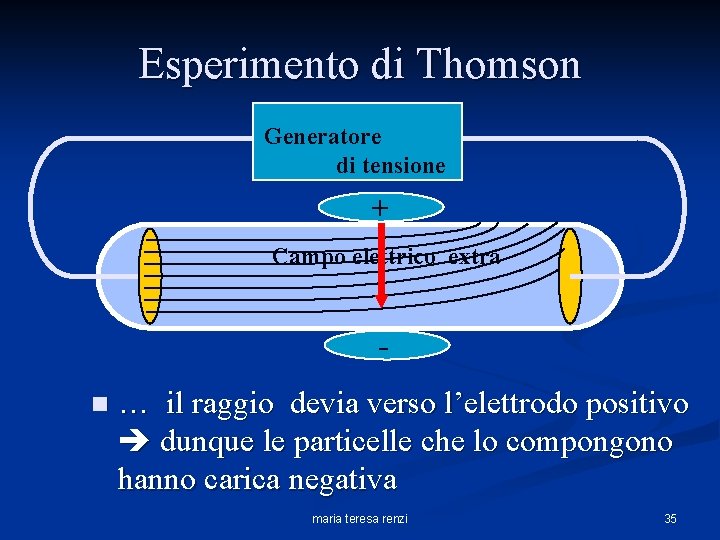
Esperimento di Thomson Generatore di tensione + Campo elettrico extra n … il raggio devia verso l’elettrodo positivo dunque le particelle che lo compongono hanno carica negativa maria teresa renzi 35

maria teresa renzi 36

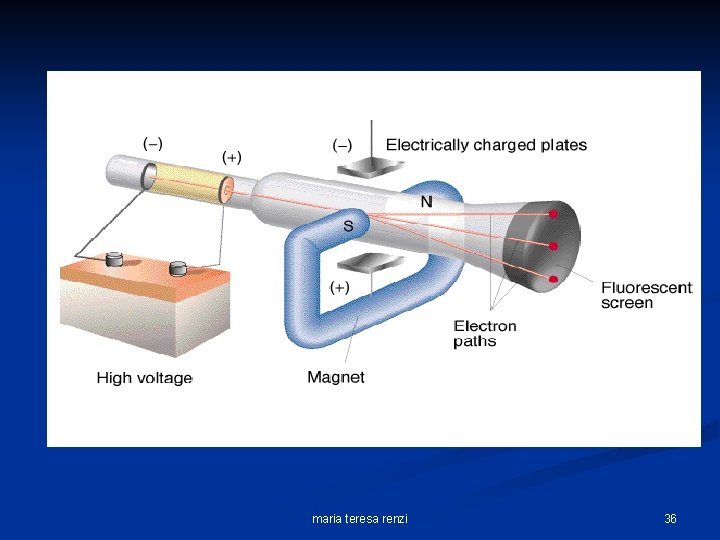
Thomson calcolò il rapporto carica/massa dell’elettrone = 1, 759 x 108 c/g. Deflessione magnetica = Campo magnetico x velocità Deflessione elettrica Campo elettrico Thomson applicò ai raggi campi elettrici e campi magnetici di intensità note e misurò l’entità della deflessione dei raggi; ponendo a confronto i valori ottenuti da un certo numero di prove, riuscì a calcolare la velocità degli elettroni. Poi considerando la velocità come una grandezza nota, poté, da una delle due formule, determinare il rapporto carica/massa/ catodo Anodo forato maria teresa renzi 37

Joseph. John. Thomson arrivò a concludere che: gli elettroni sono i costituenti fondamentali della materia. Conferme successive: - effetto fotoelettrico (Einstein 1905), - effetto termoionico, - raggi β. n maria teresa renzi 38

Millikan misura la carica dell'elettrone (1908 -1909) e riceve il premio Nobel nel 1023 n Per misurare la carica di un elettrone, Millikan studia il modo in cui si muovono piccole particelle elettricamente cariche fra due piastre metalliche parallele caricate una positivamente e l’altra negativamente tramite una batteria. maria teresa renzi 39

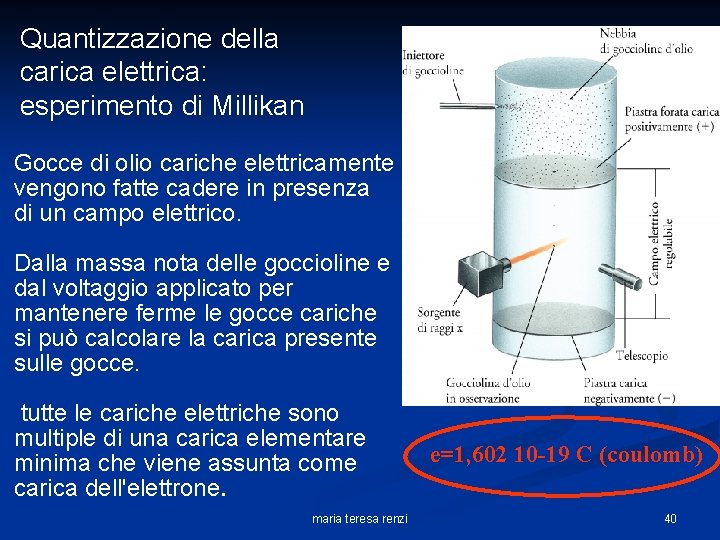
Quantizzazione della carica elettrica: esperimento di Millikan Gocce di olio cariche elettricamente vengono fatte cadere in presenza di un campo elettrico. Dalla massa nota delle goccioline e dal voltaggio applicato per mantenere ferme le gocce cariche si può calcolare la carica presente sulle gocce. tutte le cariche elettriche sono multiple di una carica elementare minima che viene assunta come carica dell'elettrone. maria teresa renzi e=1, 602 10 -19 C (coulomb) 40

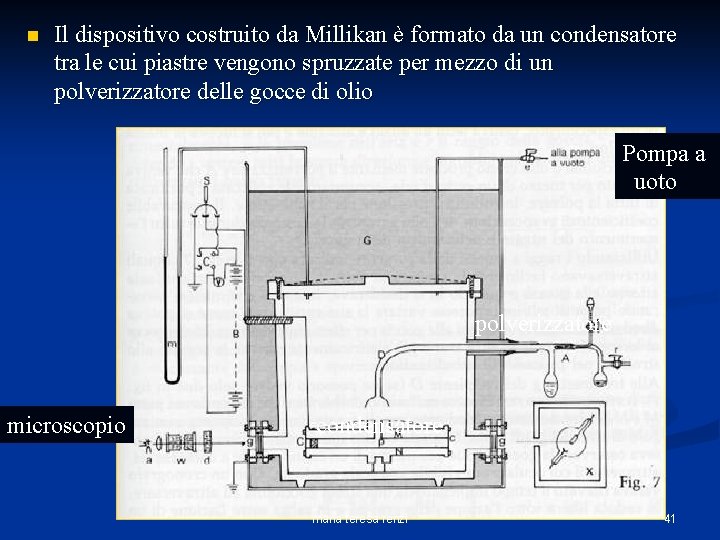
n Il dispositivo costruito da Millikan è formato da un condensatore tra le cui piastre vengono spruzzate per mezzo di un polverizzatore delle gocce di olio Pompa a vuoto polverizzatore microscopio condensatore maria teresa renzi 41

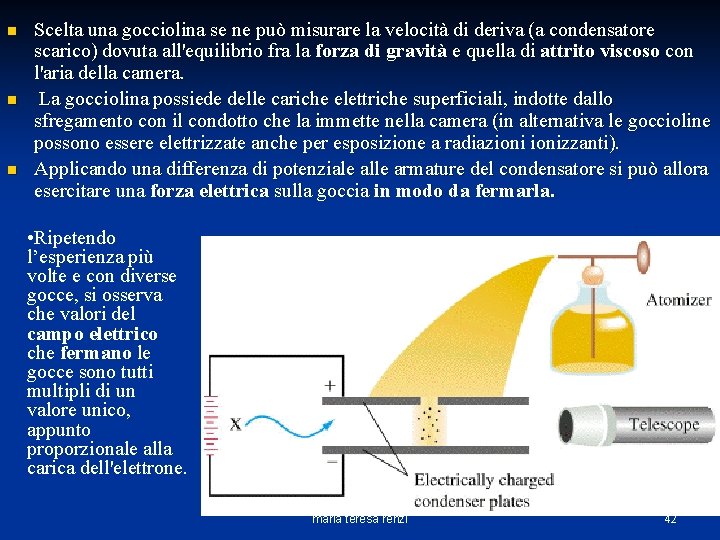
n n n Scelta una gocciolina se ne può misurare la velocità di deriva (a condensatore scarico) dovuta all'equilibrio fra la forza di gravità e quella di attrito viscoso con l'aria della camera. La gocciolina possiede delle cariche elettriche superficiali, indotte dallo sfregamento con il condotto che la immette nella camera (in alternativa le goccioline possono essere elettrizzate anche per esposizione a radiazionizzanti). Applicando una differenza di potenziale alle armature del condensatore si può allora esercitare una forza elettrica sulla goccia in modo da fermarla. • Ripetendo l’esperienza più volte e con diverse gocce, si osserva che valori del campo elettrico che fermano le gocce sono tutti multipli di un valore unico, appunto proporzionale alla carica dell'elettrone. maria teresa renzi 42

n n n n Consideriamo le forze a cui è soggetta la goccia: forza peso: F = m g forza di attrito viscoso con l'aria: F = 6ρηv. R forza elettrostatica: F = q ·V/d m = massa della goccia, g = accelerazione di gravità, q = carica sulla goccia, V = potenziale elettrico, d = distanza tra le armature del condensatore, η = coefficiente di viscosità dell'aria, R = raggio della goccia, v = velocità della goccia, ρ = densità della goccia. Se si applica un’opportuna differenza di potenziale V tra le armature del condensatore, tale che la forza elettrica eguagli la forza peso, la gocciolina resta sospesa in equilibrio. maria teresa renzi 43

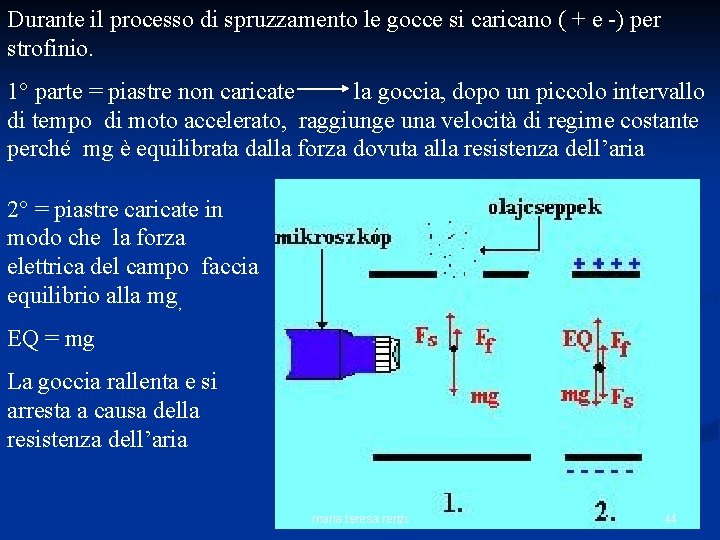
Durante il processo di spruzzamento le gocce si caricano ( + e -) per strofinio. 1° parte = piastre non caricate la goccia, dopo un piccolo intervallo di tempo di moto accelerato, raggiunge una velocità di regime costante perché mg è equilibrata dalla forza dovuta alla resistenza dell’aria 2° = piastre caricate in modo che la forza elettrica del campo faccia equilibrio alla mg, EQ = mg La goccia rallenta e si arresta a causa della resistenza dell’aria maria teresa renzi 44

n 3° parte = piastre caricate invertendo la polarità. EQ = 2 mg La velocità a regime è il doppio di quella che si ha in assenza di campo elettrico. n la velocità a regime è direttamente proporzionale alla forza risultante. 4° parte = si regola la d. d. p. e si fa variare la carica delle gocce con i raggi x La velocità a regime è direttamente proporzionale alla variazione di carica ( Dq) Le velocità misurate sono tutte multiplo di una stesso valore tutte le cariche sono multipli interi di una carica elementare non frazionabile = 1, 6 x 10 -19 C n La carica elementare coincide con la carica dell’elettrone n n Nota la carica è stata calcolata la massa dell’elettrone = 9, 11 x 10 maria– 28 g teresa renzi 45

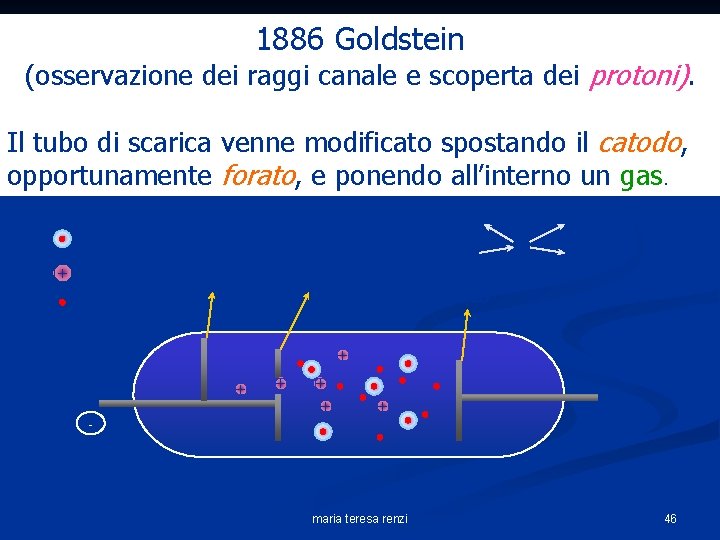
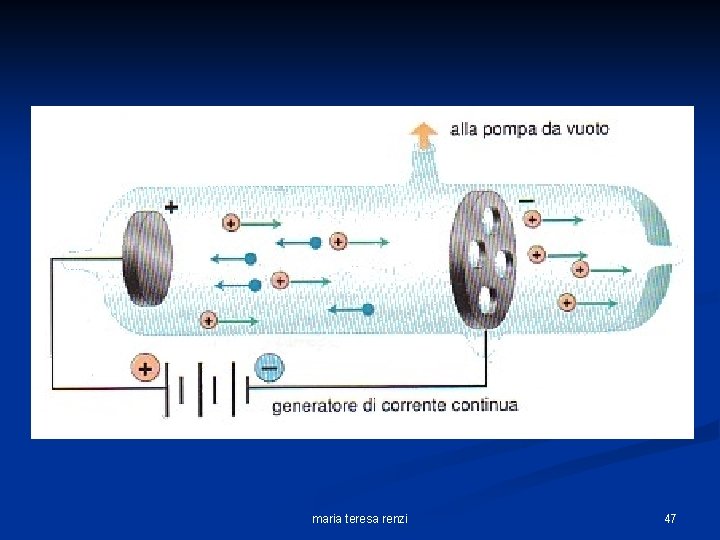
1886 Goldstein (osservazione dei raggi canale e scoperta dei protoni). Il tubo di scarica venne modificato spostando il catodo, opportunamente forato, e ponendo all’interno un gas. atomo neutro + ione positivo rivelatore catodo forato elettrone anodo + + + - maria teresa renzi 46

maria teresa renzi 47

n n 1886 Goldstein scopre i raggi canale 1898 Wien calcola il rapporto carica/massa del raggio canale e scopre che varia al variare del gas maria teresa renzi 48

Modello atomico di Thomson maria teresa renzi 49

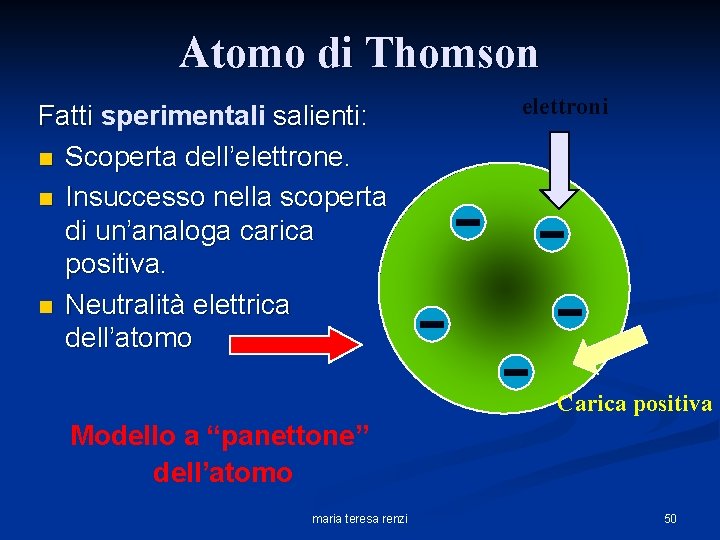
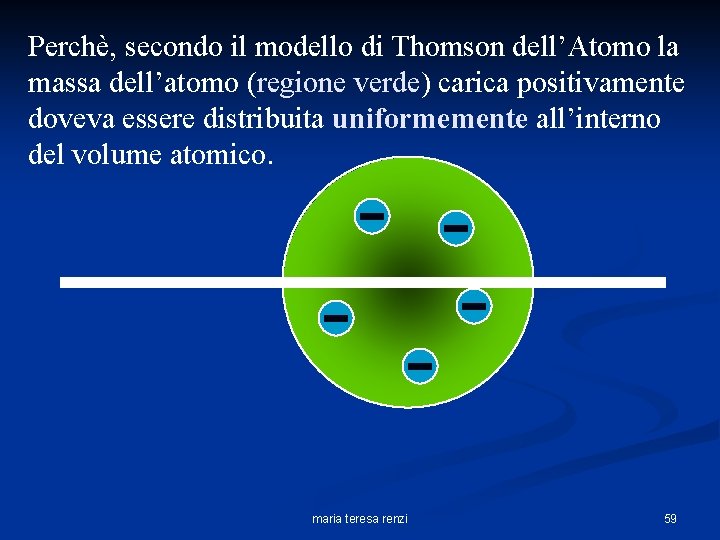
Atomo di Thomson Fatti sperimentali salienti: n Scoperta dell’elettrone. n Insuccesso nella scoperta di un’analoga carica positiva. n Neutralità elettrica dell’atomo elettroni Carica positiva Modello a “panettone” dell’atomo maria teresa renzi 50

“pezzi” mancanti nel puzzle atomico Oggigiorno sappiamo che un atomo, oltre agli elettroni contiene anche: n Protoni – carichi positivamente e 1837 volte più massicci degli elettroni. n Neutroni – neutri ma con all’incicrca la stessa massa dei protoni. Ma dove si trovano? maria teresa renzi 51

1896 Bequerelle scopre la radioattività dei sali di uranio maria teresa renzi 52

1899 i Curie scoprono la radioattività del radio e del polonio maria teresa renzi 53

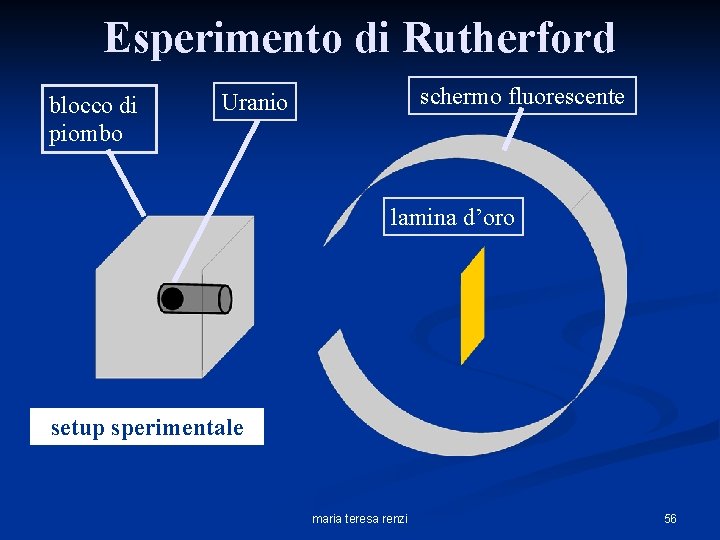
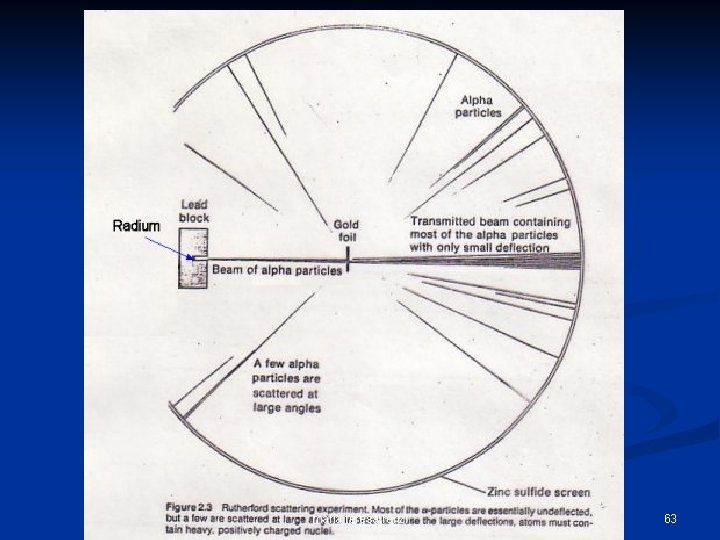
Esperimento di Rutherford n n n Ernest Rutherford fisico inglese. (1910) Partì dall’assunzione che il modello di Thomson fosse corretto. Provò a misurare l’estensione spaziale di un atomo. Utilizzò la “radioattività”, cioè particelle , cariche positivamente, rilasciate dall’Uranio. dall’ Rutherford le usò come “proiettili”, sparandoli contro una lamina d’oro, usata come bersaglio, sottilissima, spessa solo qualche strato atomico, e verificando il loro punto di impatto su di uno schermo fluorescente. maria teresa renzi 54

Rutherford bombarda con un fascio di particelle un sottile foglio d’oro maria teresa renzi 55

Esperimento di Rutherford blocco di piombo schermo fluorescente Uranio lamina d’oro setup sperimentale maria teresa renzi 56

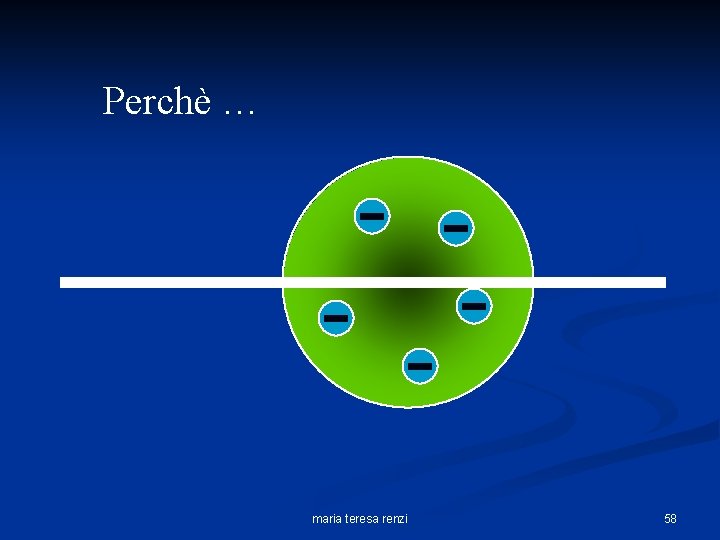
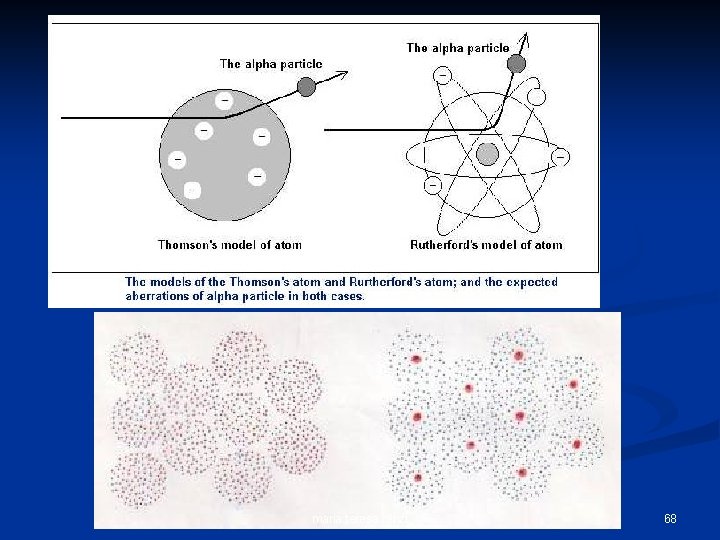
Ciò che Rutherford si aspettava era che: n n Le particelle passassero attraverso la lamina senza deviare apprezzabilmente dalla loro traiettoria. Perchè le cariche positive erano distribuite uniformemente in tutto il volume atomico. In poche parole, secondo Rutherford, l’esperimento avrebbe dovuto svolgersi così: maria teresa renzi 57

Perchè … maria teresa renzi 58

Perchè, secondo il modello di Thomson dell’Atomo la massa dell’atomo (regione verde) carica positivamente doveva essere distribuita uniformemente all’interno del volume atomico. maria teresa renzi 59

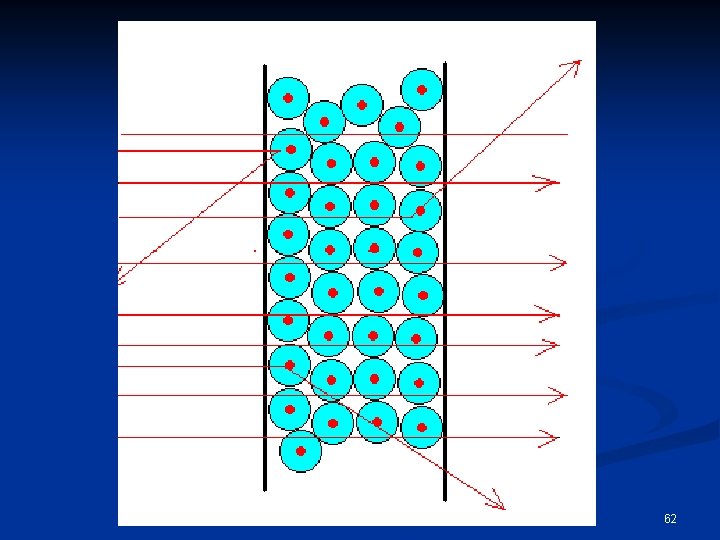
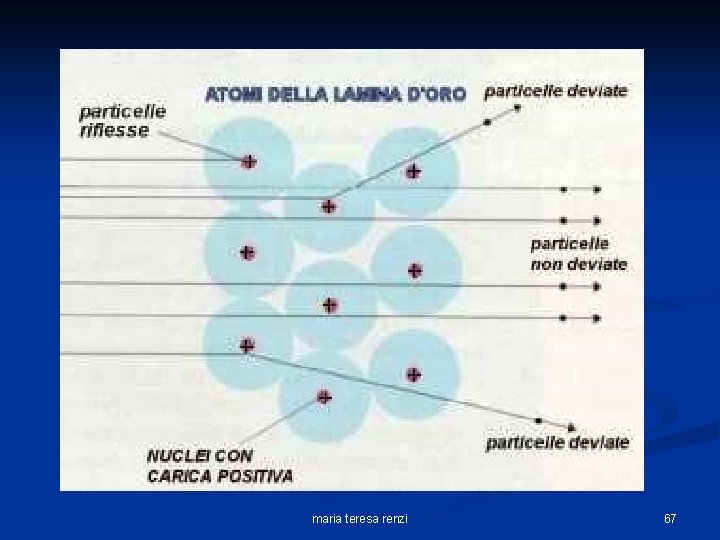
“Bombardando” più atomi di oro doveva succedere qualcosa di simile … maria teresa renzi 60

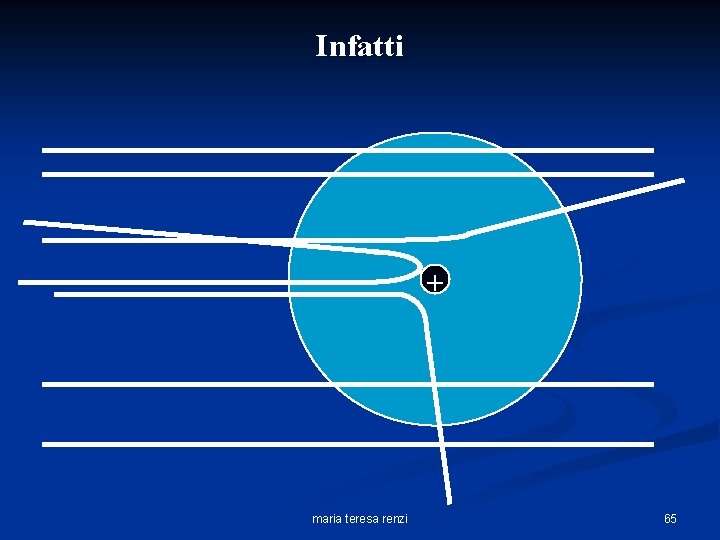
invece, Rutherford osservò che … maria teresa renzi 61

maria teresa renzi 62

maria teresa renzi 63

Spiegazione di Rutherford del risultato sperimentale ottenuto: § l’atomo risulta praticamente vuoto; § Contiene, nel centro, un pezzettino di materia (nucleo), molto denso e dotato di carica elettrica positiva, in cui è concentrata l’intera + massa; § Le particelle (cariche positivamente) se si avvicinano abbastanza al nucleo vengono al deviate in modo sostanziale. maria teresa renzi 64

Infatti + maria teresa renzi 65

L’Atomo e la sua Densità La maggior parte delle particelle , cariche +, passano indisturbate: perciò, la quasi totalità del volume dell’atomo deve essere praticamente vuota. n Le deviazioni dei proiettili incidenti, quando avvengono, sono significative: perciò l’atomo deve contenere un pezzo di materia carico positivamente, piccolo e massiccio. Conclusioni : § volume piccolo, massa elevata e, quindi, elevata densità. n Rutherford aveva scoperto il nucleo dell’atomo. n maria teresa renzi 66

maria teresa renzi 67

maria teresa renzi 68

Un nucleo atomico è caratterizzato da: • numero atomico (Z) che indica il numero di protoni • numero di massa (A) che rappresenta il numero totale di nucleoni presenti nel nucleo atomico. Se indichiamo con N il numero di neutroni, possiamo scrivere: A=N+Z. maria teresa renzi 69

ISOBARI Nuclidi con eguale numero di massa A n ISOTOPI Nuclidi con eguale numero atomico Z n ISOTONI Nuclidi con eguale numero di neutroni N n maria teresa renzi 70
 Niente si crea niente si distrugge talete
Niente si crea niente si distrugge talete Condizioni parallelogramma
Condizioni parallelogramma Piani nello spazio
Piani nello spazio Legge di talete
Legge di talete Rumus segitig
Rumus segitig Teoria e storia della traduzione
Teoria e storia della traduzione Persia antica
Persia antica Gerusalemme antica
Gerusalemme antica Cos'è la pittura vascolare
Cos'è la pittura vascolare Ostia antica geschichte
Ostia antica geschichte Canto xxvi inferno
Canto xxvi inferno Alla formica rodari
Alla formica rodari Antica via regina
Antica via regina Babilonesi veneravano iside e osiride
Babilonesi veneravano iside e osiride La palestina antica ebrei e fenici
La palestina antica ebrei e fenici Alvernia antica capitale
Alvernia antica capitale Der garten des theophrast
Der garten des theophrast Arhitectura greciei antice
Arhitectura greciei antice Storia di marrakech
Storia di marrakech Versailles reggia storia
Versailles reggia storia La storia in tasca
La storia in tasca Favole della duss storia dell'uccellino
Favole della duss storia dell'uccellino Www.didadada.it storia
Www.didadada.it storia Il corpo nella storia dell'arte
Il corpo nella storia dell'arte La storia della carta
La storia della carta Triangolo di tartaglia storia
Triangolo di tartaglia storia Storia musica leggera italiana
Storia musica leggera italiana Storia del flauto dolce
Storia del flauto dolce Marketing nivea
Marketing nivea La storia definizione
La storia definizione Origini del fumetto
Origini del fumetto 7 14 21 e 28 questa è la storia di paperotto
7 14 21 e 28 questa è la storia di paperotto Commedia dell'arte mappa concettuale
Commedia dell'arte mappa concettuale Storia per un fumetto breve
Storia per un fumetto breve Il passaggio dalla preistoria alla storia
Il passaggio dalla preistoria alla storia Barbara urdanch storia
Barbara urdanch storia Locomotiva cu aburi pacific
Locomotiva cu aburi pacific Coccodrillo lillo
Coccodrillo lillo Storia dell'arte americana
Storia dell'arte americana Storia del cellulare
Storia del cellulare La storia dei due vasi cinesi
La storia dei due vasi cinesi Storia della statistica
Storia della statistica I colori nella storia dell'uomo
I colori nella storia dell'uomo Pierino e il lupo clarinetto
Pierino e il lupo clarinetto Legge daneo credaro pronuncia
Legge daneo credaro pronuncia Un po di storia
Un po di storia Chimica macromolecolare
Chimica macromolecolare Pablo escobar storia
Pablo escobar storia Storia della lingua spagnola
Storia della lingua spagnola Retrospezione narrativa
Retrospezione narrativa La storia di chiccolino da colorare
La storia di chiccolino da colorare Storia della camicia
Storia della camicia Quadratura del cerchio storia
Quadratura del cerchio storia La storia in tasca 5
La storia in tasca 5 Il regno senza tempo
Il regno senza tempo Numero reciproco
Numero reciproco Didattica della storia sapienza
Didattica della storia sapienza Fonte iconografica significato
Fonte iconografica significato Bernadette sangue liquido
Bernadette sangue liquido Colori nella preistoria
Colori nella preistoria Tangram trapezio
Tangram trapezio Powerpoint tennis
Powerpoint tennis La tavola periodica mappa concettuale
La tavola periodica mappa concettuale Viata cotidiana in bistrita medievala
Viata cotidiana in bistrita medievala Al kuwarizmi
Al kuwarizmi Colonizzazione filippine
Colonizzazione filippine Sociologia dei consumi unimore
Sociologia dei consumi unimore Ic vallelonga
Ic vallelonga Aurelliac
Aurelliac Storia della crittografia
Storia della crittografia Pennelli preistorici
Pennelli preistorici