QUMICA INORGNICA I FQUNAM Vctor Manuel Ugalde Saldvar




















- Slides: 31

QUÍMICA INORGÁNICA I FQ-UNAM Víctor Manuel Ugalde Saldívar 1

NÚMEROS CUÁNTICOS 2

El número cuántico principal n • El valor del número cuántico principal n, toma valores enteros (1, 2, 3. . . ) y define el tamaño del orbital. Cuanto mayor sea, mayor será el volumen. También es el que tiene mayor influencia en la energía del orbital. 3

El número cuántico l • El valor del momento angular, indica la forma del orbital y el momento angular. l = [ desde 0 hasta (n – 1)] • • • Para l = 0, orbitales Para l = 1, orbitales Para l = 2, obitales Para l = 3, orbitales Para l = 4, orbitales s p d f g 4

El número cuántico ml • El valor del número cuántico magnético, define la orientación espacial del orbital frente a un campo magnético externo. ml = -l, -l+1, …, 0, …, l+1, l 5

El número cuántico s • El valor del espín, puede ser +1/2 ó 1/2. • Al orbital sin el valor de s se le llama orbital espacial, al orbital con el valor de s se le llama espínorbital. 6

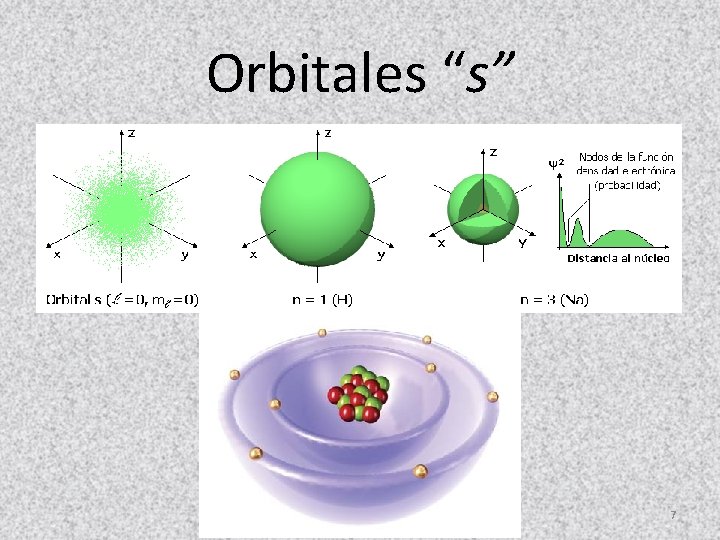
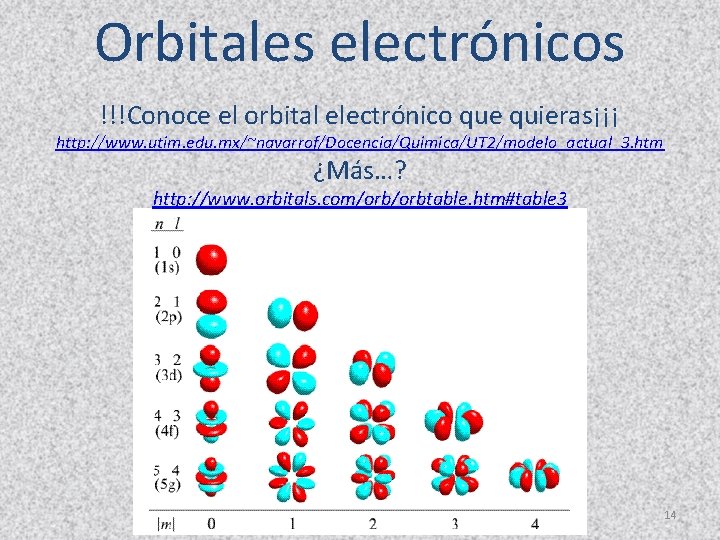
Orbitales “s” 7

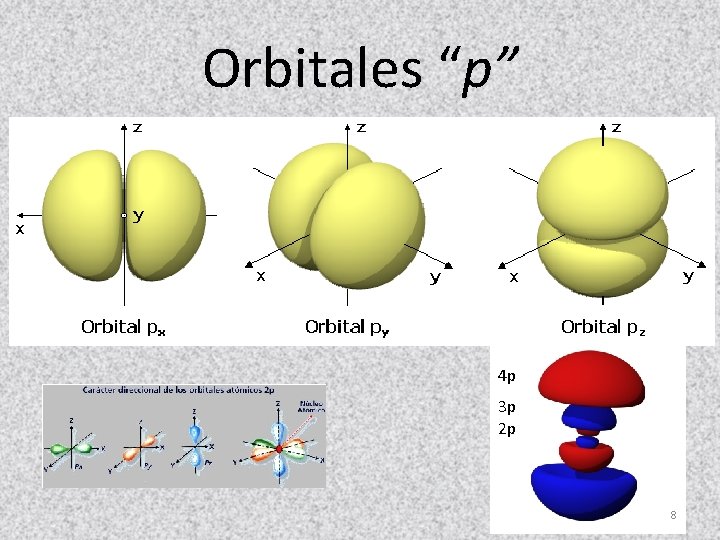
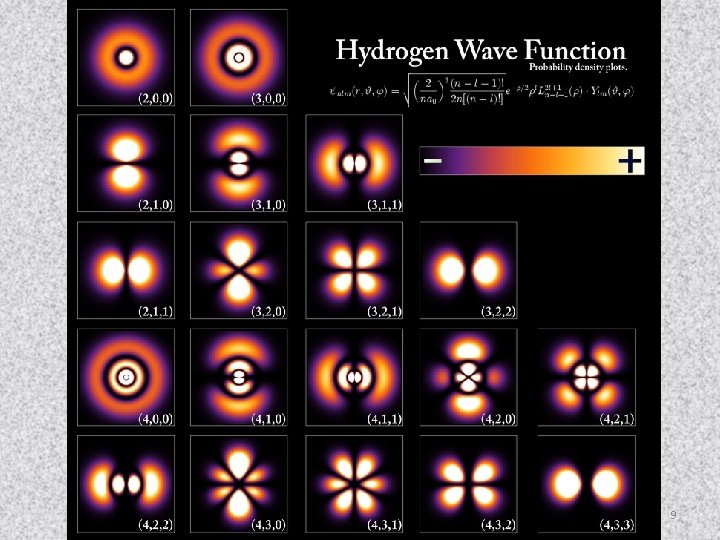
Orbitales “p” 4 p 3 p 2 p 8

9

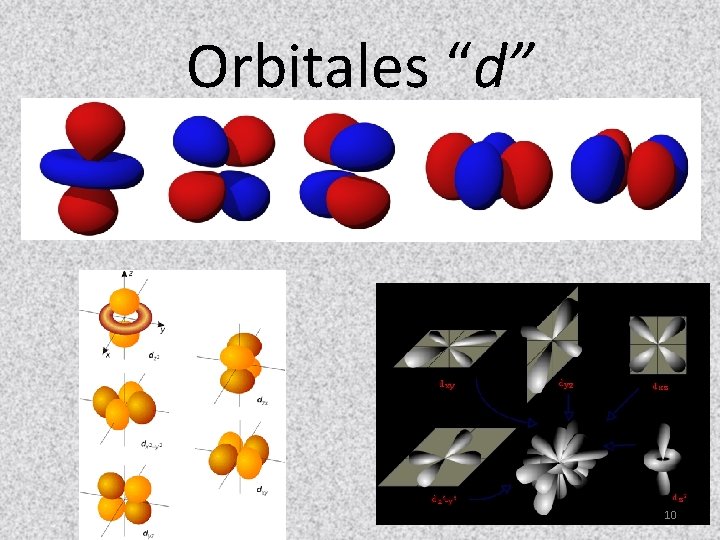
Orbitales “d” 10

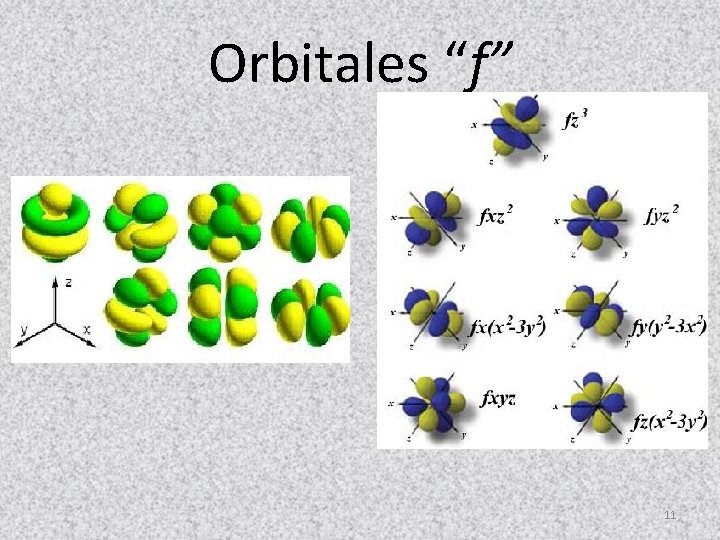
Orbitales “f” 11

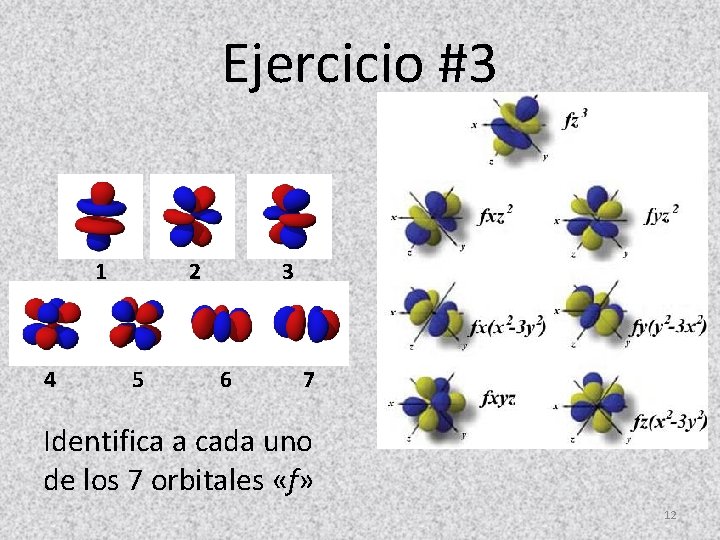
Ejercicio #3 1 2 3 4 5 6 7 Identifica a cada uno de los 7 orbitales «f» 12

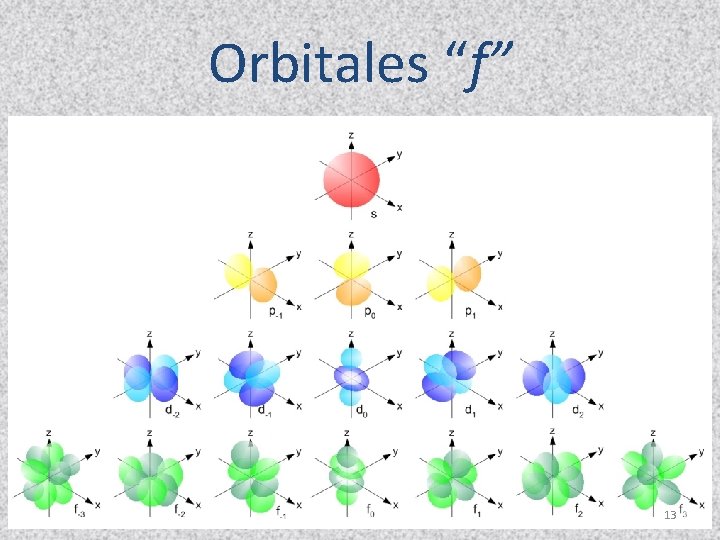
Orbitales “f” 13

Orbitales electrónicos !!!Conoce el orbital electrónico que quieras¡¡¡ http: //www. utim. edu. mx/~navarrof/Docencia/Quimica/UT 2/modelo_actual_3. htm ¿Más…? http: //www. orbitals. com/orbtable. htm#table 3 14

5 ta Conferencia (E. Solvey), 1927 Bruselas, Bélgica 15

Teoría atómica alternativa Video 2 16

Configuraciones electrónicas de los elementos químicos 17

Regla de las diagonales Si se siguen las diagonales, la dirección de las flechas te darán el orden de la configuración electrónica, respetando el Principio de Aufbau (siempre se deben colocar los electrones en los orbitales de menor energía). 1 s 22 p 63 s 23 p 64 s 23 d 104 p 65 s 24 d 105 p 66 s 24 f 145 d 106 p 67 s 25 f 146 d 107 p 6 n 1 2 3 4 5 6 7 SOBRE LOS ORBITALES ELECTRÓNICOS: • Que cada orbital acepta solo 2 electrones • Que sólo hay 1 orientación para los orbitales s (2 electrones) • Que hay 3 orientaciones para los orbitales p (6 electrones) • Que hay 5 orientaciones para los orbitales d (10 electrones) • Que hay 7 orientaciones para los orbitales f (14 electrones) 18

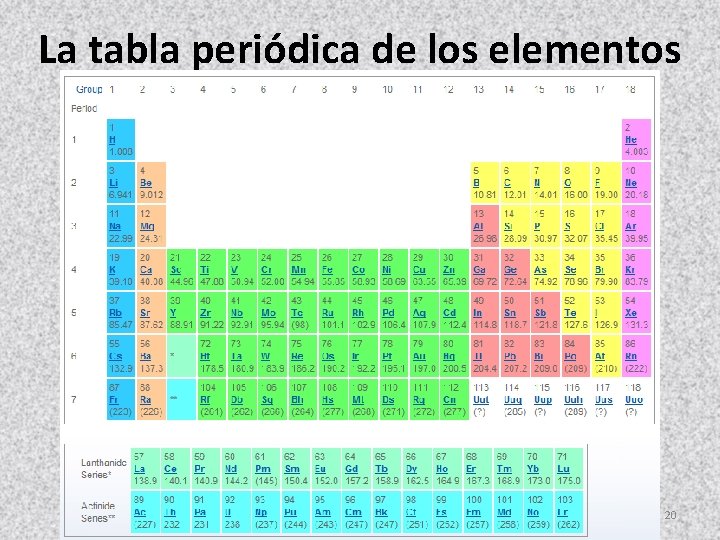
Lo primero que se debe conocer, es el número atómico del elemento (Z) 19

La tabla periódica de los elementos 20

Configuración electrónica del oxígeno (8 O) # de electrones = 1 s 22 p 4 O 8 Total de e = 2 + 4 = 8 21

Configuración electrónica del cadmio 2+ (48 Cd 2+) # de electrones = 48 -2 = 46 2+ = 1 s 22 p 63 s 23 p 64 s 23 d 104 p 64 d 105 s 0 Cd 48 Total de e = 2 + 6 + 2 + 10 + 6 + 10 = 46 22

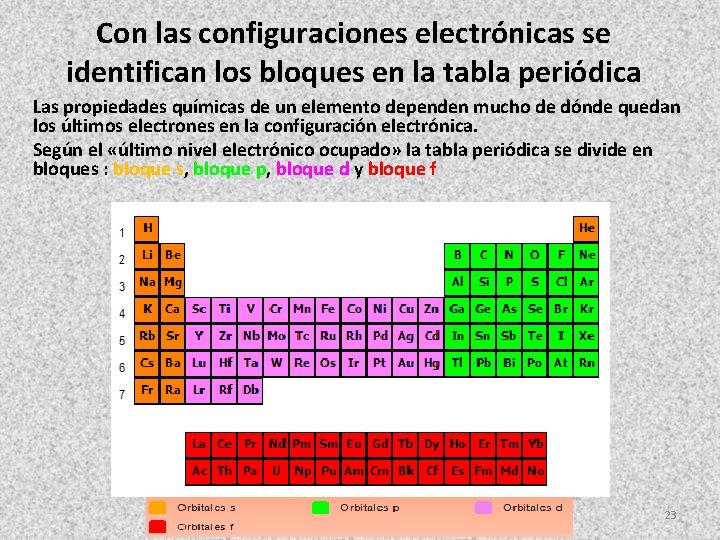
Con las configuraciones electrónicas se identifican los bloques en la tabla periódica Las propiedades químicas de un elemento dependen mucho de dónde quedan los últimos electrones en la configuración electrónica. Según el «último nivel electrónico ocupado» la tabla periódica se divide en bloques : bloque s, bloque p, bloque d y bloque f 23

Configuraciones electrónicas de los gases nobles Grupo 18: He, Ne, Ar, Kr, Xe, Rn 24

Configuraciones electrónicas con kernell Para simplificar una configuración electrónica se puede utilizar la notaciones kernell de los gases nobles y partir del gas noble cuyo número de electrones sea inmediato inferior al del átomo que va a representar. Por lo tanto tomando en cuenta esto; debemos tener presente la terminación de las configuraciones electrónicas de los gases nobles. Para representar las configuraciones electrónicas de kernell de los elementos químicos periodo dos (renglón dos) se utiliza el gas noble del periodo uno (renglón uno). 25

Ejemplo 1. - Configuración kernell del carbono: = 1 s 22 p 4 C 6 2 He 6 C 2 =1 s = [2 2 4 He] 2 s 2 p 26

Ejemplo 2. - Configuración kernell de la plata: = 1 s 22 p 63 s 23 p 64 s 23 d 104 p 65 s 24 d 9 Ag 47 22 s 22 p 63 s 23 p 64 s 23 d 104 p 6 Kr = 1 s 36 24 d 9 Ag = [ Kr] 5 s 47 36 27

Diagramas energéticos o configuraciones gráficas 28

Principios energéticos 29

Electrón diferencial 30

Ejercicio #4 1. - Describa los 4 números cuánticos para el electrón 5 dz 21 2. - Determine el número de orbitales d ocupados en el Ru 3+ y Ru 4+ 3. - Determine al catión divalente y el número de electrones totales, si éste presenta la configuración electrónica siguiente: 1 s 2, 2 p 6, 3 s 2, 3 p 6, 4 s 2, 3 d 10, 4 p 6, 5 s 2, 4 d 10 4. - Calcule el número total de orbitales p que contiene la configuración electrónica del polonio, 5. - Calcule el número total de orbitales ocupados cuyo valor de n=4 y determine el total de electrones contenidos en ellos, para la especie Eu 3+ (Z=63). 31
 Victor manuel ugalde saldivar
Victor manuel ugalde saldivar Victor manuel ugalde saldivar
Victor manuel ugalde saldivar Vctor
Vctor Vctor
Vctor Vctor
Vctor Vctor
Vctor Vctor
Vctor Vialidad de domicilio
Vialidad de domicilio Vctor
Vctor Horas de ayuno
Horas de ayuno Formulas estruturais
Formulas estruturais Como se calcula el factor gravimetrico
Como se calcula el factor gravimetrico Qumica
Qumica Qumica
Qumica Que es el proyecto genoma humano
Que es el proyecto genoma humano Qumica
Qumica Carbonos primarios secundarios y terciarios ejemplos
Carbonos primarios secundarios y terciarios ejemplos Temperatura de congelacion
Temperatura de congelacion Na y cl
Na y cl Monossacarídios
Monossacarídios Qumica
Qumica Número atomico
Número atomico Qual a sentença verdadeira
Qual a sentença verdadeira Qumica
Qumica Qumica
Qumica Homogneo
Homogneo Qumica
Qumica Qumica
Qumica Notação de lewis
Notação de lewis Qumica
Qumica Qumica
Qumica Qumica
Qumica