QUMICA INORGNICA 2007 CLASES TERICAS QUMICA DESCRIPTIVA DE














- Slides: 18

QUÍMICA INORGÁNICA 2007 CLASES TEÓRICAS QUÍMICA DESCRIPTIVA DE LOS ELEMENTOS Y SUS COMPUESTOS GRUPOS 1 Y 2

Grupo 1 Metales alcalinos Li, Na K, Rb, Cs y Fr El sodio y potasio son abundantes en la tierra, se presentan en forma de sal común (Na. Cl) y carnalita (KCl. Mg. Cl 2. 6 H 2 O). El resto de los elementos (Li, Rb y Cs) son bastante menos abundantes y se presentan en algunos silicatos minerales. El francio solo tiene isótopos de vida muy corta.

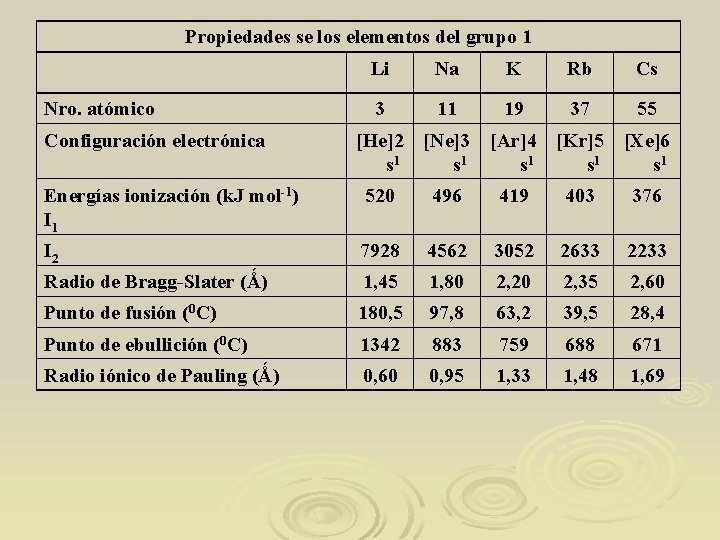
Propiedades se los elementos del grupo 1 Nro. atómico Configuración electrónica Li Na K Rb Cs 3 11 19 37 55 [He]2 [Ne]3 s 1 [Ar]4 [Kr]5 [Xe]6 s 1 s 1 Energías ionización (k. J mol-1) I 1 520 496 419 403 376 I 2 7928 4562 3052 2633 2233 Radio de Bragg-Slater (Ǻ) 1, 45 1, 80 2, 20 2, 35 2, 60 Punto de fusión (0 C) 180, 5 97, 8 63, 2 39, 5 28, 4 Punto de ebullición (0 C) 1342 883 759 688 671 Radio iónico de Pauling (Ǻ) 0, 60 0, 95 1, 33 1, 48 1, 69

Son reductores fuertes por eso nunca se los encuentra en la naturaleza como metales y la única forma de recuperarlos es por electrólisis. Los puntos de ebullición y fusión disminuyen cuando se baja en el grupo. Los valores de I 1 indican que tiene poca atracción por sus electrones de valencia, esto explica la baja energía de sublimación y la blandura.

Los metales alcalino reaccionan directamente o por calentamientos con la mayoría de los elementos. El agua ataca lentamente al Li y es el único que reacciona con el N 2, formando Li 3 N rojo rubí. Los otros elementos reaccionan con agua: Na reacción fuerte K se inflama Rb y Cs explotan Li, Na y K pueden manejarse en aire, el resto deben manejarse sumergidos en argón.

Óxidos e hidróxidos Por reacción directa con oxígeno: solo el litio forma Li 2 O (óxido) el sodio da Na 2 O 2 (peróxido) Los óxidos son compuestos iónicos, bases fuertes y se disuelven fácilmente en agua.

Haluros y sales iónicas Virtualmente se conocen sales de todos los ácidos, son compuestos sólidos cristalinos iónicos e incoloros. Alto punto de fusión y ebullición y alta conductividad eléctrica de sus fundidos y solubilidad en agua.

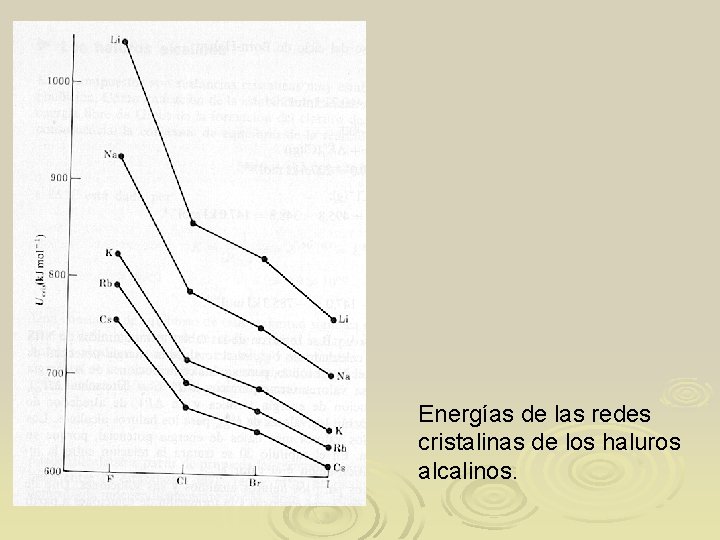
Energías de las redes cristalinas de los haluros alcalinos.

Grupo 2 Metales alcalino térreos Be, Mg, Ca, Sr, Ba y Ra Ø El berilio se presenta como mineral berilo (Be 3 Al 2(Si. O 3)). El Mg, Ca, Sr y Ba están ampliamente distribuidos en los minerales y el mar. El magnesio es el segundo elemento metálico en abundancia en el mar. Hay grandes depósitos de caliza, mármol y yeso (Ca. CO 3), dolomita (Ca. CO 3. Mg. CO 3) y carnalita (KCl. Mg. Cl 2. 6 H 2 O). Menos abundantes son estroncianita Sr. SO 4 y baritas Ba. SO 4. Todos los isótopos del radio son radioactivos.

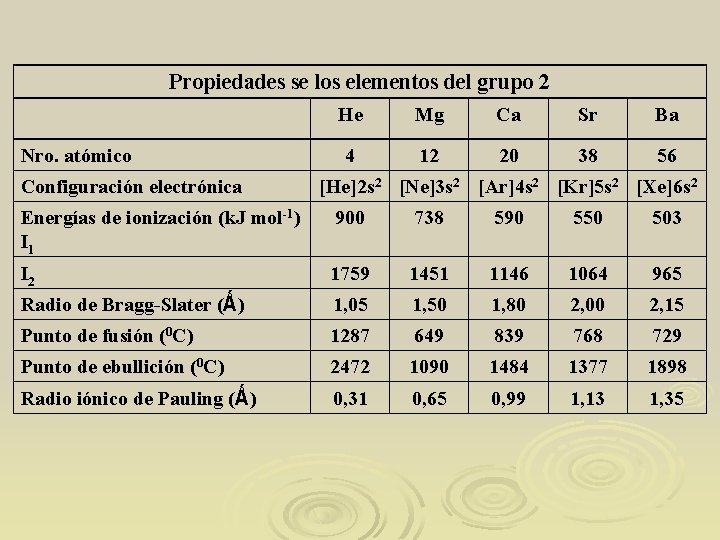
Propiedades se los elementos del grupo 2 Nro. atómico Configuración electrónica He Mg Ca Sr Ba 4 12 20 38 56 [He]2 s 2 [Ne]3 s 2 [Ar]4 s 2 [Kr]5 s 2 [Xe]6 s 2 Energías de ionización (k. J mol-1) I 1 900 738 590 550 503 I 2 1759 1451 1146 1064 965 Radio de Bragg-Slater (Ǻ) 1, 05 1, 50 1, 80 2, 00 2, 15 Punto de fusión (0 C) 1287 649 839 768 729 Punto de ebullición (0 C) 2472 1090 1484 1377 1898 Radio iónico de Pauling (Ǻ) 0, 31 0, 65 0, 99 1, 13 1, 35

Comparados con el grupo 1, los metales alcalino térreos son mas duros, pero la blandura aumenta hacia abajo en el grupo. Los radios atómicos son menores. Al tener dos electrones enlazantes, tienen mayor punto de fusión y ebullición y mayor densidad.

La I 1 no es muy grande, pero la I 2 es importante, se puede demostrar que el Ca+(g) es estable respecto de Ca(s) y Ca 2+(g). La situación cambia si se consideran las relaciones energéticas entre los iones acuosos y el metal sólido. El Ca+(ac) es inestable.

El Be y Mg son reductores mas débiles que el resto de los metales del grupo.

El magnesio tiene un comportamiento intermedio, alta capacidad de polarización. El resto de los metales alcalino térreos (Ca, Sr, Ba y Ra) forman un grupo homogéneo, con propiedades que varían en forma sistemática. Del Ca al Ra aumenta: a) La naturaleza electropositiva. b) La entalpía de hidratación de las sales. c) La insolubilidad de algunas sales (sulfato). d) Las estabilidades térmicas de los carbonatos.

Óxidos e hidróxidos Ø Se obtiene por descomposición térmica de los carbonatos. Ø Son compuestos muy estables. Ø Los metales mas pesados forman hidróxidos que son bases fuertes. Ø El berilio tiene comportamiento anfótero, reacciona con ácidos fuertes concentrados lentamente y con bases fuertes.

Haluros Ø Todos los metales alcalinos térreos se combinan con los halógenos para dar MX 2. Ø Particularmente el cloruro presenta las tendencias indicadoras del cambio de covalente a iónico.

Otras sales Ø Sulfatos y cromatos tendencias similares la solubilidad disminuye con el número atómico, tendencia contraria a los hidróxidos. Ø Los carbonatos no siguen la tendencia de los aniones grandes y los floruoruros la de los OH-. Esto demuestra que no siempre se puede predecir las tendencias.

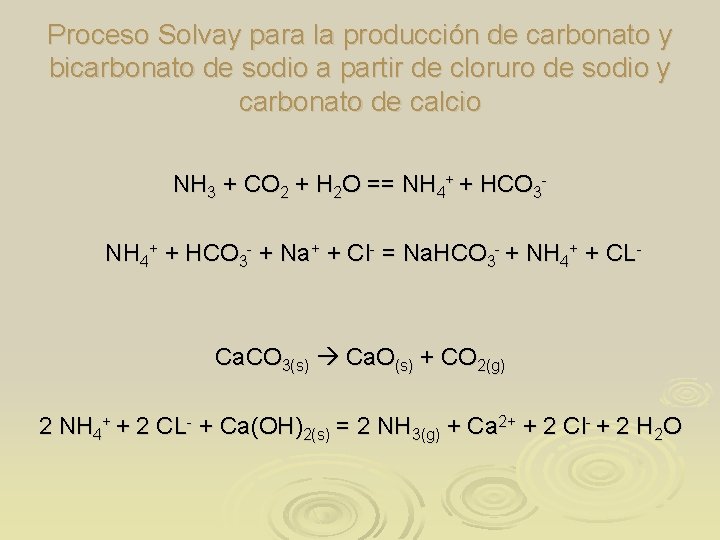
Proceso Solvay para la producción de carbonato y bicarbonato de sodio a partir de cloruro de sodio y carbonato de calcio NH 3 + CO 2 + H 2 O == NH 4+ + HCO 3 - + Na+ + Cl- = Na. HCO 3 - + NH 4+ + CL- Ca. CO 3(s) Ca. O(s) + CO 2(g) 2 NH 4+ + 2 CL- + Ca(OH)2(s) = 2 NH 3(g) + Ca 2+ + 2 Cl- + 2 H 2 O