QUMICA DESCRITIVA Parte I Composio Qumica da Terra





























- Slides: 39

QUÍMICA DESCRITIVA

Parte I Composição Química da Terra

Parte I - Composição Química da Terra Atmosfera Litosfera Hidrosfera

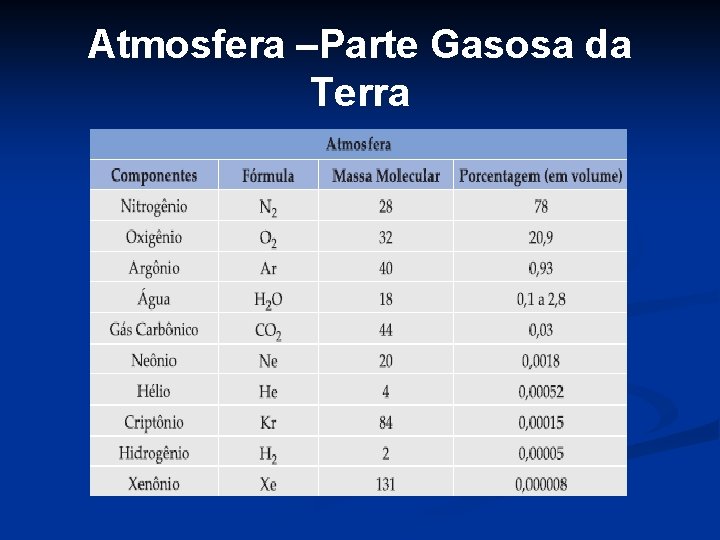
Atmosfera –Parte Gasosa da Terra

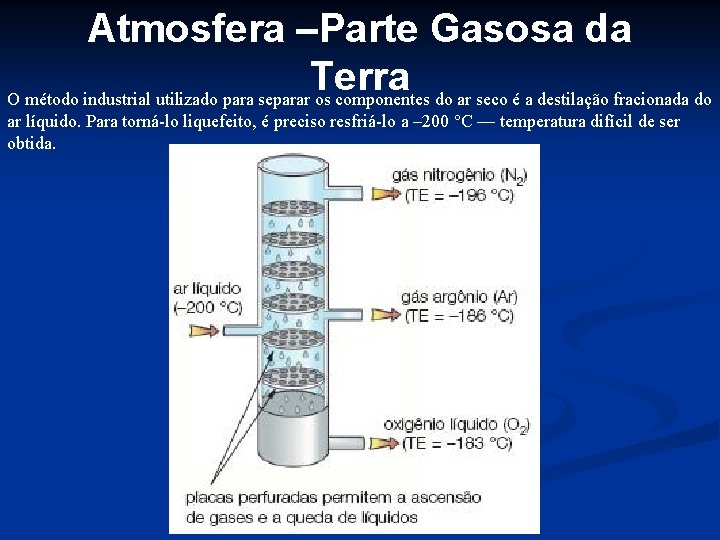
Atmosfera –Parte Gasosa da Terra

Atmosfera –Parte Gasosa da Terra O método industrial utilizado para separar os componentes do ar seco é a destilação fracionada do ar líquido. Para torná-lo liquefeito, é preciso resfriá-lo a – 200 °C — temperatura difícil de ser obtida.

Atmosfera –Parte Gasosa da Terra Usos de alguns gases purificados da atmosfera: O 2 - alimentação de combustão (queima), aparelhos de respiração artificial, produção de aço; N 2 - produção de amônia, ácido nítrico e fertilizantes; Ar - preenchimento de lâmpadas de filamento.

Litosfera – Parte Sólida da Terra n n n Elementos mais comuns na crosta terrestre (porcentagem em massa) O > Si > Al > Fe> Ca Minerais: são substâncias de origem inorgânica e natural que ocorrem na natureza no estado sólido, com uma composição química definida e uma estrutura interna de átomos na forma de arranjo geométrico. Apresentam-se geralmente na forma de cristais. Rochas: São agregados de minerais que formam toda a crosta terrestre e as partes mais profundas do planeta (com exceção do núcleo externo, que é a única parte líquida existente no interior da Terra).

Tipos de Minérios

Litosfera – Parte Sólida da Terra HEMATITA MAGNETITA

Litosfera – Parte Sólida da Terra PIRITA BLENDA

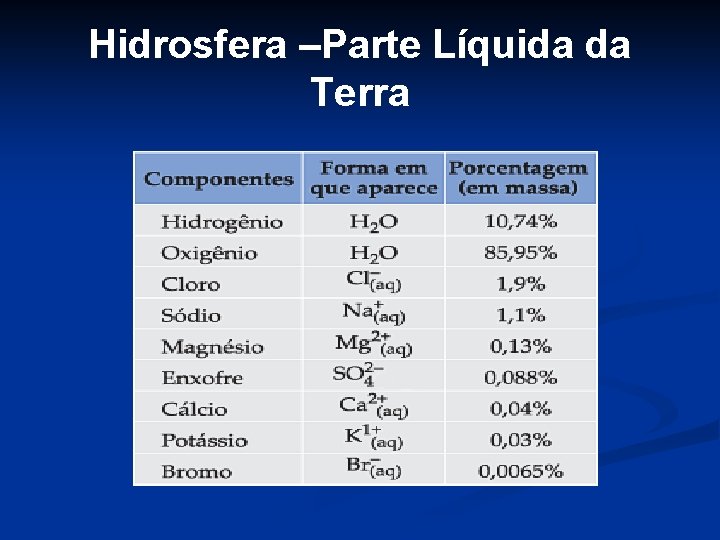
Hidrosfera –Parte Líquida da Terra

Parte II – Obtenção de substâncias

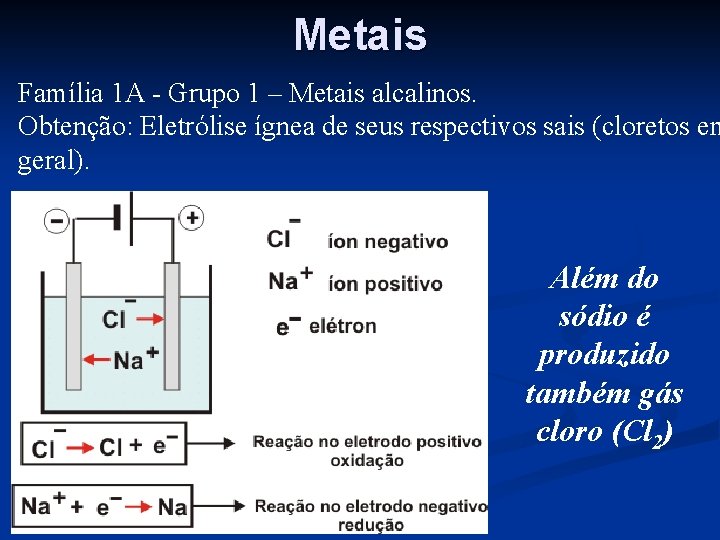
Metais

Metais Família 1 A - Grupo 1 – Metais alcalinos. Césio Sódio Potássio Lítio

Metais Família 1 A - Grupo 1 – Metais alcalinos. Os metais alcalinos apresentam alta reatividade (potencial de oxidação) e, portanto, na natureza são encontrados na forma de cátions monovalentes: Li + , Na + , K + , Rb + , Cs +

Metais Família 1 A - Grupo 1 – Metais alcalinos. Obtenção: Eletrólise ígnea de seus respectivos sais (cloretos em geral). Além do sódio é produzido também gás cloro (Cl 2)

Metais Família 2 A - Grupo 2 – Metais alcalino-terrosos Assim como os metais do grupo 1, também são reativos. Magnésio Bário

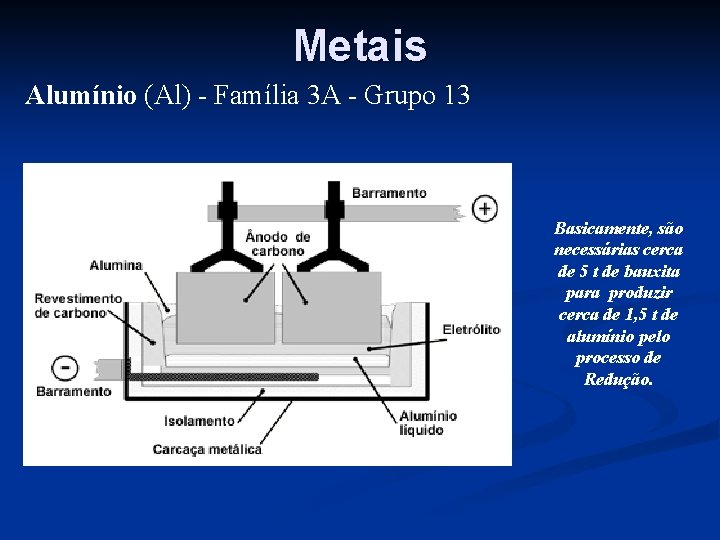
Metais Alumínio (Al) - Família 3 A - Grupo 13

Metais Alumínio (Al) - Família 3 A - Grupo 13 Devido sua relativa eletropositividade encontra-se na natureza em sua forma oxidada (Al+3 ). Fonte principal de obtenção – Bauxita A produção de bauxita brasileira concentra-se nos Estados do Para e Minas Gerais cujas reservas totais são de aproximadamente 11% das reservas mundiais O Brasil é a terceira reserva mundial de bauxita.

Metais Alumínio (Al) - Família 3 A - Grupo 13 Obtenção do Alumínio – Eletrólise ígnea do óxido de alumínio (Al 2 O 3).

Metais Alumínio (Al) - Família 3 A - Grupo 13 Basicamente, são necessárias cerca de 5 t de bauxita para produzir cerca de 1, 5 t de alumínio pelo processo de Redução.

Metais Reações envolvidas na produção do alumínio: Dissolução do óxido em criolita: Al 2 O 3 => 2 Al 3+ + 3 O 2 Em meio fortemente básico (Na. OH) No pólo negativo: 4 Al 3+ + 12 e- => 4 Al 0 No pólo positivo: 6 O 2 - => 3 O 2 + 12 e. Equação global: 2 Al 2 O 3 => 4 Al 3+ + 6 O 2 - Al 3+ + 12 e- => 4 Al 0 6 O 2 - => 3 O 2 + 12 e 2 Al 2 O 3 => 4 Al 0 + 3 O 2

Metais Ferro (Fe) – Metal de transição – Grupo 8 Ocorre na natureza na suas formas oxidadas (Fe+2 , Fe+3 ). As principais matérias primas são a hematita (Fe 2 O 3), magnetita (Fe 3 O 4) e a pirita (Fe. S). HEMATITA MAGNETITA

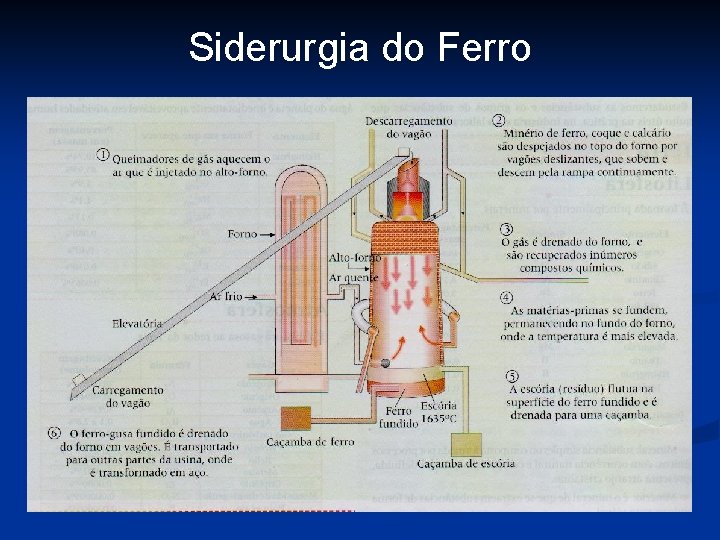
Siderurgia do Ferro

Siderurgia do Ferro Alto forno utilizado para siderurgia do ferro em Volta Redonda - RJ (CSN)

Reações ocorridas na obtenção do Fe Se o minério for Fe 2 O 3, ele é reduzido pelo CO a Fe 3 O 4 na parte superior do forno (300 °C). CO(g) + 3 Fe 2 O 3 (s) 2 Fe 3 O 4 (s) + CO 2(g) O Fe 3 O 4 vai aos poucos descendo para a parte inferior do forno onde é reduzido a Fe. O (600 °C) por diferença de densidade. CO(g) + Fe 3 O 4 (s) 3 Fe. O(s) + CO 2(g) Na parte mais baixa do forno, Fe. O é reduzido a ferro (Fe) (de 800 a 1600 °C). CO(g) + Fe. O(s) Fe(l) + CO 2(g)

Ferro como matéria prima do aço

Ferro como matéria prima do aço

Cobre - Cu

Cobre - Cu

Ametais

Oxigênio – O 2 O oxigênio líquido é obtido à temperatura inferior a – 180º C.

Oxigênio– O 2 Gás incolor, inodoro usado comburente (substância que alimenta as combustões). Ocorre livre na atmosfera, combinado com hidrogênio na hidrosfera e na forma de diversos óxidos , sulfatos , fosfatos e outros compostos de diferentes elementos na crosta terrestre.

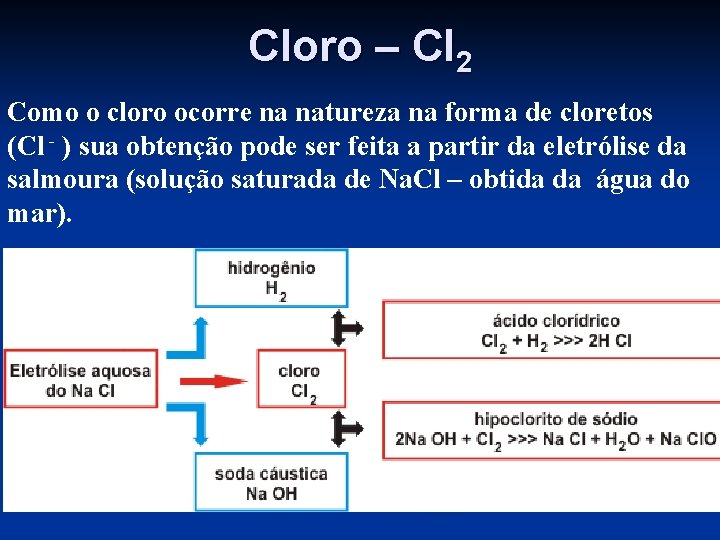
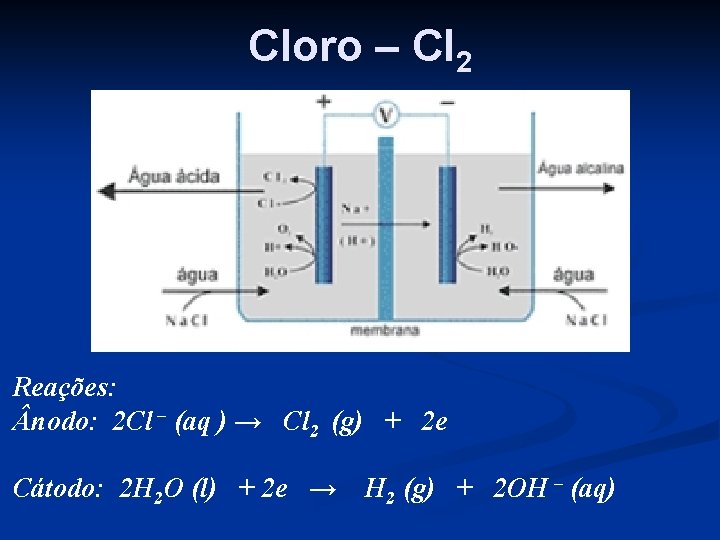
Cloro – Cl 2 Nas condições ambientes o cloro encontra-se na forma de um gás amarelo - esverdeado, de odor fortemente irritante e altamente tóxico.

Cloro – Cl 2 Como o cloro ocorre na natureza na forma de cloretos (Cl - ) sua obtenção pode ser feita a partir da eletrólise da salmoura (solução saturada de Na. Cl – obtida da água do mar).

Cloro – Cl 2 Reações: nodo: 2 Cl – (aq ) → Cl 2 (g) + 2 e Cátodo: 2 H 2 O (l) + 2 e → H 2 (g) + 2 OH – (aq)

Bromo e Iodo O bromo é um líquido avermelhado relativamente volátil, enquanto que o iodo é um sólido púrpura que sublima em condições ambiente.

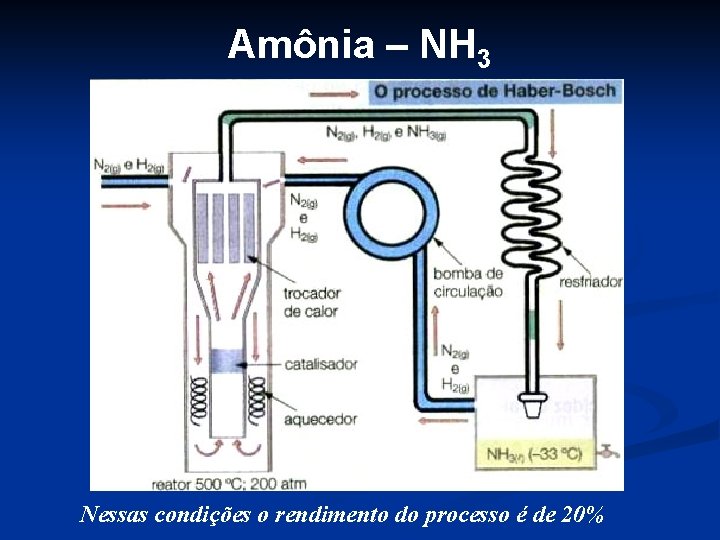
Amônia – NH 3 Nessas condições o rendimento do processo é de 20%
 La forza centrifuga si modifica variando la traiettoria
La forza centrifuga si modifica variando la traiettoria Slidetodoc.com
Slidetodoc.com Missa parte por parte
Missa parte por parte Te invitamos a ser parte o hacer parte
Te invitamos a ser parte o hacer parte Este parte aquele parte
Este parte aquele parte Recta de topo
Recta de topo Cervo
Cervo Paralelismo entre rectas
Paralelismo entre rectas Paralelismo geometria descritiva
Paralelismo geometria descritiva Cone obliquo geometria descritiva
Cone obliquo geometria descritiva Semiplano vertical superior
Semiplano vertical superior Pontos notáveis geometria descritiva
Pontos notáveis geometria descritiva Paráfrase
Paráfrase Cone obliquo geometria descritiva
Cone obliquo geometria descritiva Estrutura da reportagem
Estrutura da reportagem Quimica descritiva
Quimica descritiva Paralelismo geometria descritiva
Paralelismo geometria descritiva Resenhar
Resenhar Qumica
Qumica Qumica
Qumica Qumica
Qumica Cintica
Cintica Qumica
Qumica Geometria trigonal plana
Geometria trigonal plana Nomenclatura das bases
Nomenclatura das bases Hidrocarburos
Hidrocarburos Pilha de daniell
Pilha de daniell Qumica
Qumica Reação exergônica
Reação exergônica Qumica
Qumica Truta
Truta Quimica organica
Quimica organica Qumica
Qumica Energia en los enlaces quimicos
Energia en los enlaces quimicos Mistura quimica
Mistura quimica Qumica
Qumica Homopolissacarideos significado
Homopolissacarideos significado Caracteristicas dos seres vivos composição quimica
Caracteristicas dos seres vivos composição quimica Qumica
Qumica Ion bromonio
Ion bromonio





























































