PROSES ELEKTRODEPOSISI PENGERTIAN ELEKTRODEPOSISI l l Pada dasarnya



























































- Slides: 63

PROSES ELEKTRODEPOSISI

PENGERTIAN ELEKTRODEPOSISI l l Pada dasarnya = elektroplating Mrp proses pengendapan secara elektrokimia Termasuk : elektroforming, elektrorefining, elektrowining Biasanya diperlukan untuk finishing logam: - memperbaiki daya hantar - meningkatkan ketahanan korosi - dekoratif

PRINSIP KERJA Mengalirkan arus searah melalui elektroda ke dalam larutan elektrolit l Reaksi redoks l Banyak berhubungan dengan konduktor elektrolitik : mobilitas ion, konduktivits ion, difusi ion dan bilangan transpor l Dasarnya Hukum Faraday : - Jumlah perubahan kimia oleh satuan arus listrik sebanding dengan banyaknya arus yang mengalir - Jumlah aneka bahan berbeda yang dibebaskan oleh sejumlah tertentu listrik sebanding dengan berat ekivalennya l

OVERPOTENSIAL l l l Potensial yang diperlukan untuk mengatasi hambatan elektrolitnya Potensial yang timbul akibat adanya selisih konsentrasi ion di dekat elektroda Potensial yang diperlukan untuk merusak/ menguraikan air membentuk hidrogen dan oksigen

OVERPOTENSIAL l l l Besarnya tgt sifat permukaan katoda Pada katoda : timah, seng, timbel, besarnya sampai 1 Volt. Di platina dan grafit paling kecil. Besi tuang yang mengandung grafit sulit diplat dg seng krn arusnya dipakai untuk deposisi hidrogen, shg perlu dilapis dulu dg timah/kadmium Pengotor memperbesar overpotensial Pada lar sianida pot dep logam berdekatan dg pot. Pengeluaran hidrogen shg akan menurunkan efisiensi katoda.

BAK PLATING/ ELEKTRODEPOSISI Berisi larutan plating l Kandungan bak tergantung tujuannya, yang a. l : - sumber logam yang dideposisikan - membentuk kompleks dengan ion logam deposisinya - stabilisasi larutan ( terhadap hidrolisis) - Buffer ( stabilisasi p. H/keasaman ) - mengubah/mengatur bentuk fisik deposit - membantu pelarutan anoda l

JENIS BAK PLATING l l l Bak asam : tdr dr garam sederhana Bak alkali : lebih komplek, krn logamnya juga terdapat sebagai anion. Bak Netral : p. H 5 – 8 ( bisa garam sederhana/ kompleks)

BAK PLATING l l l Harus relatif pekat ion logamnya Diperlukan garam larut ( nitrat jarang dipakai) Untuk mencegah pasivasi anoda diperlukan ion klorida ( plating: nikel, besi dan seng ) Jarang digunakan anion organik (umumnya asam lemah) Banyak digunakan kompleks-siano dalam bak alkali (daya lontar > bak asam) Biasanya ada wetting agen (surfaktan)

BAHAN BAK PLATING l l l Bahan bak mampu menampung total larutan elektrolit Bahan bak harus tahan terhadap pengkaratan dan tahan pada suhu tertentu. Biasanya bak terbuat dari baja yang dalamnya dilapisi dengan karet, plastik, Fiber, atau PVC ( polyvinyl chloride resin )

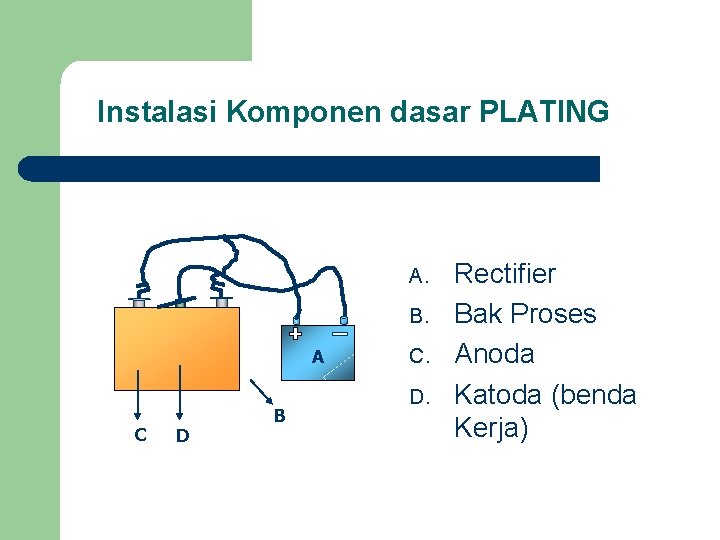
Instalasi Komponen dasar PLATING A. B. A C D B C. D. Rectifier Bak Proses Anoda Katoda (benda Kerja)

Rectifier/ penyearah arus Adalah alat yang bisa menurunkan dan mengubah tegangan AC (dari PLN) menjadi DC (searah). Rectifier yang digunakan dalam lapis logam secara umum adalah rectifier yang bisa mengeluarkan tegangan antara 1 – 12 Volt.

ANODA Bentuk : logam pejal (masif) dan potongan (oval, persegi, bulat, gerigi atau lekuk-lekuk) l Sifat : ada anoda inert dan anoda aktif (larut) l Bahan : logam murni atau alloy l

KATODA l l Merupakan bahan yang akan diplating/dilapis Bahan : logam atau non logam ( harus dibuat bersifat konduktor) Bahan non logam : kayu, plastik, kulit, daun, dll) Cara metalisasi bahan non konduktor : vakum, sputtering, semprot, dll

PROSES PENGENDAPAN • hal penting : potensial elektroda dan anoda terpolarisasi Contoh : potensial reduksi Cu (+2) menjadi Cu(0) = 0, 345 V Bila potensial diturunkan menjadi 0, 340 V maka laju reaksi anodik/ pelarutan anoda akan turun, sehingga reaksi pengendapan lebih cepat dari pada reaksi pelarutan. Bila potensial dinaikkan sampai 0, 350 V efeknya terbalik. Meskipun selisih 5 m. V belum mampu menopang proses deposisi secara memadai. Ion hidrogen selalu ada dalam larutan berair.

ANODA TERPOLARISASI l l Anoda yang diharapkan larut, terlapisi film oksida shg proses pelarutan terganggu hingga berhenti melarut, ia terpolarisasi dan menjadi pasif Film yang terbentuk bisa menjadi isolator spt pada anodisasi aluminium, atau menjadi konduktor (anoda inert, namun reaksi berlanjut dg mengeluarkan oksigen)

TERBENTUKNYA ION KOMPLEKS l l Ion Cu dalam air selalu dalam keadaan ion terhidrat, begitu pula ion logam yang lain. Namun ion kompleks yang terbentuk tidak begitu mempengaruhi potensial elektroda, karena ligannya tidak terikat kuat. Bila dalam larutan ada ion sianida maka akan terbentuk ion komplek Cu-sianida yang dpt merubah Cu(+2) menjadi Cu (+1). Shg potensialnya akan merosot yg semula elektropositif menjadi elektronegatif

EFISIENSI KATODA Rasio berat logam terendapkan terhadap nilai teoritisnya x 100% l Efisiensi < 100% karena adanya reaksi samping biasanya pengeluaran hidrogen (peruraian air) l Ion-ion yang dapat direduksi lainnya bisa menurunkan efisiensi tanpa pengeluaran hidrogen, contoh : ion nitrat yang mudah direduksi menjadi nitrit, nitrogen atau amonia l

MEKANISME PENGENDAPAN l l ION LOGAM BERSAMA LIGANNYA MELEKATKAN DIRI KE BEBERAPA KEDUDUKAN MEMBENTUK IKATAN DG PERMUKAAN KATODA DAN SEBAGIAN MUATANNYA TERNETRALKAN ( ADION) Adion menyebar di permukaan dan tumbuh mengisi cacat-cacat scr lateral sampai kisi-kisi bertetangga saling bertemu membentuk batas butiran dan terus tumbuh menjadi deposit tebal.

STRESS PADA DEPOSIT l l Menyebabkan retakan dan terkelupasnya deposit Penyebab: tidak tepatnya perhitungan parameter kisi Pengotor dari luar (oksida, air, belerang, karbon, hidrogen, ion logam lain, dll) Kisi tidak normal dan getas

PERSIAPAN ELEKTRODEPOSISI l l l Pembersihan: - pelarut organik (penghilangan lemak) - pembersihan alkali - pembersihan asam ( pickling asam) Pembersihan tergantung pada: jenis bahan yang akan dibersihkan dan jenis kotoran yang akan dihilangkan (organik/anorganik) dan ditentukan oleh proses finishing berikutnya. Standar pembersihan : ASTM B 322

TAHAPAN UMUM PEMBERSIHAN l l l Pembersihan secara mekanis Bilas air bersih Alkaline degreasing Bilas 2 – 3 kali Pickling ( cuci asam ) - Besi, Baja, SS: Konsentrasi HCl 3 - 12 % x Volume, selama 5 – 15 menit

ANEKA LOGAM PLATING Dikelompokkkan 5 golongan l Coating tumbal l Coating dekoratif-protektif l Coating logam rekayasa l Coataing logam jarang pakai l Coating alloy

COATING TUMBAL l l l Digunakan untuk melindungi logam dasar Disebut pula sebagai proses anodik (relatif thd substrat) Seng dan Kadmium sebagai pelapis besi/baja Kadmium lebih baik dr seng, tetapi > mahal Cara coating : elektroplating, celup panas atau semprot

COATING DEKORATIF-PROTEKTIF l l Yang paling populer : vernikel dan verckrom Logam pelapis : tembaga, nikel dan krom Per tahun : Cu > 50. 000 ton, Ni > 100. 000 ton dan Cr > 120. 000 ton Produk : barang rumah tangga, alat sport, alat tulis, konstruksi dan kendaraan

COATING REKAYASA l l Menggunakan logam-logam mulia : Pt, Au, Ag Ditambah logam : timah dan timbel Logam kel. Pt : rutenium, rhodium, paladium, osmium, iridium dan platina ( rhodium biasanya dipakai untuk dekoratif) Timah dan timbel untuk pelapis industri (alloy timah-timbel untuk elektronika)

LOGAM JARANG PAKAI Golongan yang mudah diplatingkan : l Fe : mudah terkorosi l Co : mahal, diganti Ni l In : mahal Golongan sukar diplatingkan: l Mo : faktor termodinamik dan kinetik(mekanisme rakasi) l W : s. d. a l Al, Mg, Be

PLATING ALLOY Alloy Cu, Sn dan Zn paling populer Keunggulan : sifat fisik, warna, sifat magnetik dan ketahan korosi l Alloy nikel-fosfor : sifat magnetik hebat (untuk teknologi komputer) l Alloy Co-W : > bagus dr “hard-chrom” l

Contoh coating tumbal : COATING SENG 1. Bak Seng Sianida ( Seng=0, 125; Na. OH=0, 445; Na. CN=0, 374; Na 2 CO 3 =0, 096) 2. Bak Sianida Encer (Seng= 0, 08, Na. OH = 0, 65 , Na. CN =0, 27 dan pencerah) 3. Bak Non Sianida (seng=0, 06; Na. OH=0, 65; Na. CN=0, 08 dan pencerah) 4. Bak Klorida netral (seng=0, 77; klorida=100 -165 ; pengkhelat =45 -90%w/v; (satuan % w)

COATING SENG l l l Hidroksida berperan sebagai pembawa arus utama, membantu pelarutan anoda, mengatur daya lontar dan efisiensinya Karbonat berperan menyerap karbon dioksida dr udara atau oksidasi sianidanya Rentang suhu lebar: 20 -65 der. celsius Ketebalan: GS(25 mikron), LS(13 mikron) dan RS (3, 8 mikron) Pasca lakuan : celup-cerahan dlm asam nitrat 1%(1 menit), bromat atau khromat

CONTOH COATING DEK-PROT: 1. COATING TEMBAGA ( Cu) l l Dlm bentuk Cu(I) dan Cu(II) Cu(I) hanya larut dlm bentuk kompleks: sianida, amonia, khlorida dan asetonitril Mudah diplatkan, hindari deposit celup ( tidak melekat dengan baik/membubuk), UNTUK ITU perlu dikomplekskan dengan sianida atau mengurangi aktivitasnya Bagus sebagai lapisan dasar sebelum diplating logam lain

BAK COATING TEMBAGA l l l Tembaga Sulfat ( Cu. SO 4. 5 H 2 O =188 g/l; H 2 SO 4 =74 g/l) Tembaga Fluoroborat ( Cu(BF 4)2 = 224 g/l; HBF 4 = 15 g/l; H 3 BO 3 =15 g/l ). Ini untuk konsentrasi rendah. Untuk kons tinggi 2 x lipat Keduanya termasuk jenis bak asam Agent pencerah : thiourea= 0, 002 -0, 005 g/l Temperatur : 18 - 60 der celsius ( bak asam baik <30 der)

2. COATING NIKEL l l Bersifat feromagnetik, > 353 der. Paramagnetik Nikel dapat digunakan sebagai katalis dlm elektro palting Garam : karbonat, klorida, sulfamat, sulfat dan fluoroborat. Bak plating yang terkenal : WATTS

BAK NIKEL SULFAT WATTS (rapat arus 500 A/m 2, t=60, p. H=3 -4) Nikel sulfat = 0, 46 %berat l Nikel Klorida = 0, 10 l Nikel total sebagai logam = 0, 31 l Asam borat = 0, 13 l Anti pitting ( krn efisiensi < 100%, terbentuk gel hidrogen) l Pencerah : yang mengandung 1. asam sulfonal aromatik, sulfonamida, sulfinat 2. kumarin, formaldehid, olefin l

3. COATING KHROM ( 3, 1 – 15, 5 A/dm 2 pada 45 der ) l l l Mrp finishing plating dek-prot Jarang diplatkan langsung, kec. Plating SS Umumnya ketebalan hanya 1 - 1, 5 mikron Ada 2 jenis Bak : konvensional dengan katalis sulfat, dan katalis tercampur ( katalis dengan kandungan fluorida/fluosilikat) Komposisi bak : asam khromat = 250 g/l dan sulfat 2, 5 g/l

CONTOH COATING REKAYASA 1. COATING PERAK l l l Sifat Ag lunak dan biasanya diperkeras dg Cu Perak dpt membentuk senyawa tak larut dan komplek stabil dengan ligan organik dan anorganik Perak membentuk kompleks halida, sianida, amonia dan thiosulfat. Senyawa tak larutnya umumnya larut dalam larutan yang mengandung pengompleknya Perak bila tidak dikomplekskan, depositnya kasar, butiran besar dan distribusi kurang baik. Perak dalam elektrolit sianida tinggi lebih mulia dari emas dan cenderung mengendap pada aneka logam, sehingga diperlukan larutan “Strike sianida”

LANJUTAN COATING PERAK l l l Sianida kalium lebih baik dari natrium (kond. >) Karbonat dan hidroksil dpt meningkatkan daya hantar, membantu kerja pencerah, menjaga p. H tetap alkali dan menyerap CO 2 dr udara agar tidak bereaksi dg sianida membentuk asam. Untuk meningkatkan daya lontar dibuat kons. perak rendah ( 1, 5 -3, 5 g/l) dan sianidanya tinggi ( 90 g/l) = lar. strike Untuk pengeras/anti aus dpt diberi antimon Anoda yang digunakan harus murni. Dlm lar. strike digunakan anoda SS, dan dlm keadaan tertentu dipakai karbon atau platina.

PASCA LAKUAN COATING PERAK l l l Perak mudah mengalami tarnish dan membentuk sulfida di atmosfer. Selain berwarna gelap juga mengurangi daya solder. Cara menghindari: melapis emas/rhodium atau lakuan passivasi dengan oksida berilium atau kromatisasi atau dg cara pembersihan berkala menggunakan alkali panas seperti: trinatrium fosfat Penggunaan: industri listrik dan elektronika

2. COATING EMAS l l l Sifat emas: mulia, tahan asam, tdk bereaksi dg O 2, S, N 2, Se atau C, tahan alkali hidroksida dan karbonat pd semua suhu, larut dalam aqua regia ( campuan as. nitrat dan as. Klorida), tidak terdapat senyawa emas sederhana Kompleks KAu(CN)2 banyak digunakan Kompleks sianida emas stabil pada p. H asam p. H 3 Senyawa organo-emas membentuk dasar dekoratif, disemprotkan dilapiskan ke keramik, gelas, dll Penerapan : dekoratif dan industri: elektronika , dirgantara dan komunikasi)

JENIS BAK PLATING EMAS Bak alkali : daya lontar baik dan tidak mudah mengalami kodeposisi l Bak netral: p. H netral menjamin tidak terjadi gangguan atas subtrat yang peka/halus , mungkin tjd kodeposisi l Bak asam : tidak merusak substrat, dpt menghasilkan plat emas murni l

BAK SIANIDA- EMAS (I) l l l Baik untuk industri maupun dekoratif Mengandung kompleks [Au(CN)2]- Bak alkali tidak dibufer pada p. H 8, 5 -13 Bak netral dibuffer pada p. H 6 -8, 5 Bak asam pada p. H 3 -6

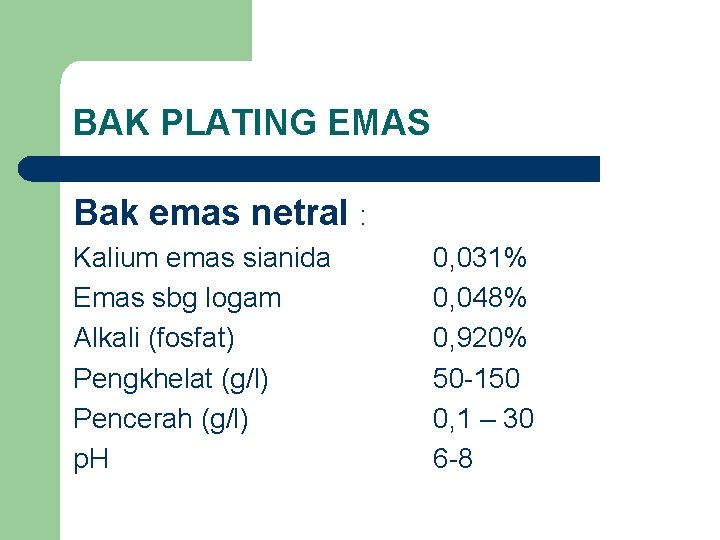
BAK PLATING EMAS Bak emas netral : Kalium emas sianida Emas sbg logam Alkali (fosfat) Pengkhelat (g/l) Pencerah (g/l) p. H 0, 031% 0, 048% 0, 920% 50 -150 0, 1 – 30 6 -8

JENIS ANODA l l l Tergantung atas jenis bak dan pertimbangan ekonomis Anoda emas : mahal, baik untuk bak alkali Anoda platina : mahal, dapat digunakan untuk semua bak Anoda titanium terplatinasi : baik untuk bak asam atau netral Anoda SS : dipakai dlm bak netral dan alkali Anoda karbon : hanya pada bak asam

BAK NON SIANIDA –EMAS (III) l l Emas (III) terkomplekskan dalam larutan sebagai anion, contoh : Au. CI 3 OH- dan juga dpt sebagai kation koordinat empat, contoh dengan piridin, fenantrolin dietilentriamin, dll Bak plating ini lebih ramah lingkungan

LARUTAN STRIKE EMAS l l Ada 2 macam : sianida alkali dan asam Strike asam : p. H pada 3 -7, untuk bahan berbasis plastik, Kandungan logam rendah (0, 5 -4 g/l), suhu 30 -60 der, 4 -12 Volt, anoda Pt/titan lapis Pt/karbon Strike alkali : p. H pada 8 -13, suhu 40 -60 der, 3 -8 Volt, anoda SS Waktu strike : 5 detik – 5 menit

PLATING EMAS DEKORATIF l l l Pemberian warna diatur dengan logam aditif. Warna emas 24 karat (kuning muda) hanya ditambahkan nikel dan tembaga sianida pada bak sianida Warna hijau diberi perak “bayangan” warna hijau diberi kadmium Warna emas antik diberi timbel Ketebalan emas dekoratif cukup 0, 2 mikron, kec. Yang potensi aus, ketebalan bisa 40 mikron

3. COATING PLATINA l l Bak plating logam-logam platina dan kelompok platina agak berbeda dengan logam yang lain, karena sangat mulia dan cenderung membentuk kompleks Konsentrasinya cukup 2 g/l Meskipun mulia tetapi cukup stabil, shg tidak membentuk deposit celup dan langsung dapat digunakan melapisi Cu atau Ni Menggunakan anoda tak larut anodik: Paladium

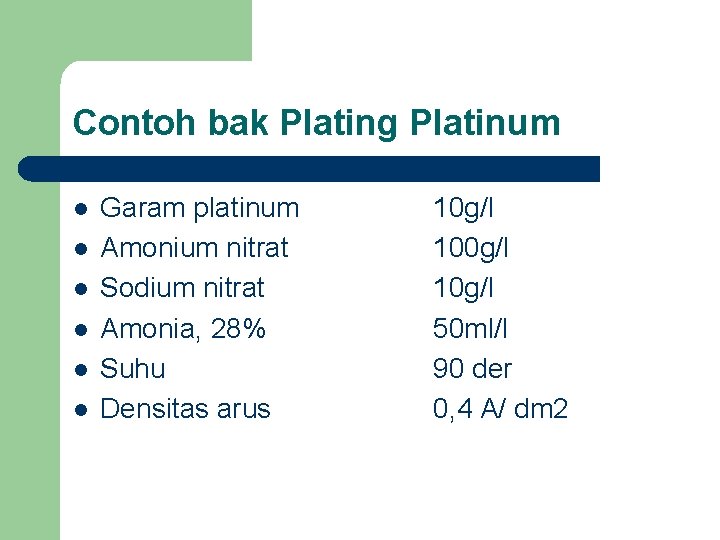
Contoh bak Plating Platinum l l l Garam platinum Amonium nitrat Sodium nitrat Amonia, 28% Suhu Densitas arus 10 g/l 50 ml/l 90 der 0, 4 A/ dm 2

Contoh bak plating platinum Ketebalan 0, 5 mm Garam platinum 40 g/l l Asam sulfamat 80 g/l l Suhu 75 der l Densitas arus 1, 5 A/dm 2 Contoh lain ( ketebalan 0, 25 mikron) l H 2 Pt(NO 2)2 SO 4 5 g/l l Asam sulfat sampai p. H 2 l Suhu 40 der l Densitas arus 0, 5 A/dm 2 l

Coating Pt tanpa listrik l l l Na 2 Pt(OH)6 Na. OH Ethylamin Hidrazin (sbg pereduksi) Suhu 10 g/l sampai p. H 10 10 g/l 0, 1 -1 g/l 30 der

4. COATING ALLOY l l Lebih sulit dari plating logam murni, shg kontrol kondisi kerja sangat penting Syarat : salah satu logamnya dapat dideposisi sendiri dan potensial keduanya sangat berdekatan ( jika tidak hrs didekatkan), kurang lebih selisih sekitar 200 m. V Cara mendekatkan potensial dengan mengkomplekskan Anoda : alloynya, inert atau logam 2 dlm alloy secara bergantian

Jenis alloy yang umum diplatingkan 1. KUNINGAN l Kuningan : Cu (70%) dan Zn (30%) l Kuningan putih : Cu (30%) dan Zn (70%), sebagai pengganti nikel sebelum diplat krom l Komposisi bak plating kuningan : tembaga sianida dan seng sianida, Na. OH dan Na 2 CO 3 dg ion amonium sbg pengontrol warna dan sedikit arsen/Ni untuk pencerah.

2. PERUNGGU ( Cu dan Sn) l Alloy timah mudah diplatkan dari stannat alkali bercampur dengan tembaga sianida l Umumnya mengandung 8 -15 % timah (warna merah sampai kuning emas)

3. TIMAH-NIKEL l l l Biasanya diplatkan pada substrat baja Untuk peningkatan ketahanan korosi baik penggunaan industri maupun di ling. laut Sebelumnya harus diplat tembaga Hasil plating timah-nikel tahan sampai 500 der Jika > 500 der akan terurai menjadi Ni 3 Sn 2 atau Ni 2 Sn 4

4. TIMAH - KOBALT l l l Biasanya juga berisi logam ketiga Dapat menggantikan lapisan krom karena warnanya sama Masih jarang, krn kobalt mahal

REAKSI PADA PROSES PLATING Reaksi pada proses plating : di Anoda : Reaksi Oksidasi di Katoda : Reaksi Reduksi l Reaksi pada proses plating (elektrolisis) pada umumnya tidak sederhana, sangat tergantung pada komposisi bak plating, bahan anoda dan katodanya. l

CONTOH ELEKTROPLATING KROM KOMPOSISI BAK PLATING: l Chrome acid : 200 - 300 g/l l Sulfuric Acid (p. a) : 2 - 3 g/l l Catalyst : 1 – 2 cc/l Catatan : Perbandingan berat Cromic acid dengan Asam sulfat yang paling baik adalah 100/1 Sulfuric Acid yang digunakan adalah sulfuric acid p. a

Kondisi Operasi l l l Suhu Rapat Arus Tegangan : 24 – 48 °C 2 : 2. 5 – 10 Amp/dm : 4 – 12 Volt

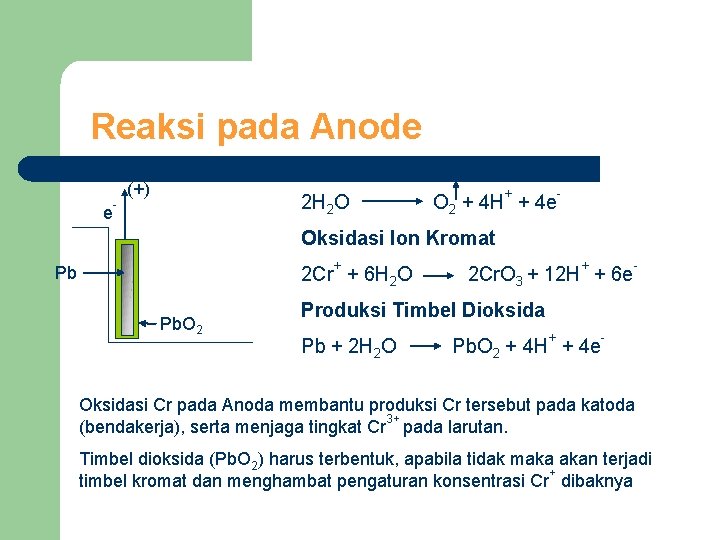
Reaksi pada Anode Pengeluaran Oksigen e - (+) + 2 H 2 O O 2 + 4 H + 4 e - Oksidasi Ion Kromat Pb + Pb. O 2 + 2 Cr + 6 H 2 O 2 Cr. O 3 + 12 H + 6 e - Produksi Timbel Dioksida + Pb + 2 H 2 O Pb. O 2 + 4 H + 4 e - Oksidasi Cr pada Anoda membantu produksi Cr tersebut pada katoda 3+ (bendakerja), serta menjaga tingkat Cr pada larutan. Timbel dioksida (Pb. O 2) harus terbentuk, apabila tidak maka akan terjadi + timbel kromat dan menghambat pengaturan konsentrasi Cr dibaknya

Reaksi di Katoda Reaksi pengendapan (-) 2 - + Cr 2 O 7 + 14 H + 12(e) 2 Cr + 7 H 2 O Cr Pengeluaran Hidrogen +++ + H 2 2 Cr - 2 H + 2 e H 2 Pembentukan Cr (III) 2 - + - Cr 2 O 7 + 14 H + 6 e 2 Cr +++ + 7 H 2 O

PROSES ELEKTROKOAGULASI l l l Proses koagulasi menggunakan arus listrik searah Digunakan sebagai salah satu cara/metoda pengolahan limbah DAN penjernihan air Pengolahan dengan elektrokoagulasi menghasilkan gumpalan padat dan selanjutnya dapat dilanjutkan dengan unit solid separation Tidak perlu menambahkan koagulan Diperlukan bahan anoda yang dapat larut dan membentuk koagulan selama proses

PROSES ELEKTROKOAGULASI l l arus listrik akan menimbulkan reaksi kimia yang membuat kontaminan yang bersuspensi dan teremulsi dalam limbah menjadi tidak stabil. Reaksi kimia yang terjadi tergantung pada jenis elektrode dan limbah yang diolah. ion logam yang berperan sebagai koagulan akan terus – menerus diproduksi di anode. Kation ini akan mendorong terjadinya koagulasi dari polutan yang ter-disperse pada larutan.

Jenis limbah yang diproses l l Limbah tekstil untuk mengurangi zat warna, COD maupun BOD Limbah pabrik kertas Limbah yang mengandung logam berat dll

KONDISI OPERASI l l l Anoda yang umum digunakan : Al dan. Fe ( relatif murah dan mudah didapat) Katoda bisa dari bahan yang sama dg anoda p. H = 8 -10 Densitas arus/ tegangan listrik tgt pada jenis limbah dan perkiraan konsentrasi limbah Konsentrasi elektrolit di dalam limbah tidak bisa terlalu tinggi ( terjadi hub. Pendek)
 Wawancara intelijen
Wawancara intelijen Elektrodeposisi adalah
Elektrodeposisi adalah Pengertian organisasi kepariwisataan regional
Pengertian organisasi kepariwisataan regional Rumus trend parabola
Rumus trend parabola Pada dasarnya ada
Pada dasarnya ada Pada dasarnya struktur
Pada dasarnya struktur Mengajar dan belajar dalam standar proses pendidikan
Mengajar dan belajar dalam standar proses pendidikan Soal uas sistem operasi
Soal uas sistem operasi Proses pada normalisasi yang kedua yaitu
Proses pada normalisasi yang kedua yaitu Manfaat pengolahan data pada komputer
Manfaat pengolahan data pada komputer Manajemen proses sistem operasi
Manajemen proses sistem operasi Proses insipirasi pada pernapasan dada diawali dengan
Proses insipirasi pada pernapasan dada diawali dengan Output data mining
Output data mining Penyepuhan bertujuan untuk
Penyepuhan bertujuan untuk Proses oksidasi biologi pada manusia
Proses oksidasi biologi pada manusia Entropi pencampuran gas ideal
Entropi pencampuran gas ideal Bab 2 reaksi redoks dan elektrokimia
Bab 2 reaksi redoks dan elektrokimia Apakah kelebihan dan kelemahan sel kerja
Apakah kelebihan dan kelemahan sel kerja Proses pembentukan gamet betina pada tumbuhan
Proses pembentukan gamet betina pada tumbuhan Ukuran standar file slax.png adalah
Ukuran standar file slax.png adalah Struktur top level komputer
Struktur top level komputer Pengaturan proses pada sistem operasi
Pengaturan proses pada sistem operasi Contoh komunikasi pada tahap perencanaan
Contoh komunikasi pada tahap perencanaan Contoh titik kritis pada proses produksi dan packing
Contoh titik kritis pada proses produksi dan packing Gametogenesis pada tumbuhan angiospermae
Gametogenesis pada tumbuhan angiospermae Contoh gambar flowchart
Contoh gambar flowchart Contoh soal algoritma penjadwalan proses
Contoh soal algoritma penjadwalan proses Proses pengolahan informasi pada manusia
Proses pengolahan informasi pada manusia Proses termal pada pengolahan pangan
Proses termal pada pengolahan pangan Proses reproduksi terjadi pada waktu perkembangan
Proses reproduksi terjadi pada waktu perkembangan Tujuan produksi pada metode harga pokok proses adalah
Tujuan produksi pada metode harga pokok proses adalah Materi gadar
Materi gadar Pengertian proses pengolahan
Pengertian proses pengolahan Contoh soal kalkulasi biaya proses
Contoh soal kalkulasi biaya proses Menguraikan prinsip-prinsip penyusunan formasi pegawai
Menguraikan prinsip-prinsip penyusunan formasi pegawai Konsep dasar manajemen proses
Konsep dasar manajemen proses Konsep dasar manajemen proses
Konsep dasar manajemen proses Pengertian standar proses
Pengertian standar proses Bisnis proses reengineering
Bisnis proses reengineering Manajemen sebagai proses
Manajemen sebagai proses Harga pokok proses
Harga pokok proses Sumbu koordinat pada java menyatakan titik (0,0) pada
Sumbu koordinat pada java menyatakan titik (0,0) pada Tab untuk membuat grafik adalah
Tab untuk membuat grafik adalah Ada otak simpulan bahasa
Ada otak simpulan bahasa Pada serangga,pertukaran udara di sistem trakea bermuara di
Pada serangga,pertukaran udara di sistem trakea bermuara di Ukuran garis
Ukuran garis The future of human computer interaction
The future of human computer interaction Mulut pada sipuncula terdapat pada bagian
Mulut pada sipuncula terdapat pada bagian Sambungan rel
Sambungan rel Penulisan alamat absolut mutlak yang benar
Penulisan alamat absolut mutlak yang benar Orientasi pada produksi
Orientasi pada produksi Komunikasi pada jaringan komputer dan telepon
Komunikasi pada jaringan komputer dan telepon Arti demokrasi secara etimologi
Arti demokrasi secara etimologi Tuliskan 2 macam pola ragam hias celup
Tuliskan 2 macam pola ragam hias celup Perbedaan antara java swing dan awt adalah
Perbedaan antara java swing dan awt adalah Java tipe sistem
Java tipe sistem Pengertian perubahan primer pada masa pubertas
Pengertian perubahan primer pada masa pubertas Validasi proses terhadap produk yang sudah berjalan adalah
Validasi proses terhadap produk yang sudah berjalan adalah Layout berorientasi produk
Layout berorientasi produk Contoh proses dan thread
Contoh proses dan thread Proses thermoforming
Proses thermoforming Proses pengujian produk
Proses pengujian produk Pengertian sistem dan lingkungan dalam termokimia
Pengertian sistem dan lingkungan dalam termokimia Mesin cetak datar
Mesin cetak datar