TERMOKIMIA I PENGERTIAN 1 SISTEM Sesuatu yang menjadi










![2. Perubahan entalpi penguraian [ ∆Hd ] • Adalah perubahan entalpi pada penguraian 1 2. Perubahan entalpi penguraian [ ∆Hd ] • Adalah perubahan entalpi pada penguraian 1](https://slidetodoc.com/presentation_image/13b0ea40dc699fef8e34e35e804daddd/image-11.jpg)
![3. Perubahan entalpi pembakaran[ ∆Hc] • Adalah perubahan entalpi pada pembakaran 1 mol zat. 3. Perubahan entalpi pembakaran[ ∆Hc] • Adalah perubahan entalpi pada pembakaran 1 mol zat.](https://slidetodoc.com/presentation_image/13b0ea40dc699fef8e34e35e804daddd/image-12.jpg)



- Slides: 15

TERMOKIMIA I. PENGERTIAN 1. SISTEM : Sesuatu yang menjadi pusat perhatian kita dalam hal ini adalah seluruh proses kimia yang terjadi. 2. LINGKUNGAN : Sesuatu diluar sistem. 3. KALOR REAKSI : Besarnya kalor yang menyertai reaksi yaitu bentuk energi yang mengalir dari sistem ke lingkungan atau sebaliknya karena ada perbedaan suhu.

4. ENTALPHI(H) : Jumlah total semua bentuk energi. • Perubahan entalphi (ΔH)terjadi bila sistem melepas atau menyerap kalor. Dalam reaksi : • A + B ( reaktan ) maka : ------- AB ( produk ) ΔH reaksi = Hp - Hr

REAKSI EKSOTERM 1. Reaksi yang membebaskan kalor 2. Suhu sistem > suhu lingkungan 3. Kalor berpindah dari sistem ke lingkungan 4. Disertai kenaikan suhu. 5. Penulisan persamaan reaksinya sbb : reaksi A + B C dibebaskan kalor 10 kj Pers. Reaksi : A + r r ΔH ΔH B = > = C p p Hp kecil = - + + 10 kj - Hr - besar

• • DIAGRAM TINGKAT ENERGI REAKSI EKSOTERM Persamaan reaksi eksoterm A + B C + 10 kj A + B C , ΔH = -10 kj Diagram tingkat energi : ( r >p )

REAKSI ENDOTERM • • • Reaksi yang memerlukan kalor Suhu sistem < suhu lingkungan Kalor berpindah dari lingkungan ke sistem Disertai dengan penurunan suhu. Penulisan persamaan reaksinya sbb: reaksi A + B C diserap kalor 25 kj pers. Reaksi : A + B + 25 kj C A + B C - 25 kj r = p - 25 kj r < p ΔH ΔH = Hp - Hr besar kecil = +

DIAGRAM TINGKAT ENERGI REAKSI ENDOTERM • • Persamaan reaksi endoterm A + B C - 25 kj atau A + B C , ΔH = + 25 KJ Diagram tingkat energi : ( r < p ) 25 C ΔH = 25 kj 0 A + B

JENIS PERUBAHAN ENTALPI 1. Perubahan entalpi pembentukan (ΔHf) 2. Perubahan entalpi penguraian ( ∆Hd ) 3. Perubahan entanpi pembakaran ( ∆Hc) 4. Perubahan entalpi netralisasi ( ∆Hnet) Yang jelas senyawa yang dibentuk, diuraikan dibakar dan reaksi asam basa harus 1 mol

1. Perubahan entalpi pembentukan (ΔHf) adalah perubahan entalpi pembentukan 1 mol senyawa dari unsurnya. [ΔHf beberapa unsur telah ditabelkan. ] Misal : ΔHf ∆Hf ∆Hf CH 3 OH (l) Fe(OH)3 (s) KMn. O 4 (s) CHCl 3 (s) = - 200, 6 kj /mol = - 823 kj / mol = - 837, 2 Kj/mol = - 103, 14 kj/mol Penulisan persamaannya sebagai berikut :

Persamaan termokimianya C(s) +2 H 2(g)+1/2 O 2 CH 3 OH , ΔH=-200 kj • Fe(s)+3/2 O 2(g)+3/2 H 2(g) Fe(OH)3(s) ΔH=-823 kj • K(s) + Mn(s) + 2 O 2(g) KMn. O 4 ∆H = - 837, 2 kj C(s) +1/2 H 2(g) + 3/2 Cl 2(g) , ∆H = - 103, 14 Kj

Tulis persamaan pembentukan 2 mol air dengan membebaskan 136, 6 kkal Persamaan termokimia : 2 H 2(g) + 02 2 H 2 O , ΔH = 136, 6 kkal Kalor reaksi : ………. . . . ΔH reaksi : ……………. . . . . Kalor pembentukan : . . . . pembentukan : ……………. . . . . ΔH
![2 Perubahan entalpi penguraian Hd Adalah perubahan entalpi pada penguraian 1 2. Perubahan entalpi penguraian [ ∆Hd ] • Adalah perubahan entalpi pada penguraian 1](https://slidetodoc.com/presentation_image/13b0ea40dc699fef8e34e35e804daddd/image-11.jpg)
2. Perubahan entalpi penguraian [ ∆Hd ] • Adalah perubahan entalpi pada penguraian 1 mol senyawa menjadi unsurnya. [merupakan kebalikan dari perubahan entalpi pembentukan ] Misal : ∆Hf CO 2 = - 393, 5 kj/mol ∆Hd CO 2 = +393, 5 kj/mol Persamaan termonya : CO 2(g) C(s) +O 2(g) ∆H=393, 5 kj
![3 Perubahan entalpi pembakaran Hc Adalah perubahan entalpi pada pembakaran 1 mol zat 3. Perubahan entalpi pembakaran[ ∆Hc] • Adalah perubahan entalpi pada pembakaran 1 mol zat.](https://slidetodoc.com/presentation_image/13b0ea40dc699fef8e34e35e804daddd/image-12.jpg)
3. Perubahan entalpi pembakaran[ ∆Hc] • Adalah perubahan entalpi pada pembakaran 1 mol zat. Misal : * ∆H pembakaran CH 4 = 112 kkal/mol Persamaan termonya. . . . * Perhatikan persamaan termokimia berikut : 2 H 2(g) + O 2 2 H 2 O ∆H = - 571 kj Tentukan ∆Hc =. . . . .

Latihan soal dulu ah !!! • Buka buku cetakmu , kerjakan * halaman 79 , uji kepahaman no 14 dan 15. * Latihan 2. 1 nomor 10 -12 * Hal. 83 uji kepahaman no 18 -29 * Latihan 2. 2

∆H REAKSI DAPAT DIHITUNG DENGAN BEBERAPA CARA 1. DENGAN ALAT KALORIMETER 2. DENGAN HUKUM HESS 3. DENGAN MENGGUNAKAN DATA ∆Hf ZAT 4. DENGAN DATA ENERGI IKAT.

LANJUTKAN DOWN LOAD FILE LK KALORIMETER - HUKUM HESS DAN ENERGI IKATAN
 Proses endoterm
Proses endoterm Segala sesuatu yang dapat mengalir adalah pengertian dari ?
Segala sesuatu yang dapat mengalir adalah pengertian dari ? Termokimia adalah cabang ilmu yang mempelajari
Termokimia adalah cabang ilmu yang mempelajari Awalan satuan besaran fisika dan teknik
Awalan satuan besaran fisika dan teknik Termokimia adalah
Termokimia adalah Apa yang dimaksud dengan termokimia
Apa yang dimaksud dengan termokimia Termokimia adalah cabang ilmu kimia yang mempelajari
Termokimia adalah cabang ilmu kimia yang mempelajari Sesuatu yang memiliki nilai dan
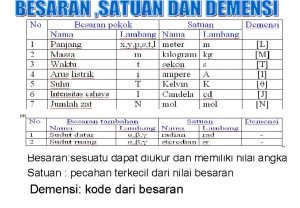
Sesuatu yang memiliki nilai dan Materi adalah sesuatu yang memiliki... .
Materi adalah sesuatu yang memiliki... . Setiap objek atau segala sesuatu yang menempati ruang
Setiap objek atau segala sesuatu yang menempati ruang Gerakan dalam tari dibedakan menjadi dua yaitu
Gerakan dalam tari dibedakan menjadi dua yaitu Zat adalah segala sesuatu yang memiliki
Zat adalah segala sesuatu yang memiliki Kebutuhan adalah segala sesuatu yang
Kebutuhan adalah segala sesuatu yang Benda adalah segala sesuatu yang menempati
Benda adalah segala sesuatu yang menempati Segala sesuatu yang merupakan
Segala sesuatu yang merupakan Menghayal sesuatu yang dapat menimbulkan syahwat
Menghayal sesuatu yang dapat menimbulkan syahwat