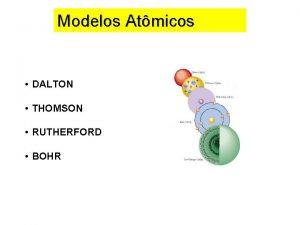
PROFESSOR SOUZA MODELO ATMICO DE DALTON MODELO ATMICO


































- Slides: 77

PROFESSOR SOUZA


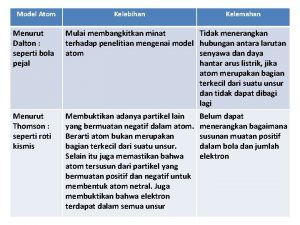
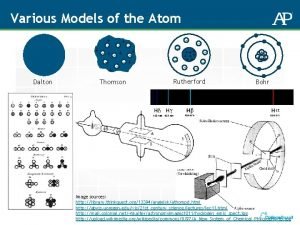
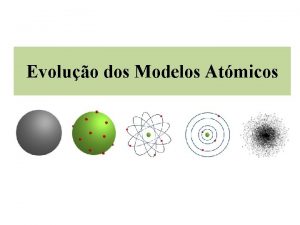
MODELO ATÔMICO DE DALTON

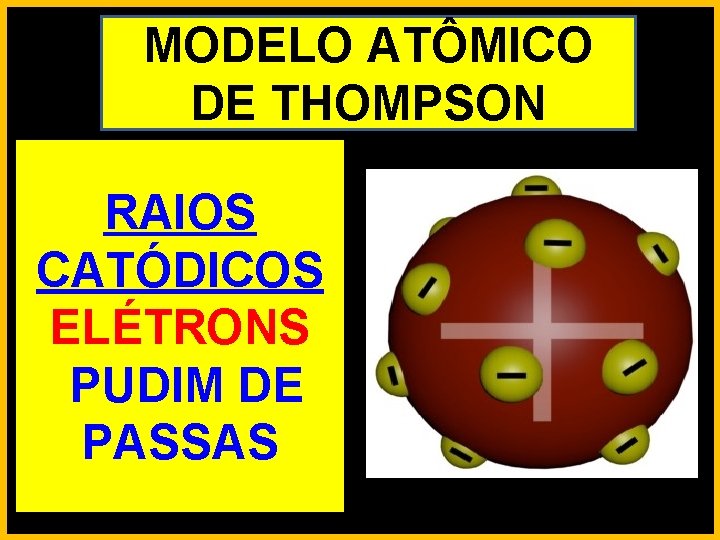
MODELO ATÔMICO DE THOMPSON RAIOS CATÓDICOS ELÉTRONS PUDIM DE PASSAS

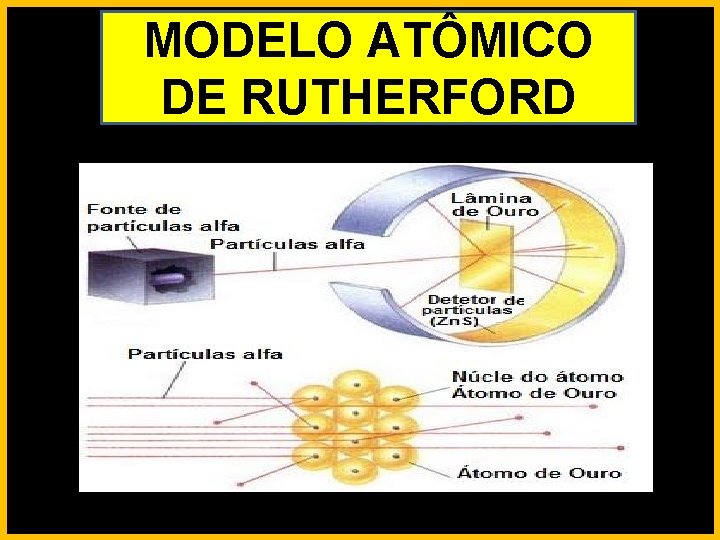
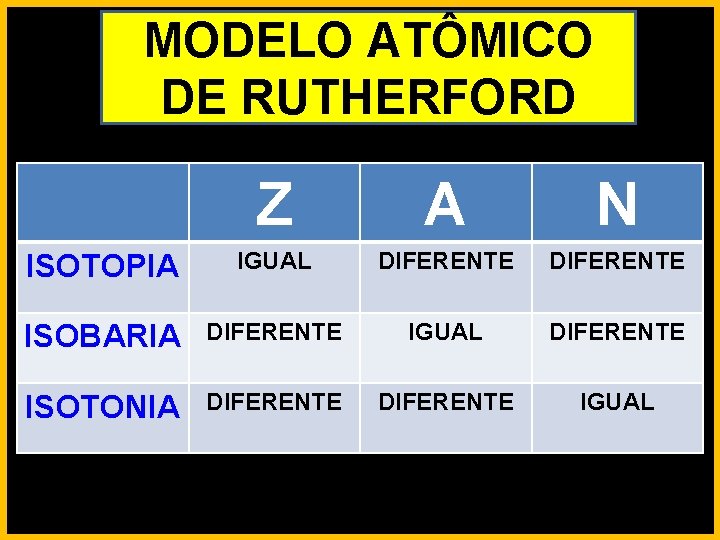
MODELO ATÔMICO DE RUTHERFORD

MODELO ATÔMICO DE RUTHERFORD Z A N ISOTOPIA IGUAL DIFERENTE ISOBARIA DIFERENTE IGUAL DIFERENTE ISOTONIA DIFERENTE IGUAL

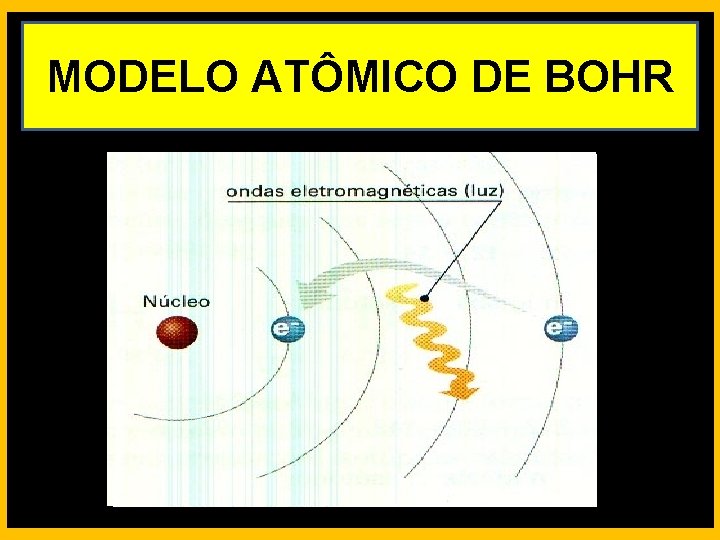
MODELO ATÔMICO DE BOHR

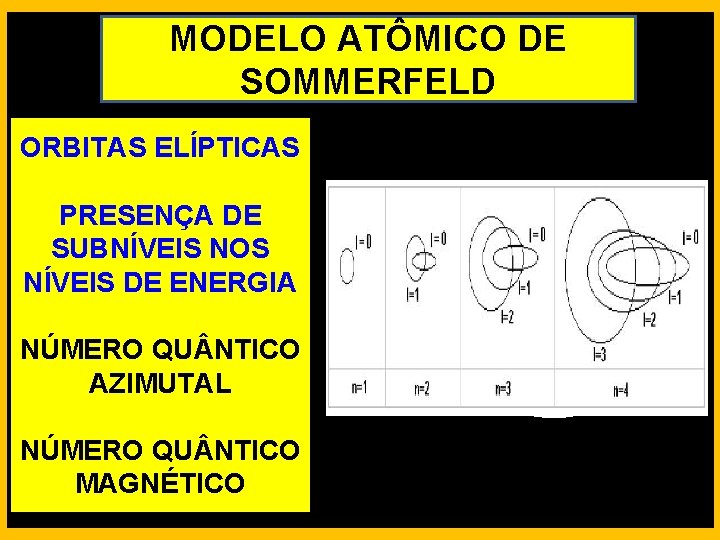
MODELO ATÔMICO DE SOMMERFELD ORBITAS ELÍPTICAS PRESENÇA DE SUBNÍVEIS NOS NÍVEIS DE ENERGIA NÚMERO QU NTICO AZIMUTAL NÚMERO QU NTICO MAGNÉTICO

Princípio da Incerteza de Heisenberg Impossível determinar com precisão a posição e a velocidade de um elétron num mesmo instante.

Princípio da Dualidade da matéria de Louis de Broglie O elétron apresenta característica DUAL (PARTÍCULA – ONDA)

Erwin Schröndinger Orbital é a região onde é mais provável encontrar um elétron.

Princípio da Exclusão de Pauli Em um mesmo átomo, não Em um orbital cabe no se pode haver dois elétrons máximo dois elétrons de com os quatro números spins contrários. quânticos iguais.

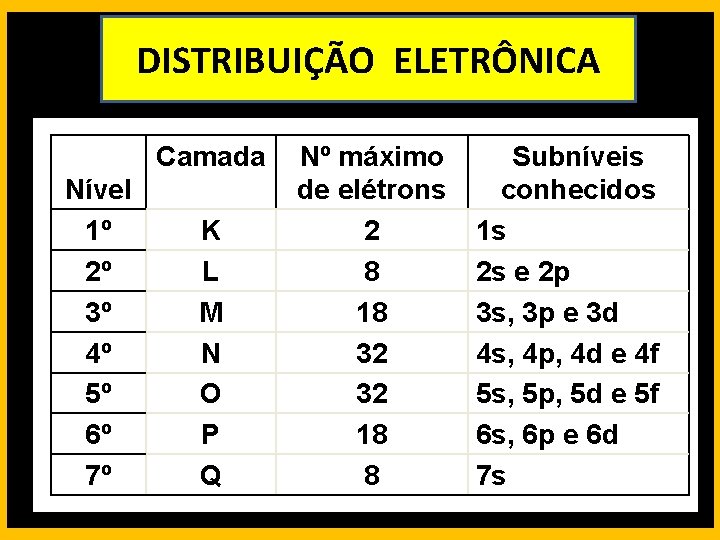
DISTRIBUIÇÃO ELETRÔNICA Camada Nível 1º 2º 3º 4º 5º 6º 7º K L M N O P Q Nº máximo de elétrons 2 8 18 32 32 18 8 Subníveis conhecidos 1 s 2 s e 2 p 3 s, 3 p e 3 d 4 s, 4 p, 4 d e 4 f 5 s, 5 p, 5 d e 5 f 6 s, 6 p e 6 d 7 s

DISTRIBUIÇÃO ELETRÔNICA DE CÁTIONS Fe: 1 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 6 HETEROGÊNEOS Fe 2+: 1 s 2 2 p 6 3 s 2 3 p 6 3 d 6 Fe 3+: 1 s 2 2 p 6 3 s 2 3 p 6 3 d 5 DISTRIBUIÇÃO ELETRÔNICA DE NIONS Cl: 1 s 2 2 p 6 3 s 2 3 p 5 Cl 1 - : 1 s 2 2 p 6 3 s 2 3 p 6

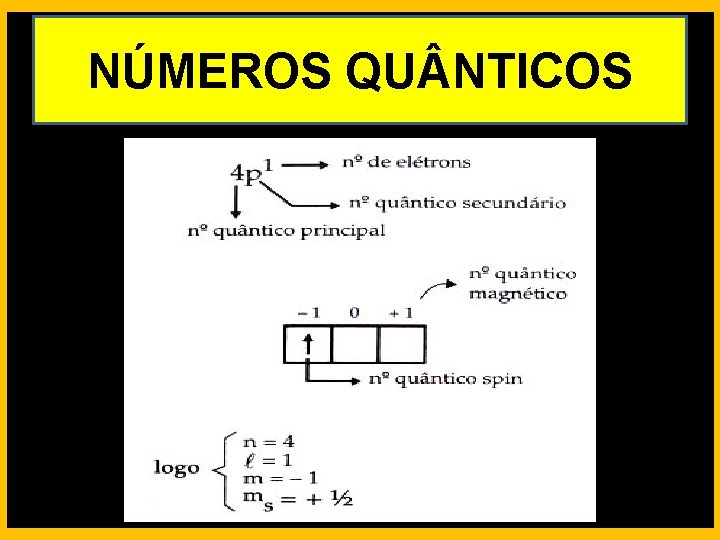
NÚMEROS QU NTICOS


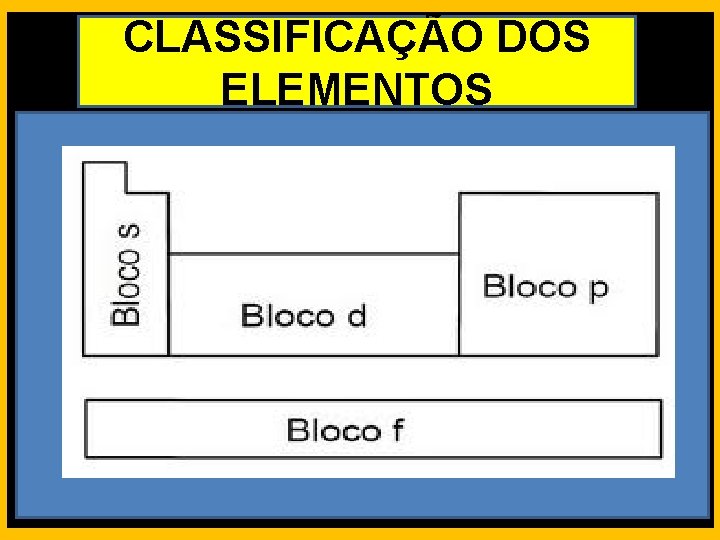
CLASSIFICAÇÃO DOS ELEMENTOS Elementos representativos: Pertencentes aos grupos 1, 2 e dos grupos de 13 a 17. Elementos de transição externa: Pertencentes aos grupos de 3 a 12.

CLASSIFICAÇÃO DOS ELEMENTOS Elementos de transição interna: Pertencentes às séries dos lantanídeos e dos actinídeos. Gases nobres: Pertencentes ao grupo 18.

CLASSIFICAÇÃO DOS ELEMENTOS

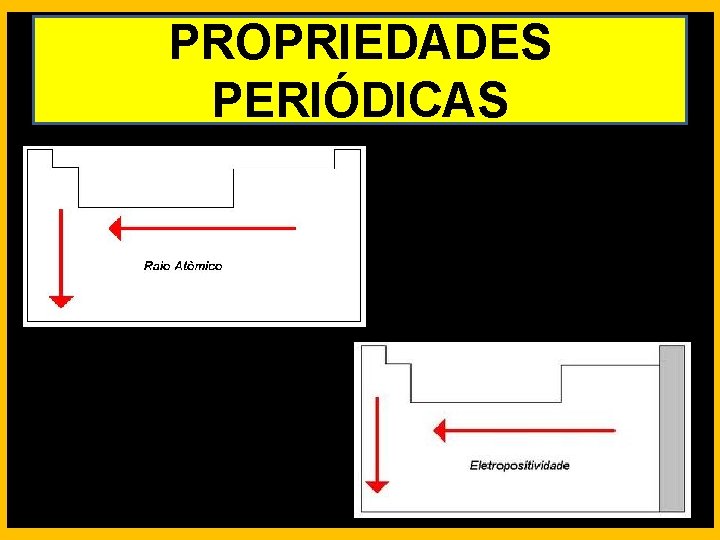
PROPRIEDADES PERIÓDICAS



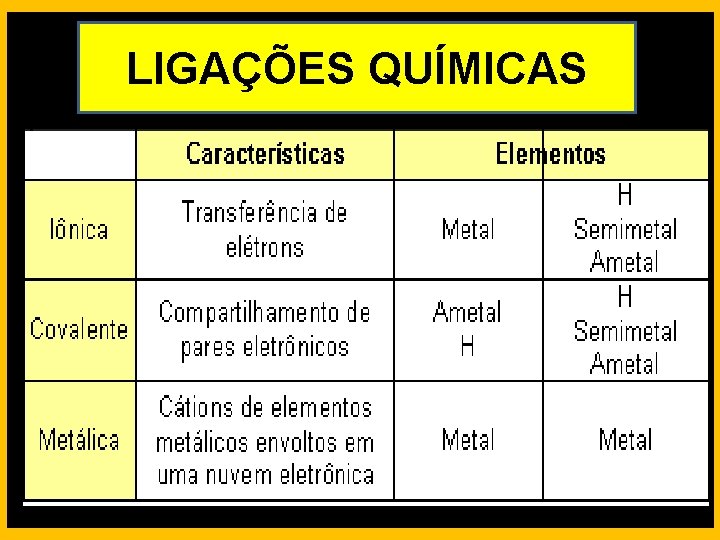
LIGAÇÕES QUÍMICAS

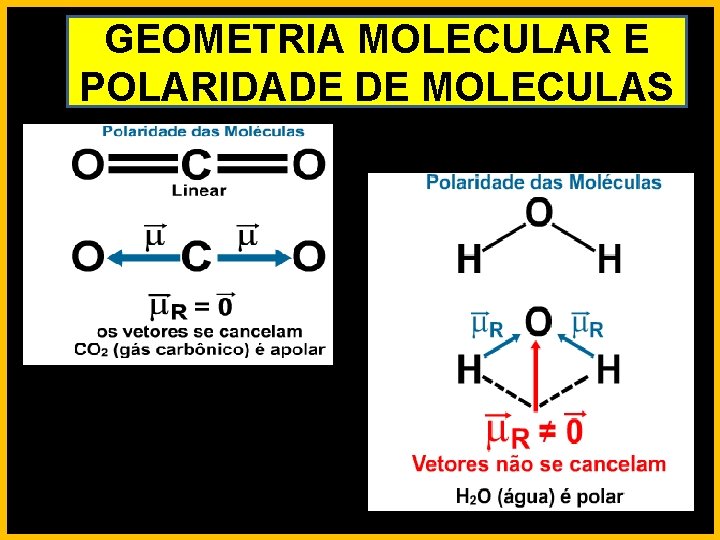
GEOMETRIA MOLECULAR E POLARIDADE DE MOLECULAS



FORÇAS INTERMOLECULARES E PROPRIEDADE FÍSICAS

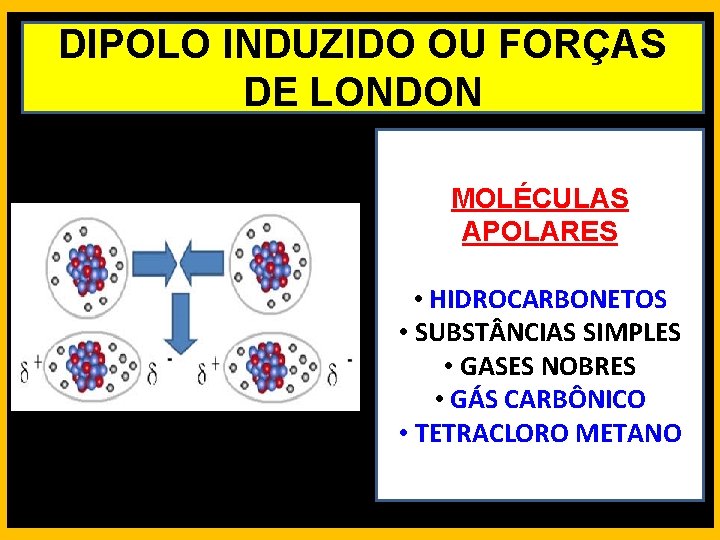
DIPOLO INDUZIDO OU FORÇAS DE LONDON MOLÉCULAS APOLARES • HIDROCARBONETOS • SUBST NCIAS SIMPLES • GASES NOBRES • GÁS CARBÔNICO • TETRACLORO METANO

DIPOLO – DIPOLO OU DIPOLO PERMANETE MOLÉCULAS POLARES • ÉTER (DISCRETO) • ALDEÍDO • CETONA • ÉSTER • HALETOS • AMINA TERCIÁRIA

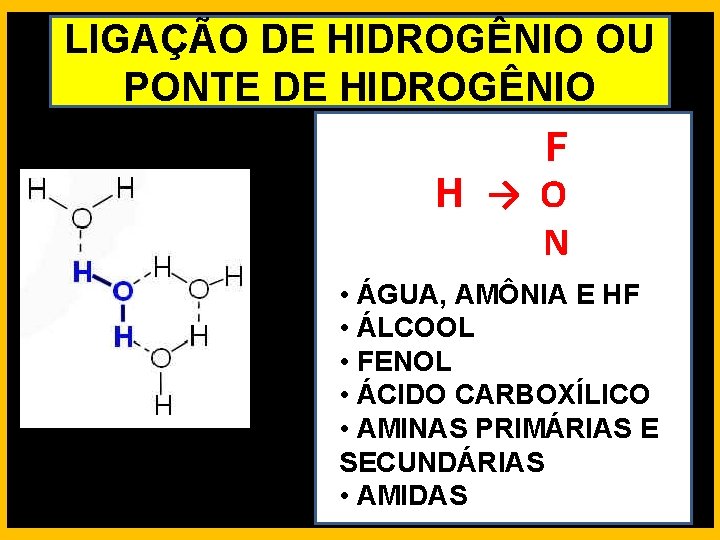
LIGAÇÃO DE HIDROGÊNIO OU PONTE DE HIDROGÊNIO F H → O N • ÁGUA, AMÔNIA E HF • ÁLCOOL • FENOL • ÁCIDO CARBOXÍLICO • AMINAS PRIMÁRIAS E SECUNDÁRIAS • AMIDAS

PONTO DE EBULIÇÃO Éter dimetílico < etanol (VERDADEIRO) propanona < ácido etanóico (VERDADEIRO) naftaleno > benzeno (VERDADIERO) VANDER WAALS < DIPOLO-DIPOLO < PONTES H

SOLUBILIDADE Etanol > n-propanol > n-butanol > n-pentanol > n-hexanol. VERDADEIRO PONTO DE EBULIÇÃO E FUSÃO Etanol > n-propanol > n-butanol > n-pentanol > n-hexanol. FALSO





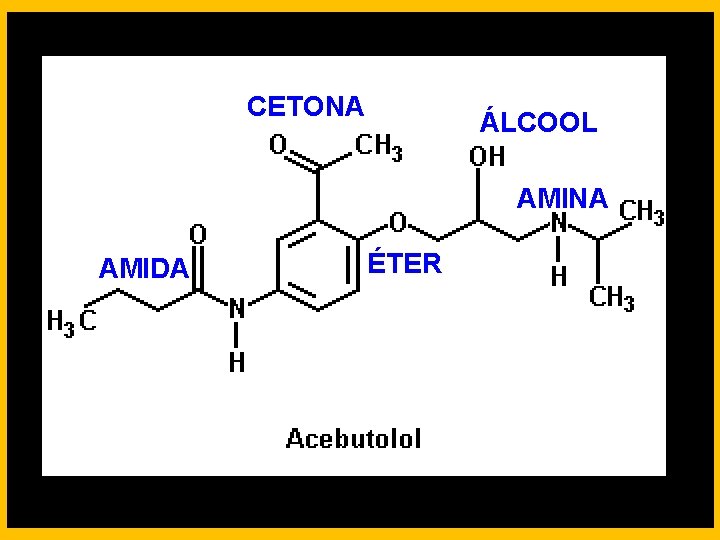
CETONA ÁLCOOL AMINA AMIDA ÉTER

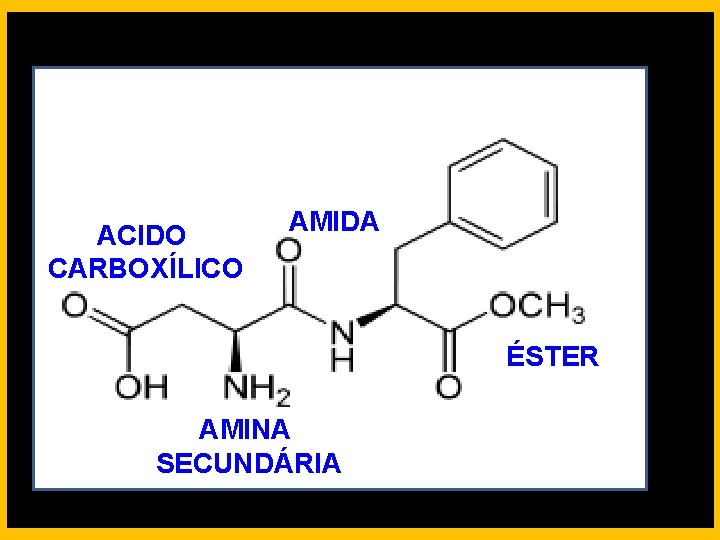
ACIDO CARBOXÍLICO AMIDA ÉSTER AMINA SECUNDÁRIA

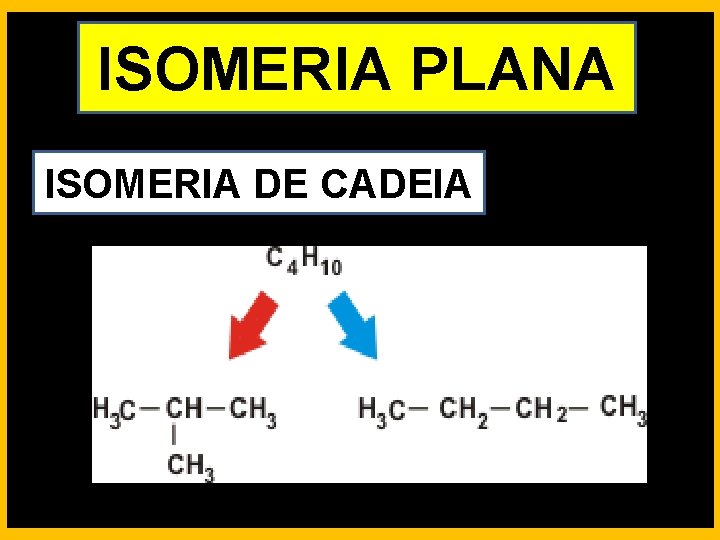
ISOMERIA PLANA ISOMERIA DE CADEIA

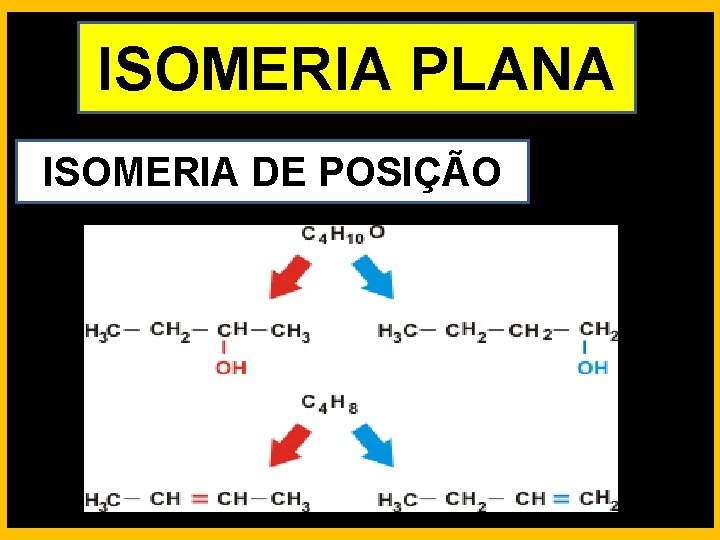
ISOMERIA PLANA ISOMERIA DE POSIÇÃO

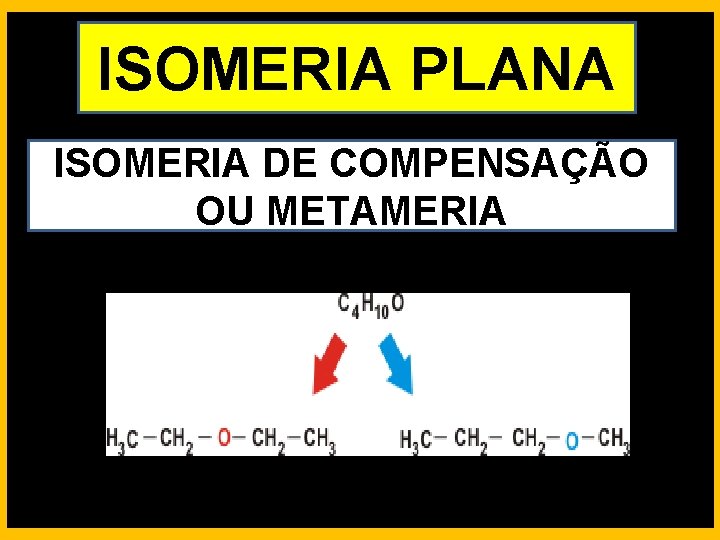
ISOMERIA PLANA ISOMERIA DE COMPENSAÇÃO OU METAMERIA

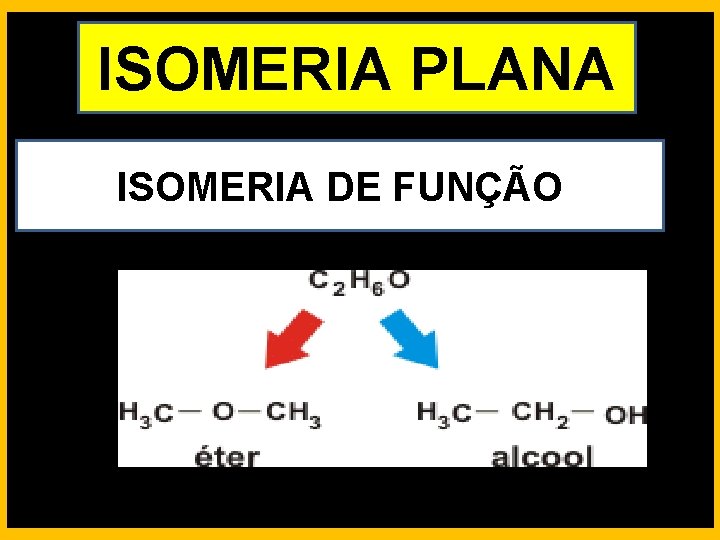
ISOMERIA PLANA ISOMERIA DE FUNÇÃO

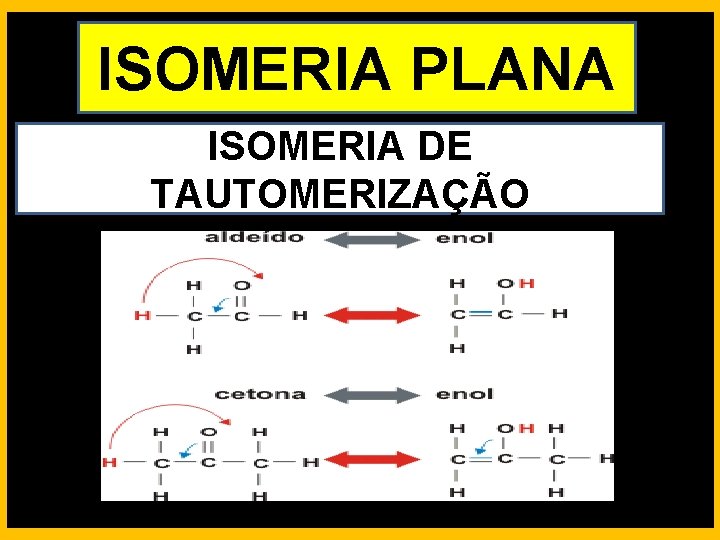
ISOMERIA PLANA ISOMERIA DE TAUTOMERIZAÇÃO

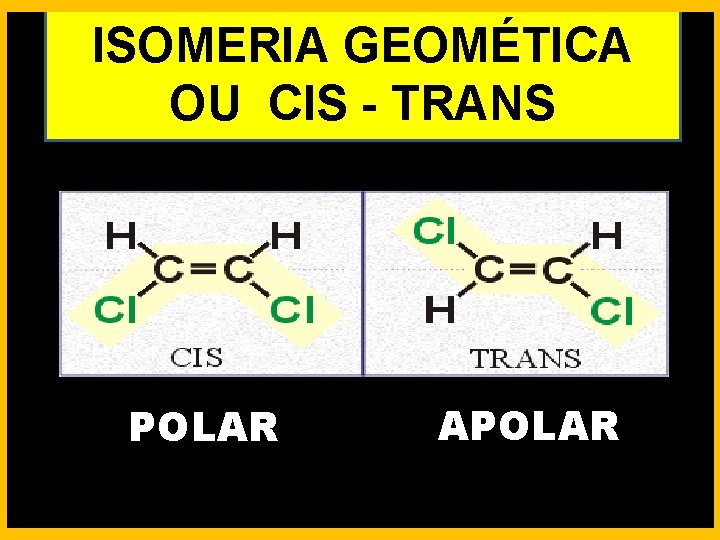
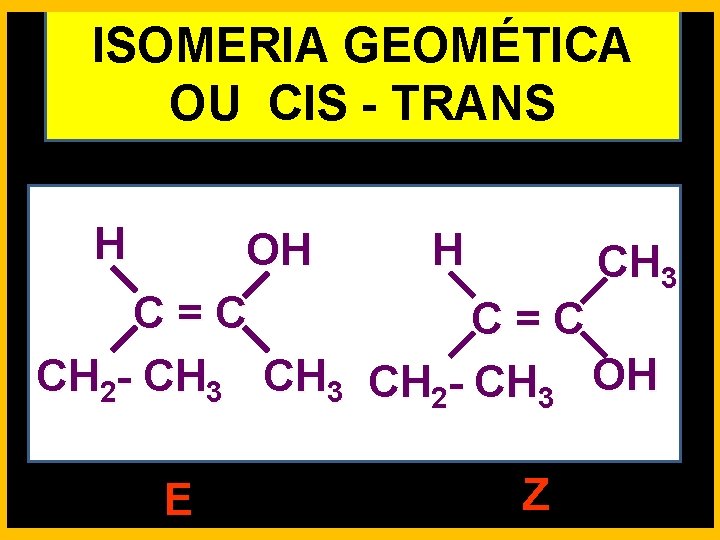
ISOMERIA GEOMÉTICA OU CIS - TRANS POLAR APOLAR

ISOMERIA GEOMÉTICA OU CIS - TRANS H H OH CH 3 C = C CH 2 - CH 3 OH E Z

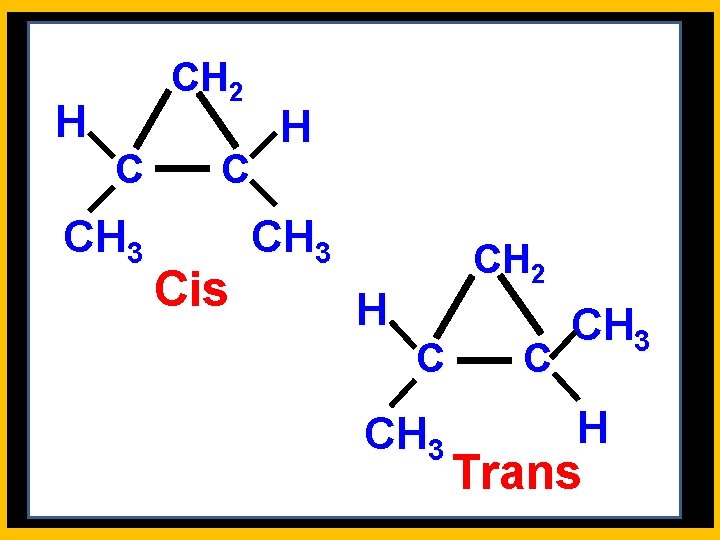
H CH 2 C C CH 3 Cis H CH 3 H CH 2 C C CH 3 H Trans

ISOMERIA ÓPTICA (assimetria molecular)

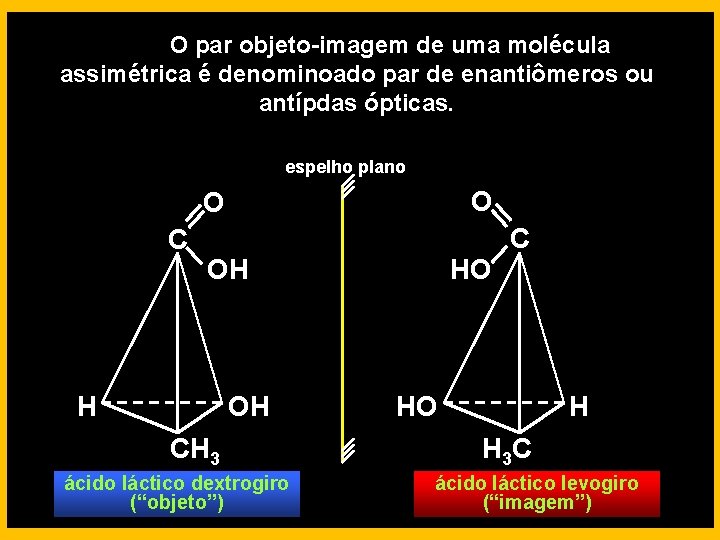
O par objeto-imagem de uma molécula assimétrica é denominoado par de enantiômeros ou antípdas ópticas. espelho plano O O C OH H OH CH 3 ácido láctico dextrogiro (“objeto”) HO C HO H H 3 C ácido láctico levogiro (“imagem”)

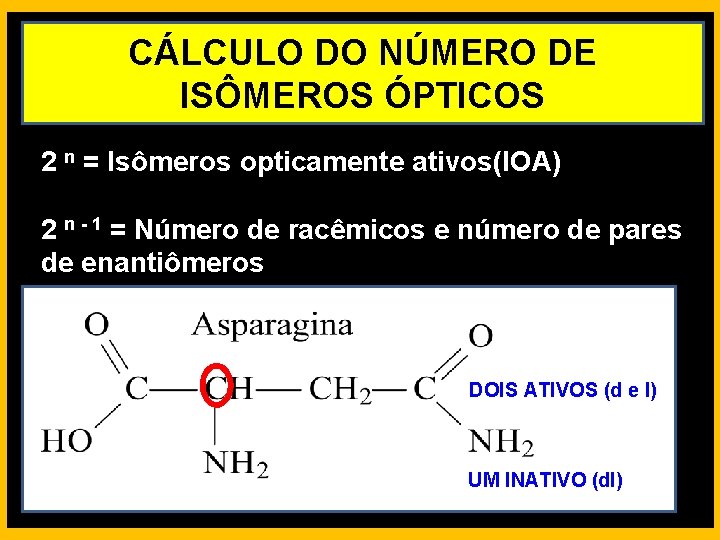
CÁLCULO DO NÚMERO DE ISÔMEROS ÓPTICOS 2 n = Isômeros opticamente ativos(IOA) 2 n - 1 = Número de racêmicos e número de pares de enantiômeros DOIS ATIVOS (d e l) UM INATIVO (dl)

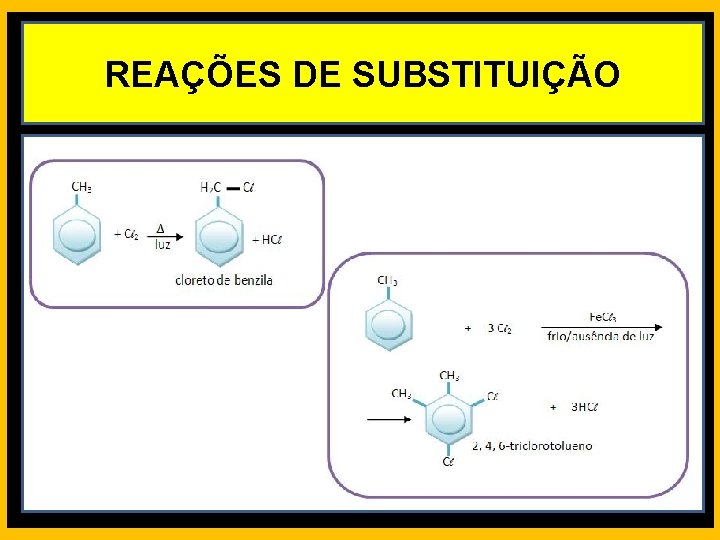
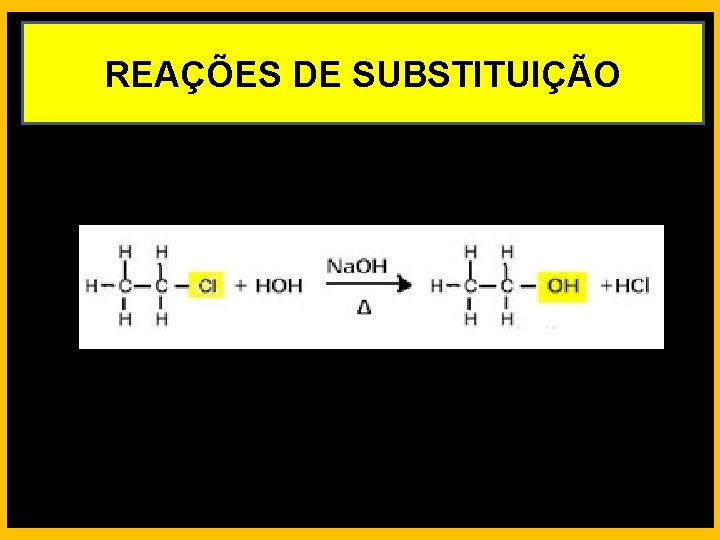
REAÇÕES DE SUBSTITUIÇÃO HALOGENAÇÃO EM ALCANOS

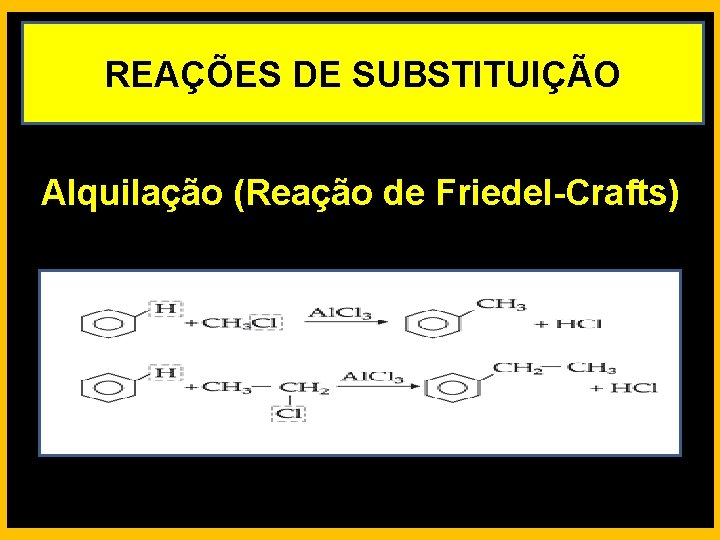
REAÇÕES DE SUBSTITUIÇÃO Alquilação (Reação de Friedel-Crafts)

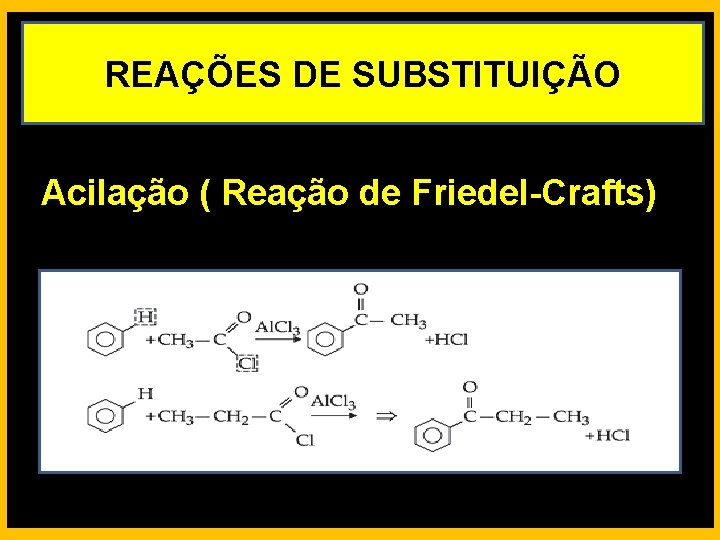
REAÇÕES DE SUBSTITUIÇÃO Acilação ( Reação de Friedel-Crafts)

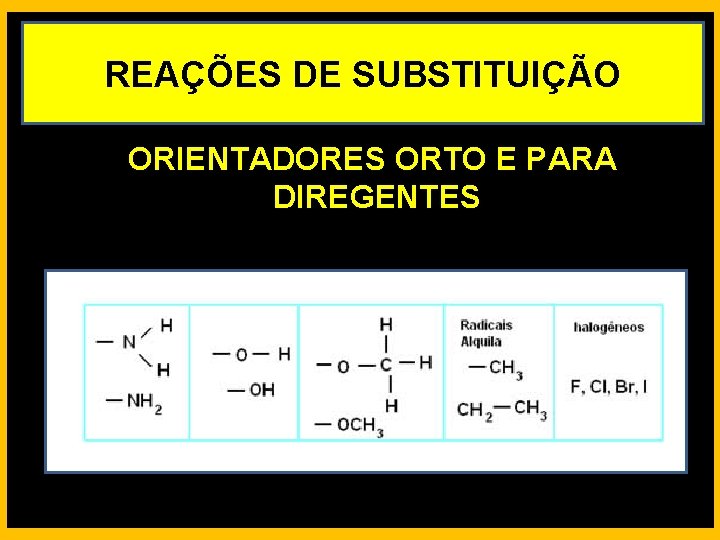
REAÇÕES DE SUBSTITUIÇÃO ORIENTADORES ORTO E PARA DIREGENTES

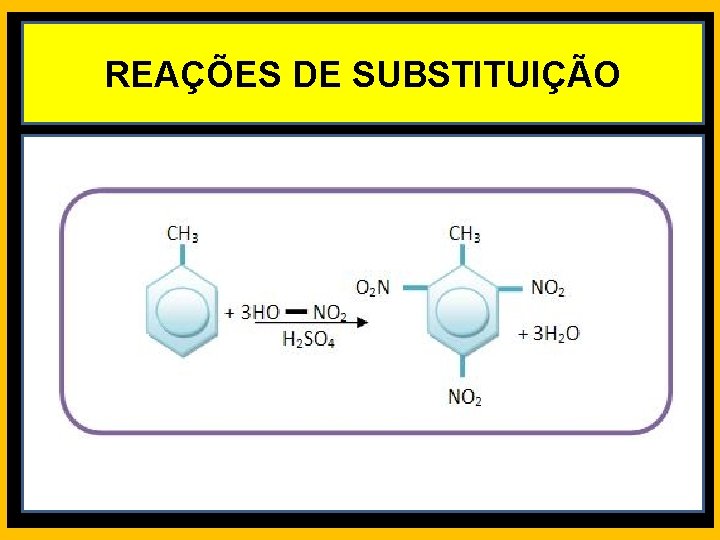
REAÇÕES DE SUBSTITUIÇÃO

REAÇÕES DE SUBSTITUIÇÃO

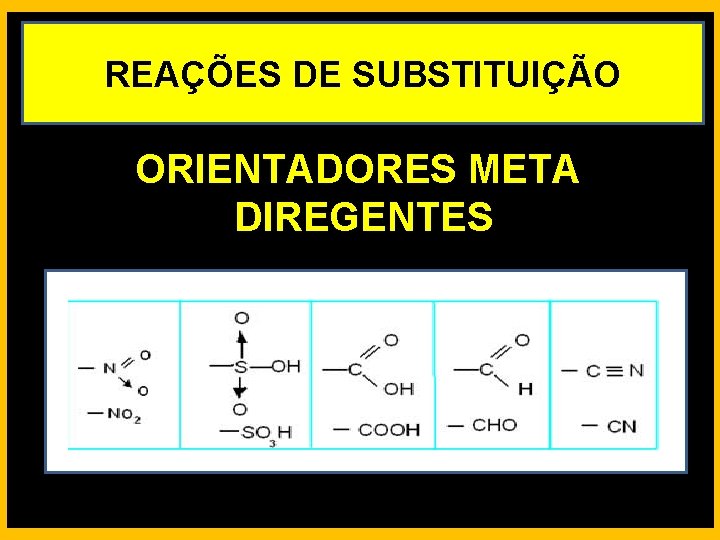
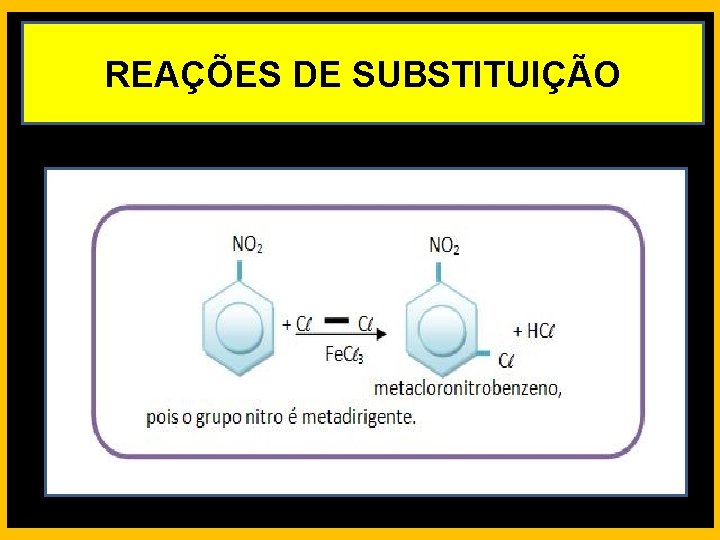
REAÇÕES DE SUBSTITUIÇÃO ORIENTADORES META DIREGENTES

REAÇÕES DE SUBSTITUIÇÃO

REAÇÕES DE SUBSTITUIÇÃO

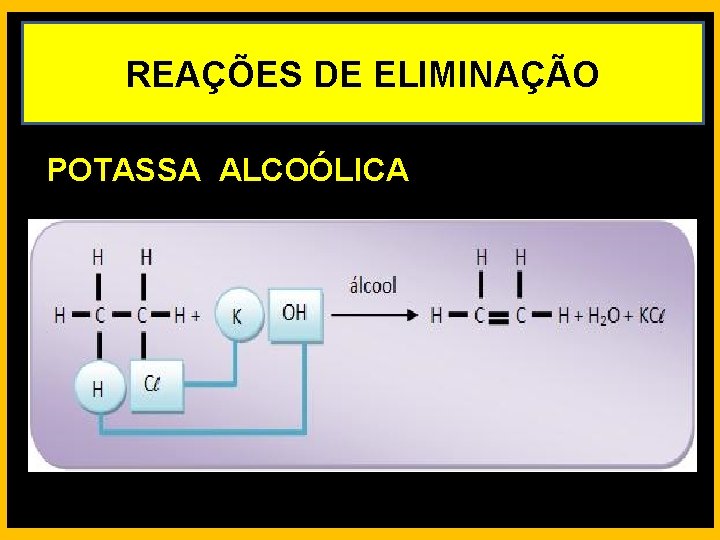
REAÇÕES DE ELIMINAÇÃO POTASSA ALCOÓLICA

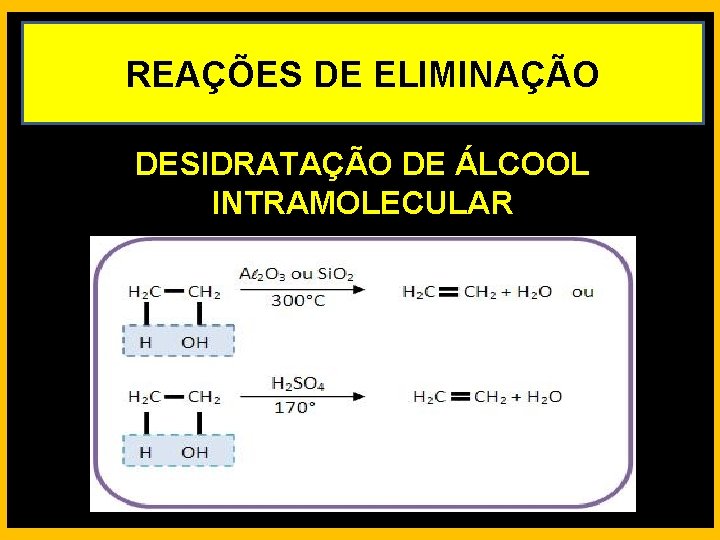
REAÇÕES DE ELIMINAÇÃO DESIDRATAÇÃO DE ÁLCOOL INTRAMOLECULAR

REAÇÕES DE ELIMINAÇÃO DESIDRATAÇÃO INTERMOLECULAR DE ÁLCOOL

REAÇÕES DE ADIÇÃO HIDROALOGENAÇÃO – REGRA DE Markovnikov

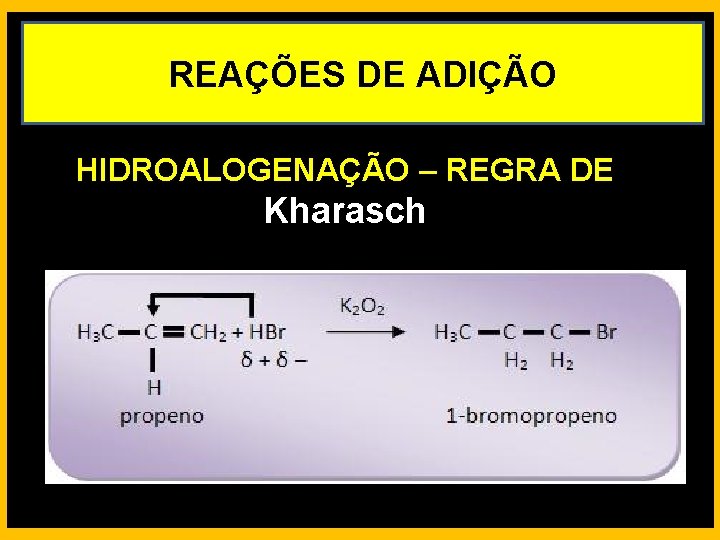
REAÇÕES DE ADIÇÃO HIDROALOGENAÇÃO – REGRA DE Kharasch

REAÇÕES DE ADIÇÃO HIDRÓLISE ÁCIDA DE ALCENOS

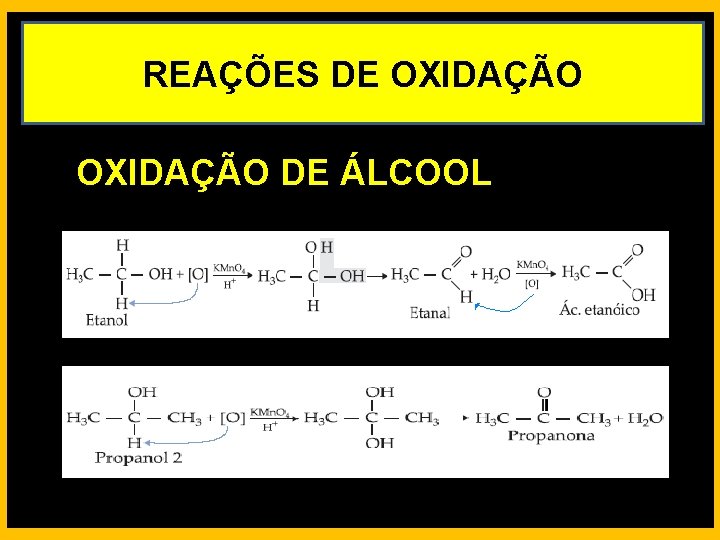
REAÇÕES DE OXIDAÇÃO DE ÁLCOOL

REAÇÕES DE OXIDAÇÃO Oxidação Branda - É conseguida usando-se como oxidante uma solução aquosa diluída, neutra ou levemente alcalina, de permanganato de potássio (KMn. O 4).

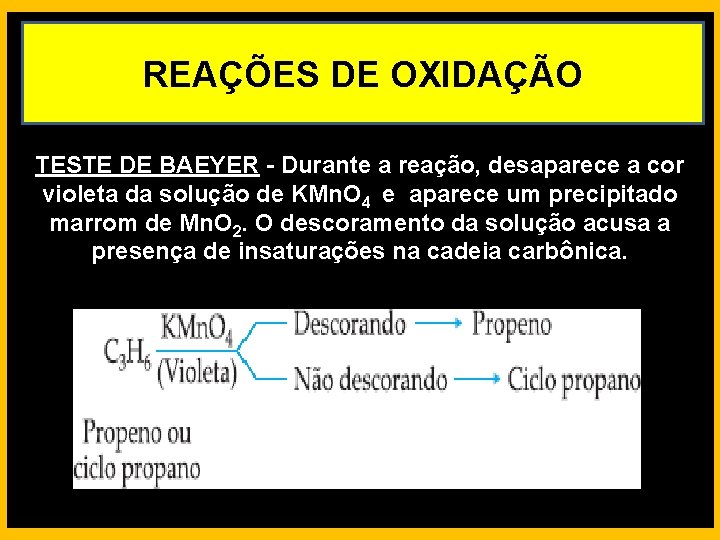
REAÇÕES DE OXIDAÇÃO TESTE DE BAEYER - Durante a reação, desaparece a cor violeta da solução de KMn. O 4 e aparece um precipitado marrom de Mn. O 2. O descoramento da solução acusa a presença de insaturações na cadeia carbônica.

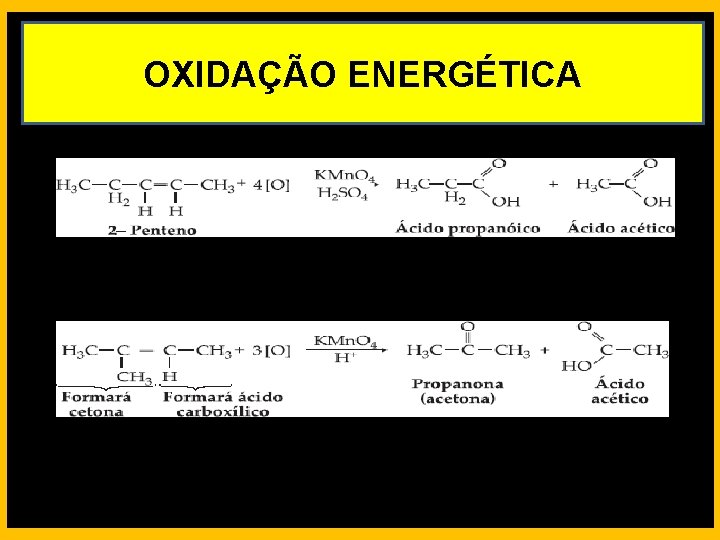
REAÇÕES DE OXIDAÇÃO Oxidação Energética - É conseguida usando-se, como oxidante uma solução aquosa, concentrada, ácida, de permanganato ou dicromato de potássio. Carbono primário produz CO 2 e H 2 O Carbono secundário produz ácido carboxílico Carbono terciário produz cetona

OXIDAÇÃO ENERGÉTICA

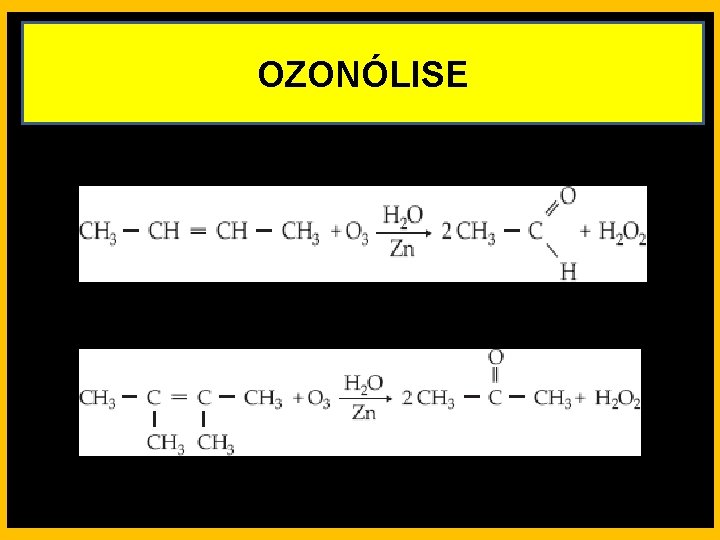
REAÇÕES DE OXIDAÇÃO Ozonólise - É a reação de alcenos com ozônio (O 3), formando ozonetos, seguida por hidrólise desse ozoneto, formando aldeído e/ou cetona e mais peróxido de hidrogênio. • CARBONO PRIMÁRIO OU SECUNDÁRIO DA LIGAÇÃO DUPLA PRODUZ ALDEÍDO • CARBONO TERCIÁRIO PRODUZ CETONA

OZONÓLISE

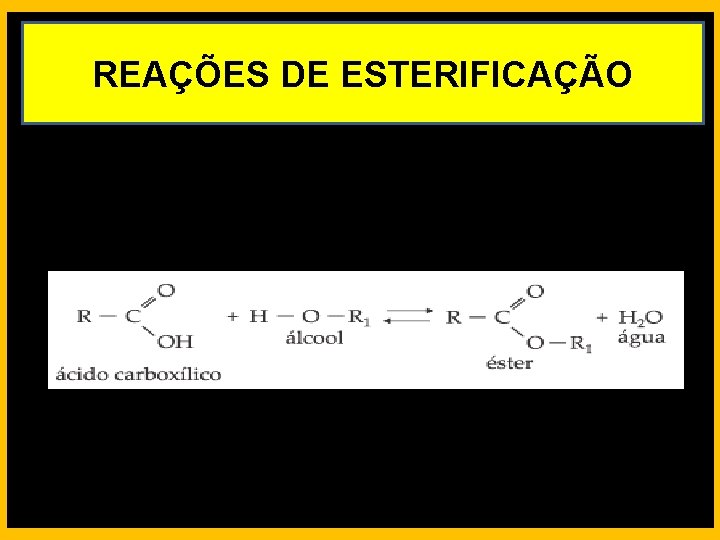
REAÇÕES DE ESTERIFICAÇÃO

AGORA. . . FINALIZANDO. . .

Olha o concorrente. . .


E o nosso aluno ALFA. . .

 Promotion from associate professor to professor
Promotion from associate professor to professor Curiosidades de john dalton
Curiosidades de john dalton Mg modelo de dalton
Mg modelo de dalton Modelo atomico de ernest rutherford
Modelo atomico de ernest rutherford Modelo atomico dalton
Modelo atomico dalton Modelo atomico de dalton
Modelo atomico de dalton Atmica
Atmica Programação linear inteira
Programação linear inteira Dra mirella gastropediatra
Dra mirella gastropediatra Paula souza
Paula souza Caixeiro viajante
Caixeiro viajante Val de souza
Val de souza Marcone jamilson freitas souza
Marcone jamilson freitas souza Social cognitivo
Social cognitivo Mirella gomes de souza
Mirella gomes de souza Elvira souza lima
Elvira souza lima Jonathan d souza
Jonathan d souza Repudio positivista de wundt
Repudio positivista de wundt Irineu de souza francisco
Irineu de souza francisco Mirella gomes de souza
Mirella gomes de souza Paula souza
Paula souza What are the 4 strands of sexuality
What are the 4 strands of sexuality Alfred souza
Alfred souza El comedor paulo souza
El comedor paulo souza Ellen de souza siqueira
Ellen de souza siqueira Marcone jamilson freitas souza
Marcone jamilson freitas souza Edilece souza couto
Edilece souza couto Projeto de pesquisa cronograma
Projeto de pesquisa cronograma Anita d'souza md
Anita d'souza md Souza instrumentos musicais
Souza instrumentos musicais Guido lemos de souza filho
Guido lemos de souza filho Antonio francisco de paula souza
Antonio francisco de paula souza Hansel d'souza
Hansel d'souza Mabel
Mabel Marcone jamilson freitas souza
Marcone jamilson freitas souza Luiz vicente de souza queiroz
Luiz vicente de souza queiroz Atmico
Atmico Como calcular el numero de protones de un elemento
Como calcular el numero de protones de un elemento Atmico
Atmico Es posible predecir la trayectoria exacta del electrón
Es posible predecir la trayectoria exacta del electrón Atmico
Atmico Masa del neutron
Masa del neutron Que es nucleido
Que es nucleido Plano atmico
Plano atmico Atmico
Atmico Que es radio atomico
Que es radio atomico Ndice
Ndice Cadena planetaria
Cadena planetaria Atom dalton
Atom dalton Teoria atomica de dalton
Teoria atomica de dalton Dalton atom modeli
Dalton atom modeli Unit of universal gas constant
Unit of universal gas constant John dalton atomic model drawing
John dalton atomic model drawing Ley de dalton
Ley de dalton Kelebihan atom john dalton
Kelebihan atom john dalton Democritus teori atom
Democritus teori atom Dalton atom modeli
Dalton atom modeli Kugelmodell dalton
Kugelmodell dalton Dalton's gas law
Dalton's gas law Medida dalton
Medida dalton Dalton's law of partial pressure
Dalton's law of partial pressure Pigou condition of maximum social advantage
Pigou condition of maximum social advantage Gacollege 411
Gacollege 411 Dalton atom modeli maketi
Dalton atom modeli maketi Claudette dalton md
Claudette dalton md Dr dalton exley
Dr dalton exley Teori atom dalton
Teori atom dalton Legge di dalton gas
Legge di dalton gas Dalton gmez
Dalton gmez John dalton matter
John dalton matter Antecedentes de dalton
Antecedentes de dalton Household composition letter
Household composition letter Atom models history
Atom models history Dalton cannonball model
Dalton cannonball model Leggi ponderali della chimica
Leggi ponderali della chimica James chadwick
James chadwick Dalton law of partial pressure
Dalton law of partial pressure John dalton billiard ball model
John dalton billiard ball model