TEORI ATOM 1 John Dalton Pendapat John Dalton














- Slides: 19

TEORI ATOM

1. John Dalton Pendapat John Dalton tentang atom adalah: Setiap unsur tersusun atas partikel-partikel kecil yang tidak dapat dibagi lagi yang disebut atom Atom-atom dari unsur yang sama akan mempunyai sifat yang sama, sedangkan atom-atom dari unsur yang berbeda kan mempunyai sifat yang berbeda pula Dalam reaksi kimia tidak ada atom yang hilang, tetapi hanya terjadi perubahan susunan atom-atom dalam zat tersebut

2. J. J. THOMSON - Atom merupakan bola pejal positif yang didalamnya tersebar elektron bermuatan negatif

3. RUTHERFORD Atom terdiri dari inti atom yang snagat kecil dan bermuatan positif, dikelilingi elektron negatif pada jarak yang sangat jauh. elektron tidak tertarik ke inti karena gaya tarik inti dilawan oleh gaya sentrifugal dari elektron yang bergerak melingkar.

NIELS BOHR Selama mengelilingi inti atom, elektron tidak kehilangan energi dan berada pada tingkat-tingkat energi tertentu yang disebut orbit atau kulit elektron.

MODEL ATOM MODERN (MEKANIKA GELOMBANG) Elektron tidak dapat dipastikan tempatnya, hanya dapat ditentukan kemungkinan terbesar elektron berada.

PARTIKEL-PARTIKEL DASAR PENYUSUN ATOM: partikel massa ELEKTRON 9, 1100 X 10 -28 massa relatif muatan (coulomb) muatan relatif 0 - 1, 6 X 10 -19 -1 PROTON 1, 6726 X 10 -24 1 + 1, 6 X 10 -19 +1 NEUTRON 1, 6750 X 10 -24 1 0 0

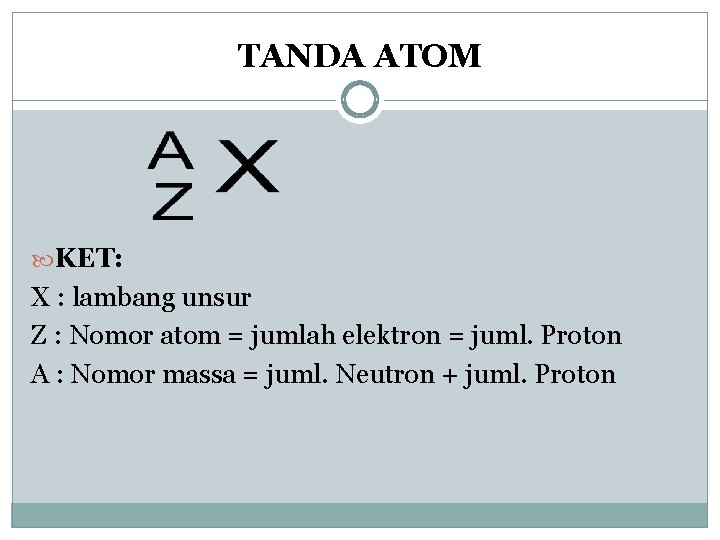
TANDA ATOM KET: X : lambang unsur Z : Nomor atom = jumlah elektron = juml. Proton A : Nomor massa = juml. Neutron + juml. Proton

LATIHAN Jawablah pertanyaan di bawah ini dengan tepat 1. Jelaskan teori atom menurut: a. John Dalton b. JJ. Thomson c. Rutherford d. Niels Bohr e. Mekanika gelombang 2. Sebutkan nama, muatan serta massa partikel dasar penyusun atom

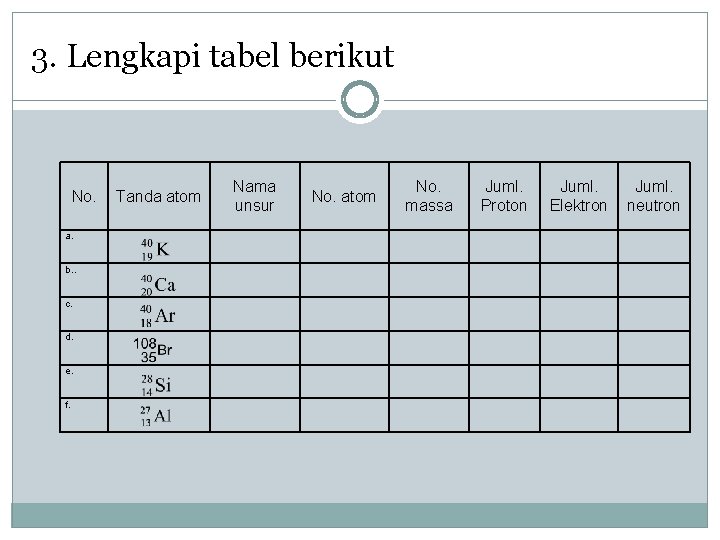
3. Lengkapi tabel berikut No. a. b. . c. d. e. f. Tanda atom Nama unsur No. atom No. massa Juml. Proton Juml. Elektron Juml. neutron

ISOTOP, ISOBAR DAN ISOTON 1). ISOTOP Adalah atom-atom dari unsur yang sama (mempunyai nomor atom yang sama) tetapi berbeda nomor massanya.

2). ISOBAR Adalah atom-atom dari unsur yang berbeda (mempunyai nomor atom berbeda) tetapi mempunyai nomor massa yang sama

3). ISOTON Adalah atom-atom dari unsur yang berbeda (mempunyai nomor atom berbeda) tetapi mempunyai jumlah neutron yang sama. Contoh : dengan

KONFIGURASI ELEKTRON Persebaran elektron dalam kulit-kulit atomnya ü Kulit atom yang pertama (yang paling dekat dengan inti) diberi lambang K, kulit ke-2 diberi lambang L dst. ü Jumlah maksimum elektron pada setiap kulit memenuhi rumus 2 n 2 (n = nomor kulit). Contoh :

Kulit K (n = 1) maksimum 2 x 12 = 2 elektron Kulit L (n = 2) maksimum 2 x 22 = 8 elektron Kulit M (n = 3) maksimum 2 x 32 = 18 elektron Kulit N (n = 4) maksimum 2 x 42 = 32 elektron Kulit O (n = 5) maksimum 2 x 52 = 50 elektron Catatan : Meskipun kulit O, P dan Q dapat menampung lebih dari 32 elektron, namun kenyataannya kulit-kulit tersebut belum pernah terisi penuh.

Jumlah maksimum elektron pada kulit terluar (elektron valensi) adalah 8. Elektron valensi berperan pada pembentukan ikatan antar atom dalam membentuk suatu senyawa. Sifat kimia suatu unsur ditentukan juga oleh elektron valensinya. Oleh karena itu, unsur-unsur yang memiliki elektron valensi sama, akan memiliki sifat kimia yang mirip.

Contoh: Tentukan konfigurasi elektron unsur berikut: 18 Na Jawab: 18 Na K L M JUML. KULIT ELEKTRON VALENSI 2 8 8 3 8

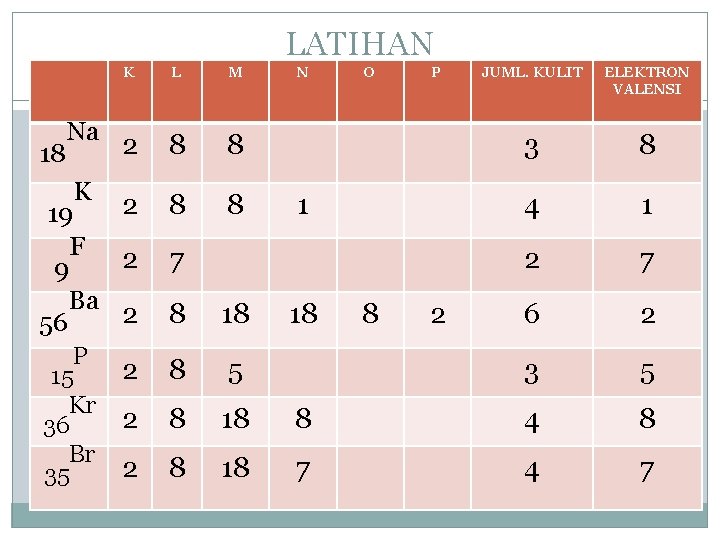
LATIHAN K L M 2 8 8 2 19 F 2 9 Ba 2 56 8 8 18 Na K P 15 Kr 36 Br 35 N O P 1 7 18 8 2 JUML. KULIT ELEKTRON VALENSI 3 8 4 1 2 7 6 2 3 5 8 18 2 8 5 2 8 18 8 4 8 2 8 18 7 4 7
