1 1 Modelo atmico 1 1 Modelo atmico











- Slides: 19

1. 1 Modelo atómico

1. 1 Modelo atómico História do modelo atómico Modelo atómico de Dalton No início do seculo XIX, o físico inglês John Dalton ainda imaginava os átomos como corpúsculos indivisíveis e indestrutíveis. 1766 - 1844 Modelo atómico de Thomson O físico inglês Joseph Thomson explicou que os átomos eram constituídos por uma massa positiva onde se encontravam dispersos os eletrões, com carga negativa e em número suficiente para a carga global ser nula. 1856 -1940 2

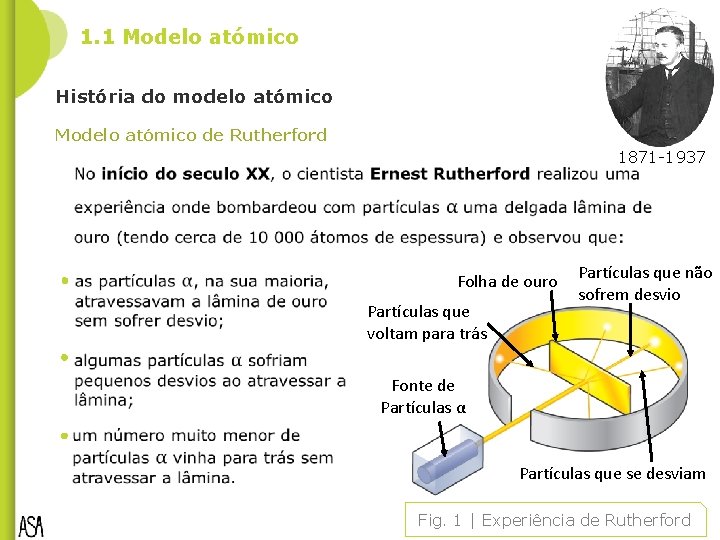
1. 1 Modelo atómico História do modelo atómico Modelo atómico de Rutherford 1871 -1937 Folha de ouro Partículas que voltam para trás Partículas que não sofrem desvio Fonte de Partículas α Partículas que se desviam Fig. 1 | Experiência de Rutherford

1. 1 Modelo atómico de Rutherford História do modelo atómico As partículas α atravessavam a lâmina sem se desviarem. As partículas α eram desviadas devido a repulsão. Se chocavam frontalmente com ela, voltavam mesmo para trás. A maior parte do átomo seria espaço vazio A existência de uma zona central muito pequena, com carga positiva, onde estaria concentrada toda a sua massa Isto levou Rutherford a imaginar os átomos constituídos por: um núcleo muito pequeno, com carga positiva, onde se concentra toda a massa do átomo; eletrões, com carga negativa, movendo-se em volta do núcleo, tal como os planetas se movem em volta do Sol. Primeiro modelo nuclear de átomo. Núcleo 4

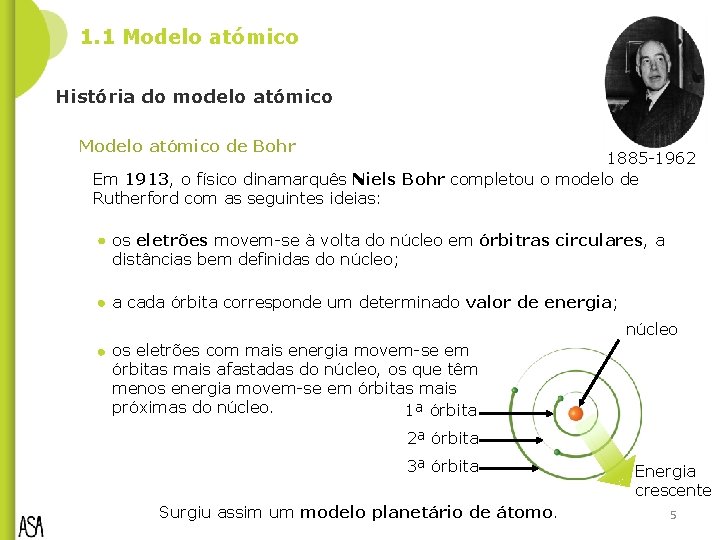
1. 1 Modelo atómico História do modelo atómico Modelo atómico de Bohr 1885 -1962 Em 1913, o físico dinamarquês Niels Bohr completou o modelo de Rutherford com as seguintes ideias: os eletrões movem-se à volta do núcleo em órbitras circulares, a distâncias bem definidas do núcleo; a cada órbita corresponde um determinado valor de energia; núcleo os eletrões com mais energia movem-se em órbitas mais afastadas do núcleo, os que têm menos energia movem-se em órbitas mais próximas do núcleo. 1ª órbita 2ª órbita 3ª órbita Surgiu assim um modelo planetário de átomo. Energia crescente 5

1. 1 Modelo atómico História do modelo atómico Modelo da nuvem eletrónica Modelo aceite atualmente Os eletrões dos átomos movem-se sem órbitas definidas e com velocidade elevadíssima. Por isso, não é possível dizer onde estão os eletrões num certo instante. Apenas se pode falar na probabilidade de os encontrar à volta do núcleo. A zona de grande probabilidade de encontrar os eletrões chama-se nuvem eletrónica. Núcleo Nuvem eletrónica 6

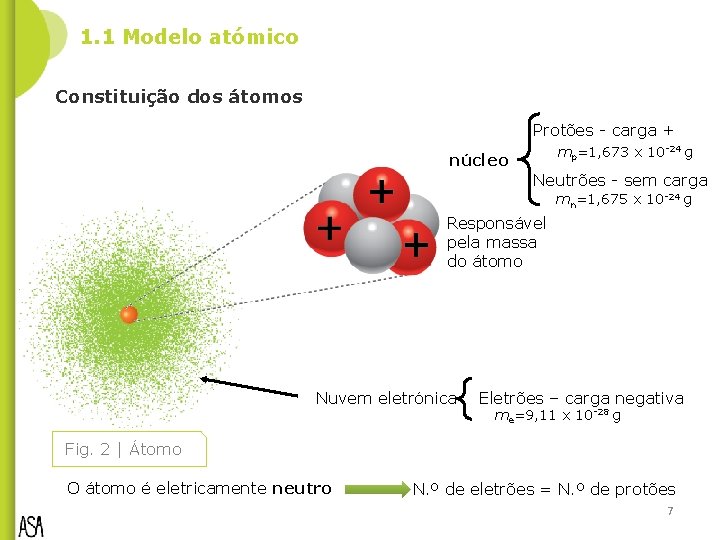
1. 1 Modelo atómico Constituição dos átomos Protões - carga + mp=1, 673 x 10 -24 g núcleo Neutrões - sem carga mn=1, 675 x 10 -24 g Responsável pela massa do átomo Nuvem eletrónica Eletrões – carga negativa me=9, 11 x 10 -28 g Fig. 2 | Átomo O átomo é eletricamente neutro N. º de eletrões = N. º de protões 7

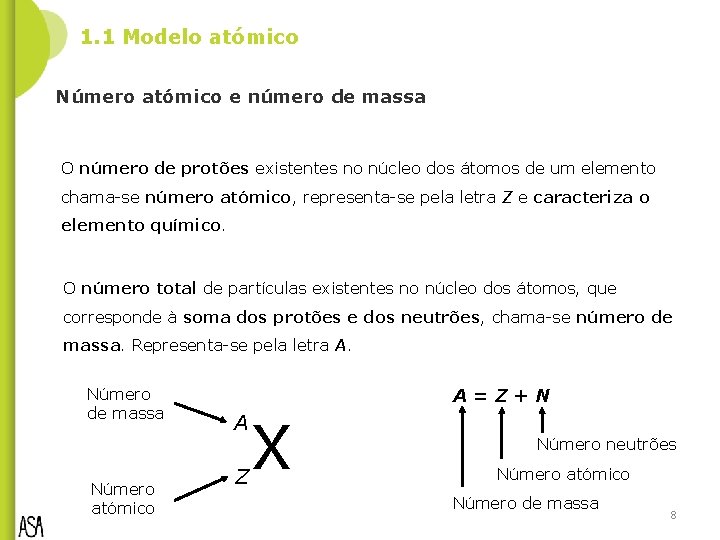
1. 1 Modelo atómico Número atómico e número de massa O número de protões existentes no núcleo dos átomos de um elemento chama-se número atómico, representa-se pela letra Z e caracteriza o elemento químico. O número total de partículas existentes no núcleo dos átomos, que corresponde à soma dos protões e dos neutrões, chama-se número de massa. Representa-se pela letra A. Número de massa Número atómico A=Z+N A Z X Número neutrões Número atómico Número de massa 8

1. 1 Modelo atómico Isótopo de um elemento Os isótopos de um elemento têm: o mesmo número atómico Z; diferente número de massa A, pois o número de neutrões N é diferente. Cloro-37 Cloro-35 35 17 37 Cℓ 17 17 protões 18 Neutrões 17 eletrões Cℓ 17 protões 20 Neutrões 17 eletrões 9

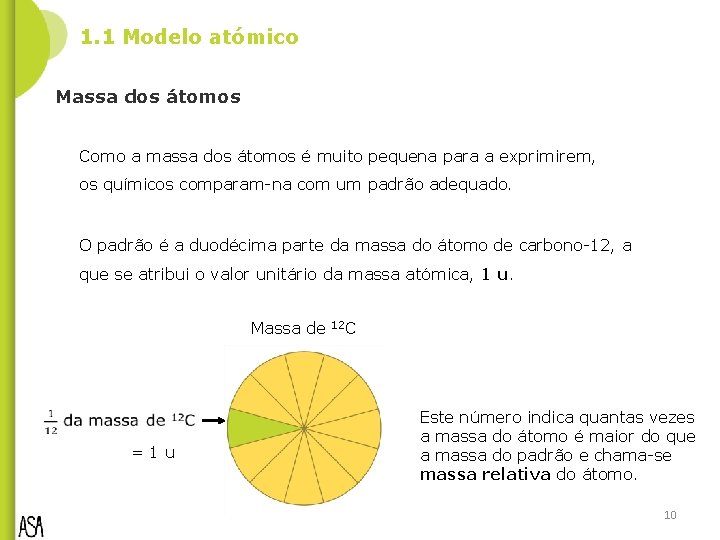
1. 1 Modelo atómico Massa dos átomos Como a massa dos átomos é muito pequena para a exprimirem, os químicos comparam-na com um padrão adequado. O padrão é a duodécima parte da massa do átomo de carbono-12, a que se atribui o valor unitário da massa atómica, 1 u. Massa de =1 u 12 C Este número indica quantas vezes a massa do átomo é maior do que a massa do padrão e chama-se massa relativa do átomo. 10

1. 1 Modelo atómico Massa atómica relativa dos elementos Quando um elemento tem isótopos, a massa atómica relativa, Ar do elemento corresponde a uma média das massas relativas dos seus isótopos, que tem em conta as suas abundâncias na Natureza. Isótopo Massa isotópica relativa Abundância (%) 14, 003 99, 3 15, 000 0, 7 11

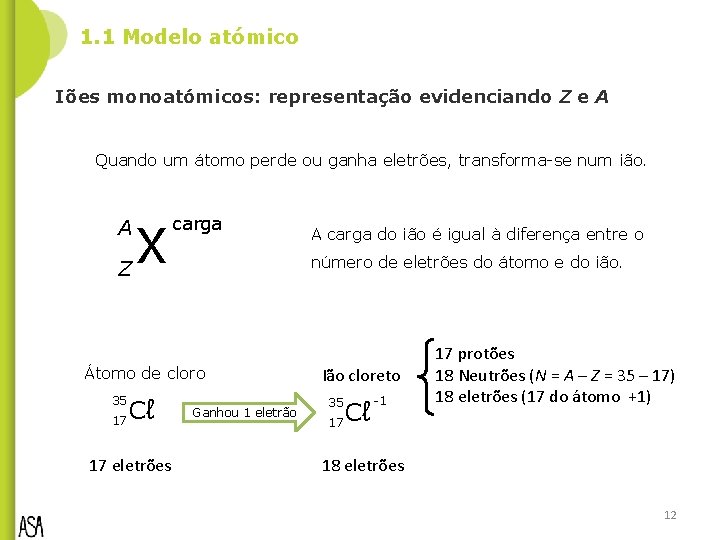
1. 1 Modelo atómico Iões monoatómicos: representação evidenciando Z e A Quando um átomo perde ou ganha eletrões, transforma-se num ião. X Z A carga número de eletrões do átomo e do ião. Átomo de cloro Cℓ 17 35 17 eletrões A carga do ião é igual à diferença entre o Ganhou 1 eletrão Ião cloreto 35 17 Cℓ -1 17 protões 18 Neutrões (N = A – Z = 35 – 17) 18 eletrões (17 do átomo +1) 18 eletrões 12

ÁTOMOS E IÕES 23 11 Na Átomo de sódio Constituição: 11 Protões 12 Neutrões 11 Eletrões 23 Perde um eletrão 11 + Na Ião sódio: Na+ Constituição: 11 Protões 12 Neutrões 10 Eletrões

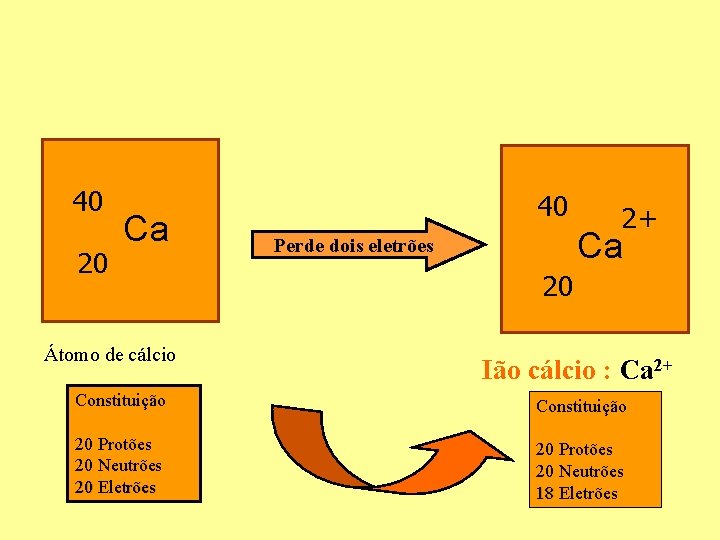
40 20 Ca Átomo de cálcio 40 2+ Ca Perde dois eletrões 20 Ião cálcio : Ca 2+ Constituição 20 Protões 20 Neutrões 20 Eletrões 20 Protões 20 Neutrões 18 Eletrões

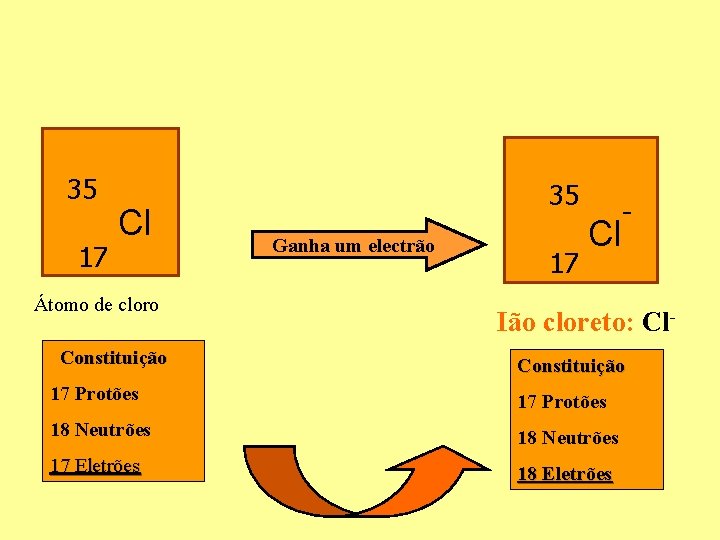
35 17 Cl Átomo de cloro Constituição 35 Ganha um electrão 17 Cl - Ião cloreto: Cl. Constituição 17 Protões 18 Neutrões 17 Eletrões 18 Eletrões

ÁTOMOS E IÕES 16 8 O Átomo de oxigénio 16 Ganha dois eletrões 8 O 2 - Ião óxido: O 2 - Constituição 8 Protões 8 neutrões 8 eletrões 8 Protões 8 neutrões 10 eletrões

1. 1 Modelo atómico Síntese Modelos atómicos Dalton Átomo indivisível Thomson Rutherford Bohr Nuvem eletrónica Cargas negativas Os eletrões movem- Há regiões do espaço dispersas numa movem-se em torno do onde é maior a massa positiva torno do núcleo em órbitas probabilidade de positivo circulares encontrar um eletrão Os átomos são constituídos por um núcleo com protões e neutrões e um espaço à volta do núcleo, onde se movem os eletrões. A massa do protão é praticamente igual à do neutrão e muito maior do que a do eletrão. A massa de um átomo está praticamente concentrada no núcleo. 17

1. 1 Modelo atómico Síntese A carga do protão é +1, a do eletrão é -1 e o neutrão não tem carga. O número de protões é característico dos átomos de cada elemento químico e chama-se número atómico, Z. A soma dos protões e neutrões de um átomo chama-se número de massa, A. Cada tipo de átomos é caracterizado por um número atómico e um número de massa, e pode representar-se por: A Z X Os isótopos de um elemento são átomos que têm igual número atómico, Z, mas diferente número de massa, A, pelo que têm massa diferente. A massa relativa de um isótopo ou massa isotópica relativa indica-se apenas por um número, sem unidades, em relação a um padrão estabelecido que é 18

1. 1 Modelo atómico Síntese Chama-se massa atómica relativa de um elemento Ar à média das massas relativas dos seus isótopos, tendo em conta a sua abundância na Natureza. Indica-se apenas por um número. Os átomos transformam-se em iões monoatómicos quando perdem ou ganham eletrões, sendo: carga do ião = n. º de eletrões do átomo – n. º de eletrões do ião. Os iões monoatómicos podem representar-se por: A X Z carga 19